半夏泻心汤联合谷氨酰胺治疗化疗相关性腹泻及调节肠道菌群的实验研究*
2023-03-04何文广刘小梨刘其龙谢意程
何文广, 刘小梨, 刘其龙, 谢意程△
广州医科大学附属第四医院 1普外科, 2输血科(广东广州 511300); 3中山大学附属第一医院东院胃肠外科(广东广州 510700)
化疗相关性腹泻(chemotherapy-induced diarrhea,CID)是肿瘤化疗常见剂量限制性毒性反应,严重时可导致患者脱水休克甚至死亡。目前临床尚无预防CID的药物,已有治疗性药物通过抑制肠蠕动仅对轻度CID症状有缓解作用,不能从根本上预防化疗对肠黏膜上皮细胞的损伤[1-2]。半夏泻心汤具有寒热平调,消痞散结的功能,用于寒热错杂之痞证,为调和寒热、辛开苦降治法的代表方剂,对化疗中出现的恶心呕吐、腹泻等具有良好的治疗效果[3]。谷氨酰胺(Gln)是体内肠道上皮细胞、淋巴细胞等快速增殖细胞的主要能量来源,有助于维持肠道的形态和免疫系统功能[4]。目前鲜见半夏泻心汤联用谷氨酰胺对于CID治疗的报道。2020年6月至2022年3月,本研究通过建立化疗相关性腹泻模型,予以半夏泻心汤联用谷氨酰胺治疗,观察大鼠一般体征、病理和血生化变化以及对肠道菌群的影响,初步探究半夏泻心汤联用谷氨酰胺对于CID的作用机制,为CID的中药开发打开新的思路。
1 材料与方法
1.1 主要试剂和仪器 半夏泻心汤由广州医科大学附属第四医院中药药房提供,氟尿嘧啶、谷氨酰胺购于美国sigma公司,内毒素(endotoxin, ET)ELISA试剂盒、D-乳酸脱氢酶(D-lactic dehydrogenase, D-LDH)ELISA试剂盒、二胺氧化酶(diamine oxidase, DAO)ELISA试剂盒均购于美国abcam公司,丙二醛(malonaldehyde, MDA)生化试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)生化试剂盒均购于南京建成生物工程研究所,苏木精、伊红、多聚甲醛购于美国sigma公司;显微镜来自日本OLYMPUS公司,全波长酶标仪(SpectraMax Plus 384)来自美国MD公司,轮转式切片机(RM2235)来自LEICA公司。
1.2 实验动物及分组 30只Sprague Dawley(SD)雄性大鼠(220~320 g)购自上海斯莱克有限公司(合格证号20170005059522),所有SD大鼠饲养在SPF级环境中,温度范围20~25℃,相对湿度范围40%~70%,试验前在SPF级环境中适应1周。本研究所涉及的动物实验获得广州医科大学附属第四医院伦理委员会批准(2022-H-004)。实验分为空白对照组(Ctrl组)、化疗相关性腹泻模型组(CID组)、半夏泻心汤组(BXT组)、谷氨酰胺组(Gln组)、半夏泻心汤+谷氨酰胺组(BXT+Gln组),每组6只SD大鼠。Ctrl组每天灌胃给药2 mL生理盐水;CID组、BXT组、Gln组、BXT+Gln组在第1~8天分别灌胃给予等体积的生理盐水、半夏泻心汤2.5 g/kg,谷氨酰胺1 g/kg、半夏泻心汤2.5 g/kg+谷氨酰胺1 g/kg,在给药的第3~8天同时腹腔注射氟尿嘧啶40 mg/kg。实验结束后先用3%戊巴比妥钠麻醉大鼠再脱颈处死大鼠,取病变结肠部位做病理检查,收集血清进行生化及ELISA检测,收集每只老鼠粪便做肠道菌群测序。
1.3 体征观察 (1)一般情况:自实验第1天开始观察,每天定时称量大鼠体重和进食量,同时观察粪便、毛发、活动情况、精神状态等,末次注射氟尿嘧啶后出现的腹泻认为是迟发性腹泻。(2)腹泻评分:参考Akinobu Kurita方法。0分:大便正常或没有;1 分:轻度腹泻,大便可见轻微湿软; 2分:中度腹泻,大便较湿且不成形并伴有轻度肛周污迹;3分:重度腹泻,水样便并伴有重度肛周污迹。
1.4 HE染色 取大鼠结肠组织置于4%多聚甲醛溶液中固定3 d后将结肠修整为适当的形状及厚度,经脱水和石蜡包埋后将结肠组织切片,厚度为4 μm。切片脱蜡复水:二甲苯Ⅰ 15 min、二甲苯Ⅱ 15 min、无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、95%乙醇5 min、80%乙醇5 min、纯净水浸洗1 min;染色:将切片浸入苏木精染液中常温染色5 min,纯净水洗1 min;将切片浸入1%盐酸酒精溶液数秒,纯净水至组织返蓝;将切片浸入伊红染液中染色3 min,纯净水洗去玻片上的浮色;脱水、透明、封固:80%乙醇0.5 min、95%乙醇Ⅰ 0.5 min、95%乙醇Ⅱ 0.5 min、无水乙醇Ⅰ 0.5 min、无水乙醇Ⅱ 0.5 min、二甲苯Ⅰ 透明3 min、二甲苯Ⅱ 透明3 min,取出切片用中性树胶封固;镜下观察拍照,对样本的病理变化作综合性描述。
1.5 ELISA及比色法生化检测 取大鼠血清,根据ELISA试剂盒说明书和生化检测试剂盒说明书操作检测血清中ET、D-LDH、DAO以及MDA和SOD的含量。
1.6 肠道菌群的分析测定 将大鼠粪便样本进行高通量16S rDNA扩增子测序。首先提取粪便中细菌的总DNA后,进行PCR扩增。PCR扩增产物通过2%琼脂糖凝胶电泳进行检测,并对目标片段进行回收,回收采用AxyPrep PCR Cleanup Kit回收试剂盒。纯化后的PCR产物采用Quant-iT PicoGreen dsDNA Assay Kit在Qbit荧光定量系统上对文库进行定量,合格的文库浓度应在2 nmol/L以上。将合格的上机测序文库(Index 序列不可重复)梯度稀释后,根据所需测序量按相应比例混合,并经NaOH变性为单链进行上机测序,使用NovaSeq测序仪进行2×250 bp的双端测序。
1.7 统计学方法 使用 GraphPad Prism 8.0 软件进行统计分析,计量资料以均数±标准差表示,两组间比较采用Student′st检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况观察 Ctrl组大鼠体重增加,进食量平稳,毛发光滑,自由活动;CID组大鼠体重和进食量随着给药时间的增加而降低,毛发粗糙,活动缓慢;与CID组相比,BXT组、Gln组以及BXT+Gln组体重均有所增加,大鼠的毛发粗糙和活动频率都优于CID组;其中BXT+Gln组大鼠的体重增加明显多于BXT组和Gln组,BXT组大鼠的体重增加量也是多于Gln组(图1,表1);在大鼠进食量方面,Gln组以及BXT+Gln组大鼠进食量都多于CID组,Gln组以及BXT+Gln组多于BXT组,Gln组与BXT+Gln组相比无明显变化(图2,表2)。

图1 各组大鼠体重变化情况
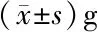
表1 各组大鼠体重变化情况
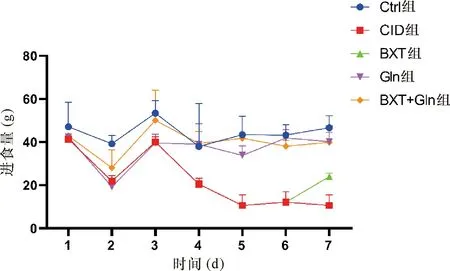
图2 各组大鼠进食量变化情况
2.2 腹泻评分比较 BXT组(0.8±0.8)、Gln组(1.0±0.6)以及BXT+Gln组(0.5±0.5)大鼠的腹泻评分都低于CID组(2.2±1.0)(P<0.05),BXT组、Gln组以及BXT+Gln组之间的比较差异无统计学意义(P>0.05)。
2.3 HE染色结果 Ctrl组结肠组织绒毛结构完整,腺体排列有序,无明显炎症和组织水肿充血。CID组病变严重,肠绒毛重度水肿,上皮细胞坏死,腺体排列杂乱,肠壁淤血,大量炎细胞浸润。BXT组结肠组织炎性细胞浸润较Gln组少,肠绒毛轻度水肿,腺体排列相对有序。Gln组病变较严重,但病变程度比CID组有所减轻,肠绒毛中度水肿,腺体排列杂乱,有充血,炎细胞浸润。BXT+Gln组病变程度均较BXT组和Gln组轻,有少量炎细胞浸润,肠绒毛轻度水肿,偶见肠壁组织充血(图3)。
表2 各组大鼠进食量变化情况

图3 H&E染色观察各组大鼠结肠病理变化(×400)
2.4 降毒素作用 大鼠血清中BXT组和BXT+Gln组的MDA含量明显低于CID组(P<0.05),BXT+Gln组血清MDA的含量低于Gln组(P<0.05),余各组比较差异无统计学意义(P>0.05); 各组大鼠血清SOD水平,BXT组和BXT+Gln组高于CID组(P<0.05),BXT+Gln组高于Gln组(P<0.05),余各组比较差异无统计学意义(P>0.05)。各组大鼠血清DAO水平,BXT组、Gln组以及BXT+Gln组低于CID组(P<0.05),Gln组高于BXT组(P<0.05),BXT+Gln组低于BXT组(P<0.05),BXT+Gln组低于Gln组(P<0.05);各组大鼠血清ET含量,BXT组、Gln组以及BXT+Gln组低于CID组(P<0.05),BXT+Gln组低于BXT组(P<0.05),BXT+Gln组低于Gln组(P<0.05),BXT与Gln组相比差异无统计学意义(P>0.05);各组大鼠血清D-LDH含量,BXT组和BXT+Gln组低于CID组(P<0.05),Gln组高于BXT组(P<0.05),BXT+Gln组低于Gln组(P<0.05),余各组比较差异无统计学意义。见表3~4。
表3 比色法检测大鼠血清中MDA和SOD含量

表4 ELISA检测大鼠血清中MDA和SOD含量
2.5 对大鼠肠道菌群多样性的影响 通过主坐标分析(principal coordinate analysis, PCoA)结果显示,Ctrl组和CID组组间样本具有明显的分离,说明5-FU诱导(M组)导致大鼠肠道菌群发生了改变(图4-A)。BXT组、Gln组和BXT+Gln组的样本与Ctrl组无明显分离,说明组间菌群结构相似,进一步说明BXT组、Gln组和BXT+Gln组处理有助于恢复大鼠的肠道菌群组成(图4-B)。此外,BXT+Gln与CID组组内样本呈现聚集倾向,组间样本菌群明显分开,说明两组菌群结构具有明显不同(图4-C)。

图4 各组肠道菌群PCoA分析
2.6 对大鼠肠道菌群丰度的影响 在门水平上,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)占了各组大鼠肠道菌群细菌总丰度的80%以上,是绝对优势菌(图5)。与Ctrl组相比,CID组的髌骨细菌门(Patescibacteria)、硝化螺旋菌门(Nitrospirae)和蓝细菌(Cyanobacteria)的丰度变化差异有统计学意义(图6-A,P<0.05)。与CID组相比,BXT组中具有显著性差异的物种有髌骨细菌门(Patescibacteria)和粘细菌(Myxococcota)(图6-B,P<0.05);Gln组中具有显著性差异的物种有髌骨细菌门(Patescibacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、Planctomycetota和蓝细菌(Cyanobacteria)(图6-C,P<0.05);BXT+Gln组中具有显著性差异的物种有髌骨细菌门(Patescibacteria)和弯曲杆菌门(Campylobacterota)(图6-D,P<0.05)。
3 讨论
化疗是治疗恶性肿瘤的常用方法之一,在大大提高肿瘤患者生存率的同时,也带来了很多不良反应,如恶心、呕吐、骨髓抑制、腹泻等。其中CID是化疗最常出现的并发症之一,研究显示接受常规剂量化疗药物的患者CID的发生率达40%,而接受大剂量化疗或持续性化疗的患者CID的发生率高达60%[5-6]。CID通常表现为恶心、呕吐、腹痛和严重的腹泻等。CID的病理生理过程是复杂的,由多种因素共同作用导致,普遍认为与肠上皮细胞损伤、炎症、感染等多种因素有关,其中认为与化疗药物对肠黏膜细胞的直接抑制和破坏作用有密切联系。CID一旦发生,将限制化疗药物的使用,影响患者的治疗效果和生活质量,甚至因为肠道黏膜损伤导致致病菌菌群移位出现败血症而危及患者生命,同时也会加重患者的病痛和治疗费用。
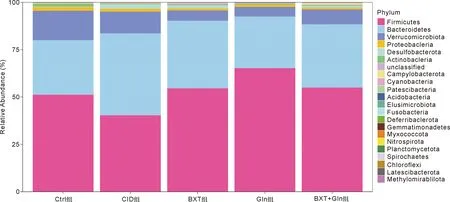
图5 各组肠道内容物菌群在门水平上物种组成热图

图6 各组肠道内容物菌群具有显著性差异的物种
CID的发病机制尚不明确,国际上尚无满意的治疗方案[7],大多是以止泻为主的被动对症治疗,没从根本上调理肠胃功能[8]。中医认为CID属“泄泻”、“下利”等病证范畴。正如《景岳全书·泄泻》:“泄泻之本,无不由于脾胃”。化疗药物耗伤人体正气,脾失健运,胃失和降,水谷不化,内生湿热,而导致的大肠传导功能失常而发病[9]。《伤寒论》所载半夏泻心汤由半夏、黄芩、干姜、人参、黄连、大枣、炙甘草7味药物组成,具有寒热平调,消痞散结的功能,用于寒热错杂之痞证,为调和寒热,辛开苦降治法的代表方剂。半夏泻心汤对临床化疗过程中出现的恶心、呕吐、腹胀腹泄、食欲不振等消化道不良反应有较好的治疗作用[10],该方可通过影响结肠黏膜内脑肠肽变化,调节胃肠运动功能,从而发挥缓解腹痛、腹部不适,改善大便性状的效应[11]。
谷氨酰胺是体内肠道上皮细胞、淋巴细胞等快速增殖细胞的主要能量来源,有助于维持肠道的形态和免疫系统功能[12-13]。在创伤、腹部手术、化疗等应激状态下,体内谷氨酰胺消耗增加,自身合成的谷氨酰胺不能满足代谢需要,导致相对缺乏,体内谷氨酰胺耗竭反过来又会造成肠黏膜萎缩、通透性增加、免疫功能下降,肠道细菌和毒素突破肠黏膜造成细菌移位等[12, 14-15]。目前,动物实验和临床试验均证明,在创伤、感染、重症疾病状态时补充谷氨酰胺可维持体内谷氨酰胺浓度,改善氮平衡,促进蛋白质合成,防止创伤所致的肠黏膜萎缩,减少细菌、毒素易位,缩短住院时间,降低院内感染率和病死率[16-17]。口服谷氨酰胺可降低放化疗期间肠壁的通透性,维持肠道免疫屏障功能的完整性,防止肠道细菌和毒素易位的发生,减少肠源性感染的发生。
鉴于半夏泻心汤和谷氨酰胺可以通过不同的治疗机制抑制腹泻,促进胃肠动力,维护肠道免疫屏障功能。本研究创新性地选择半夏泻心汤联合谷氨酰胺的方式治疗化疗相关性腹泻。研究结果显示,联合给药后的大鼠一般体征,如体重,大鼠的毛发情况和活动频率等都明显优于模型组。对大鼠进行的腹泻评分也证实了联合给药能够明显抑制化疗相关性腹泻。HE病理染色提示联合给药后的大鼠结肠组织炎细胞浸润减少,肠绒毛水肿减轻,腺体排列相对有序,肠壁组织充血明显减轻。与此同时,血清生化及ELISA检测发现,联合给药后大鼠血清中丙二醛(MDA)显著下降,超氧化物歧化酶(SOD)显著上升,并且二胺氧化酶(DAO)、内毒素(ET)和D-乳酸脱氢酶(D-LDH)显著下降,这些都证实了半夏泻心汤联合谷氨酰胺具有降毒素和抑制脂质过氧化物的作用。更加令人欣喜的是,相较于单独给予半夏泻心汤或者谷氨酰胺,半夏泻心汤和谷氨酰胺联合给药的方式能更明显抑制化疗相关性腹泻,大鼠的一般体征、病理结果、血清生化指标都能很好地支持以上结果。
正常的肠黏膜屏障系统包括机械屏障、免疫屏障、生物屏障、化学屏障、黏液屏障等,五者之间相辅相成,其功能主要在于防止肠道内细菌及内毒素的移位[18-19]。究其本质,CID就是肠黏膜屏障尤其是由肠上皮细胞、细胞间连接以及菌膜构成的机械屏障损伤[20]。细菌是肠黏膜屏障的重要组成部分。人体内寄生着大量细菌,这些细菌共生构成肠道菌群,在食物消化吸收、产生维生素等营养物质、抵御外来致病菌侵入、刺激免疫系统等众多生理功能方面发挥着重要作用[21-23]。然而,化疗药物可杀灭肠道菌群,并抑制有益菌生长,破坏肠道菌群平衡。因此,维持CID后原有的肠道菌群平衡显得十分重要。在本研究中,通过对各组肠道菌群PCoA分析验证样本群落组成的相似性,我们可以看到正常组和模型组组间样本具有明显的分离,说明氟尿嘧啶诱导后(CID组)导致大鼠肠道菌群发生了改变。然而,给予半夏泻心汤联合谷氨酰胺后,肠道菌群结构与正常组相似,与模型组完全不同。这证实了半夏泻心汤联合谷氨酰胺可以恢复原有的肠道菌群结构。另一方面,我们探究了大鼠肠道菌群丰度的变化。在门水平上,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)占了各组大鼠肠道菌群细菌总丰度的80%以上,是绝对优势菌。相较于模型组,给予药物治疗后可以提高厚壁菌门(Firmicutes)、髌骨细菌门(Patescibacteria)菌群丰度,有利于肠道营养物质的吸收;同时拟杆菌门(Bacteroidetes)出现丰度的下降,可以抑制此类部分条件致病菌引起的炎症性肠病。出乎意外的是,弯曲杆菌门(Campylobacterota)菌群丰度出现部分上升,弯曲杆菌容易诱发细菌性肠炎,是一类不利因素,这可能需要进一步的研究和数据论证。
综上所述,半夏泻心汤联用谷氨酰胺可以明显抑制化疗相关性腹泻,保护肠道免疫屏障,抑制血清内毒素和脂质过氧化水平。半夏泻心汤和谷氨酰胺不同的药理学效应使得其联合使用的效果更加突出。与此同时,我们进一步探究其具体作用机制,发现可能与调节肠道菌群有关。总的来说,本研究初步阐明了半夏泻心汤联用谷氨酰胺对于CID的作用效果和作用机制,为治疗CID的中药开发打开新的思路。
利益相关声明:所有作者声明不存在任何利益冲突。
作者贡献说明:何文广、谢意程参与实验的设计和规划,何文广、刘小梨、刘其龙、谢意程参与了实验和数据收集、整理,何文广、刘小梨、刘其龙、谢意程参与了论文的撰写,何文广、谢意程负责论文的修订工作。
