基于光动力疗法的四苯基卟啉脂质体制备及体外抗肿瘤活性评价
2023-03-02吕佳佳袁泽利韦恋祝
吕佳佳,袁泽利,韦恋祝,王 莎,高 杰
(遵义医科大学 药学院,贵州 遵义 563099)
癌症作为全球重大的公共卫生问题,严重威胁着人类的健康,根据国际癌症研究机构公布的数据显示,2020年全世界约有1 930万新发癌症病例(排除非黑色素瘤皮肤癌后约1 810万例),近1 000万患者死于癌症(排除非黑色素瘤皮肤癌后约990万例)[1-3]。目前癌症的治疗方式仍然主要为手术治疗、放射治疗和化学治疗等。手术治疗属于侵入性的治疗方式,通常手术切除后容易复发;放射疗法目前以计算机断层扫描定位为主,对部分肿瘤边界和危及器官勾画存在不确定性,同时放疗存在烧伤肿瘤区域皮肤的可能性[4];而化学疗法的毒副作用大,缺乏特异性常在杀死肿瘤细胞的同时对正常细胞也有较大的损伤[5]。光动力疗法(Photodynamic therapy,PDT)作为一种新兴的抗癌手段,利用光诊疗剂在光的照射下可以实现肿瘤组织甚至肿瘤细胞的荧光可视化,通过产生活性氧和/或光热效应同时实现肿瘤的成像和清除[6-7]。现今大多数光敏剂为疏水性光敏剂,进入体内后缺乏靶向性且易在血管内聚集[8]。脂质体作为目前研究较为热门的纳米药物载体,主要由磷脂和胆固醇构成类细胞膜的封闭式囊泡,具有良好的生物相容性、低毒性以及天然的靶向性等特点广泛应用于生物医学领域[9-11]。本实验将疏水性的光敏剂包载于脂质体中,以提高光敏剂的水溶性、稳定性以及靶向性能等。制备了四苯基卟啉脂质体药物递送系统,以黑色素瘤细胞B16F10和乳腺癌细胞4T1为实验对象,通过细胞摄取和细胞毒性实验(MTT法)考察四苯基卟啉脂质体光动力疗法对上述2种细胞的体外靶向性及抗肿瘤活性。
1 材料与方法
1.1 试药与细胞 四苯基卟啉(TPP,上海阿拉丁生化科技股份有限公司,批号:20181106,纯度>95%);胆固醇(CHO,上海Adamas试剂有限公司,批号:P1276888);大豆卵磷脂(SPC,上海艾韦特医药科技有限公司,批号:SY-SI-170105);聚乙二醇-二硬脂酰磷脂酰乙醇胺( DSPE-PEG2000-OME,上海艾韦特医药科技有限公司,批号:B50639);1,3-二苯基异苯并呋喃(DPBF,上海萨恩化学技术有限公司,批号:20171005),DMEM培养基和RPMI-1640培养基(北京赛默飞世尔生物化学制品有限公司,批号分别为20191103和20191218);葡聚糖凝胶G50 (北京索莱宝科技有限公司,批号:S8151);小鼠黑色素瘤细胞B16F10和小鼠乳腺癌细胞4T1(中国科学院上海细胞库);其余试剂均为分析纯。
1.2 仪器 Nano-Brook 90 PLAS 激光粒度及zeta 电位分析仪(美国布鲁克海文仪器有限公司);UVD-680-1紫外检测仪(上海金达生化仪器有限公司);JY92-IIN 超声波细胞粉碎机(宁波新芝生物科技股份有限公司);BT125D 分析天平(赛多利斯科学仪器北京有限公司);RE-2000A 旋转蒸发仪(上海亚荣生化仪器厂);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);HNY-303恒温培养振荡器(天津市欧诺仪器仪表有限责任公司);WCI-180二氧化碳培养箱(北京维根技术有限公司);IX73倒置荧光显微镜(日本OLYMPUS有限公司);WD-2102B 型全自动酶标仪(北京六一生物科技有限公司)等。
1.3 方法
1.3.1 四苯基卟啉单线态氧的测定 (1)TPP储备液的制备:精密称取1.30 mg TPP于100 mL棕色容量瓶中,加甲醇溶解并定容至刻度,得质量浓度为0.013 mg/mL的TPP储备液,备用;(2)DPBF储备液的制备:精密称取2.70 mg DPBF于10 mL棕色容量瓶中,加甲醇溶解并定容至刻度,得质量浓度为0.27 mg/mL的DPBF储备液,备用;(3)TPP+DPBF混合溶液的测定:分别精密吸取1 mL TPP储备液和0.5 mL DPBF储备液于10 mL棕色容量瓶中,加甲醇定容至刻度,得到TPP质量浓度为1.3 μg/mL和DPBF质量浓度为13.5 μg/mL的混合溶液,光照前对混合溶液在411 nm处进行吸光度测定,接着按照累积测量时间段0、0.5、1、1.5、2、2.5、3、4、5、7、9 min在610 nm激光下光照并分别测定吸光度;(4)空白DPBF溶液的测定:精密吸取DPBF储备液0.5 mL于10 mL棕色容量瓶中,加甲醇定容至刻度,得DPBF质量浓度为13.5 μg/mL溶液,同“TPP+DPBF混合溶液的测定”方法,对其进行测定。
1.3.2 四苯基卟啉脂质体的制备 根据文献[12],采用薄膜分散-超声法制备脂质体,精密称取处方量的脂质材料CHO、SPC、DSPE-PEG2000-OME(摩尔比为33∶59∶8)溶于混合有机溶剂中(氯仿∶甲醇,v/v2∶1),按药脂比1∶50加入四苯基卟啉。将上述脂质材料和药物加至25 mL茄形瓶,在25 ℃条件下旋转蒸发有机溶剂,制成脂质薄膜并在真空干燥器中储存3 h。再使用10 mmol/L的Hepes缓冲液(pH 7.4)为水化介质,在180 rpm/min和25 ℃条件下水化30 min后,利用探头超声仪超声2 min(功率为230 W),即制得四苯基卟啉脂质体。
1.3.3 四苯基卟啉脂质体的包封率考察[12]采用葡聚糖凝胶(G-50)色谱柱法分离四苯基卟啉脂质体和游离药物,使用紫外可见分光光度法测定四苯基卟啉的含量。取200 μL四苯基卟啉脂质体溶液加于G-50柱顶端,利用Hepes缓冲液进行洗脱并连接紫外检测仪,紫外检测信号开始时收集2 mL洗脱液于离心管内。取过柱后的四苯基卟啉脂质体溶液500 μL,加500 μL甲醇破乳(涡旋5 min),加甲醇至2 mL,以甲醇为空白对照,在413 nm处测定脂质体中四苯基卟啉的含量,记为W包封;另取未过柱的四苯基卟啉脂质体500 μL,加500 μL甲醇破乳(涡旋5 min),加甲醇至2 mL,再从中取500 μL稀释至3 mL,测定总四苯基卟啉的含量,记为W总。包封率(EncapsuLation efficiency,EE)计算公式如下:EE=W包封/W总×100%。其中:W包封——包封于脂质体中的四苯基卟啉;W总——总四苯基卟啉的含量。
1.3.4 四苯基卟啉脂质体的粒径、电位和形态考察 取100 μL四苯基卟啉脂质体加入Hepes缓冲液稀释至2 mL,采用Nano-Brook 90 PLAS 激光粒度及zeta 电位分析仪测定四苯基卟啉脂质体的粒径、Zeta电位和多分散系数(Polydispersity index,PDI),同时通过FEI Tecnai F20透射电镜考察四苯基卟啉脂质体的外观形态。
1.3.5 四苯基卟啉脂质体的稳定性考察 将制备好的四苯基卟啉脂质体放置于4 ℃冰箱中,分别于制备当天(第0天)和制备后连续9 d取样测定其粒径分布并观察脂质体的外观稳定性,考察4 ℃储存条件下样品稳定性。
1.3.6 体外抗肿瘤评价
1.3.6.1 细胞培养 将B16F10细胞以适宜的密度置于培养皿中,用含10% FBS、100 U/mL链霉素和100 U/mL青霉素的RPMI-1640培养基培养;而4T1细胞用含10% FBS、100 U/mL链霉素和100 U/mL青霉素的DMEM培养基培养,待细胞单层铺满培养瓶时用0.25%的胰酶消化,待细胞刚开始皱缩时用含血清的培养基终止消化,离心(2 000 rpm,3 min),部分细胞继续传代培养,部分细胞用于实验分析。上述细胞均培养在无菌、37 ℃、含有5% CO2的细胞培养箱中。
1.3.6.2 四苯基卟啉脂质体暗毒性考察 按照“1.3.2项下”方法制备TPP-Lip,对B16F10和4T1细胞分别进行暗毒性考察,根据预实验结果,向已接种5×103个细胞/孔并孵育24 h的96孔板中分别加入浓度为1.25、2.5、5、10、15、20、25、30 μg/mL的TPP-Lip,每个浓度设置6个复孔。在培养箱中孵育24 h后取出,弃掉含药培养基,PBS洗涤2次,每孔加入20 μL MTT溶液(5 mg/mL)和180 μL完全培养基,继续孵育4 h后取出,小心吸去孔内培养液。每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解后在酶联免疫检测仪490 nm处测量各孔的吸光度值。
1.3.6.3 四苯基卟啉脂质体光毒性考察 按照“1.3.2项下”方法制备TPP-Lip,同时精密称取一定量的TPP溶于DMSO中,得到游离TPP浓度为10 mg/mL,考察游离TPP和TPP-Lip对B16F10和4T1细胞的光毒性。根据前期单因素实验结果,分别用无血清的培养基将游离TPP和TPP-Lip配制成以下浓度(TPP浓度):1.25、2.5、5、10、15、20、25、30 μg/mL。向已接种5×103个细胞/孔并孵育24 h的96孔板中分别加入上述配制好的不同浓度游离TPP和TPP-Lip,每个浓度设置6个复孔。在培养箱中孵育4 h后取出光照(B16F10和4T1细胞均采用610 nm激光灯分别照射3、6 min),光照后继续孵育至24 h,取出弃掉含药培养基,PBS洗涤2次后每孔加入20 μL MTT溶液(5 mg/mL)和180 μL完全培养基,再孵育4 h后取出,小心吸去孔内培养液。每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解后在酶联免疫检测仪490 nm处测量各孔的吸光度值。
1.3.6.4 四苯基卟啉脂质体对B16F10和4T1细胞摄取实验 向6孔板中分别接种B16F10细胞和4T1细胞,接种数量均为1×105个细胞/孔,在5% CO2,37 ℃的培养箱中孵育24 h后加入CFPE标记的脂质体和培养基混合溶液2 mL(v/v=1∶1),继续孵育4 h后取出用PBS洗涤3次,加入2 mL 4%多聚甲醛溶液固定细胞,继续孵育20 min,再次用PBS洗涤3次后用DAPI染细胞核,每孔加入200 μL DAPI染液,染15 min后吸出,PBS洗涤3次后置于倒置荧光显微镜下观察以考察细胞摄取情况。
2 结果
2.1 单线态氧测定结果 按照“1.3.1项下”方法对四苯基卟啉单线态氧进行测定(见图1)。
从图1可知,四苯基卟啉在610 nm激光照射下可有效产生单线态氧。其中,激光照射3 min后,DPBF的吸光度不再下降,初步说明四苯基卟啉不再继续产生单线态氧,可能是由于四苯基卟啉被光漂白。
2.2 四苯基卟啉脂质体的包封率、粒径分布、Zeta电位和形态测定结果 按照“1.3.3项下”方法对四苯基卟啉脂质体的包封率进行考察,利用紫外可见分光光度法测定四苯基卟啉的含量,并根据包封率公式计算包封率值。按照“1.3.4项下”方法对四苯基卟啉脂质体的粒径分布、Zeta电位、多分散系数以及形态进行考察,结果见图1~2及表1。
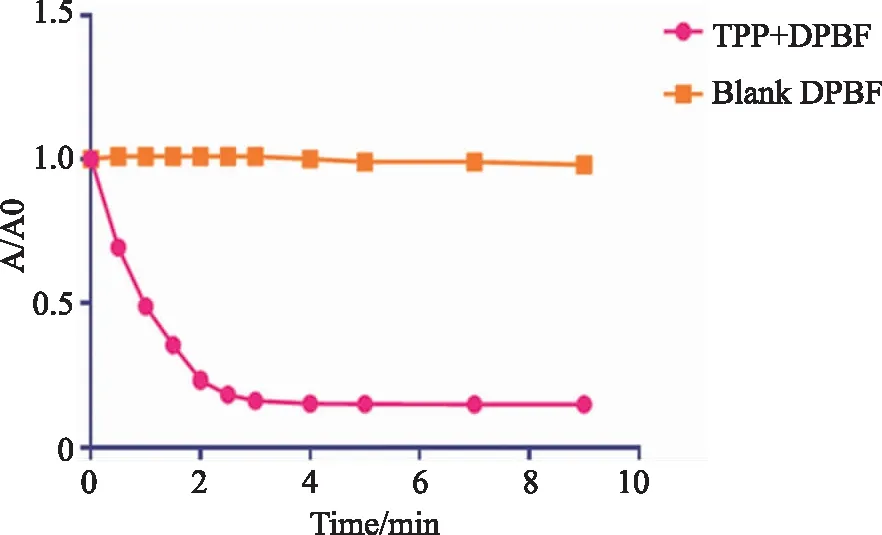
图1 四苯基卟啉单线态氧测定结果
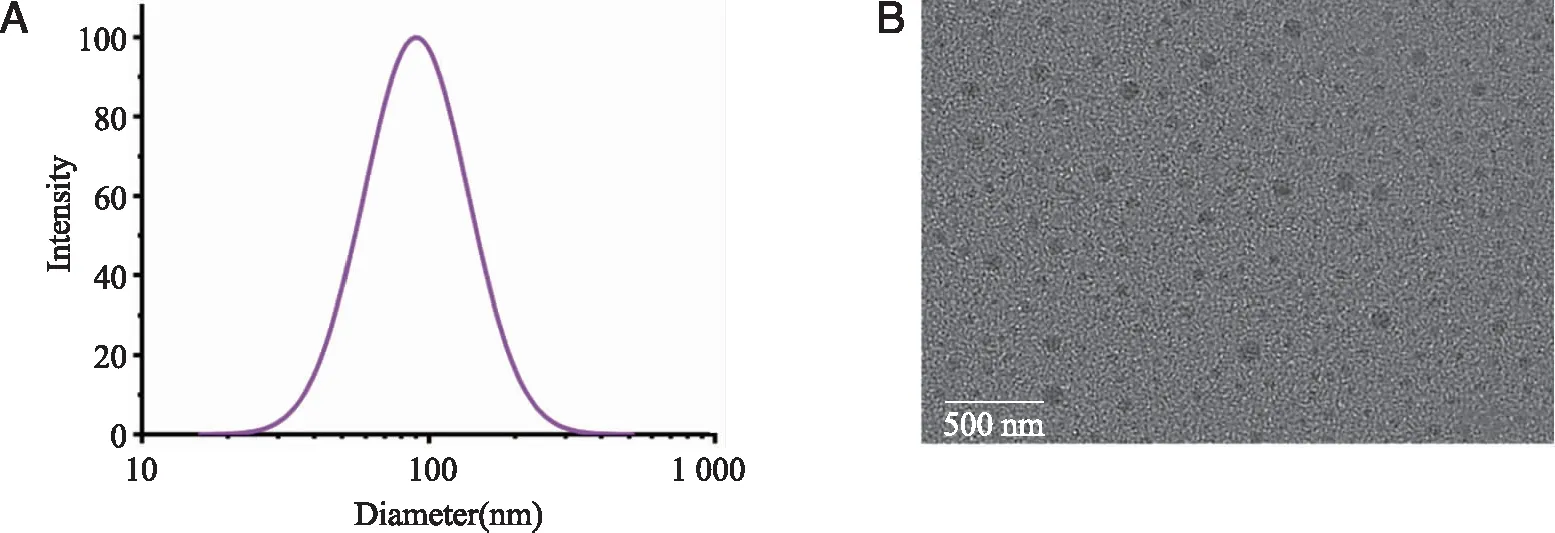
A:四苯基卟啉脂质体粒径分布;B:四苯基卟啉脂质体透射电镜结果。

表1 四苯基卟啉脂质体的包封率、粒径、电位和多分散系数实验结果(n=3)
四苯基卟啉脂质体的包封率为(88.84±2.64)%,粒径分布为(115.84±3.89)nm,Zeta电位为(11.66±5.41)mV,多分散系数为(0.251±2.40)。上述结果表明,四苯基卟啉脂质体在Hepes缓冲溶液中分散良好分布均匀,粒径在110 nm左右,能很好的满足EPR效应,形态均匀大多呈球形或类球形。
2.3 四苯基卟啉脂质体的稳定性考察结果 按照“1.3.5项下”方法对四苯基卟啉脂质体的稳定性进行考察,连续9 d测定样品的粒径分布同时观察样品的外观稳定性(见图3)。
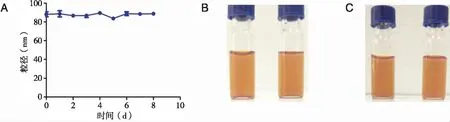
A:四苯基卟啉脂质体粒径稳定性; B:第0天外观稳定性;C:第9天外观稳定性。
四苯基卟啉脂质体溶液在4 ℃避光条件下粒度分布均匀,无絮集现象产生,放置9 d脂质体溶液仍保持澄清,均无浑浊或沉淀,连续9 d测定其粒径,变化不大,表明四苯基卟啉脂质体较为稳定。
2.4 体外抗肿瘤评价结果
2.4.1 四苯基卟啉脂质体暗毒性考察 按照“1.3.6.2项下”方法考察TPP-Lip的暗毒性(见图4)。
2.4.2 四苯基卟啉脂质体与游离四苯基卟啉的光毒性考察 按照“1.3.6.3项下”方法考察TPP-Lip和free TPP的光毒性(见图5)。
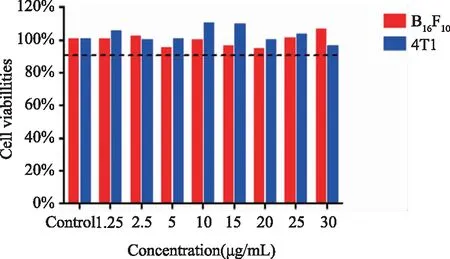
图4 四苯基卟啉脂质体对两种细胞的暗毒性
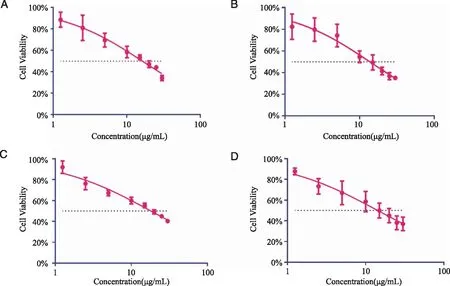
A:TPP-Lip对4T1细胞;B:16F10细胞的光毒性; C:free TPP对4T1细胞;D:B16F10细胞的光毒性。
由图4可知,在(1.25~30)μg/mL浓度范围内B16F10和4T1细胞的存活率均大于90%,说明TPP-Lip在上述条件下对B16F10和4T1细胞暗毒性小,安全性高。
由图5所对应的数据计算出TPP-Lip对4T1细胞的IC50为16.30 μg/mL、B16F10细胞的IC50为13.73 μg/mL;free TPP对4T1细胞的IC50为19.11 μg/mL、B16F10细胞的IC50为15.29 μg/mL。说明TPP-Lip对2种细胞均有较强的光毒性,且对B16F10细胞比4T1细胞更好,为后续动物实验提供参考,同时脂质体包封后的光毒性优于游离四苯基卟啉,可能与增强其溶解性和增加细胞摄取效率相关。
2.4.3 细胞摄取考察 通过薄膜分散-超声法制备CFPE标记的脂质体。按照“1.3.6.4项下”方法对B16F10和4T1细胞进行细胞摄取实验(见图6)。
由图6可知,脂质体能较好地被B16F10和4T1细胞摄取,两种细胞对其摄取效率相差不大,这一结果与光毒性效果相吻合,也能为后续体内实验提供相应参考。
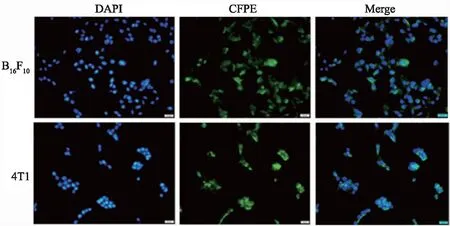
图6 载CFPE染料的脂质体在B16F10细胞和4T1细胞上的摄取
3 讨论
四苯基卟啉是一种常用的卟啉类光敏剂[13],因其具有较高的单线态氧产率所以可以通过光动力疗法在激光照射下产生活性氧以实现抗肿瘤效果。然而,其水溶性较差,将它与脂质体结合以增加溶解性,同时脂质体这类纳米递送载体具有被动靶向到肿瘤部位的作用,因此脂质体包载后可以进一步提高四苯基卟啉的抗肿瘤效果。
脂质体的制备方法有薄膜分散超声法、注入法(乙醇注入法、乙醚注入法)、逆向蒸发法等[14]。本文四苯基卟啉脂质体的制备方法是通过前期的单因素实验和Box-Benhnken中心组合实验优化而得,最终确定使用薄膜分散超声法制备,根据该方法制备的脂质体大小均一,粒径适宜,形态规整。研究表明,通常粒径在20~200 nm的纳米粒子能通过实体瘤的高通透性和和滞留效应被动靶向到肿瘤部位[15]。构建的TPP-Lip粒径为(115.84±3.89)nm,且包封率为(88.84±2.64)%,说明四苯基卟啉光敏剂被有效的包裹到脂质体中。
本文还进行了体外抗肿瘤活性考察。首先测定四苯基卟啉的单线态氧产生情况,初步确定光照时间。此外,前期实验还对2种细胞的最佳光照时间、四苯基卟啉脂质体浓度以及孵育时间等进行考察,确定了最终光照时间、脂质体浓度和孵育时间等条件,在此条件下研究四苯基卟啉脂质体对B16F10、4T1 2种细胞的光毒性和暗毒性,为后期体内研究提供实验依据。
