芪丹益肺通窍颗粒对变应性鼻炎大鼠免疫功能的影响及机制
2023-03-02谭道富唐友琼
谭道富,唐友琼,宋 丹,许 诣
(1.恩施土家族苗族自治州中心医院 药剂科,湖北 恩施 445000;2.湖北文理学院附属医院,襄阳市中心医院 儿科, 湖北 襄阳 441021)
变应性鼻炎(Allergic rhinitis,AR)即“过敏性鼻炎”,是一种常见的耳鼻喉类疾病[1]。近年来,AR发病率呈上升趋势[2]。该疾病治疗手段较为单一,且发病机制还未完全阐明,急需开发具有针对性的治疗药物缓解疾病。目前研究发现有多个因子参与调控AR,免疫功能在调控AR病情中发挥重要作用,机体接触特异性变应原并呈递抗原过程中,辅助性T细胞1(Th1)/辅助性T细胞2(Th2)介导免疫偏移及失衡,是引发AR的重要机制[3]。临床报道发现,白细胞介素-33(Interleukin-33,IL-33)可与受体-生长刺激表达基因2(Growth stimulating expressed gene 2,ST2)结合,刺激相关通路激活,促进T细胞向Th2型细胞转化,并诱导Th2型细胞产生免疫因子向鼻黏膜组织聚集,介导AR炎性疾病的产生[4-5]。推测IL-33/ST2通路在AR发生发展中起到关键作用。
中医将AR归属为“鼻鼽”范畴,且中药在AR领域的治疗有几千年历史,利用中药治疗相关疾病成为目前研究的重点[6]。本科室用“芪丹益肺通窍颗粒”治疗AR,在缓解AR患者喷嚏、鼻黏膜肿胀等症状方面,有较好的效果。且前期动物实验发现,“芪丹益肺通窍颗粒”可显著调控AR大鼠Th1/Th2免疫失衡,缓解鼻部炎症症状[7]。但其调控AR免疫失衡的具体分子生物学机制还不甚明确。本研究通过建立AR大鼠模型,探讨芪丹益肺通窍颗粒调控AR免疫失衡可能的作用机制,以期为“芪丹益肺通窍颗粒”的开放应用提供可靠资料。
1 材料与方法
1.1实验材料 清洁级SD大鼠120只,6~8周龄,雌雄不限,体重180~220 g,购自成都达硕实验动物有限公司,SCXK(川)2020-030。本院动物房中适应性饲养大鼠,试验符合3R原则,经本院伦理委员会批准。
“芪丹益肺通窍颗粒”(包括黄芪、防风、白术、牡丹皮、川芎、黄芩、肾荆芥等,成药由成都中医药大学附属医院药剂科提供);卵白蛋白标准品(货号:BTN90610,北京百奥莱博科技有限公司);HE试剂盒(货号:AR1180,武汉博士德生物工程有限公司);ELISA试剂盒:血清免疫球蛋白(IgE)(货号:XFFM072D,上海信帆生物科技有限公司)、白细胞介素-8(IL-8)(货号:SD11356,上海心语生物科技有限公司)、趋化因子CC基序配体2(CCL2)(货号:SRE-12169,上海赛可锐生物科技有限公司)、肿瘤坏死因子-β(TNF-β)(货号:CK-E10109,武汉益普生物科技有限公司)、白细胞介素(IL-2、IL-6、IL-9)(货号:qy-r0042,qy-r0040,qy-r0045,上海乔羽生物科技有限公司);IL-33、ST2、Th1转录因子(T-bet)、Th2转录因子(Gata3)、髓样分化蛋白88(MyD88)、肿瘤坏死因子受体相关因子6(TRAF6)抗体均购自美国abcam公司;CytoFLEX SRT流式细胞仪购自贝克曼库尔特商贸(中国)有限公司。
1.2 方法
1.2.1 大鼠AR模型建立及分组给药 参照文献[7]取SD大鼠,用卵白蛋白(0.3 mg/mL,溶剂为30 mg/mL的氢氧化铝生理盐水溶液)腹腔注射1次/d、连续7 d,进行初步致敏,再用5%卵白蛋白(50 μL/只,1次/d)滴鼻进行强化致敏,若大鼠出现反复抓鼻、喷嚏、流涕现象,视为造模成功。将造模成功的大鼠随机分为模型组、中药组、pcDNA-IL-33组、pcDNA-NC组、中药+pcDNA-IL-33组,每组20只,另取20只大鼠,作为正常对照组,除腹腔注射及滴鼻溶液为氧化铝生理盐水溶液外,其余同模型组。中药组参照文献[7]设置剂量,并按成人用量的8倍给药(药物浓度2.8 g/mL,10 mL/kg给药剂量,2次/d),pcDNA-IL-33组及pcDNA-NC组分别经尾静脉注射给予IL-33过表达重组蛋白载体及阴性对照溶液(250 μL/kg,50 μmoL/L,1次/3d);正常对照组及模型组灌胃给予等量生理盐水;各组连续给药14 d,每次给药治疗结束后,用5%卵白蛋白(500 μL/kg,1次/d,共14次)进行滴鼻致敏。末次给药30 min后,参照文献[7]中大鼠行为症状评分表,对大鼠鼻部AR症状进行评分。
1.2.2 ELISA法测血清IgE、IL-8、CCL2水平 评分后麻醉各组大鼠,取腹主动脉血3 mL,离心收集上层血清,按ELISA试剂盒说明书方法检测血清IgE、IL-8、CCL2水平。
1.2.3 流式细胞术检测Th1/Th2比例 取大鼠腹主动脉血3 mL,加入等体积磷酸缓冲溶液稀释后,用淋巴细胞分离液提取单个核细胞,参照文献[8]中方法,用流式细胞仪检测Th1/Th2比例。
1.2.4 鼻黏膜组织HE染色及嗜酸性粒细胞数目检测 各组随机取6只大鼠,麻醉处死,取鼻黏膜组织,置于4 %多聚甲醛中固定24 h后,透明、浸蜡、包埋后切成5 μm切片。取部分切片按HE试剂盒说明书方法染色、封片后置于光镜下拍照。光镜下可见嗜酸性粒细胞胞核为杆状或分叶状,胞浆呈鲜红色。每片随机取5个视野对嗜酸性粒细胞进行计数。
1.2.5 免疫组化法检测IL-33、ST2阳性表达 取剩余鼻黏膜石蜡切片,脱蜡、水化及抗原修复后,加入一抗(IL-33、ST2,1∶500)4 ℃孵育过夜,加入羊抗兔IgG二抗(1∶500)室温孵育50 min,苏木精复染、封片,光镜下观察拍照,用Image Pro Plus 5.0系统分析图像阳性表达的平均光密度值。
1.2.6 ELISA法检测鼻腔灌洗液中TNF-β、IL-2、IL-6、IL-9水平 各组随机取6只大鼠,麻醉后,用生理盐水灌洗鼻腔,反复灌洗收集鼻腔灌洗液,确保回收率>80%,按ELISA说明书方法检测组织TNF-β、IL-2、IL-6、IL-9水平。
1.2.7 Western blot法检测鼻黏膜组织T-bet、Gata3、IL-33、MyD88、TRAF6蛋白表达 各组剩余8只大鼠麻醉处死,取新鲜鼻黏膜组织,冰上研磨取匀浆液,用蛋白提取试剂盒及BCA法提取并测定蛋白浓度,取50 μg蛋白进行电泳、转膜,加入一抗(T-bet、Gata3、IL-33、MyD88、TRAF6(1∶1 000)、β-actin内参(1∶2 000)),4 ℃湿盒孵育过夜,加入羊抗兔二抗(1∶2 000),37 ℃孵育4 h,增强化学发光法显色,化学发光仪观察、拍照,用Image-J软件分析蛋白表达。
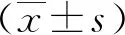
2 结果
2.1 各组大鼠鼻部症状评分比较 与正常对照组相比,模型组大鼠鼻部搔抓及打喷嚏次数增多,鼻黏液增多,AR鼻部症状评分升高(P<0.05)。与模型组相比,中药组大鼠AR鼻部症状评分降低(P<0.05);pcDNA-IL-33组大鼠AR鼻部症状评分进一步升高(P<0.05)。中药+pcDNA-IL-33组上述指标变化与中药组相反(P<0.05,见表1)。
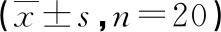
表1 大鼠AR鼻部症状评分比较
2.2 各组大鼠血清IgE、IL-8、CCL2、TGF-β水平比较 与正常对照组相比,模型组大鼠血清IgE、IL-8、CCL2水平升高(P<0.05)。与模型组相比,中药组大鼠血清IgE、IL-8、CCL2水平降低(P<0.05);pcDNA-IL-33组大鼠血清IgE、IL-8、CCL2水平进一步升高(P<0.05)。中药+pcDNA-IL-33组上述指标变化与中药组相反(P<0.05,见表2)。
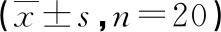
表2 大鼠血清IgE、IL-8、CCL2水平比较
2.3 各组大鼠外周血Th1/Th2比例比较 与正常对照组相比,模型组大鼠外周血Th1、Th1/Th2比例降低(P<0.05),Th2比例升高(P<0.05)。与模型组相比,中药组大鼠外周血Th1、Th1/Th2比例升高(P<0.05),Th2比例降低(P<0.05);pcDNA-IL-33组大鼠外周血Th1、Th1/Th2比例进一步降低(P<0.05),Th2比例进一步升高(P<0.05)。中药+pcDNA-IL-33组上述指标变化与中药组相反(P<0.05,见表3,图1)。
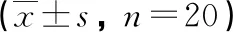
表3 大鼠外周血Th1、Th2、Th1/Th2水平比较
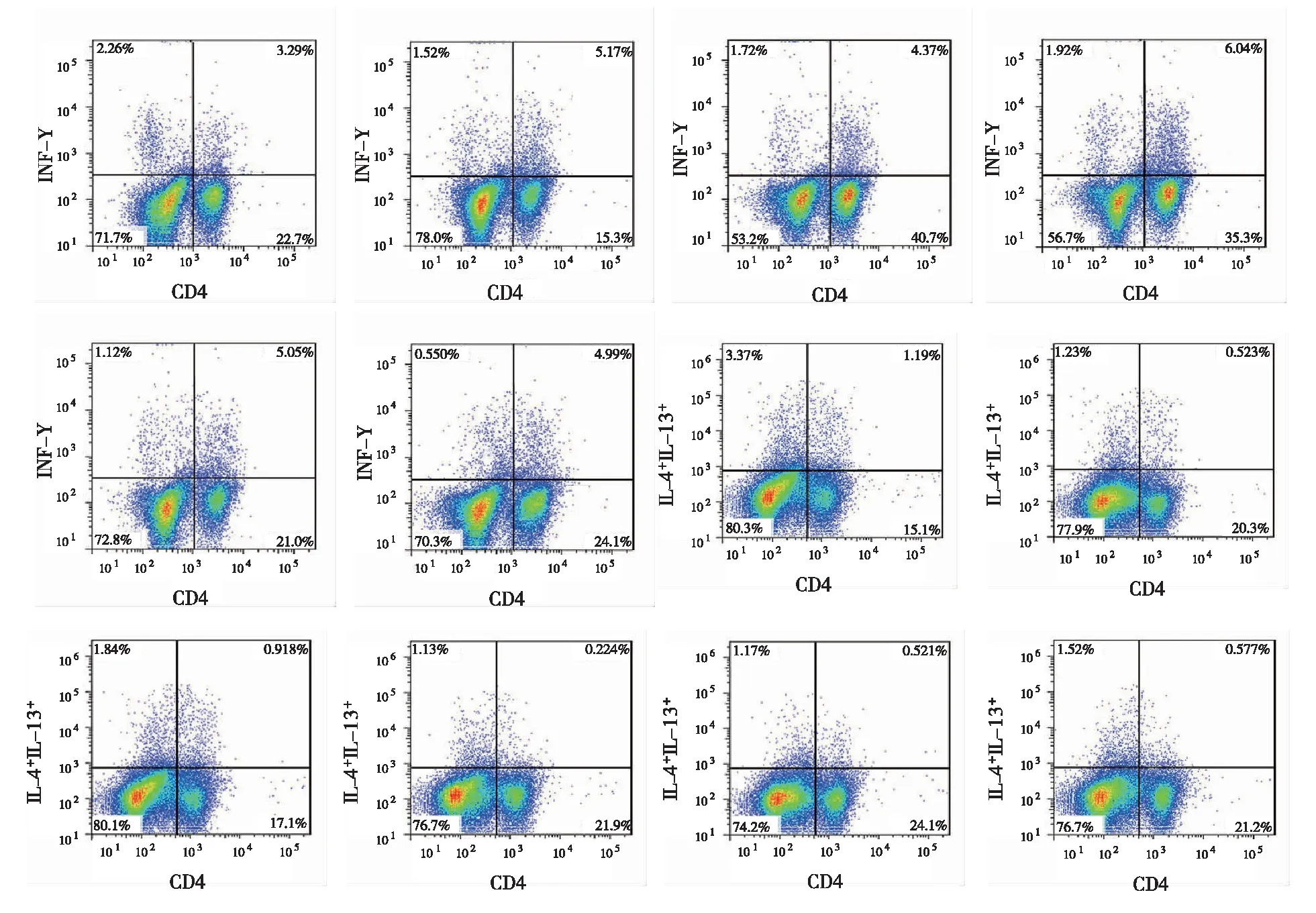
A:正常对照组;B:模型组;C:中药组;D:pcDNA-IL-33组;E:中药+pcDNA-IL-33组;F:pcDNA-NC组。
2.4 各组大鼠鼻黏膜组织病理变化及嗜酸性粒细胞数目比较 正常对照组鼻黏膜组织结构正常,无明显损伤。模型组大鼠可见鼻黏膜组织水肿、上皮脱落、腺体增生,嗜酸性粒细胞及淋巴细胞浸润明显,胞核为杆状或分叶状、胞浆呈鲜红色的嗜酸性粒细胞数目增多(P<0.05)。与模型组相比,中药组大鼠鼻黏膜组织水肿、上皮脱落及炎性浸润明显缓解,嗜酸性粒细胞数目减少(P<0.05);pcDNA-IL-33组大鼠鼻黏膜组织病理损伤进一步加重,嗜酸性粒细胞数目进一步升高(P<0.05)。中药+pcDNA-IL-33组上述指标变化与中药组相反(P<0.05,见表4,图2)。
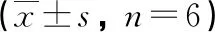
表4 大鼠嗜酸性粒细胞数目比较
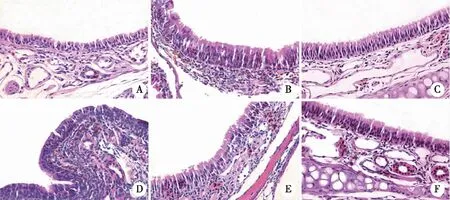
A:正常对照组;B:模型组;C:中药组;D:pcDNA-IL-33组;E:中药+pcDNA-IL-33组;F:pcDNA-NC组;×200。
2.5 各组大鼠鼻腔灌洗液TNF-β、IL-2、IL-6、IL-9表达比较 与正常对照组相比,模型组大鼠鼻腔灌洗液TNF-β、IL-2水平降低(P<0.05),IL-6、IL-9水平升高(P<0.05)。与模型组相比,中药组大鼠鼻腔灌洗液TNF-β、IL-2水平升高(P<0.05),IL-6、IL-9水平降低(P<0.05);pcDNA-IL-33组大鼠鼻腔灌洗液TNF-β、IL-2水平进一步降低(P<0.05),IL-6、IL-9水平进一步升高(P<0.05)。中药+pcDNA-IL-33组上述指标变化与中药组相反(P<0.05,见表5)。
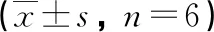
表5 大鼠鼻腔灌洗液TNF-β、IL-2、IL-6、IL-9表达水平比较
2.6 各组大鼠鼻黏膜组织IL-33、ST2阳性表达比较 与正常对照组相比,模型组大鼠鼻黏膜组织IL-33、ST2阳性表达水平升高(P<0.05)。与模型组相比,中药组大鼠鼻黏膜组织IL-33、ST2阳性表达水平降低(P<0.05);pcDNA-IL-33组大鼠鼻黏膜组织IL-33、ST2阳性表达平进一步升高(P<0.05)。中药+pcDNA-IL-33组上述指标变化与中药组相反(P<0.05,见图3,表6)。
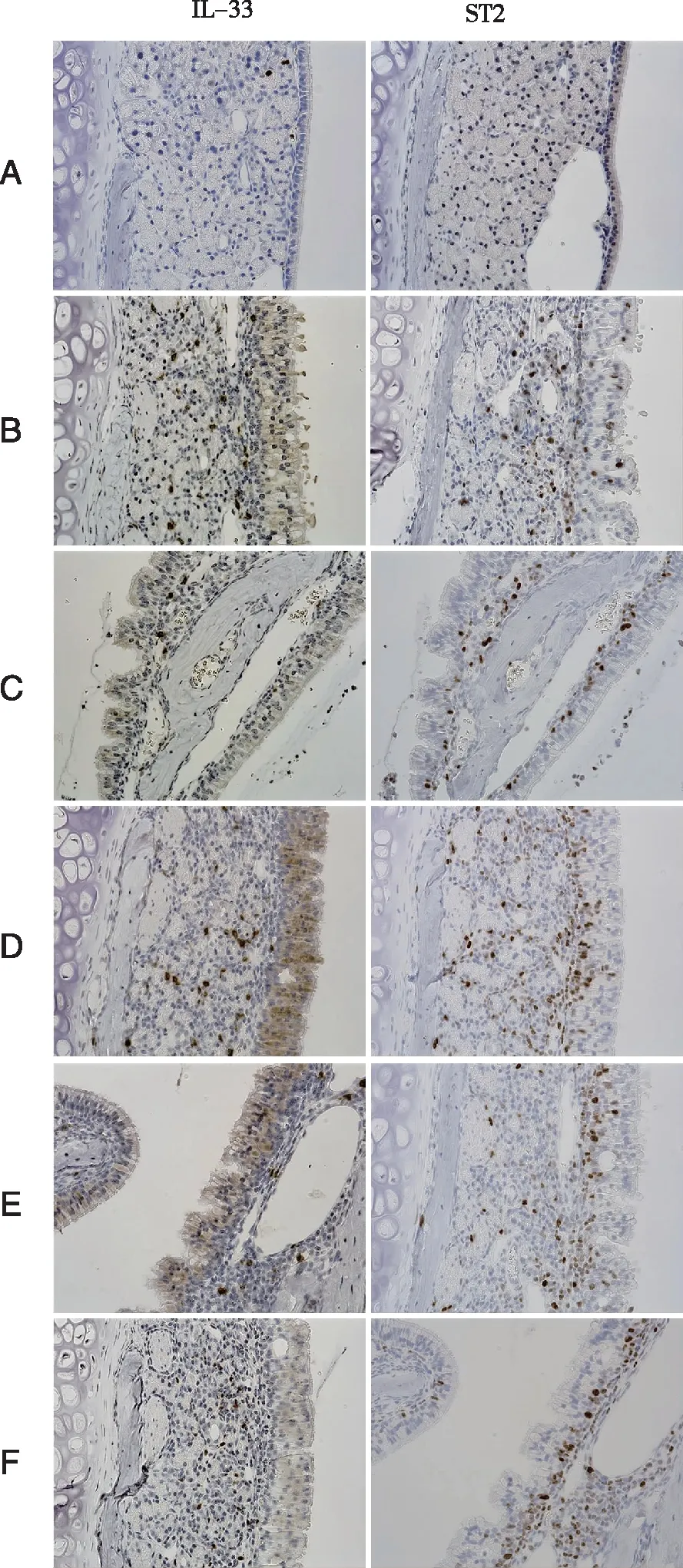
A:正常对照组;B:模型组;C:中药组;D:pcDNA-IL-33组;E:中药+pcDNA-IL-33组;F:pcDNA-NC组;×200。
表6 大鼠鼻黏膜组织IL-33、ST2阳性表达比较
2.7 各组大鼠鼻黏膜组织IL-33、MyD88、TRAF6、T-bet、Gata3蛋白表达比较 与正常对照组相比,模型组大鼠鼻黏膜组织IL-33、MyD88、TRAF6、Gata3蛋白表达升高(P<0.05),T-bet蛋白表达降低(P<0.05)。与模型组相比,中药组大鼠鼻黏膜组织IL-33、MyD88、TRAF6、Gata3蛋白表达降低(P<0.05),T-bet蛋白表达升高(P<0.05);pcDNA-IL-33组大鼠鼻黏膜组织IL-33、MyD88、TRAF6、Gata3蛋白表达进一步升高(P<0.05),T-bet蛋白表达进一步降低(P<0.05)。中药+pcDNA-IL-33组上述指标变化与中药组相反(P<0.05,见图4,表7)。
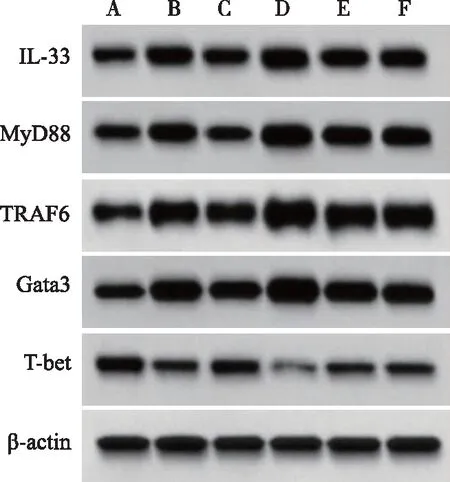
A:正常对照组;B:模型组;C:中药组;D:pcDNA-IL-33组;E:中药+pcDNA-IL-33组;F:pcDNA-NC组。
表7 大鼠鼻黏膜组织IL-33、MyD88、TRAF6、Gata3、T-bet蛋白表达比较
3 讨论
AR主要以间歇性、持久性的鼻塞、喷嚏、清水样涕、鼻痒为临床症状,严重影响患者的工作和生活[9]。AR患者机体接触变应原或同种变应原再次进入机体后,机体产生的免疫球蛋白(IgE)可刺激肥大细胞脱颗粒活化,并释放大量组胺、半胱氨酰白三烯等多种炎症介质,加快细胞因子如IL-8、趋化因子如CCL2及生长因子如TGF-β等合成,刺激鼻黏膜毛细血管,增加鼻黏膜通透性及腺体分泌,介导AR鼻黏膜组织非感染性损伤的产生[10]。另外,AR患者机体产生IgE抗体时,也会刺激T淋巴细胞、嗜酸粒细胞、肥大细胞等免疫效应细胞,向鼻黏膜组织浸润,引起鼻黏膜组织损伤[11]。故IgE水平及嗜酸粒细数目,在AR诊断中有重要意义[12]。本研究构建AR模型后发现,大鼠血清IgE、IL-8、CCL2水平及外周血嗜酸粒细胞数目异常升高,AR症状评分(抓鼻、喷嚏、流涕等)明显升高,鼻黏膜组织水肿、上皮脱落、腺体增生、嗜酸性粒细胞及淋巴细胞浸润等病理损伤加重,提示造模成功。
近年来通过中药配方治疗疾病的案例逐渐增多,“芪丹益肺通窍颗粒”由玉屏风散加味而成,被证实在治疗肺气虚症性AR效果显著。许江涛等[13]及刘慧霞等[7]发现玉屏风散及加味后的“芪丹益肺通窍颗粒”可显著改善AR大鼠鼻黏膜组织炎症损伤,但具体的作用机理尚不清楚。本研究发现“芪丹益肺通窍颗粒”干预治疗后,大鼠血清IgE、IL-8、CCL2水平及外周血嗜酸粒细胞数目明显降低,AR症状评分降低,鼻黏膜组织病理损伤明显缓解,证实“芪丹益肺通窍颗粒”对AR有较好的治疗效果。但具体的作用机制有待进一步探究。
有文献指出,变应原或同种变应原入侵机体时,机体效应细胞-T淋巴细胞可迅速识别并呈递抗原,并介导机体细胞免疫及体液免疫的产生及转换,参与机体免疫应答过程[14]。T淋巴细胞可分化成Th1细胞及Th2细胞[15]。其中Th1细胞主要分泌IL-2、TNF-β等细胞因子,作用于B细胞抑制IgE生成,从而介导细胞免疫[16]。Th2细胞可分泌IL-6、IL-9等炎症因子刺激嗜酸性粒细胞趋化、上调黏附分子黏附与聚集、启动B淋巴细胞合成IgE等介导体液免疫反应[17]。当机体受到异常抗原刺激时,Th2细胞因子会过度表达,Th1细胞功能受到抑制,Th1/Th2比例失衡,细胞免疫反应减弱,导致AR等过敏性疾病的产生[18]。本研究发现,AR大鼠外周血Th1比例降低,Th2比例升高,Th1/Th2降低,鼻腔灌洗液中IL-2、TNF-β分泌减少,但IL-6、IL-9比例升高,提示AR大鼠出现Th1/Th2免疫功能失衡现象,与上述研究机理相一致。
ST2是IL-33的唯一受体,可表达于嗜酸粒细胞、肥大细胞、Th2细胞等免疫效应细胞中,在AR疾病中扮演重要角色[19]。研究证实,在AR疾病中,过敏原反复刺激机体导致鼻黏膜上皮细胞受损、坏死时,组织释放的IL-33可与各种免疫细胞表面的ST2受体结合,加速炎性细胞增殖活化,促进Th2型细胞转录因子(Gata3)表达,进一步抑制Th1型细胞转录因子(T-bet)表达,导致Th2型细胞功能过度激活,介导免疫失衡,IL-33/ST2通路在Th1/Th2免疫功能调节中发挥重要作用[4, 20]。本研究发现,AR大鼠黏膜组织上皮细胞胞浆中ST2、IL-33表达异常升高,MyD88、TRAF6表达升高,进一步上调IL-33表达后,大鼠Th1/Th2免疫功能失衡及AR症状加重,提示IL-33/ST2通路活化,可能是引起Th1/Th2免疫功能失衡,AR变应性炎症损伤发生的关键通路之一。本研究发现,“芪丹益肺通窍颗粒”组大鼠鼻黏膜组织中IL-33/ST2表达降低,Th1/Th2免疫功能逐渐恢复正常,提示“芪丹益肺通窍颗粒”抑制大鼠AR症状及鼻黏膜组织损伤可能与抑制IL-33/ST2通路激活有关。上调IL-33表达,可逆转“芪丹益肺通窍颗粒”的上述作用。
综上所述,“芪丹益肺通窍颗粒”可能通过抑制IL-33/ST2通路激活,抑制Th1/Th2免疫功能向Th2偏移,缓解大鼠AR症状。但机体免疫调节机制复杂,涉及多条通路共同调节,是否有其他通路间接参与调控“芪丹益肺通窍颗粒”改善大鼠AR变应性炎症症状,还需继续深入研究。
