卵圆孔未闭超声诊断中国专家共识
2023-03-02中国医师协会心血管内科医师分会结构性心脏病学组
中国医师协会心血管内科医师分会结构性心脏病学组
心源性脑卒中人群的高危预测模型及治疗策略的临床研究课题组
卵圆孔未闭(patent foramen ovale,PFO)的解剖与临床意义认识经历了3个阶段的发展。PFO的早期认识来自于尸体解剖[1],被认为是“无意义”的解剖变异。此后PFO作为“矛盾性栓塞”的潜在通道以及与不明原因脑卒中、偏头痛等疾病的关系被报道,封堵治疗也应运而生,然而2012—2013年发表的临床试验并不支持PFO封堵预防脑卒中的有效性[2-4]。但2017年后发表的4项随机对照试验[5-8]证明PFO封堵治疗不明原因脑卒中安全有效,成为支持有适应证人群经导管PFO封堵治疗的有力证据。至此对PFO的病理及临床意义认识日渐明晰[9-10]。精准、规范诊断PFO是合理选择治疗手段的基础。超声是PFO首选的无创检查手段,也是无创评估PFO的“金标准”,既可用于筛查有无PFO,也可评价可能与栓塞高危及介入治疗并发症相关的解剖特征。针对我国PFO临床诊治现状,我们联合国内超声、结构性心脏病、神经内科专家,总结国内外进展并参阅相关规范与指南[11-14],制定《卵圆孔未闭超声诊断中国专家共识》。
1 卵圆孔胚胎发育与PFO分流机制
房间隔由原发隔、继发隔和房室间隔三部分组成。胚胎第28天,原发隔自心房顶部发生,向发育中的心内膜垫生长,二者之间的孔称为“原发孔”或称“第一房间孔”;在原发孔融合关闭之前,原发隔的顶部逐渐被吸收而出现“继发孔”,又称“第二房间孔”,借此孔左、右心房保持相通。继发隔是由心房顶部向内折叠而形成(介入操作房间隔穿刺经过此折叠处可能导致心脏压塞),紧邻原发隔右侧,于胚胎第40天左右起向下生长,呈新月状,其下缘围成一孔称“卵圆孔(foramen ovale)”。薄且柔软有弹性的原发隔在胚胎期呈瓣膜样位于卵圆孔的左侧,故又称为卵圆孔瓣。卵圆孔和继发孔构成成熟胎心的房间通道。胎儿期,经胎盘获得的含氧血自下腔静脉回流右心房,由下腔静脉瓣引导至房间隔卵圆孔,推开卵圆孔瓣经继发孔进入左心房,再运输到全身脏器。出生后左心房压逐渐升高,卵圆孔瓣被压向继发隔,卵圆孔功能性关闭。出生后2个月左右原发隔与继发隔解剖融合,卵圆孔处只有一层膜性的原发隔组织,形成房间隔最薄弱的区域,即卵圆窝,厚度约2 mm[15]。2/3的小儿在出生后12个月内卵圆孔完全封闭。如3岁以上卵圆孔仍未完全关闭,称之为PFO(图1)。在一项965例人体心脏解剖的研究中,PFO的发生率为27.3%,其中30岁及以下、31~80岁、81~100岁发生率分别为34.3%、25.4%、20.2%;PFO的直径为1~19 mm(平均4.9 mm),其中98%的PFO直径为1~10 mm[1]。
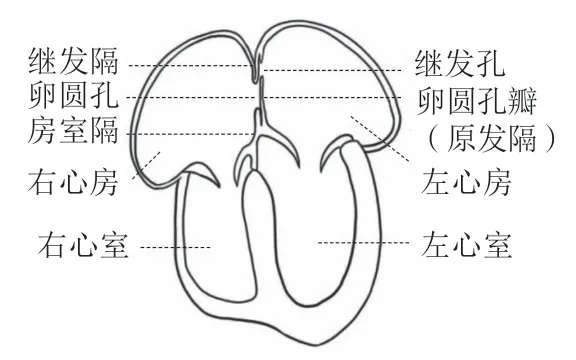
图1 卵圆孔未闭示意图Figure 1 Diagram of patent foramen ovale
原发隔与继发隔重叠处若仅一侧融合而另一侧开放,可形成盲袋样结构,称为“房间隔囊袋(atrial septal pouch)”,多数情况下囊袋开口向左心房侧(图2),是潜在血栓形成部位并可能增加体循环栓塞风险[16];部分开口向右心房侧(图3),有报道房间隔穿刺操作并发症(房间隔夹层、穿孔)与此变异相关[17]。若原发隔发育质量较差或较长,在卵圆窝处可形成瘤样膨出,是房间隔膨出瘤(atrial septal aneurysm,ASA)形成的基础,此时发育不良的原发隔常不能与继发隔融合而合并存在PFO。通常情况下左心房压高于右心房压,ASA凸向右心房侧;右心房压高时凸向左心房侧;也可随心动周期和呼吸摆动,交替凸向右侧或左侧。ASA的诊断标准为凸向一侧深度超过中线>10 mm或左右摆动深度之和>15 mm[12](图4)。
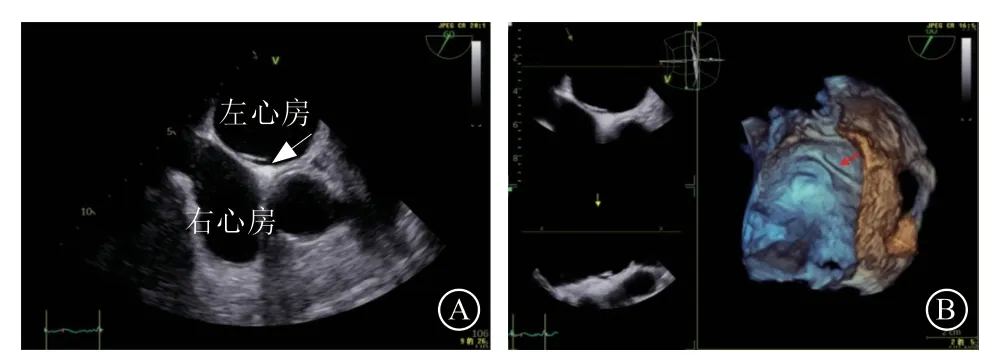
图2 左侧房间隔囊袋Figure 2 Left side atrial septal pouch
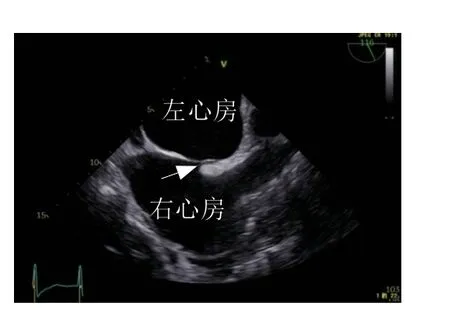
图3 右侧房间隔囊袋Figure 3 Right side atrial septal pouch
欧氏瓣(Eustachian valve)是胎儿期下腔静脉瓣退化不良的残留组织,PFO合并过长欧氏瓣时(图4),可因欧氏瓣阻止卵圆孔功能性关闭而增加矛盾性栓塞风险[18]。希阿里网(Chiari network)是静脉窦右瓣的残余(图5),可出现在右心房的不同部位,包括下腔静脉口和冠状静脉窦口附近,表现为丝网状结构,存在于2%~3%的普通人群中,与PFO和ASA相关[19]。
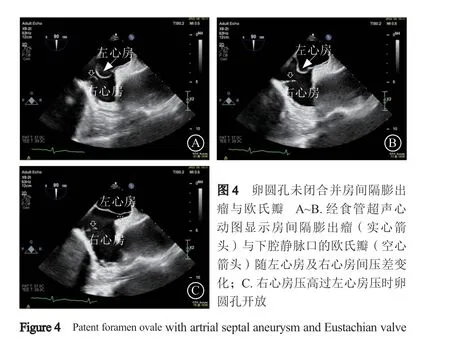

图5 卵圆孔未闭合并房间隔膨出瘤与希阿里网 A.经胸超声心动图胸骨旁四腔切面显示房间隔膨出瘤(实箭头)与右心房内希阿里网(空心箭头);B.显示房间隔膨出瘤边缘卵圆孔未闭的左向右过隔分流Figure 5 Patent foramen ovale with artrial septal aneurysm and Chiari network
典型PFO是位于房间隔前上部、右下-左上走行的原发隔与继发隔之间的潜在缝隙。通常情况下左心房压比右心房压高3~5 mmHg(1 mmHg=0.133 kPa),卵圆孔可呈功能性闭合状态,仅当右心房压升高超过左心房压时产生间歇性右向左分流(right to left shunt,RLS)。有些病例中,PFO可呈类似隧道样的功能性开放状态,静息时左向右分流,而当右心房压升高超过左心房压时出现短暂RLS;部分病例中,因心房扩张和重构导致继发隔前缘“拉伸”而与原发隔错位形成缺损,称为“拉伸型”PFO,分流方向同样取决于左心房与右心房间的压差[12]。DEFENSE-PFO研究[8]中,静息情况下41.7%~43.3%的PFO患者无分流,51.7%~56.7%左向右分流,5%RLS,1.7%双向分流。总的来说,PFO因解剖特征与左右心房间压差情况可表现为无分流、左向右分流、RLS或双向分流,但所有PFO都会在右心房压升高超过左心房压时(如咳嗽、Valsalva动作、容量负荷过重、肺血管疾病、呼气末正压)出现或间歇短暂或持续的RLS。RLS是PFO诊断的关键和PFO导致矛盾性栓塞的基础。

要点.P FO能性隔“是房间隔原发隔与继发隔之间右下-左上走行的通道,可为功 贴合的潜在缝隙、持续开放的“隧道样”结构或原发隔与继发 拉伸型”错位结构。.静息状态下PFO 可无分流、左向右分流、RLS 或双向分流,但所有PFO 在右心房压力升高超过左心房时都会发生短促或持续的RLS。
2 PFO超声评估
2. 1 经胸超声心动图(transthoracic echocardiography,TTE)
TTE筛查PFO时应从不同角度全面探查房间隔,包括胸骨旁心底短轴切面、心尖四腔切面、剑突下四腔与双心房切面等,彩色多普勒血流显像标尺下调至35~40 cm/s,以便显示低速分流信号。可使用局部放大功能观察房间隔解剖结构,同时评价有无欧氏瓣、希阿里网、ASA及其他合并异常等。TTE常无法清晰显示PFO解剖结构,通常通过彩色多普勒血流显像发现斜行穿房间隔分流信号诊断PFO。“拉伸型”或隧道样持续开放的PFO较易探及左向右分流信号,而间歇的低速RLS多普勒不易探及。故单独TTE对PFO诊断特异度高而敏感度低,须结合右心声学造影评价潜在RLS。
要点
.TTE 发现斜行穿房间隔分流信号可间接诊断PFO,单独TTE 诊断PFO 敏感度低。
2. 2 经食管超声心动图(transesophageal echocardiography,TEE)
TEE近距离高频率高分辨率探查房间隔,能够清晰显示房间隔动态结构。行TEE时,应至少以15°间隔连续扫查房间隔,彩色多普勒血流显像标尺调低至25~40 cm/s观察分流信号[20]。房间隔为复杂、动态的三维解剖结构,PFO形态也千差万别,三维TEE可直观显示PFO动态变化及其周围结构。因PFO形态随心动周期及左右心房压差而动态变化,其大小也动态改变,建议TEE测量PFO静息直径与开放直径(有效Valsalva动作后的最大直径),及静息长度与Valsalva动作后长度(原发隔与继发隔重叠长度,图6)。
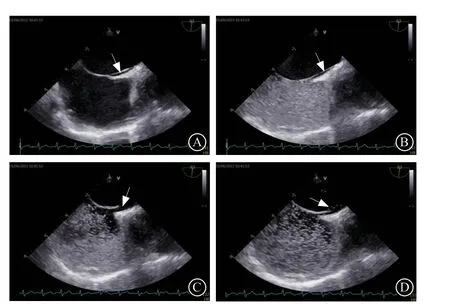
图6 卵圆孔未闭右心声学造影 A.经食管超声心动图可见房间隔原发隔与继发隔间缝隙(箭头所示);B.右心声学造影静息相右心房可见高回声气泡显影、左心房无显影;C.Valsalva 动作后,卵圆孔开放(箭头所示);D.右心房内气泡经卵圆孔进入左心房(箭头所示)Figure 6 Contrast echocardiography of patent foramen ovale
PFO的解剖特征与矛盾性栓塞风险、PFO介入治疗难度、封堵器选择以及介入并发症等密切相关[21]。TEE除观察原发隔与继发隔间是否存在缝隙与分流外,还应全面评价PFO相关解剖,包括缝隙长度、左心房面与右心房面开口大小、原发隔摆动度、是否合并存在ASA、房间隔缺损、欧氏瓣、希阿里网、继发隔是否增厚等,以判断PFO为简单型或复杂型[11],见表1。除表1中各参数外,原发隔与继发隔自发分离(PFO持续开放)、房间隔高摆动性(随心动周期摆动性≥5 mm)、PFO与下腔静脉的角度≤10º等也被认为是“高危”PFO解剖特征。2021年PASCAL评分被用来评估PFO相关脑卒中的可能性,包括ROPE评分(≥7)和PFO相关解剖(大量RLS和ASA)两个指标[22]。如果以上两个指标都存在,提示PFO相关脑卒中可能性很大;如果以上两个指标只存在一个,提示PFO相关脑卒中可能性中等;如果没有上述的任何一个指标,提示PFO相关脑卒中可能性不大。

表1 复杂型卵圆孔未闭的解剖特征[11]Table 1 Anatomical characteristics of complex patent foramen ovale

?要点.TEE 诊断PFO 须观察到原发隔与继发隔间缝隙、且同时观察到穿间隔分流信号。对功能性贴合的PFO 或静息状态下无分流的PFO,单独TEE 仍无法建立诊断。.TEE 须同时评价PFO 相关解剖特征,包括PFO 隧道长度、左心房面与右心房面开口大小、原发隔摆动度、是否合并存在房间隔膨出瘤、房间隔缺损、欧氏瓣、希阿里氏网、继发隔增厚等,以判断PFO 为简单型或复杂型。
尽管TEE能够详尽评估房间隔解剖,但对PFO的潜在分流评估仍有局限,如对于静息状态下原发隔与继发隔贴合而功能性关闭的卵圆孔,TEE虽可观察到两层贴合的房间隔结构,但多普勒无法探及分流,仍无法建立PFO诊断。TEE联合右心声学造影被认为是PFO诊断的“金标准”[12,23],理想情况下,可直接观察到微泡经PFO缝隙穿过房间隔进入左心房。但由于患者口含经食管超声探头或者在全身麻醉下检查,可能无法实现有效激发动作。故应结合经胸超声心动图右心声学造影(transthoracic contrast echocardiography,cTTE)结果进行判断[13]。
2. 3 右心声学造影
明确穿房间隔的分流是诊断PFO的必要条件。PFO的分流常为非连续性的低速血流,彩色多普勒血流显像难以探及,但超声可敏感显示血液中的微气泡(表现为高亮回声),配合生理动作升高右心房压激发RLS,可提高探查PFO的敏感度。静脉注射右心声学对比剂后,微气泡随血液回流右心房、右心室、肺动脉,因微气泡直径较大无法通过肺毛细血管网,而在毛细血管前嵌顿破裂,气体由肺呼出,故正常情况下右心可见亮而密的气泡显影,而左心无显影,故名“右心声学造影”。存在PFO时,静息状态下多无左心显影;当存在病理性右心房压力增高时,可能存在持续性或间歇性左心显影;配合激发动作右心房压升高超过左心房压时产生瞬时RLS,微气泡进入左心房、左心室而出现一过性、短促左心显影。需鉴别的是肺动-静脉分流时(如肺动静脉瘘)右心声学造影也为阳性结果,此时左心气泡显影表现为延迟出现、延迟消散的“迟滞”显像,且通常在静息情况下就可出现。
2. 3. 1 右心声学造影对比剂 通常使用震荡生理盐水(空气微泡),也有中心使用含二氧化碳类等微泡对比剂[24]。制备震荡生理盐水,准备2只10 ml注射器,经三通与静脉连接。一只注射器抽取9 ml生理盐水+1 ml空气,或8 ml生理盐水+1 ml回抽血液+1 ml空气,经三通与另一注射器联通,来回推动至空气混匀于盐水中,盐水充分浊化后,旋转三通使含震荡盐水的注射器与静脉相通,弹丸式注射(2~3 s内)入静脉内。加入血液的震荡盐水可增加微泡浓度[25]。
2. 3. 2 静脉路径 通常选择回心距离近、便于操作的上肢肘静脉或贵要静脉。如需评价可能存在的左位上腔静脉引流入冠状静脉窦及无顶冠状静脉窦综合征时,须选择左侧上肢静脉。存在明显欧氏瓣等特殊情况下,如考虑因欧氏瓣遮挡造成假阴性结果,可选择经下肢静脉注射对比剂。
2. 3. 3 超声图像采集 连续采集储存动态图像,自右心房出微泡起10~15个心动周期,或10~30 s,便于逐帧回放判读。TTE通常使用心尖四腔切面观察;TEE探查房间隔的最佳成像角度为30°~100°,双平面成像可提高探查细束RLS的敏感度。
2. 3. 4 激发动作 右心造影须包含静息相与激发相。PFO在静息状态下注射对比剂可能观察不到RLS微泡,也可为偶发、瞬时左心微泡显影。嘱患者做可瞬间增加右心房压力的动作,激发RLS,对于PFO诊断至关重要。经典的激发动作是Valsalva动作,即正常或深吸气后声门关闭做用力屏气动作、再快速呼气,Valsalva动作要保持足够长的时间(通常至少为5 s以上),以使微泡充满右心房。除经典Valsalva动作外,视患者配合情况,还可选择改良Valsalva动作(嘱患者吹注射器,或吹连接压力计的导管达到并维持40 mmHg)、腹部加压(检查者用手按压患者腹部并嘱患者用力对抗)及咳嗽等动作。先对患者进行训练,并通过观察房间隔是否能够在激发动作释放期膨向左侧(表明右心房压力超过左心房)或使用脉冲多普勒观察二尖瓣口舒张期血流频谱E峰是否下降超过20%来判断激发动作是否有效。
为避免激发动作不充分造成假阴性结果,当结果不明确时,应至少重复3次激发动作。激发动作与对比剂注射时机要充分配合。激发动作包含张力期(憋气)与释放期(呼气),释放期须快速吐气,以使回流右心房血量瞬时增加以推开卵圆孔瓣。
2. 3. 5 结果判读 (1)静息相、激发相左心均无微泡显影,为阴性,无RLS。(2) 静息相左心无显影,或出现偶发、不连续的微泡显影,激发相(尤其是释放期)左心出现瞬时明显微泡显影,为阳性,提示为PFO-RLS。PFO的左心显影与心房间动态压差相关,静息状态下左心显影出现时间不固定,与激发动作相关的瞬时左心显影是诊断关键。(3)静息相右心房显影3~6个心动周期后左心出现连续、持续的微泡显影,左心微泡清空晚于右心,为阳性,提示为肺动静脉分流(如肺动静脉瘘、肝肺综合征等)。激发动作后,张力期因回左心血量减少,左心微泡显影可随之减少,释放期因回左心血量增多、微泡显影也可随之增加。对于静息相左心无显影者,基本可排除肺动静脉分流。(4)静息相右心房显影3~6个心动周期后左心出现连续、持续的微泡显影,激发相左心出现明显的瞬时显影增加,不能除外PFO与肺动静脉分流并存,应在微泡清空后再次行激发动作。注意在右心房尚无微泡回流时就要开始充分的激发动作,理想的情况是释放期微泡瞬时进入右心房,观察释放后左心显影出现的时间,PFO在右心显影后3~6个心动周期内出现瞬时左心显影,而肺动静脉分流左心显影出现在3~6个心动周期后且为持续显影。特殊情况下,如不能区分PFO与肺动静脉瘘,可以穿刺股静脉,将导管置于肺动脉行声学造影,如左心显影,可考虑为肺动静脉分流。同时导管可分别置于左右肺动脉以初步判断肺动静脉分流的部位。(5)阳性标准与分流量判定:分流量的多少以充分激发动作后的左心最大显影量为判断依据。
cTTE(图7):以静止单帧图像上左心腔内出现的最大微泡数量进行分级。0级,左心腔内没有微泡,无RLS;Ⅰ级,左心腔内<10个微泡/帧,为少量RLS;Ⅱ级,左心腔内10~30个微泡/帧,为中量RLS;Ⅲ级,左心腔内可见>30个微泡/帧,或左心腔几乎充满微泡、心腔混浊,为大量RLS[11]。大量微泡无法计数或充满左心腔时应在报告中注明。须注意左心微泡的数量也取决于注入的微泡浓度及激发动作的充分性。经食管超声心动图右心声学造影(contrast transesophageal echocardiography,cTEE;图8):建议将静止单帧图像上左心房内出现的最大微泡数量>20个,定义为大量RLS[22]。

图7 经胸超声心动图右心声学造影显示右向左分流量判断 A. Ⅰ级,左心腔内<10 个微泡/帧,为少量右向左分流;B.Ⅱ级,左心腔内10~30 个微泡/帧,为中量右向左分流;C.Ⅲ级,左心腔内可见>30个微泡/帧,为大量右向左分流;D.大量微泡无法计数或充满左心腔Figure 7 Grading right to left shunting on contrast transthoracic echocardiography
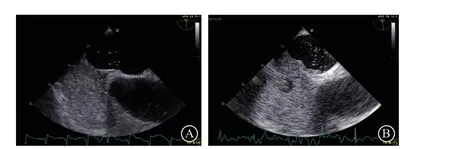
图8 经食管超声心动图右心声学造影显示右向左分流量判断 A.少量右向左分流;B.静止单帧图像上左心房内出现的最大微泡数量>20 个,为大量右向左分流Figure 8 Grading right to left shunting on contrast transesophageal echocardiography
文献报道部分健康人群可以存在生理性Ⅰ~Ⅱ级肺循环来源微泡[26-27]。亦有报道以TTE激发动作后左心至少1个微泡显影为阳性诊断标准,PFO-RLS诊断的敏感度为99%,但特异度为57%;而以至少5个微泡为阳性标准,则PFO-RLS诊断的敏感度为99%,特异度为89%,诊断准确性为95%[28]。提示以左心至少5个微泡显影作为PFO-RLS阳性诊断标准更合理。
2. 4 对比增强经颅多普勒超声(contrast transcranial doppler,cTCD)

要点. 明确穿房间隔分流是诊断PFO 的必要条件。右心声学造影用于明确诊断有无穿房间隔RLS 及分流量。. 右心声学造影用于PFO 诊断强调对比剂微泡浓度及充分的激发动作。.PFO-RLS 表现为与激发动作(右心房压力升高)相关的短促、一过性、快速消散的左心显影。
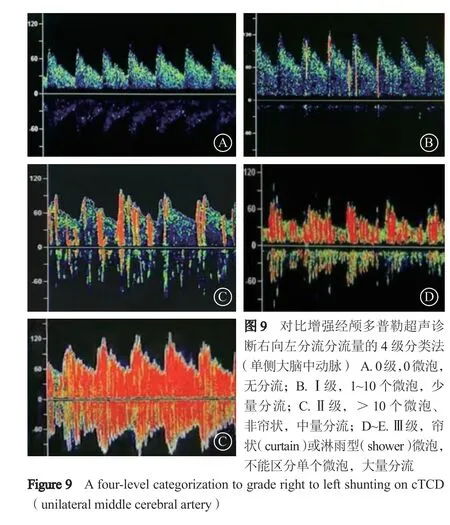
cTCD对比剂制备及注射操作与右心声学造影相同。因为微泡至脑血管的路径较长,微泡破裂导致假阴性的可能性较cTTE高,建议cTCD使用混血的激活生理盐水作为对比剂。每次开始注射时开始计时,注射5 s时开始充分的Valsalva动作,持续至少5 s。通过观察大脑中动脉的血流速度判断是否为有效的Valsalva动作,血流速度较基线下降25%为有效的Valsalva动作,必要时可延长Valsalva动作的时间至10 s。记录20~25 s内一侧大脑中动脉记录的微泡信号数目。每次注射操作后待最后一个微泡信号消失时至少再等待40 s,再开始下一次注射操作。如超声不能穿透颞窗监测大动脉中动脉,可以选择经枕窗监测椎基底动脉。cTCD根据大脑中动脉记录的微泡信号数目对RLS进行分级。4级分类法(单侧大脑中动脉,如双侧分流量不完全一致,记录分流量较大的一侧)[29]:0级,0微泡,无分流;Ⅰ级,1~10个微泡(双侧1~20个),为少量RLS;Ⅱ级,>10个微泡(双侧>20个)、非帘状,为中量RLS;Ⅲ级:微泡信号呈帘状(curtain)或淋雨型(shower)、不能区分单个微泡,为大量RLS。我国学者提出的改良的4级分类法(单侧大脑中动脉)[30]:0微泡,无分流;1~10个微泡,少量RLS;11~25个微泡,中量RLS;>25个微泡,大量RLS。分流量大且无法计数单个微泡,应在报告中注明“大量分流,呈雨帘状”(图9)。

要点.cTCD 用于诊断是否存在RLS 及分流量。.PFO-RLS 表现为与激发动作(右心房压力升高)相关的短促、一过性、快速消散的左心显影或大脑中动脉微泡信号。cTCD 不易直观区分分流来自心内(如PFO)或心外(如肺动静脉分流)。
2. 5 心腔内超声(intracardiac echocardiography,ICE)
ICE一般不用于PFO的术前诊断,但可以在封堵术中实时成像以进行诊断和评估,减少X线曝光时间,耐受性良好。其作用:(1)封堵术中卵圆窝局部解剖评估,包括PFO隧道的长度,入口和出口宽度;有无欧氏瓣或希阿里网,是否合并房间隔缺损、ASA等;结合彩色多普勒超声,可以评估有无房水平分流以及分流方向;也可于术中结合右心声学造影判断PFO是否存在以及分流量大小;(2)指导手术过程和评估封堵效果,如指导导丝导管通过PFO和封堵器释放,观察封堵器的位置形态以及与周边结构的关系,观察牵拉试验时封堵器的稳定性,结合术中彩色多普勒超声以及右心声学造影评估有无残余分流等(图10);(3)评估有无手术并发症,如心包积液等。研究显示ICE对房间隔交通封堵术(包括房间隔缺损和PFO)的指导从2003年的9.7%增加到2014年的50.6%。与TEE组相比,主要不良心血管事件的主要终点发生率较低(分别为11.1%与14.3%,P=0.008)[31]。但由于ICE检查为有创操作,且目前ICE导管价格相对较贵,一定程度上限制了临床使用。伴随ICE临床使用的普及、导管费用的降低以及三维ICE导管的研发,ICE仍有一定临床价值。

?要点.PFO 诊断强调有无PFO(缝隙通道及充分激发动作下的穿房间隔右向左分流)、右向左分流量、相关解剖。.cTTE、cTEE、cTCD 均可用于评价有无右向左分流及分流量。. 初诊建议首选cTTE 或者cTCD。.cTEE 是PFO 诊断“金标准”,可同时评价解剖与右向左分流量。但在激发动作配合不良时须结合cTTE 和(或)cTCD 结果判断分流量。
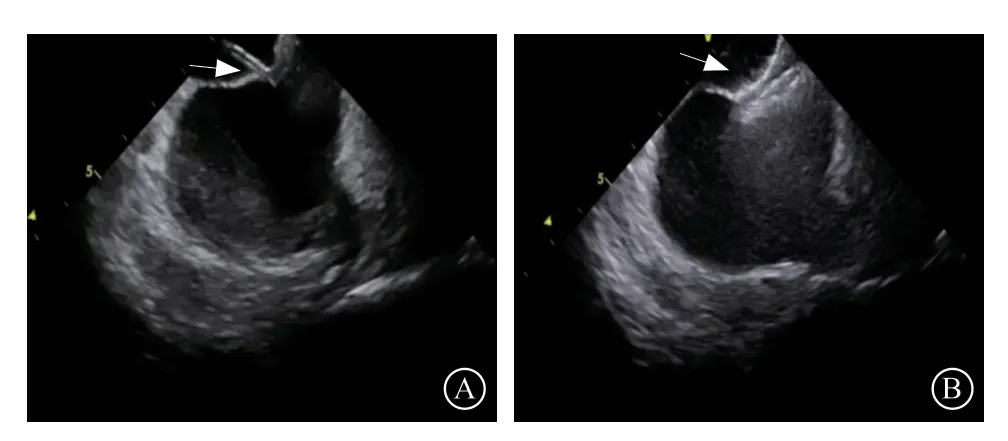
图10 心腔内超声指导下卵圆孔未闭封堵 A. 鞘管通过卵圆孔未闭(箭头所示);B.封堵器释放后形态(箭头所示)Figure 10 Patent foramen ovale closure guided by intracardiac echocardiography

?要点.ICE 用于有条件或困难病例PFO 封堵术中评价。
2. 6 cTTE、cTEE、cTCD对比
诊断PFO及RLS分级,强调对比剂微泡浓度及充分的激发动作。虽然cTEE被认为是PFO诊断的“金标准”,但也有报道cTTE与cTEE诊断率相当[32],cTEE诊断PFO敏感度高于cTTE但分流分级低于cTTE[33],及cTTE检出PFO效率优于cTEE[34]。cTCD诊断敏感度高而鉴别RLS来源困难。三种方法的特点对比见表2。
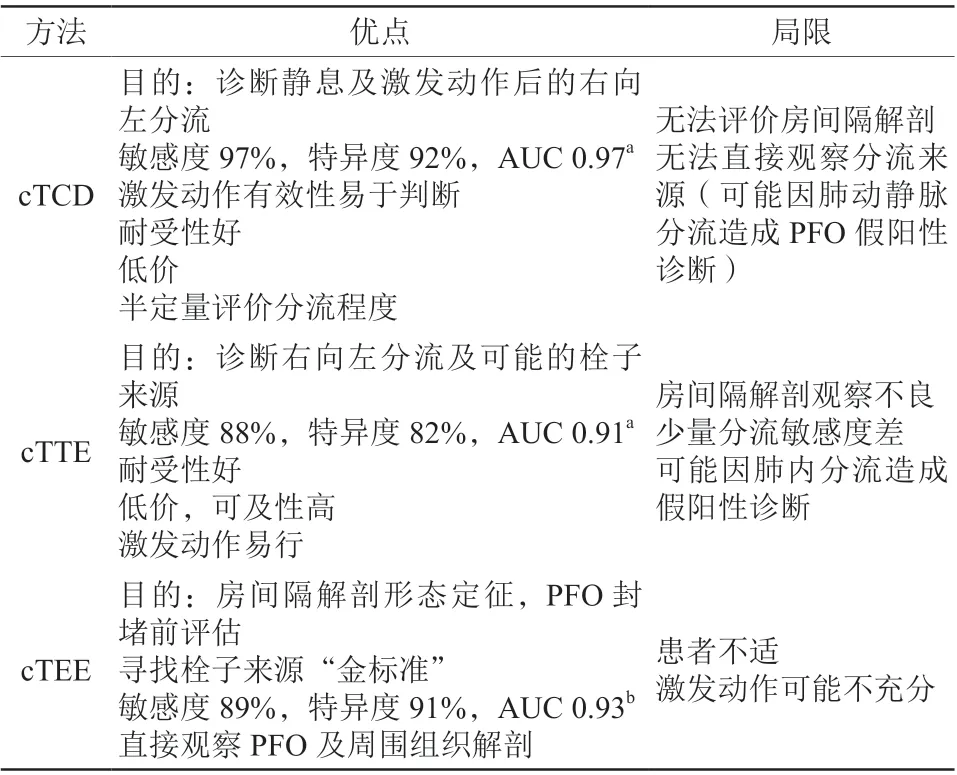
表2 PFO 超声诊断方法[35]Table 2 Patent foramen ovale ultrasonic diagnosis method
3 PFO临床诊断建议
PFO临床诊断应包含是否存在PFO、RLS分流量、PFO相关解剖评价三个层面(图11)。

图11 临床PFO 诊断流程Figure 11 Suggested clinical diagnostic protocol for patent foramen ovale
初筛诊断是否存在PFO及分流量,建议使用cTTE和(或)cTCD,有条件的中心建议二者联合应用提高诊断准确性。诊断困难者进一步行cTEE。TTE应同时评估患者有无ASA、是否存在欧式瓣或者希阿里网、是否存在其他病变及解剖异常。
PFO封堵术前,如果患者无TEE禁忌证,建议使用TEE评价相关解剖。应描述:(1)是否存在ASA(突出方向、深度以及基底宽度);(2)继发隔厚度;(3)是否存在欧氏瓣或者希阿里网;(4)静息及Valsalva动作后房间隔原发隔与继发隔最大分离距离以及重叠长度;(5)是否合并房间隔缺损、左心耳血栓、瓣膜赘生物以及主动脉斑块等。
责任作者:马为(北京大学第一医院),杨颖(北京大学第一医院),吴永健(中国医学科学院阜外医院)
执笔专家:杨颖(北京大学第一医院),马为(北京大学第一医院),孙葳(北京大学第一医院),邱林(北京大学第一医院)
专家组成员(按照姓名汉语拼音排序):白元(中国人民解放军海军军医大学第一附属医院),陈维(同济大学附属第十人民医院),陈晓霖(首都医科大学附属北京天坛医院),董少红(深圳市人民医院),方军(福建医科大学附属协和医院),方臻飞(中南大学湘雅二医院),冯沅(四川大学华西医院),郭然(大连医科大学附属第一医院),韩克(西安交通大学第一附属医院),胡海波(中国医学科学院阜外医院),黄一宁(北京大学第一医院),霍勇(北京大学第一医院),姜小飞(珠海市人民医院),姜正明(郑州大学第一附属医院),蒋世良(中国医学科学院阜外医院),金泽宁(首都医科大学附属北京天坛医院),孔祥清(江苏省人民医院),李飞(中国人民解放军空军军医大学第一附属医院),李捷(广东省人民医院),李元十(哈尔滨医科大学附属第一医院),李越(中国人民解放军总医院第一医学中心),廖晓凌(首都医科大学附属北京天坛医院),刘巍(北京积水潭医院),刘先宝(浙江大学医学院附属第二医院),刘煜昊(河南省人民医院),卢成志(天津市第一中心医院),马登峰(北京大学第一医院太原医院),潘文志(复旦大学附属中山医院),秦永文(中国人民解放军海军军医大学第一附属医院),阮宏云(徐州市中心医院),尚小珂(华中科技大学同济医学院附属协和医院),宋光远(首都医科大学附属北京安贞医院),宋治远(中国人民解放军陆军军医大学第一附属医院),王斌(厦门大学附属心血管病医院),王广义(中国人民解放军总医院第一医学中心),王浩(中国医学科学院阜外医院),王军(北京大学第一医院太原医院),王廉一(清华大学第一附属医院),王硕(首都医科大学附属北京天坛医院),吴永健(中国医学科学院阜外医院),谢明星(华中科技大学同济医学院附属协和医院),袁杰(深圳市人民医院),曾杰(四川省人民医院),张曹进(广东省人民医院),张刚成(武汉大学中南医院),张浩(江苏省人民医院),张龙岩(武汉亚洲心脏病医院),张梅(山东大学齐鲁医院),张申伟(郑州市第七人民医院),张玉顺(西安交通大学第一附属医院),周达新(复旦大学附属中山医院),朱航(中国人民解放军总医院第一医学中心),朱天刚(北京大学人民医院),朱鲜阳(中国人民解放军北部战区总医院),朱政斌(上海交通大学医学院附属瑞金医院)
利益冲突所有作者均声明不存在利益冲突
