急诊经导管主动脉瓣置换术应用于急性心力衰竭患者的临床疗效分析
2023-03-02刘洪艳龙艳丽郭卉徐承义王波
刘洪艳 龙艳丽 郭卉 徐承义 王波
主动脉瓣狭窄患者出现临床症状后的生存年限为2~5年,心力衰竭是其主要死因。在高危患者中,经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)与外科主动脉瓣置换术相比,具有更低的30 d死亡率及并发症发生率[1],目前已成为高危主动脉瓣狭窄患者的一种有效治疗手段[2]。现对武汉亚洲心脏病医院接受急诊TAVR患者的临床资料进行总结,分析其临床疗效及预后的影响因素。
1 对象与方法
1. 1 研究对象
回顾性收集2016年1月至2020年12月武汉亚洲心脏病医院行TAVR患者117例,其中行急诊TAVR共计19例。纳入标准:(1)符合急性心力衰竭诊断标准;(2)符合心原性休克诊断标准;(3)接受急诊TAVR。急性心力衰竭诊断标准:尽管经过标准的合理药物治疗,在休息或轻微活动中,心力衰竭症状和体征仍然不能改善或症状恶化,反复发作。心原性休克的诊断标准:(1)在容量充足的情况下,收缩压<90 mmHg(1 mmHg=0.133 kPa)持续30 min及以上或平均动脉压<65 mmHg持续30 min及以上,或需要血管活性药物才能维持收缩压>90 mmHg ;(2)存在组织器官低灌注表现之一或以上,如神志改变、皮肤湿冷、少尿、血乳酸增高。
1. 2 研究方法
从本院电子病历库中收集患者资料,包括年龄、性别、既往病史、心功能状态、临床检查及化验、术中和术后并发症发生情况及临床转归。
1. 3 手术方法
患者平卧或半卧位,全身麻醉,常规术野消毒,铺无菌巾,经右侧颈内静脉路径留置临时起搏器。右/左侧股动脉切开作为主路径,置入10 F动脉鞘管。穿刺对侧股动脉作为辅路,置入6 F血管鞘。如患者术前无法耐受CT检查,可先行一侧股动脉穿刺并造影,评估冠状动脉、升主动脉、头臂干及股动脉的条件;经辅路送猪尾导管至无冠状动脉窦底部;沿10 F股动脉鞘管送入AL 1/2造影导管至升主动脉,交换直头导丝,跨主动脉瓣至左心室,将AL 1/2造影导管沿导丝送至左心室,经AL 1/2造影导管交换普通导丝至左心室,撤出AL 2造影导管,置入猪尾导管至左心室腔内并测压,将塑形好的超硬导丝交换入左心室腔内;撤出10 F血管鞘,沿超硬导丝置入20 F导引鞘。选工作体位,经食管超声心动图(transesophageal echocardiography,TEE)评估瓣环的直径,并预装瓣膜;选择合适球囊在快速起搏情况下(140~180次/分)进行预扩张;沿超硬导丝送入瓣膜支架至主动脉瓣环合适高度,根据猪尾导管造影调整位置,部分释放后快速起搏,逐步释放瓣膜支架,再次造影或者TEE评估是否需要后扩张;沿超硬导丝送猪尾导管至左心室,撤出超硬导丝;测量左心室压力。经猪尾导管在主动脉瓣根部造影,判断瓣膜反流、瓣周漏及冠状动脉情况。外科缝合股动脉伤口,局部敷料包扎。保留心内膜起搏器24~48 h。
1. 4 统计学分析
采用SPSS 23.0统计软件进行统计分析。对于正态分布的计量资料采用均数±标准差(x-±s)表示,计数资料采用[例(%)]表示。符合正态分布的计量资料采用独立样本t检验,计数资料采用χ2检验,使用Kaplan-Meier曲线进行生存分析。以P<0.05为差异有统计学意义。
2 结果
2. 1 患者临床基线资料
共纳入19例行急诊TAVR的患者,其中男15例(78.9%),平均年龄(73.9±4.7)岁。术前平均N末端B型脑钠肽前体(amino-terminal probrain natriuretic peptide,NT-proBNP)为(19 734.4±13 565.7)pg/ml(表1)。左心室射血分数≤35%者8例(42.1%),单纯主动脉瓣狭窄患者5例(26.3%),合并主动脉瓣关闭不全10例(52.6%),主动脉瓣二瓣化畸形6例(31.6%)。5例(26.3%)合并中重度二尖瓣反流,7例(36.8%)术前出现肺动脉高压,平均肺动脉压力为(57.4±2.2)mmHg(表2)。
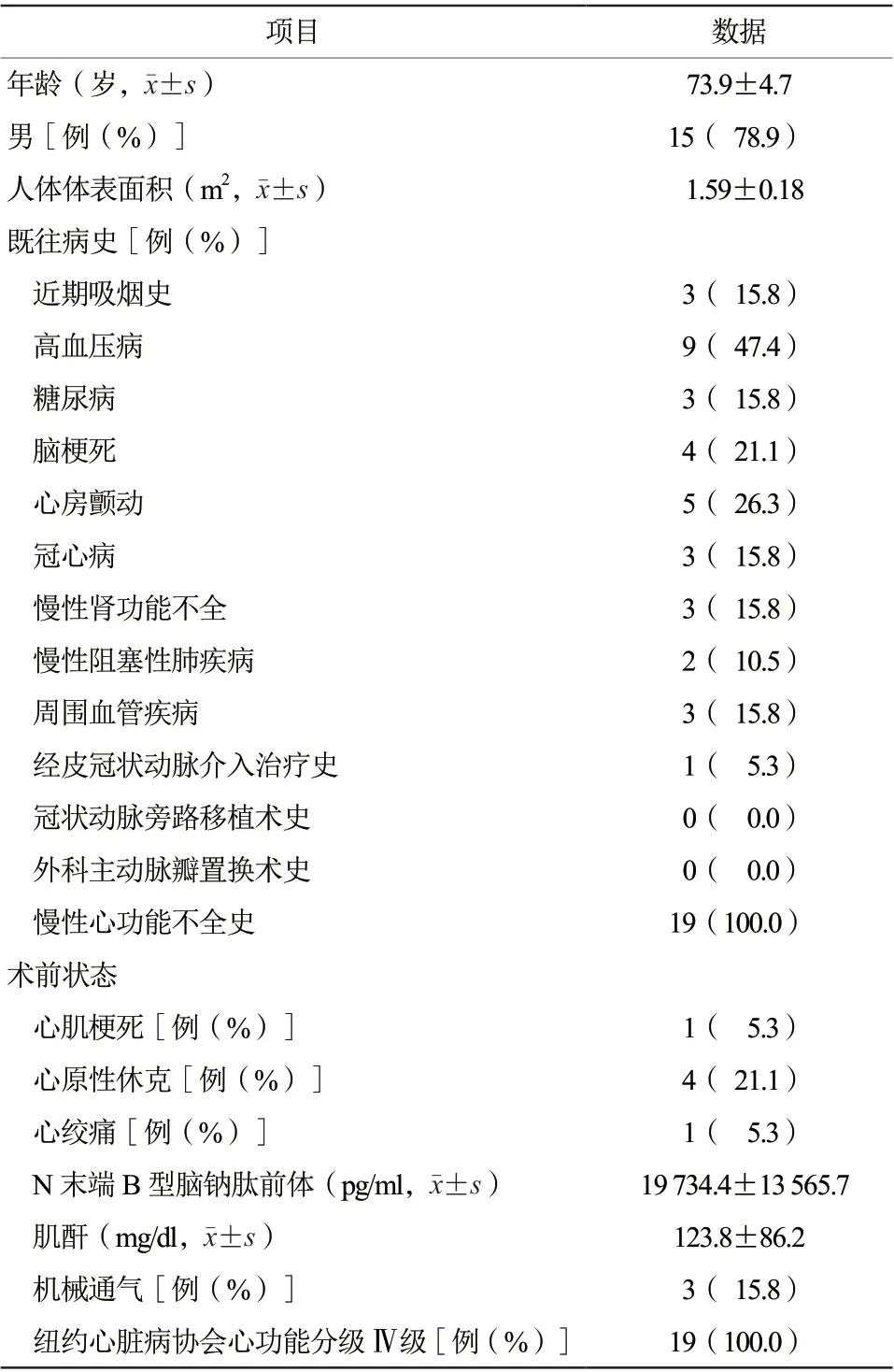
表1 19 例患者术前临床基线资料Table 1 Preoperative clinical baseline information
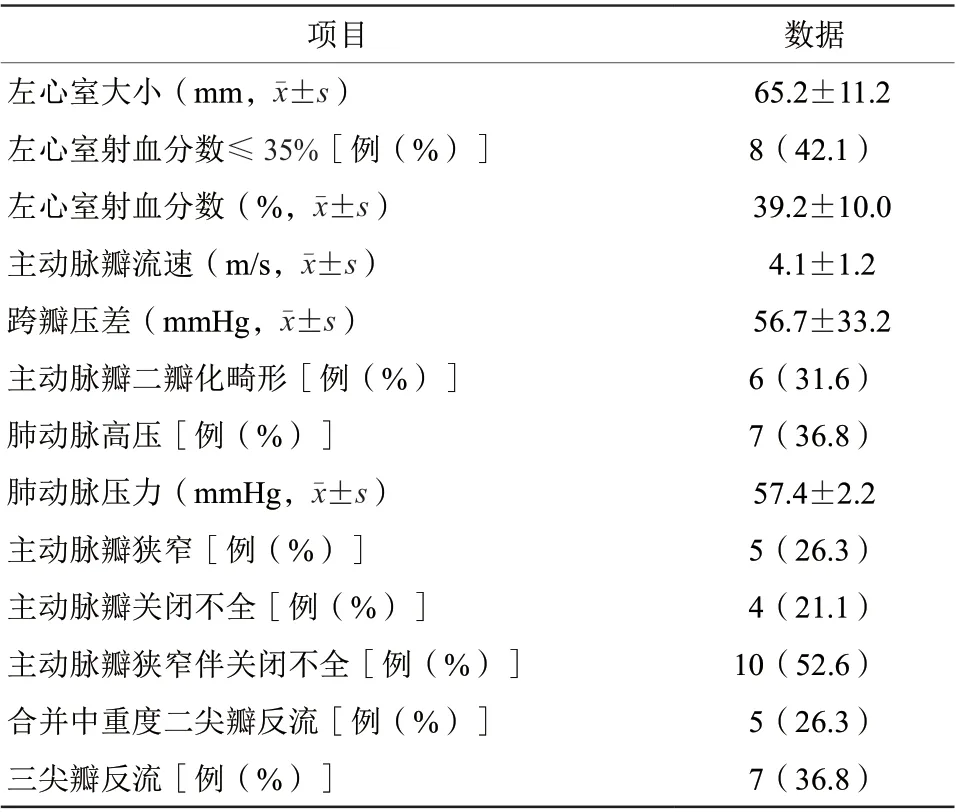
表2 19 例患者术前经食管超声心动图结果Table 2 Preoperative transesophageal echocardiography results
2. 2 患者手术资料
手术均在全身麻醉下进行。14例患者选择经股动脉路径,4例经心尖路径,1例经颈动脉路径。均使用国产自膨胀式瓣膜(表3)。4例患者在手术中出现心搏骤停,行心肺复苏术后2例患者循环恢复,术后存活;1例患者转体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)辅助,术后存活;另外1例于TAVR术中出现心搏骤停抢救无效死亡。1例患者术前出现急性心肌梗死,术中同期行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术,术后存活。存活患者术后心功能分级较术前明显改善,术后1个月复查平均NT-proBNP为(2 848.7±2 513.2)pg/ml,平均主动脉瓣流速为(2.2±0.7)m/s,平均跨瓣压差(20.7±10.0)mmHg(表4)。
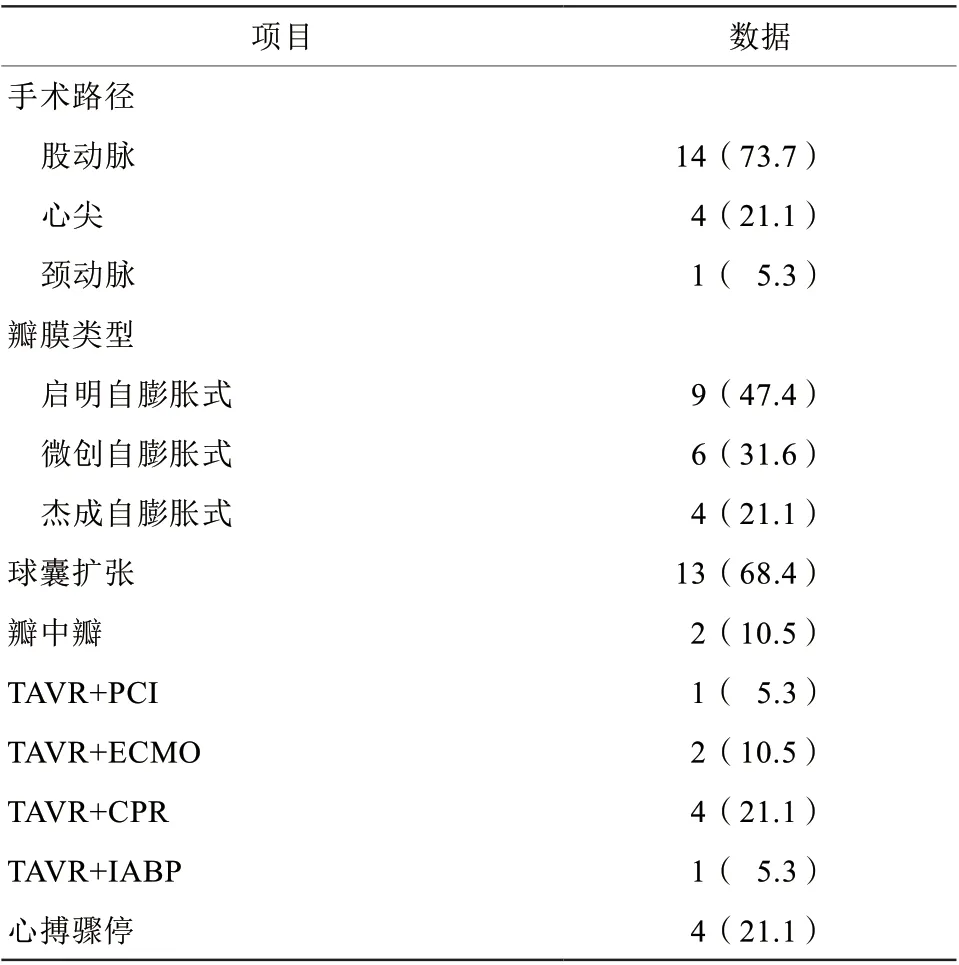
表3 19 例患者术中情况[例(%)]Table 3 Intraoperative conditions

表4 19 例患者术后临床结局Table 4 Postoperative clinical outcomes
2. 3 患者住院期间及随访情况
住院期间死亡3例,其中2例为心肺复苏术后在ECMO和主动脉内球囊反搏(intraaortic balloon pump,IABP)辅助下行TAVR术,术后因多器官功能衰竭死亡,另外1例于TAVR术中出现心搏骤停抢救无效死亡。16例患者好转出院,进入随访,随访时间3~46个月,平均随访时间为19个月,随访期内死亡4例,死亡率为25.0%(图1)。随访期间,出现中度以上瓣周漏3例,新发左束支传导阻滞5例,二度以上房室传导阻滞2例,其中1例术后植入永久起搏器(表4)。
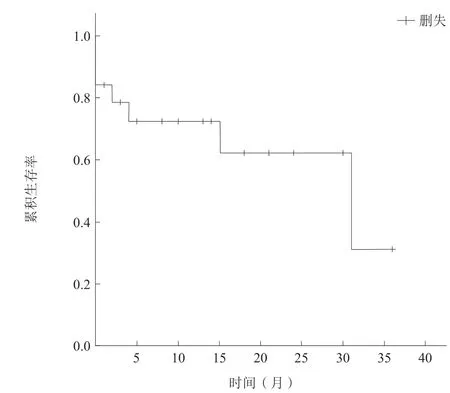
图1 Kaplan-Meier 生存分析Figure 1 Kaplan-Meier survival analysis
2. 4 患者远期预后的影响因素
根据术前是否合并二尖瓣中度以上的反流分为两组进行分析发现,两组生存率比较,差异有统计学意义(P=0.028),合并二尖瓣中度以上反流患者的生存率更低(图2)。进一步研究发现,低主动脉瓣跨瓣压差患者(压差≤50 mmHg)的中位生存时间低于高跨瓣压差的患者,但差异无统计学意义(P=0.346,图3)。

图2 MR 对生存率的影响Figure 2 The relationship between mitral regurgitation and survival

图3 主动脉瓣跨瓣压差对生存率的影响Figure 3 Relationship between low transvalvular pressure diff erence and survival
3 讨论
股动脉路径由于其安全快捷的特点,是此类患者首选的路径方式。由于患者均为急诊手术,大部分未行CT检查,因此在手术开始前,首先通过术中超声评估股动脉直径及钙化程度。通常股动脉直径要求>6 mm,如果患者血管条件较好,选择小号瓣膜无鞘方法也可以放宽到5 mm。股动脉路径的迂曲程度则通过术中穿刺造影来评估,如果因为迂曲导致置入困难,可以通过将直头导丝从股动脉送至对侧股动脉或桡动脉,双向拉直头导丝将血管拉直的情况下置入大鞘管。若患者股动脉纤细、迂曲,主动脉弓角度异常及瓣膜严重钙化,则颈动脉路径被证明是比较安全的选择。研究显示,经颈动脉路径TAVR在病死率、脑卒中、短暂性脑缺血发作的发生率与经股动脉路径及经心尖路径无明显差异[3]。本研究19例患者中,14例选择经股动脉路径,4例经心尖路径,1例经颈动脉路径,均顺利完成手术。
在没有术前CT的情况下,无法提前准确评估瓣膜大小、瓣环的钙化程度及冠状动脉开口高度,导致手术风险增加。本中心的经验是,在TAVR术中,使用三维超声测量出主动脉瓣环内径、流出道直径、冠状动脉高度、窦部宽度、升主动脉宽度及心室大小,以主动脉瓣环内径作为选择球囊大小的依据。根据三维超声测量的瓣环内径,选择小于瓣环内径2~3 mm的球囊进行球囊预扩张,根据球囊预扩张情况选择瓣膜尺寸。球囊预扩张后可能会出现几种情况:(1)有轻微腰征但是无瓣周漏,则可以选择比球囊大3 mm的瓣膜,假设20号的球囊无瓣周漏可以选择23号直径的瓣膜;(2)无腰征无瓣周漏,则可以选择大于球囊3~6 mm的瓣膜,就是20号的球囊无瓣周漏可以选择23号或者26号;(3)球囊预扩张后出现瓣周漏,则需要选择更大型号的球囊进行预扩张,直到无瓣周漏出现后再选择瓣膜;(4)球囊出现严重腰征,此种情况出现较少,可以选择更大型号的球囊,也可以通过测量腰部的直径来选择瓣膜。本研究中,所有患者均使用自膨胀式瓣膜,根据自膨胀式瓣膜公理性结论,瓣膜尺寸需要大于瓣环直径3~6 mm。由于纳入的患者病情危重,手术目的在于救治患者性命,瓣膜型号越大,出现瓣周漏的风险越低,但是会相应增加其他并发症的发生风险,比如压迫左束支导致房室传导阻滞,或者是对于严重钙化的患者,容易造成瓣环撕裂。因此对于急诊TAVR患者,选择更小号瓣膜可能增加手术成功率,降低瓣膜撕裂及左束支传导阻滞的发生风险。
对于主动脉瓣反流的患者[4],主动脉瓣环直径超过26 mm可能导致手术失败的概率增加。术前的三维超声需要明确主动脉瓣环内径,左心室流出道、窦管交界、升主动脉的直径,确定是否有足够的锚定平面。根据主动脉瓣反流的分型:(1)瓣环内径/左心室流出道内径在0.95~1.05,表明瓣环及流出道有锚定力,可通过标准位释放,依托瓣环和流出道进行锚定;(2)瓣环内径/左心室流出道内径<0.95,则表明瓣环有锚定力,而左心室流出道无锚定力,根据窦管交界与升主动脉的条件,可选择高位释放一个瓣膜;(3)瓣环内径/左心室流出道内径>1.05,此时流出道的挤压力高于瓣环的挤压力,高位释放瓣膜有可能导致飞瓣,只能选择标准位或低位释放瓣膜,术中根据二尖瓣的情况,可酌情选择瓣中瓣策略。选择投照体位时,将猪尾导管放置于无冠状动脉窦底部,进行造影调整,需确保三个窦底部处于同一个水平面。瓣膜释放时,停呼吸,高速起搏,瓣膜底部开花后一次性完全释放。在本研究中,主动脉瓣反流患者6例,有2例选择瓣中瓣策略,1例术后出现左束支传导阻滞,未出现飞瓣及冠状动脉阻塞等严重并发症。
本研究中所有急诊TAVR的患者,手术前均采用主动脉根部造影明确冠状动脉狭窄程度。若冠状动脉开口较低或狭窄,术中可行冠状动脉保护或冠状动脉球囊扩张或支架置入术,从而降低术中心肌缺血风险。球囊预扩张阶段可再次确认冠状动脉开口高度,从而降低瓣膜释放阶段冠状动脉阻塞的风险。在本研究中,只有1例患者合并了右冠状动脉中段90%的狭窄,先行右冠状动脉PCI术,再行TAVR,术后恢复顺利,随访期内长期存活。术中常规监测心电图,用于监测有无心肌缺血及房室传导阻滞。
尽管TAVR可降低围术期30 d的死亡率,但对已出现心原性休克的患者,死亡率仍较高。有研究显示,对于心原性休克患者,与术后相比,术前早期的机械循环辅助有可能降低术中恶性心律失常的风险,为术中操作赢得时间,增加手术成功的机会[5]。因此,对于急性心力衰竭或心原性休克高危的患者,在休克早期就更积极地使用机械循环辅助进行血流动力学干预,降低其他器官缺血低灌注的时间,维持术前及术中血流动力学的平稳,或许是增加术后生存率的关键。本研究中,共计4例术前出现心原性休克, 1例患者接受ECMO辅助,1例接受IABP辅助,2例患者均术后死亡,由于样本量偏少,未能明确心原性休克失代偿期的患者是否能从机械循环辅助中获益。因此,机械循环辅助在急性心力衰竭患者中的使用时机是我们未来需要研究的方向。
此外,这4例心原性休克均为主动脉瓣狭窄继发左心室扩大的患者,主动脉瓣跨瓣压差均低于40 mmHg,同时合并左心室扩大,左心室舒张末期内径>65 mm(平均71 mm),左心室射血分数<35%(平均31%)且均合并二尖瓣反流。在本研究中,出现心原性休克的患者,在机械循环辅助的情况下,死亡率仍高达50%,是本研究中导致患者死亡的最主要原因。研究显示,与高跨瓣压差的患者相比,低跨瓣压差的患者具有更差的预后[6],与本研究中结果一致。考虑低流速主要继发于左心室收缩功能障碍,左心室高后负荷导致左心室顺应性下降,充盈压增加,出现急性心力衰竭甚至心原性休克。因此,此类患者一经诊断,应尽快行手术治疗,纠正患者的血流动力学状态,预防出现不可逆的器官低灌注,有望改善此类患者的预后。
在本研究中,26.3%的患者合并有二尖瓣反流。考虑可能是继发于左心室扩大及收缩功能的下降。据文献报道,在行TAVR的患者中,同时合并二尖瓣反流的约占48%。二尖瓣反流对中远期预后均有较大的影响[7]。Bedogni等[8]报道了不同程度的二尖瓣反流对1年生存率的影响,发现中度及重度二尖瓣反流可使1年死亡率分别增加12%和17%。此类患者中,大部分为功能性二尖瓣反流,TAVR术后,有47%重度和35%中度的二尖瓣反流程度会减轻,但是仍有8.4%的患者反流程度加重。尽管TAVR术后可使一部分患者的二尖瓣反流程度减轻,但是并不能改善总体的中远期生存率[9]。在本中心行TAVR的患者中,有5例患者合并有二尖瓣中度以上反流,经过主动脉瓣置换后,有4例二尖瓣反流变为轻度,1例仍为重度。若行TAVR术后二尖瓣仍有反流,处理方式目前存在争议。有中心建议若术前发现二尖瓣反流,可先处理主动脉瓣,二次处理二尖瓣,处理方式以修复为主,比如采用Mitral Clip技术[10]。同期处理目前经验有限,未来还需要进一步研究。
本研究的不足之处:是小样本、单中心的回顾性研究,而且只统计了手术的这部分患者,还有因各种原因未手术的患者没有被纳入,因此存在一定的选择偏倚。由于样本量偏小,未能进一步行亚组分析以及Cox回归分析影响患者生存率的主要因素。
利益冲突所有作者均声明不存在利益冲突
