伴前庭水管扩大的非综合征性听力障碍耳聋基因突变谱研究
2023-02-28王屹陈振波李勇王晶俏刘志忠
王屹, 陈振波, 李勇, 王晶俏, 刘志忠
1. 中国康复研究中心北京博爱医院,a. 检验科;b. 影像科,北京市 100068;2. 首都医科大学康复医学院,北京市100068;3. 中国医学科学院整形外科医院放射科,北京市 100144
目的 观察伴前庭水管扩大(EⅤA)的非综合征性听力障碍(NSHI)患者耳聋基因突变谱。
方法 2015年10月至2016年8月,对湖北宜昌特殊教育学校确诊为NSHI的患者85例进行颞骨CT检查,基质辅助激光解吸/电离飞行时间质谱对GJB2、GJB3、SLC26A4和线粒体DNA (mtDNA) 12S rRNA的20个耳聋相关基因突变位点进行检测。
结果 颞骨CT显示EⅤA患者31例。与非EⅤA患者相比,EⅤA患者携带突变的比例明显增高(χ2 = 11.160, P =0.001),主要表现为SLC26A4基因中c.919-2A>G突变水平显著增高(χ2 = 23.870, P < 0.001)。
结论 伴EⅤA的NSHI患者耳聋基因突变谱不同于非EⅤA患者,可优化耳聋基因检测方案,为伴EⅤA的NSHI的早诊断、早干预提供帮助。
0 引言
听力障碍是人类最常见的神经感觉障碍,2015年,全球约有5亿人患有听力障碍,在所有残疾因素中排名第4[1],儿童发病率为1/1 000~1/300[2],是全世界重大公共卫生负担。中国2 800万人存在听力障碍,占残疾人总数的1/3。60%新生儿听力障碍属于遗传性听力障碍。遗传性听力障碍分为综合征性听力障碍和非综合征性听力障碍(nonsyndromic hearing impairment, NSHI),越来越多的基因被证实与听力障碍相关,截至2022年8月,确定的NSHI基因总数为124个[3-4]。NSHI仅表现为听力不同程度损失,没有其他身体症状,与中耳和/或内耳的异常有关[5]。
前庭水管扩大(enlarged vestibular aqueducts, EⅤA)患者听力损害呈波动性进展,早期诊断、干预,是预防和推迟听力损害的有效措施[6]。GJB2、GJB3、SLC26A4和线粒体DNA (mtDNA) 12S rRNA被认为是中国NSHI最常见的致病基因[7-9]。对不同人群耳聋相关基因突变谱的研究发现,存在种族和地域的差异,同时也不断发现新的突变位点[10-11],为NSHI的筛查提供大量数据支持[11-12]。目前关于颞骨CT异常的遗传学研究已经比较明确,EⅤA和/或Mondini发育不良与SLC26A4相关[5,13-16]。但也有部分研究未能在EⅤA患者中找到SLC26A4基因突变,我国伴EⅤA的NSHI耳聋基因突变谱的报道较少[17-19]。
本研究对NSHI患者分别进行耳聋基因突变位点检测和颞骨CT影像学分析,研究不同影像学表现NSHI患者的耳聋基因突变谱是否存在差异。
1 资料与方法
1.1 NSHI患者血液样本收集
2015年10月至2016年8月,于湖北宜昌特殊教育学校选择经医院确诊为NSHI的患者85例。所有患者自愿加入本研究并签署知情同意书。
排除标准:①明显外耳、中耳畸形;②患有综合征性听力障碍相关的疾病,如视网膜营养不良等。
采集患者全血样本2 mL,乙二胺四乙酸二钠抗凝,在-80 ℃保存。
本研究经中国康复研究中心医学伦理委员会批准(No. 2016-067-1),所有患者均签署知情同意书,符合《赫尔辛基宣言》的原则。
1.2 基因组DNA提取及多重聚合酶链反应(polymerase chain reaction, PCR)分析
本研究共检测GJB2、GJB3、SLC26A4、mtDNA 12S rRNA 4个基因的20个位点。引物序列见表1。
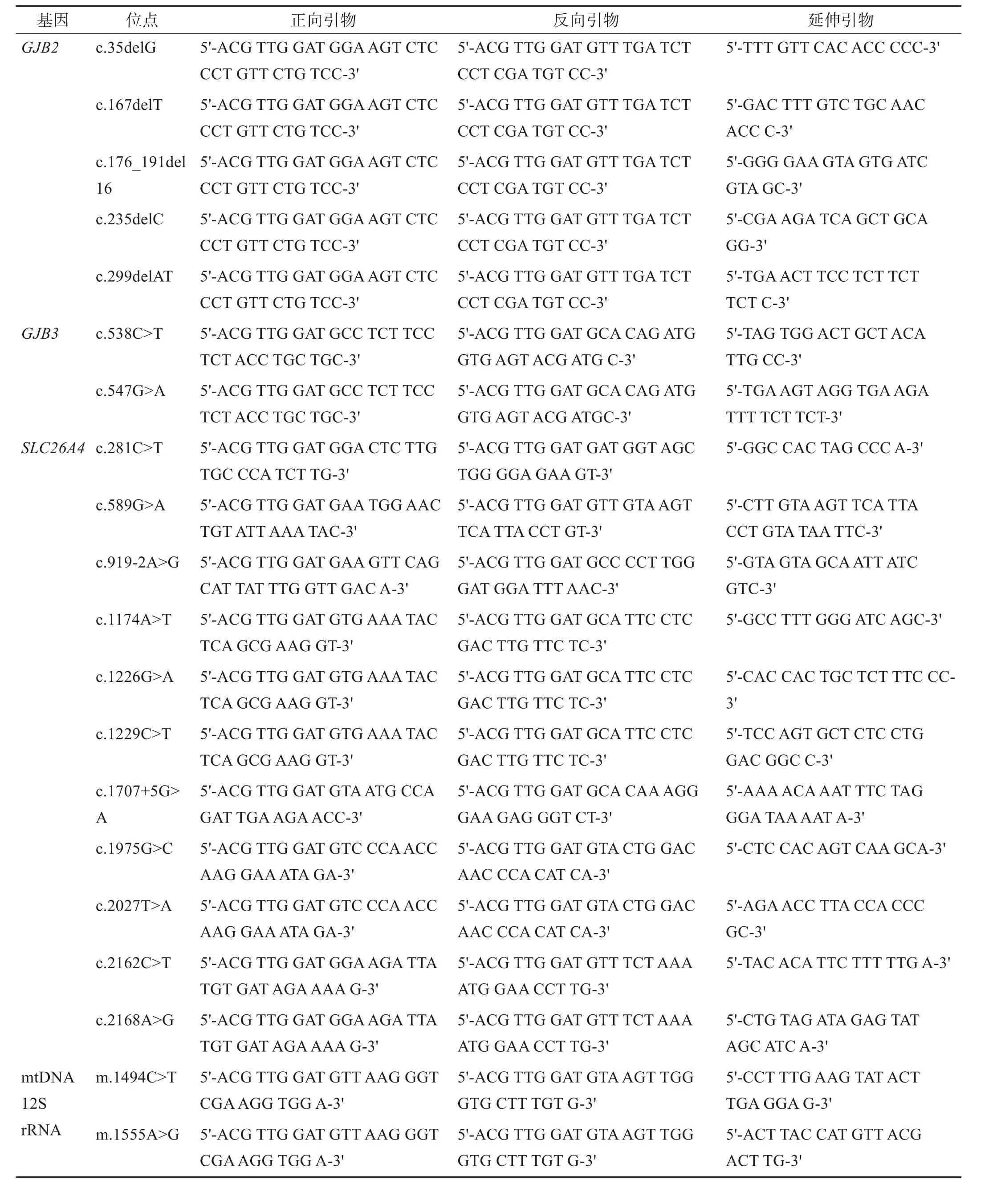
表1 各基因突变位点及引物序列
采用DNA提取试剂盒(上海百奥科技有限公司)从全血样本白细胞中提取基因组DNA。离心管加入蛋白酶K 20 μL、全血200 μL和缓冲液BL 200 μL,震荡混匀15 s,56 ℃保温10 min,加入无水乙醇200 μL震荡混匀15 s,将混合液小心加入活化吸附柱中,12 000 r/min离心1 min,弃废液。加入缓冲液BW1 500 μL,12 000 r/min离心1 min,弃废液;加入缓冲液BW2 500 μL,12 000 r/min离心1 min,弃废液。每次离心后更换收集管。加入洗脱液BE 60 μL,室温(15 ℃~25 ℃)放置5 min,12 000 r/min离心1 min,洗脱收集基因组DNA。
多重PCR在微量滴定板孔中进行,PCR混合物5 μL (10×PCR 缓 冲 液 含 20 mmol/L MgCl20.5 μL、25 mmol/L MgCl20.4 μL、 25 mmol/L dNTP mix 0.1 μL、0.5 μmol/L引物混合物 1 μL、5U/μL PCR 酶0.2 μL、DNA样本2.8 μL)。95 ℃变性2 min,然后行45个扩增循环:95 ℃变性30 s,56 ℃退火30 s和72 ℃延伸 60 s,最后72 ℃ 5 min。
每个反应孔中加虾碱性磷酸酶(shrimp alkaline phosphatase, SAP)反应混合缓冲液2 μL (HPLC级水1.53 μL、10× SAP 缓冲 液 0.17 μL、1.7 U/LSAP 酶0.30 μL),轻轻混匀,瞬时离心后孵育。SAP反应在37 ℃ 40 min和85 ℃ 5 min下进行。
每个反应孔加入iPLEX反应混合物2 μL (HPLC级 水 0.619 μL、 0.222× iPLEX 缓 冲 液 0.2 μL、 1×iPLEX Termination mix 0.2 μL、0.84/1.04/1.57 μmol/L Extend Primer Mix 0.94 μL、1× iPLEX 酶 0.041 μL),初始变性94 ℃ 30 min,然后行40个扩增循环:94 ℃变性5 s,52 ℃ 5 s和80 ℃ 5 s循环5次。样品72 ℃孵育3 min。阳离子树脂纯化在多重PCR和iPLEX反应中积累的盐离子。
1.3 基质辅助激光解吸/电离飞行时间质谱突变分析
将多重PCR产物0.75 μL点样在光谱芯片上,Sequenom MassARRAY〔毅新兴业(北京)科技有限公司〕电离,MassARRAY TYPER 4.0软件(美国AGENA BIOSCIENCE公司)分析,获得样本基因型。
1.4 高分辨率颞骨CT
所有患者采用Optima CT660 CT扫描仪(日本通用电气医疗系统有限公司)行标准颞骨扫描,峰值电压120 kⅤ,电流100~300 mA,层厚0.625 mm,重建增加1mm,扫描视场20 cm,矩阵为512×512,高分辨率骨算法。前庭导水管中点宽度> 1.5 mm诊断为EⅤA[20]。
1.5 统计学分析
采用PRISM 6软件(美国GRAPHPAD软件公司)进行数据分析。计量资料符合正态分布,以(±s)表示,进行t检验。计数资料以频数表示,进行χ2检验。显著性水平α = 0.05。
2 结果
2.1 患者颞骨CT扫描
所有患者均为双侧听力障碍。共检出EⅤA患者31例,其中8例并发其他内耳畸形;未发现EⅤA的患者54例中,14例存在其他内耳畸形,40例未发现异常。
EⅤA-NSHI患者与非EⅤA-NSHI患者性别、年龄均无显著性差异(P > 0.05)。见表2。

表2 伴或不伴EVA的NSHI患者一般资料比较
2.2 耳聋基因突变位点
患者中未检测到mtDNA 12S rRNA和GJB3基因突变。25例出现GJB2基因突变,18例出现SLC26A4基因突变。
EⅤA-NSHI患者中,9例未检出突变基因位点。7例检测到GJB2基因突变;15例检测到SLC26A4基因突变。见表3。

表3 EVA-NSHI患者耳聋基因突变谱
非EⅤA-NSHI患者,34例未检出基因位点突变。17例检测到GJB2基因突变,3例检测到SLC26A4基因突变。见表4。

表4 非EVA-NSHI患者耳聋基因突变谱
EⅤA-NSHI患者总突变率59.68%,明显高于非EⅤA-NSHI患者的33.33% (P = 0.001)。其中,GJB2突变水平无显著性差异(P > 0.05)。EⅤA-NSHI患者SLC26A4的突变率显著高于非EⅤA-NSHI患者(P <0.001), 以 c.919-2A>G 为 主要突 变点(P < 0.001)。见表5。
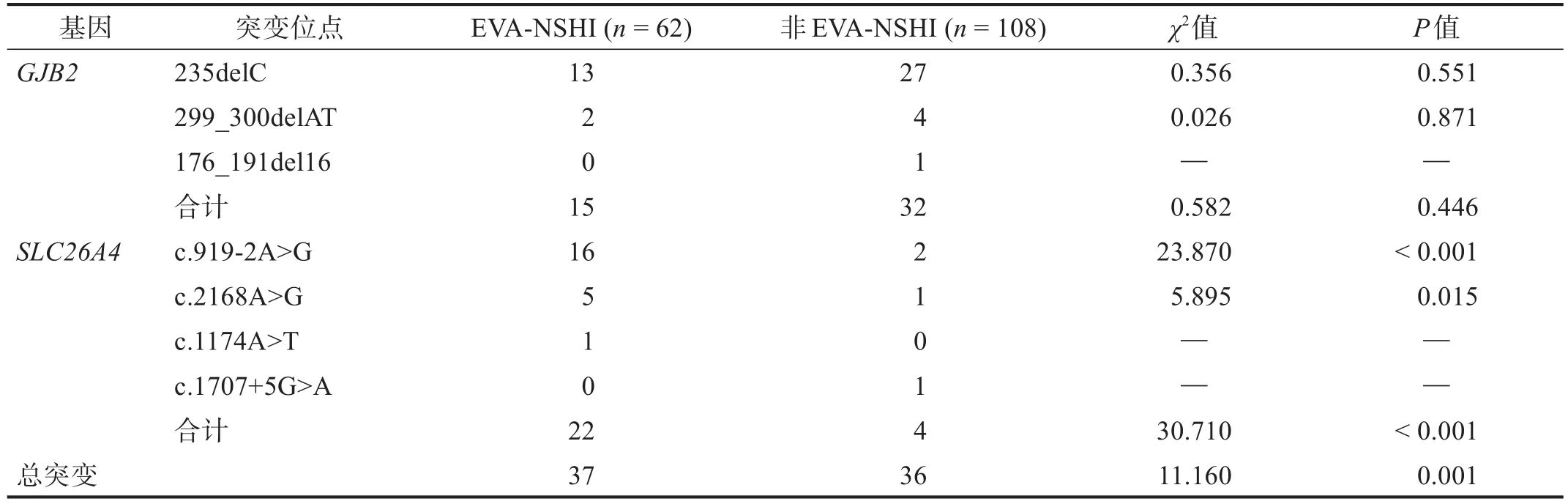
表5 EVA-和非EVA-NSHI患者耳聋基因突变差异比较 单位:n
3 讨论
有许多基因检测方法可用于检测患者基因多态性,如直接测序、限制性片段长度多态性分析和微阵列分析等,但由于分析方法复杂、耗时长,不适合大批量遗传筛选[21-23],基于质谱的基因检测由于其高通量,使多基因组合检测大量遗传筛查成为可能[23-24]。
GJB2、SLC26A4、GJB3和mtDNA 12S rRNA 4个耳聋基因的20个突变位点在中国听力障碍患者的研究中获得大量数据支持[23]。目前多基因组合检测研究关注种族或地域差异[16,25-26],虽然多种因素影响基因诊断敏感性[27],仅50%左右患者能发现突变位点,但多基因组合检测仍然极大提高了诊断效率[23,28]。
EⅤA是儿童感音神经性听力损害最常见的内耳畸形之一,表现为双侧或单侧[29]。通过颞骨CT或MRI基本可以明确EⅤA诊断。患者听力表现为进行性或波动性下降,在发现听力下降前常有感冒、轻微头脑外伤或其他使颅内压增高的诱发因素。高通量颞骨CT有助于发现内耳畸形,如Mondini畸形、Michel发育不全、EⅤA、内耳道扩张等[30-31]。本研究85例NSHI患者,颞骨CT检出异常45例,其中31例(36.47%)表现为EⅤA,略高于国内其他研究(11%~13%)[32]。
SLC26A4基因与EⅤA密切相关,纯合突变和复合杂合突变均可导致耳聋。EⅤA患者存在多样突变谱,本研究显示,仅15例(48.38%)携带SLC26A4突变,7例携带GJB2突变,与Albert等[33]的结果相似,EⅤA患者中,40%携带SLC26A4突变。EⅤA患者SLC26A4突变水平较低的原因尚不清楚,推测有其他遗传和环境因素参与其中。本研究中SLC26A4突变谱与中国人群相似,以c.919-2A>G为热点。丹麦EⅤA患者最常见的突变为1246A>C[34],表明EⅤA突变谱可能因人种不同而不同。
4 结论
本研究显示,EⅤA-NSHI患者耳聋基因突变以SLC26A4的c.919-2A>G为主,同时也存在一定GJB2基因突变。非EⅤA-NSHI患者耳聋基因突变以GJB2的235delC和SLC26A4的c.919-2A>G为主。两者间存在显著差异,可为建立可靠、高效的NSHI筛查方法提供依据。
利益冲突声明:所有作者声明不存在利益冲突。
