木薯MeCML24与MeSAUR1互作调控MeAGPS1a表达的功能验证
2023-02-27郑婉茹丁凯旋陆小花李琳琳王超群陈银华耿梦婷
郑婉茹,丁凯旋,陆小花,李琳琳,王超群,陈银华,姚 远,陈 新*,耿梦婷*
1.海南大学热带作物学院,海南海口 570228;2.海南省热带生物资源可持续利用国家重点实验室培育基地,海南海口570228;3.中国热带农业科学院热带生物技术研究所,海南海口 571101;4.海南省种子总站,海南海口 571100
木薯(Manihot esculentaCrantz)根部膨大形成富含淀粉的储藏根,淀粉含量约占干质量的70%~80%,占鮮质量的20%~30%[1],是全球第六大粮食作物,与马铃薯、红薯并列为世界三大薯类作物,也是我国重要的工业和生物能源原料[2]。参与淀粉生物合成的酶包括腺苷二磷酸葡萄糖焦磷酸化酶(ADP-glucose pyrophosphorylase, AGPase),淀粉合酶(starch synthase, SS),淀粉分支酶(starch branching enzyme, SBE)及去分支酶(starch debranching enzyme, DBE)等四大类[3]。AGPase是淀粉合成的关键酶和限速酶,其催化G-1-P和ATP生成淀粉生物合成的底物ADPG和PPi[4]。AGPase酶活性是影响淀粉类作物产量的重要因素。
AGPase酶由大亚基和小亚基构成。木薯MeAGPS1a基因编码的小亚基是 AGPase的催化中心。实验室前期研究表明生长素响应因子MeSAUR1作为转录因子,可结合MeAGPS1a基因翻译起始位点上游-201~400 bp的启动子区,正调控MeAGPS1a基因的表达[5]。SAUR(small auxin-up RNA)是生长素响应因子之一,也是最大的一类生长素反应因子,在大多数植物中约有60~140个基因[6]。本实验室通过酵母双杂交筛选木薯 cDNA文库,结果显示钙调素类似蛋白MeCML24为 MeSAUR1的候选互作蛋白(未发表)。钙调素类似蛋白(CaM-like, CML)是一类重要的钙信号传感蛋白,具有植物发育、逆境胁迫反应、离子吸收、转录调控等多种生物学功能。为了确定木薯的MeCML24是否与MeSAUR1存在互作关系,本研究克隆了MeCML24基因,通过酵母双杂交点对点实验、双分子荧光互补(BiFC)实验进行互作验证;利用双荧光素酶实验分析MeCML24参与MeSAUR1对MeAGPS1a基因表达的调控功能。揭示木薯 MeCML24和MeSAUR1协同调控MeAGPS1a基因表达的功能,有利于进一步了解木薯块根淀粉积累过程中的分子调控网络,也为木薯分子育种提供新的思路。
1 材料与方法
1.1 材料
‘SC8’木薯(Manihot esculentaCrantz)、烟草本生烟(Nicotiana benthamiana)由本实验室提供;大肠杆菌菌株 Trans5α、农杆菌感受态细胞GV3101(pSoup-p19)购自上海唯地生物技术有限公司,酵母菌株AH109由本实验室提供;酵母双杂交载体质粒 pGBKT7-laminc、pGADT7-LargeT、pGBKT7、pGADT7、pGBKT7-MeSAUR1、pGBKT7-p53;双分子荧光互补载体 pNC-BiFCEnc及 pNC-BiFC-Ecc、双荧光素酶实验载体CaMV35S::MeSAUR1-MeAGPS1a pro::LUC 和MeAGPS1a pro::LUC均由海南大学生物资源可持续利用生物重点实验室提供。
1.2 方法
1.2.1MeCML24基因的克隆及生物信息学分析根据phytozome数据库中获得MeCML24蛋白的编码基因信息,采用 Premier 5.0软件设计MeCML24基因的克隆及酵母双杂交验证引物(表1),在上海生工生物技术公司合成。以‘SC8’木薯 cDNA为模板,采用 RT-PCR方法扩增MeCML24基因的编码区序列。PCR扩增体系如下:PrimerSTART Mix 25 μL,10 mmol/L 上下游引物各2 μL,木薯cDNA 2 μL,去离子水补足至50 μL。反应程序设置如下:94℃预变性5 min;35个循环包括98℃变性10 s,56℃退火30 s,72℃延伸1 min;最后72℃再延伸10 min。产物经 1%琼脂糖凝胶电泳检测、凝胶回收试剂盒切胶回收,送深圳华大基因科技有限公司测序,分析MeCML24基因序列。利用ExPASy软件分析木薯MeCML24的生理生化性质,利用SOPMA软件分析MeCML24蛋白的二级结构。

表1 本研究所用引物Tab.1 Primers for this study
1.2.2 MeSAUR1与MeCML24蛋白的酵母双杂交点对点验证 采用限制性内切酶EcoRI和SalI,双酶切pGBKT7(BD)空载质粒,纯化回收载体框架,用T4 DNA连接酶将MeCML24克隆到BD载体上,构建BD-MeCML24载体。将连接产物转化大肠杆菌 Trans5α感受态细胞,进行单克隆菌落PCR,筛选阳性克隆送深圳华大基因科技有限公司测序进一步验证。提取测序正确的BD-MeCML24质粒与 AD空载质粒共转 AH109酵母菌株,并在 SD/TL,SD/TLHA,SD/TLHA+x-α-gal培养基平板上,检测MeCML24蛋白是否具有自激活活性。将 BD-MeCML24质粒和AD-MeSAUR1质粒共转 AH109酵母菌株,在SD/TL、SD/TLHA 和 SD/TLHA+x-α-gal培养基平板上生长,验证MeSAUR1与MeCML24蛋白的互作关系。酵母双杂阳性对照为共转 AD-largeT和BD-p53的AH109酵母菌株、阴性对照为共转AD-largeT和BD-laminc的AH109酵母菌株。
1.2.3 双分子荧光互补(BiFC)实验进行植物体内验证 使用 PrimerSTART 高保真酶,以 1.2.1获得的MeCML24基因编码区为模板,PCR扩增MeCML24基因,通过同源重组的方式将MeSAUR1克隆到pNC-BiFC-Enc载体,MeCML24克隆到pNC-BiFC-Ecc,转化大肠杆菌Trans5α感受态,进行菌落PCR检测,挑选阳性克隆并送深圳华大基因科技有限公司测序验证。将构建成功的重组质粒 pNC-BiFC-Enc-MeSAUR1和 pNCBiFC-Ecc-MeCML24分别转化 GV3101(pSoupp19)农杆菌菌株,注射侵染生长30 d本氏烟草叶片。避光培养3 d后在激光共聚焦显微镜下观察侵染叶片是否产生YFP 荧光。
1.2.4 MeSAUR1和 MeCML24互作对MeAGPS1a基因的调控效应 本实验室前期已构建了双荧光素酶实验载体 CaMV35S::MeSAUR1-MeAGPS1a pro::LUC(简化命名为MeSAUR1-pMeAGPS1a)和MeAGPS1a pro::LUC(简化命名为pMeAGPS1a),验证了MeSAUR1对MeAGPS1a基因启动子的正调控功能。本研究使用PrimerSTART高保真酶扩增MeCML24基因。回收扩增片段,通过同源重组的方式将MeCML24克隆到 CaMV35S::MeSAUR1-MeAGPS1a pro::LUC质粒中MeSAUR1基因的下游,形成CaMV35S::MeSAUR1-T2A-MeCML24-MeAGPS1 apro::LUC(简化命名为MeSAUR1-MeCML24-pMeAGPS1a)载体(图1)。2个基因之间通过T2A短肽连接。在蛋白翻译过程中T2A连接的2个蛋白可以被分割成2个独立的蛋白,因此可以共表达 MeSAUR1及 MeCML24。将分别携带MeSAUR1-MeCML24-pMeAGPS1a、MeSAUR1-pMeAGPS1a和pMeAGPS1a载体的农杆菌GV3101(pSoup-p19)侵染本氏烟草叶片,利用Pierce™ Renilla-Firefly Luciferase Dual Assay Kit进行双荧光素酶活性检测。

图1 双荧光素酶载体构建示意图Fig.1 Schematic diagram of double luciferase vector construction
2 结果与分析
2.1 MeCML24基因的克隆
根据 phytozome数据库中获得的MeCML24信息(基因组编号:Manes.01G116700),以‘SC8’木薯品种的cDNA为模板,采用RT-PCR方法扩增MeCML24基因的编码区(图2)。经测序分析,MeCML24(基因组编号:Manes.01G116700)的编码区长度为492 bp,可编码163个氨基酸。
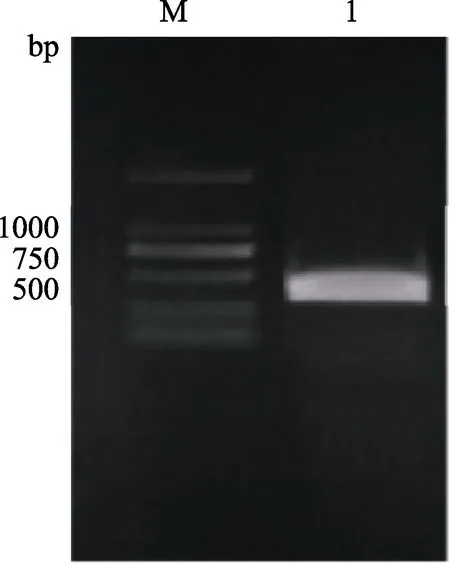
图2 PCR扩增MeCML24基因Fig.2 PCR amplification of MeCML24
2.2 MeCML24的生物信息学分析
2.2.1 MeCML24的理化性质分析 利用 ExPASy(https://web.expasy.org/protparam/)在线软件对木薯MeCML24蛋白的生理生化性质进行分析,结果表明该蛋白的理化分子式为 C768H1227N211O265S13,氨基酸数量为163,分子量为18 073.23 Da,原子总数为2484,理论等电点pI值约为4.38。MeCML24蛋白富含天冬氨酸Asp(13.5%),甘氨酸Gly(11.7%),赖氨酸Lys(8.0%),异亮氨酸Ile(7.4%),亮氨酸Leu(7.4%),谷氨酸Glu(6.7%)。MeCML24蛋白带负电荷的残基总数(Asp+Glu)为33,正电荷残基总数(Arg+Lys)为19,脂溶指数为70.55,不稳定性指数(II)为30.80,表明该蛋白质归类为稳定蛋白。MeCML24蛋白亲水性总平均值为-0.569(负值表示亲水性,正值表示疏水性)(图3),表明该蛋白亲水性较高。采用TMHMM Server软件进行跨膜分析发现,MeCML24没有跨膜结构,因此该蛋白不属于跨膜蛋白。

图3 木薯MeCML24蛋白亲水性分析Fig.3 Hydropilia analysis of MeCML24 from cassava
2.2.2 MeCML24的蛋白二级结构分析 采用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线工具分析预测 MeCML24蛋白的二级结构。结果表明MeCML24蛋白的结构中,α-螺旋(alpha helix)占52.76%,含有86个氨基酸,无规则卷曲(random coil)占30.06%,含有49个氨基酸,β-转角结构(beta turn)占11.04%,含有18个氨基酸,延伸链(Extended strand)占6.13%,含有10个氨基酸(图4)。

图4 木薯 MeCML24 的蛋白二级结构分析Fig.4 Protein secondary structure analysis of MeCML24 from cassava
2.3 MeSAUR1与MeCML24的酵母双杂交点对点验证
将pGBKT7(BD)载体与MeCML24连接,转化大肠杆菌Trans5α感受态细胞,进行菌落PCR筛选阳性克隆,构建酵母双杂交载体BD-MeCML24。PCR产物电泳结果显示,目的条带单一,且大小与预期一致(图5)。阳性克隆菌液送深圳华大基因科技有限公司测序,证明MeCML24已成功构建至 pGBKT7载体。提取BD-MeCML24载体质粒,用于转酵母进行自激活分析及酵母双杂交验证实验。
在酵母双杂交实验前,利用构建成功的BD-MeCML24载体进行自激活检测。在SD/TL平板上实验组酵母菌(共转AD+BD-MeCML24)和对照组酵母菌(阳性对照AD-largeT+BD-p53、阴性对照AD-largeT+BD-laminc)均能正常生长,在SD/TLHA平板上只有阳性酵母生长,且在SD/TLHA+x-a-gal平板上阳性酵母菌落变蓝,实验组和阴性对照不生长。此结果表明候选互作蛋白MeCML24不具有自激活活性(图6)。

图6 MeCML24的自激活检测Fig.6 Self-activation test of MeCML24
在 MeCML24没有自激活的基础上,本研究进一步通过酵母双杂交点对点实验,验证MeSAUR1与 MeCML24是否存在互作关系。将AD-MeSAUR1+BD-MeCML24共转 AH109酵母菌,接着将转基因酵母菌分别于SD/TL、SD/TLHA和SD/TLHA+x-α-gal培养基平板上生长。结果发现只有阴性对照酵母菌(AD-largeT+BD-laminc)在SD/TLHA平板上不生长,AD-MeSAUR1+BD-MeCML24酵母菌株和阳性对照菌(AD-largeT+BD-p53)均能生长,并且在 SD/TLHA+x-α-gal平板上的酵母菌落会变蓝。此结果表明,MeCML24候选蛋白与MeSAUR1蛋白存在互相作用(图7)。

图7 酵母双杂交验证Fig.7 Validation of yeast two-hybrid system
2.4 双分子荧光互补(BiFC)体内验证MeSAUR1与MeCML24互作关系
由于酵母双杂交实验存在一定的假阳性可能性,本研究采用双分子荧光互补技术(BiFC)进一步鉴定MeSAUR1与MeCML24的互作关系。将MeSAUR1克隆到pNC-BiFC-Enc载体上,构建pNC-BiFC-Enc-MeSAUR1载体,融合表达MeSAUR1-nEYFP蛋白;将MeCML24克隆到pNC-BiFC-Ecc载体上,构建 pNC-BiFC-Ecc-MeCML24,融合表达MeCML24-cEYFP蛋白。如果MeSAUR1与MeCML24互作,黄色荧光蛋白EYFP的N端区域(nEYFP)和C端区域(cEYFP)将在空间上相互靠近互补,恢复EYFP的功能。将携带 pNC-BiFC-Enc-MeSAUR1载体和 pNCBiFC-Ecc-MeCML24载体的农杆菌混合注射烟草,72 h后在激光共聚焦显微镜观察黄色荧光蛋白 EYFP的发光情况。结果发现,MeSAUR1与MeCML24互作,在烟草细胞膜、细胞核和细胞质上有黄色荧光信号;对照组在相同条件下没有荧光信号(图8)。
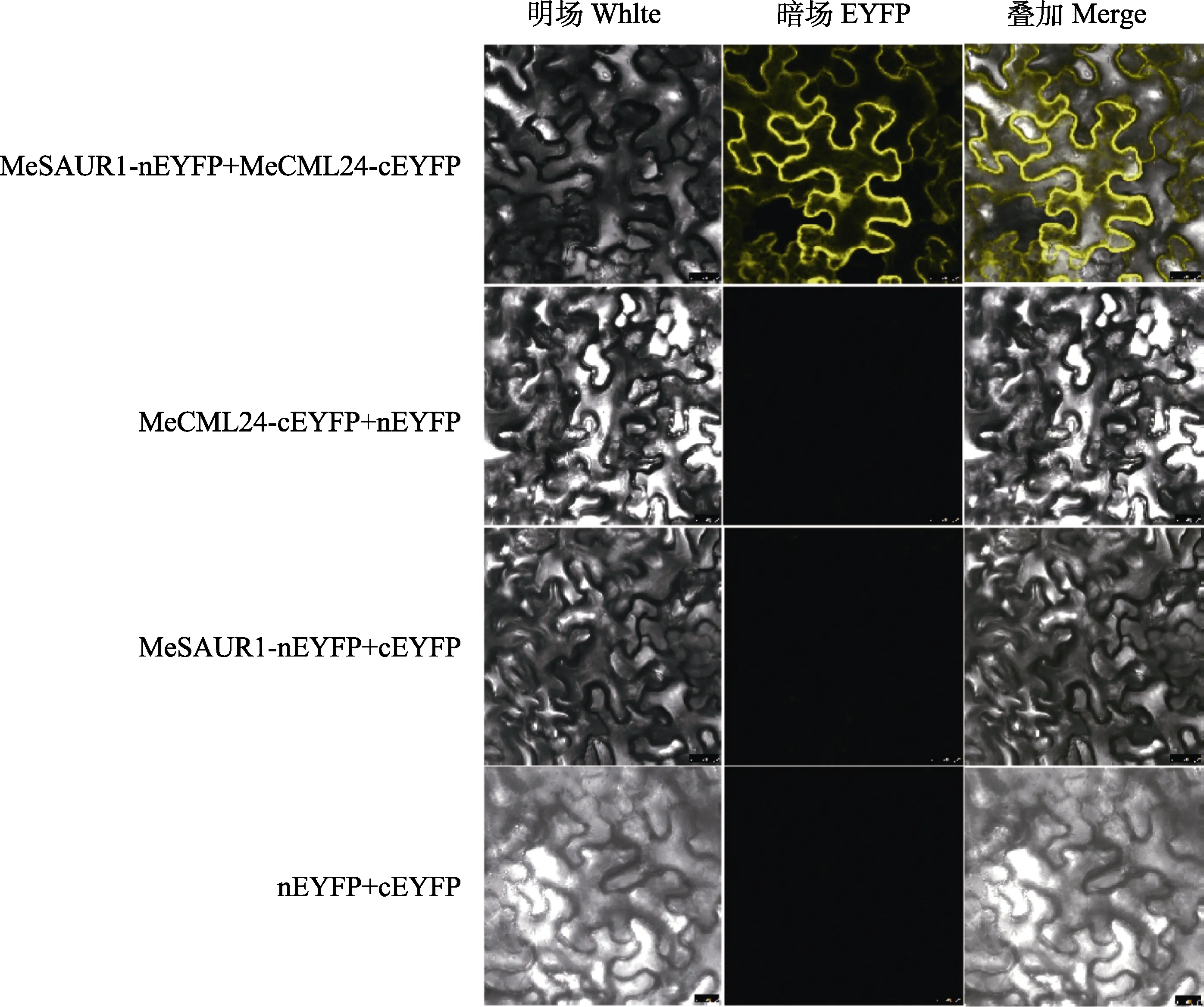
图8 烟草BiFC验证MeSAUR1与MeCML24蛋白互作Fig.8 Bimolecular fluorescence complementation assays for MeSAUR1-MeCML24 interaction in tobacco leaves
2.5 双荧光素酶实验分析 MeSAUR1与MeCML24互作对 MeAGPS1a 基因表达的调控效应
构建双荧光素酶载体MeSAUR1-MeCML24-pMeAGPS1a,该载体可以共表达 MeSAUR1和MeCML24蛋白,以分析这 2个蛋白互作对pMeAGPS1a启动子活性的影响。采用2个对照载体:pMeAGPS1a载体是仅有pMeAGPS1a启动子的双荧光素酶载体,用于分析该启动子的本底表达;MeSAUR1-pMeAGPS1a载体可表达MeSAUR1蛋白,正调控pMeAGPS1a启动子。将分别携带MeSAUR1-MeCML24-pMeAGPS1a、MeSAUR1-pMeAGPS1a和pMeAGPS1a载体的农杆菌GV3101(pSoup-p19)侵染本氏烟草叶片,进行双荧光素酶活性检测。结果显示双荧光素酶载体表达MeSAUR1后,pMeAGPS1a启动子活性上升了44.43%,而共表达MeSAUR1和MeCML24后,pMeAGPS1a启动子活性仅为单独表达MeSAUR1的31.26%,是pMeAGPS1a启动子本底表达活性的45.15%。因此MeCML24与MeSAUR1 互作后可抑制MeAGPS1a基因表达(图9)。

图9 双荧光素酶实验分析MeSAUR1-MeCML24互作对 MeAGPS1a 基因表达的调控效应Fig.9 Dual-luciferase assay to analyze the regulatory effect of MeSAUR1-MeCML24 on the expression of MeAGPS1a gene
3 讨论
木薯的光合速率比较高,蔗糖合成能力也比较强,但木薯块根的淀粉含量低于理论值[7]。AGPase是淀粉合成的关键酶和限速酶,淀粉的含量和产量都与 AGPase酶的活性有很大的关联,因此以AGPase酶为切入点,开展作物遗传改良,对提高作物产量及淀粉含量具有重要的意义。木薯MeAGPS1a基因编码的小亚基是AGPase的催化中心,无论在叶片还是块根中的表达量均高于其他MeAGPase[8]。本实验室前期研究发现,MeSAUR1转录因子可结合在MeAGPS1a基因翻译起始位点上游-201~400 bp的启动子区,正调控MeAGPS1a基因的转录。通过酵母双杂交文库筛选,发现MeCML24可能是MeSAUR1的候选互作蛋白(未发表)。
钙调素类似蛋白(CaM-like, CML)是一类重要的钙信号传感蛋白,具有植物发育、逆境胁迫反应、离子吸收、转录调控等多种生物学功能。在植物响应各种生理刺激时,Ca2+参与调节植物的多种生长发育和胁迫适应过程,在这些过程中,Ca2+信号带有特异性标签,通过 Ca2+结合蛋白及其下游靶蛋白感知不同刺激并翻译成响应的细胞反应,钙调素(CaM)和钙调素类蛋白(CML)是Ca2+主要的感受器,通过调节不同靶蛋白的活性调控多种细胞功能[9]。植物钙调素类蛋白(CML)在钙信号转导中发挥重要作用,拟南芥CML37可调节植物多种胁迫反应,促进干旱诱导的ABA合成[10],且Ca2+敏感蛋白CML37在拟南芥中起着正向防御调节作用,通过促进 JAR1的活性来增强茉莉酸途径,从而激活下游防御[11]。CML20是响应胞质内钙离子的下游负调控因子,参与介导ABA调控气孔运动过程,影响植物抗干旱能力[12];拟南芥 CML24参与调控花粉萌发和花粉管长度并影响果荚的结实率[13]。研究木薯钙信号相关受体(CaM、CML、CBL)的表达模式,发现钙信号在木薯响应干旱胁迫和抗采后生理性变质过程中具有关键作用[14]。然而,CML参与调控木薯块根积累过程的研究尚未报道。
本研究通过酵母双杂交点对点实验、BiFC实验证实了MeCML24与MeSAUR1的互作关系。POPESCU等[15]通过高密度拟南芥蛋白微阵列挖掘CML蛋白的互作蛋白,发现拟南芥CML9与SAUR_B蛋白(At5g20810)存在潜在互作关系,并通过免疫共沉淀(Co-Ip)验证了这2个蛋白的互作关系。然而CML9与SAUR_B互作生物学功能尚未明确。本研究利用双荧光素酶实验,证明了MeCML24负调控MeSAUR1对MeAGPS1a基因的激活作用。此研究结果说明,钙信号途径参与调控木薯淀粉的合成过程。后续工作中,将进一步利用转基因及基因编辑技术,研究MeSAUR1与互作蛋白MeCML24对MeAGPS1a基因的调控效应及对木薯淀粉合成的影响。
