采后黄瓜响应低温胁迫的转录组学分析
2023-02-27黄泳谚易景怡
黄泳谚,易景怡,王 斌
韶关学院广东省粤北食药资源利用与保护重点实验室/韶关学院英东生物与农业学院,广东韶关 512005
果蔬(水果和蔬菜的简称)采收后因脱离了母体,失去了养分供应来源,只能依靠自身贮存的营养物质维持正常的生命活动[1]。但采后果蔬仍是鲜活的生命体,各种生理代谢活动依然旺盛,在常温贮藏极易腐烂变质,导致营养物质流失甚至失去商品价值,会造成较为严重的经济损失和资源浪费[2]。在低温环境条件下,病原微生物的活动减弱,采后果蔬的呼吸作用强度下降,内源乙烯释放量减少。因此,低温贮运被认为是保持采后果蔬贮藏品质的最重要技术之一[3]。但是,许多原产于热带亚热带地区的果蔬,对低温特别敏感,在低温贮藏期间很容易发生冷害[4],极大限制了低温贮运技术在这类果蔬中的推广应用。黄瓜(Cucumis sativusL.)是葫芦科黄瓜属植物,采后黄瓜对低温十分敏感,在低于10℃的环境下贮藏时,即可产生明显的冷害症状[5]。发生冷害的采后黄瓜在货架期会腐烂变质,造成较大的经济损失。因此,探究采后黄瓜对贮藏低温响应的分子机理,能为改进采后贮运技术提供理论依据。
植物应答低温胁迫是一个十分复杂的调控过程[6]。关于植物应答低温胁迫的分子机理,在模式植物拟南芥(Arabidopsis thaliana)上研究的比较清楚[7]。对拟南芥的研究显示,拟南芥主要通过依赖CBF/DREB(C-repeat binding factor/dehydration responsive element binding protein)和不依赖CBF/DREB两种途径实现对低温信号的传导[8]。在CBF途径中,低温胁迫处理能在短时间内诱导 3个CBF基因的表达,紧接着 CBF蛋白被活化,直接作用于低温响应相关基因的启动子区域,激活或抑制下游靶基因的表达[9]。转录组分析发现,在拟南芥中大约只有12%的低温响应相关基因依赖于CBF信号转导途径[10]。此外,转录后调控以及蛋白修饰也可能参与植物对低温信号的响应与传导[11-12],显示植物对低温信号响应的复杂性。同时,拟南芥是非冷敏感型植物,且处于低温胁迫条件时仍没有脱离母体,冷敏型采后果蔬对低温胁迫的应答机理可能很大区别于仍处于营养生长期的耐冷型植物,比如拟南芥。因此,探究冷敏型采后果蔬响应低温胁迫的分子机理,对于完善和丰富植物低温胁迫应答机理具有重要意义。
随着高通量测序技术的快速发展,转录组测序已成为研究植物低温信号应答分子机理的重要方法之一[13-15]。本研究以采后黄瓜为试材,评估了采后黄瓜在低温贮藏期间的冷害情况,检测了5℃低温贮藏的采后黄瓜在72 h以内的转录组变化,并结合生物信息学分析的方法,在转录组层面分析了采后黄瓜响应冷害温度的分子机理。分析采后黄瓜响应冷害低温处理的转录组变化,能鉴定出耐冷关键基因和关键防御途径,为耐冷相关基因的功能研究奠定基础。
1 材料与方法
1.1 材料
供试黄瓜的商品名称为“翠夏”,父母本信息不详。从种植基地运到农贸市场前,未经预冷处理。将供试黄瓜在2 h内从农贸市场运回实验室,立即挑选果形基本一致、无病虫害和明显机械伤的果实,作为试验样品。将采后黄瓜分别放置在3个塑料筐中,每个筐中装22根,共66根。其中,30根(3个重复,每重复10根)用于观察在低温贮藏期间的冷害发生情况,另外36根用于取样分析,每次从中随机抽取3根。塑料筐装好黄瓜后,用塑料薄膜保鲜袋密封包装,贮藏于 5℃的低温恒温培养箱中,相对湿度为95%~98%。共贮藏12 d,期间每间隔2 d观察一次冷害情况。转录组测序的样品在低温贮藏12 h和72 h时收集,以果皮作为分析样品。果皮用削皮刀削下后,立即用液氮速冻处理,保存于-80℃冰箱。
1.2 方法
1.2.1 采后黄瓜的冷害指数、相对电导率和 PSⅡ原初光能转化效率测定 采后黄瓜的冷害症状表现为在果皮出现水渍状凹陷斑,根据凹陷斑症状占果皮表面总面积的比例,统计并计算采后黄瓜的冷害指数(chilling injury index, CII)[16]。将冷害指数分为5级:0级,未产生冷害症状;1级,冷害症状的面积占单果表面积的比例低于25%;2级,冷害症状面积占单果表面积的比例为 26%~50%;3级,冷害面积占单果表面积的比例为51%~75%;4级,冷害面积超过表面积的75%。冷害指数=∑(级数×相应级数果实的数量)/总果实数量。
采用电导率仪测定黄瓜果皮的相对电导率(relative electrical conductivity, REC)[17]。用不锈钢削皮刀削取约 1 mm厚度的黄瓜果皮,用0.5 cm孔径的打孔器制得果皮小圆片,每个重复20个小圆片。将小圆片放置在50 mL离心管中,用超纯水冲洗3次,沥干小圆片表皮水分。在离心管中加入25 mL的超纯水,盖住离心管盖子。室温(25℃)浸泡2 h,测定果皮小圆片渗出物的初始电导值C1。然后将含有小圆片及渗出物的理性在沸水中煮30 min,自然冷却至室温(25℃)后,测定渗出物的终止电导值C2。计算公式: REC(%)=100×(C1/C2)。
在测定PSⅡ原初光能转化效率(Fv/Fm)前,采后黄瓜在黑暗条件下处理30 min,将黄瓜果实横切成3等份,取中间1段测定黄瓜果皮的PSⅡ原初光能转化效率。具体测定方法见WANG等[17]的论文。
1.2.2 黄瓜果皮总RNA提取和 cDNA文库构建采用天根生化科技(北京)有限公司的RNAprep Pure多糖多酚植物总 RNA提取试剂盒(产品编号:DP441)提取黄瓜果皮总RNA,操作方法和步骤严格按照试剂盒说明书进行。转录组测序在北京百迈客生物科技有限公司完成。使用Agilent Bioanalyzer 2100 system检测黄瓜果皮总RNA浓度和RIN值,总RNA纯度使用超微量紫外分光光度计 Nano DropTM仪器检测。质检合格的总RNA用Illumina TruSeqTM RNA Sample Preparation Kit试剂盒构建cDNA文库,具体方法参照试剂盒说明书进行。构建好的文库用ABI Step One Plus Real-Time PCR System对文库的有效浓度(>2 nmol/L为有效浓度)准确定量,以保证cDNA文库质量。质检合格后,用Illumina平台测序分析[13]。
1.2.3 基因组比对、差异表达基因筛选及富集分析 测序完成后,采用HISAT(hierarchical indexing for spliced alignment of transcripts)方法[18],以黄瓜基因组数据作为参考,进行序列比对及后续分析,黄瓜基因组数据库地址:http://www.cucurbitgenomics.org/organism/20。采用DESeq2法比较样品组间的基因表达差异[19],获得差异表达基因集。筛选差异表达基因的标准为:差异倍数(fold Change, FC)大于等于2.5,且错误发现率(false discovery rate, FDR)小于0.01[13]。FC由2组相比较样品的表达量得到,FDR通过对差异显著性P值(Pvalue)校正得到。
利用 NCBI非冗余蛋白质数据库(ftp://ftp.-ncbi.nih.gov/blast/db/)、GO(gene ontology, http://www.geneontology.org/)、大型蛋白质家族数据库(http://pfam.xfam.org/)、蛋白质直系同源数据库(http://www.ncbi.nlm.nih.gov/COG/)、KEGG(kyoto encyclopedia of genes and genomes, http: //www.genome.jp/kegg)、蛋白质序列注释数据库 Swiss-Prot(http://www.uniprot.org/)等公共数据库注释基因功能。基于GOseq R软件中的phyper函数进行GO分类富集分析,应用R软件进行KEGG通路富集分析[20]。
1.2.4 差异表达基因的表达分析 StringTie通过最大流量算法,采用FPKM(fragments per kilobase of transcript per million fragments mapped)[21-22]表示基因的表达水平。根据KEGG通路富集结果,在北京百迈客生物科技有限公司的在线云平台(http://www.biocloud.net)上,筛选与植物激素信号转导、植物-病原互作以及苯丙烷合成等途径中的差异表达基因。
随机挑选9个代表性差异表达基因,采用荧光定量PCR(qRT-PCR)的方法验证其表达情况。使用上海翊圣生物科技有限公司的荧光定量PCR检测试剂盒(产品编号:11201ES03)和美国Bio-Rad公司的荧光定量PCR仪分析9个代表性差异表达基因的表达情况。qRT-PCR反应体系为:1 μL 的 cDNA 模板,各 1 μL 的正反向引物,10 μL的PCR Mix和7 μL的RNase free water,总反应体积为 20 μL。qRT-PCR反应条件为:95℃预变性2 min,95℃变性15 s、60℃退火20 s、72℃延伸26 s,总共40个循环。引物信息见表1,以黄瓜ACTIN基因(CsaV3_6G041900.1)作为内参基因。

表1 本研究所用引物Tab.1 Primers used in this study
1.3 数据处理
使用Excel 2016软件记录、整理和分析数据。差异表达基因的火山图、GO和KEGG富集分析在北京百迈客生物科技有限公司的在线云平台(http://www.biocloud.net/)完成,采用 Tbtools软件绘制差异表达基因的表达热图。
2 结果与分析
2.1 5℃低温贮藏期间采后黄瓜冷害情况
采后黄瓜对低温敏感,贮藏在10℃低温及以下温度时,即可发生冷害[17]。在 5℃低温贮藏期间,黄瓜冷害指数(CII)和相对电导率(REC)随贮藏时间逐渐增加,PSⅡ原初光能转化效率(Fv/Fm)逐渐降低(图1)。0 d时,采后黄瓜没有出现任何冷害症状,但在低温贮藏 12 d时,CII为1.5。在贮藏12 d时,REC比0 d高58.20%,Fv/Fm比0 d低71.63%。说明采后黄瓜在5℃低温贮藏期间发生了明显的冷害,且冷害症状随贮藏时间逐渐加重,在 12 d时出现了严重的冷害症状。

图1 5℃低温贮藏期间采后黄瓜冷害情况Fig.1 Chilling injury of harvested cucumber during cold storage at 5℃
2.2 转录组测序数据质量分析
测序包括对照组(0 h)和低温处理组(12 h和72 h),共3组样品。每组样品设置3个独立的生物学重复,共9个样品。测序数据经过组装、基因组比对后,基因组比对效率介于 85.37%~93.93%之间,均值为90.06%。9个样品的平均GC含量比例为44.32%,Q30为93.32%。这些结果表明,转录组测序数据的质量很高,可用于后续的生物信息学分析。
2.3 低温处理12 h对黄瓜转录组的影响
通过火山图可以直观地查看基因在不同样品间表达水平的差异,以及统计学的差异显著性。与处理前(0 h)相比较,5℃低温处理12 h导致1500个基因差异表达,其中706个基因表达上调,794个基因表达下调(图2A),表明采后黄瓜在转录组层面对胁迫低温作出了快速响应。分别采用KEGG通路富集和GO功能分类富集的分析方法,分析了受低温处理影响的差异表达基因的功能。KEGG通路富集分析的结果显示,植物激素信号转导(plant hormone signal transduction)通路富集的差异表达基因数量最多,且该通路的q值最低,其次是苯丙氨酸代谢(phenylalanine metabolism)和苯丙烷素生物合成(phenylpropanoid biosynthesis)(图2B)。GO功能分类富集分析结果显示,在生物过程(biological process)分类下,差异表达基因被显著富集在以 DNA为模板的转录调控(regulation of transcription, DNA-templated)和蛋白磷酸化(protein phosphorylation)2个过程中;在细胞组份(cellular component)分类下中,被显著富集的差异表达基因主要与细胞膜(membrane)和细胞核(nucleus)有关;在分子功能(molecular function)中,差异表达基因的功能主要与DNA结合(DNA binding)和转录因子活性(transcription factor activity)功能有关(图2C)。KEGG和GO富集分析的结果表明,采后黄瓜响应低温胁迫可能是一个十分复杂的生理过程,涉及到植物激素信号转导、苯丙烷类化合物合成、蛋白磷酸化、转录调控、细胞器组分和形态变化等。

图2 低温处理12 h的转录组变化Fig.2 Transcriptomic changes following 12 h of cold treatment
2.4 低温处理72 h对黄瓜转录组的影响
与低温处理0 h相比,5℃处理72 h导致7799个基因差异表达,其中 3995个基因表达上调,3804个基因表达下调(图3A),表明较长时间的低温处理在转录组层面诱导了更广泛的反应。KEGG通路富集分析的结果显示,苯丙氨酸代谢、植物病原菌互作(plant-pathogen interaction)和光合作用天线蛋白(photosynthesis-antenna proteins)3个KEGG通路的富集可靠性最高(图3B)。GO功能分类富集分析结果显示,在生物过程分类下,差异表达基因被显著富集在跨膜转运(transme-mbrane transport)、蛋白泛素化(protein ubiquitination)和蛋白磷酸化 3个过程中;在细胞组分分类下,被显著富集的差异表达基因主要与细胞膜和细胞质(cytoplasm)等细胞器有关;在分子功能分类下,差异表达基因的功能主要与ATP结合(ATP binding)和蛋白丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)功能有关(图3C)。KEGG和GO富集分析的结果表明,蛋白磷酸化修饰和泛素化降解可能与采后黄瓜耐冷性密切相关。因为胁迫低温会使蛋白构象发生变化,使蛋白丧失原有功能[5]。此外,植物与病原菌互作有关的基因也被显著富集,表明抗病相关基因可能在采后黄瓜适应低温胁迫过程中扮演重要作用。
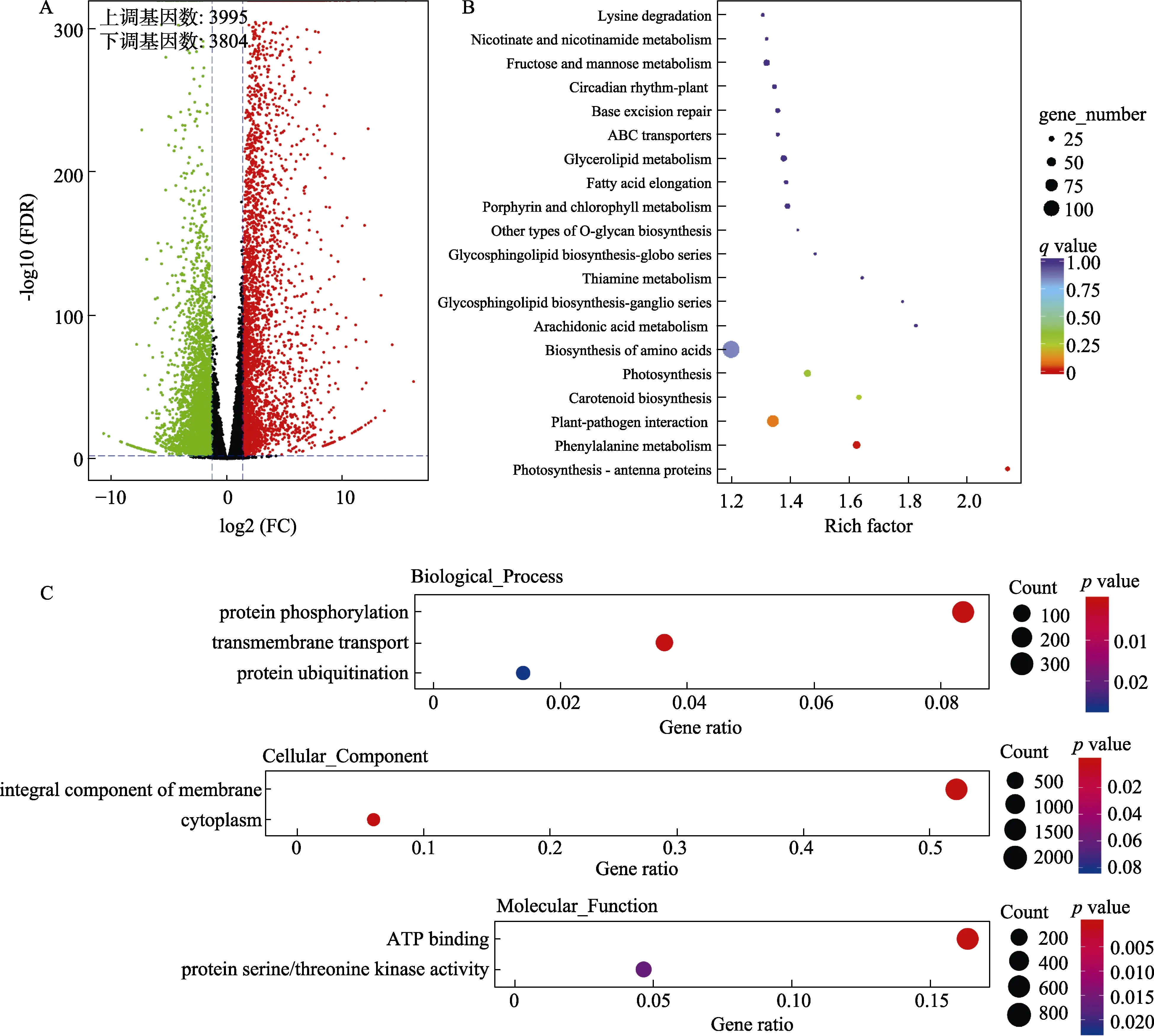
图3 低温处理72 h的转录组变化Fig.3 Transcriptomic changes following 72 h of cold treatment
2.5 低温处理72 h与处理12 h间黄瓜转录组的差异
12 h与 72 h不同时长的低温处理组间共有6523个基因差异表达。与 12 h处理相比,3430个基因在处理72 h时表达上调,3093个基因表达下调(图4A)。表明低温持续诱导了采后黄瓜在转录组层面的变化,尽管采后黄瓜在低温处理72 h时已经表现出了一定程度的冷害症状。KEGG通路富集分析的结果显示,氨基酸合成(biosynthesis of amino acids)通路富集的差异表达基因数量最多,但该通路的q值大于0.50(图4B)。富集结果可靠性最高的4个KEGG通路分别是苯丙氨酸代谢、卟啉与叶绿素代谢(porphyrin and chlorophyll metabolism)、植物病原菌互作和光合作用天线蛋白(图4B)。说明72 h的低温胁迫处理可能已经对采后黄瓜光合作用系统造成了损害,再次表明冷害低温诱导的抗病相关基因表达可能与采后黄瓜耐冷性有关。GO功能分类富集分析结果显示,在生物过程分类下,差异表达基因被显著富集在跨膜转运和蛋白磷酸化2个过程中;在细胞组分分类下,被显著富集的差异表达基因主要与细胞膜、细胞质和叶绿体(chloroplast)等细胞器有关;在分子功能分类下,差异表达基因的功能主要与ATP结合、蛋白激酶活性(protein kinase activity)和水解酶活性(hydrolase activity)功能有关(图4C)。与低温处理12 h相比,采后黄瓜冷害在5℃处理72 h时已经发生,表明细胞膜、细胞质和叶绿体等细胞器的完整性受损,胞内水解活性增加,物质的跨膜运输加快。图1B的结果也反应,采后黄瓜在5℃贮藏72 h(3 d)细胞膜透性增大。

图4 低温处理72 h与12 h组间的转录组差异Fig.4 Transcriptomic differences between 72 h and 12 h of cold treatment
2.6 与植物激素信号有关的差异表达基因在低温处理期间的表达变化
由于低温处理12 h诱导的差异表达基因最显著富集到植物激素信号转导通路中,暗示着低温胁迫处理通过影响植物激素含量传递信号。因此,分析了与植物激素信号转导有关的差异表达基因在响应低温胁迫处理期间的表达模式。如图5所示,低温处理影响50个与植物激素信号转导有关的基因差异表达,这些差异表达基因的表达模式可大体分为4种类型(图5)。有些差异表达基因在胁迫低温处理后,表达被12 h低温处理明显诱导,但在处理72 h时,其表达量又有所下降,但仍比0 h高,比如CsaV3_1G039360基因;有些差异表达基因的表达量持续被低温处理所诱导,比如CsaV3_2G002930基因的表达随处理时长而逐渐增强;有些差异表达基因只被12 h的低温处理所诱导,比如CsaV3_7G000720基因;另一些差异表达基因的表达显著被12 h和72 h的低温处理所抑制,且随处理时长增加,抑制效果越明显,比如CsaV3_5G000620基因。以上结果表明,与植物激素信号有关的差异表达基因,参与了采后黄瓜对低温胁迫信号的快速响应和传递。

图5 与植物激素信号有关的差异表达基因的表达模式Fig.5 Expression pattern of DEGs related to plant hormone signal
2.7 与苯丙烷素合成有关的差异表达基因在低温处理期间的表达变化
在不同时长的低温处理中,与苯丙烷素合成或者苯丙氨酸代谢途径有关的基因显著富集。为此,重点分析了与苯丙烷素合成和苯丙氨酸代谢相关的差异表达基因在低温处理期间的表达模式。表达热图的结果显示,在5℃低温处理期间,共鉴定到了63个苯丙烷途径的差异表达基因。其表达模式可大致分为3种,一些差异表达基因被2个不同时长的低温处理所诱导;一些基因的表达被一种处理所诱导,却被另一种处理所抑制;一些差异表达基因的表达被低温处理抑制(图6)。其中,31个差异表达基因被至少1种时长的低温处理强烈诱导。比如,CsaV3_3G030410基因在12 h的表达量显著高于 0 h和 72 h,而 CsaV3_6G039700基因在72 h的表达量显著高于0 h和12 h。6个差异表达基因(CsaV3_7G031600、CsaV3_7G008590、CsaV3_6G039660、CsaV3_5G033660、CsaV3_3G032630和 CsaV3_1G013520)在12 h时的表达量显著低于0 h和72 h。26个差异表达基因的表达被 2种时长的低温处理所抑制,且处理时间越长,对表达的抑制效果越明显,比如CsaV3_3G019500和CsaV3_3G047080基因。表明低温处理影响苯丙氨酸代谢和苯丙烷素生物合成等过程,可能通过影响苯丙烷途径相关基因的表达,诱导苯丙烷素类物质的合成与积累。
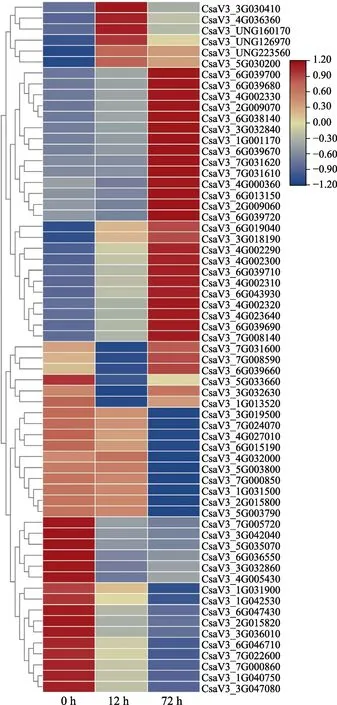
图6 与苯丙烷素合成有关的差异表达基因的表达模式Fig.6 Expression pattern of DEGs related to phenylpropanoid biosynthesis
2.8 与植物与病原菌互作有关的差异表达基因在低温处理期间的表达变化
72 h的低温处理显著影响与植物-病原菌互作有关基因的表达,表明植物-病原菌互作可能参与采后黄瓜对低温胁迫的适应过程。共鉴定到了 76个与植物-病原菌互作有关的差异表达基因,其在低温处理期间的表达模式如图7所示。差异表达基因的表达模式大体可分为2种类型,低温处理诱导抑制 21个差异表达基因的表达,却诱导 55个差异表达基因的表达。比如,CsaV3_1G045860基因的表达量随低温处理时长而逐渐降低,但CsaV3_3G040820基因的表达量随处理时长而逐渐增强。被低温处理显著影响的差异表达基因主要是与钙离子信号有关的基因,以及一些受体类的蛋白激酶、热激蛋白(heat shock protein)、NADPH 氧化酶(respiratory burst oxidase homolog, RBOH)和WRKY转录因子基因。被低温处理所诱导的差异表达基因数量明显多于被抑制的,且72 h的低温处理对差异表达基因的诱导作用更强(图7)。表明低温处理诱导了更多抗病有关基因的表达,其表达可能是采后黄瓜应对低温胁迫的重要机制。
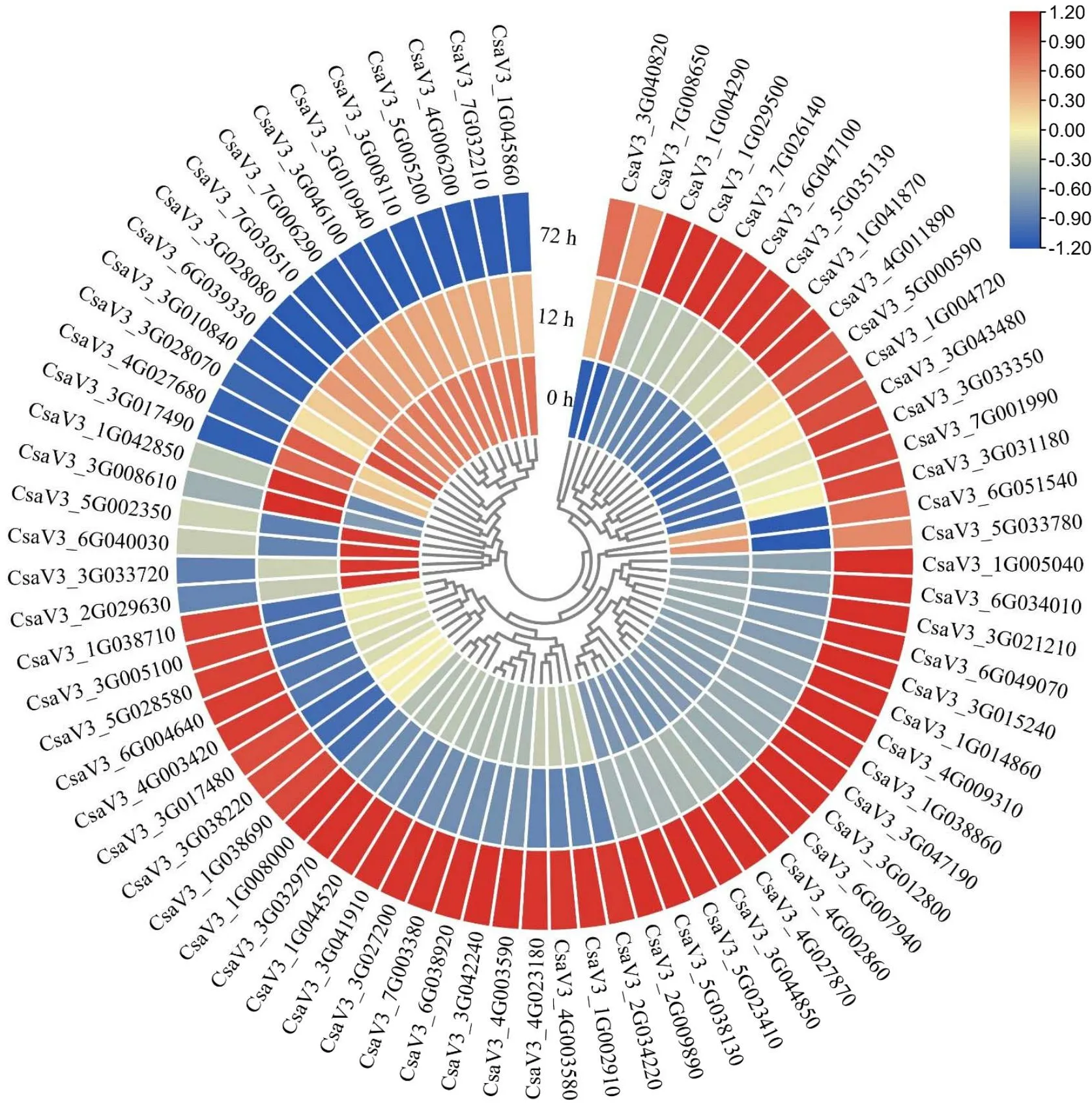
图7 与植物与病原菌互作有关的差异表达基因的表达模式Fig.7 Expression pattern of DEGs related to plant-pathogen interaction
2.9 差异表达基因的qRT-PCR验证
为检验转录组数据的准确性和可靠性,从差异表达基因中,随机挑选了9个代表性基因,采用qRT-PCR法验证其表达[13]。在转录组测序的结果中,3个差异表达基因(CsaV3_3G012390、CsaV3_3G022370和CsaV3_5G027300)在低温处理12 h时表达量显著增加,在72 h时表达量又降低(图8A~图8C)。5个差异表达基因(CsaV3_3G022290、CsaV3_6G037780、CsaV3_3 G034870、CsaV3_3G036040和CsaV3_4G004700)的表达量随处理时长而显著增加(图8D~图8H)。1个差异表达基因(CsaV3_6G044400)的表达在低温处理12 h时被抑制,却在处理72 h时再次被激活(图8I)。如图8所示,尽管同一差异表达基因在转录组和 qRT-PCR分析结果中的差异倍数不完全一致,但其表达趋势是高度一致的。证明转录组数据的准确性与可信性很高,通过分析转录组数据得到的结论是可靠的。

图8 qRT-PCR验证差异表达基因Fig.8 Representative gene expression validated by qRT-PCR
3 讨论
采后黄瓜对低温敏感,在低温贮藏期间很容易发生冷害[23]。采后黄瓜的冷害症状主要表现为果皮出现水渍状凹陷斑,冷害严重程度与贮藏环境温度高低以及低温胁迫持续时间有关[17]。本研究中,采后黄瓜在 5℃温度下贮藏时产生了明显的冷害症状,表现为冷害指数和相对电导率增加,PSⅡ原初光能转化效率降低。冷害指数以及相对电导率与冷害严重程度正相关,冷害指数和相对电导率越大,采后黄瓜冷害越严重。Fv/Fm值与冷害程度负相关,Fv/Fm值越大,光合作用系统完整性好,冷害症状越轻[13],尽管采后黄瓜在贮藏期间光合作用较弱。表明可同时通过监测冷藏黄瓜的冷害指数、相对电导率和 PSⅡ原初光能转化效率的变化,联合评估采后黄瓜的冷害情况。
植物激素作为重要的信号分子,在传递胁迫信号过程中具有重要作用[24]。乙烯(ethylene,ETH)、茉莉酸(jasmonic acid, JA)与脱落酸(abscisic acid, ABA)与植物逆境胁迫密切相关,许多研究的结果表明,这3种植物激素均参与植物对低温胁迫的响应[25]。本研究中,鉴定到了 3个与ABA信号有关的低温响应差异表达基因。其中,低温处理诱导 2个 ABA受体基因PYL9(CsaV3_3G008140)和PYL4(CsaV3_3G033450)表达,抑制了PYL8(CsaV3_5G000620)表达(图5),表明在采后黄瓜适应低温胁迫过程中ABA参与了对低温胁迫信号的传递。鉴定到了 4个与ETH信号有关的差异表达基因,低温诱导 2个ETF1B(ethylene-responsive transcription factor 1B)(CsaV3_2G012870 和 CsaV3_3G012170)和1个ETH不敏感突变体EIN3(ethylene-insensitive 3)(CsaV3_2G002930)表达,2个乙烯受体基因ER2(ethylene receptor 2)(CsaV3_3G012390)和ER1(CsaV3_2G009260)的表达只被12 h的低温处理所诱导,且72 h的低温处理抑制ER2基因表达。EIN3蛋白可通过与 F-box蛋白 EBF1/2(EIN3-binding F-box 1/2)结合,激活CBF表达,并增强植物低温耐受性[26]。在番茄(Lycopersicon esculentum)和烟草(Nicotiana tabacumL.)中,过表达乙烯响应因子ERF2(ethylene responsive element binding factor 2)能促进内源乙烯的合成[27]。表明乙烯信号参与了采后黄瓜对低温胁迫的响应,诱导的乙烯信号途径相关基因与低温应答密切相关。此外,4个与 JA信号有关的基因(protein TIFY)(CsaV3_3G030830、CsaV3_1G041270、CsaV3_1G007260和 CsaV3_6G007840),在低温处理后表达量发生了显著变化。低温处理12 h均诱导这4个TIFY基因的表达,但在处理72 h时,TIFY-10A(CsaV3_1G041270)和TIFY-6B(CsaV3_1G007260)的表达量显著低于0 h时的表达量。在植物中,TIFY蛋白是JA信号的抑制子,负调控JA反应[28]。低温处理能诱导JA合成,外源 JA处理也能增强植物的抗冷性[29]。表明短时的低温处理通过激活TIFY基因表达,抑制了JA信号反应,激活JA信号反应可能需要更长时间的低温处理。
油菜素内酯(brassinolide, BR)、赤霉素(gibberellin, GA)、吲哚乙酸(indole-3-acetic acid,IAA)和生长素(auxin, AUX)是植物生长类激素,现有的研究证实,这4种激素也参与植物对低温的响应与调控[30]。本研究中,共鉴定了 17个与AUX信号有关的差异表达基因,其中6个是AUI(auxin-induced protein)基因,11个是AUR(auxin-responsive protein)。4个AUR基因(CsaV3_1G030930、CsaV3_6G040760、CsaV3_2G015590和CsaV3_1G045520)的表达均被不同时长的低温处理所诱导,却抑制 4个AUR基因(CsaV3_7G022810、CsaV3_6G047000、CsaV3_6G013600和CsaV3_2G015380)表达,3个AUR基因(CsaV3_7G000720、CsaV3_3G012650和CsaV3_3G007730)的表达在 12 h时被诱导,却在72 h时被抑制,表明AUX十分复杂地参与低温信号的传导。低温处理诱导2个GA受体基因GR-1C(gibberellin receptor 1C)和GR-1B(CsaV3_1G039360和CsaV3_7G028420)的表达,表明低温处理激活了GA信号途径。与0 h相比,BKI1(brassinolide kinase inhibitor 1)(CsaV3_2G027990)在12 h时表达上调,72 h却抑制其表达,BZR1(brassinazole-resistant 1)的表达模式刚好与BKI1基因相反。在植物中,BKI1负调控BR信号[31],BZR1正向调控 BR信号[32]。表明BR信号传导反应被短期低温处理所抑制,BR信号可能是其他信号的下游事件,比如ETH和ABA信号。此外,低温处理还诱导一个IAA合成酶基因(CsaV3_3G018080)的表达,表明低温处理促进了IAA的生物合成,诱导的IAA可能参与低温信号的传导过程。
植物体内含有种类和含量丰富的次生代谢产物, 其具有抗细胞毒性、抑菌、抗氧化等多种生物活性[33-34]。研究表明,酚类物质在采后果蔬抵御低温胁迫过程中发挥重要作用,而苯丙烷途径是合成酚类物质的主要通路[35]。本研究中,低温处理诱导的差异表达基因被显著富集在苯丙氨酸代谢和苯丙烷素合成途径中。苯丙氨酸是合成大部分酚类物质的初始化合物[36]。本研究中,KEGG富集分析共鉴定到了 43个与苯丙氨酸代谢有关的差异表达基因,其中27个被低温显著诱导,16个在低温处理后表达量下降。表明低温处理促进了苯丙氨酸代谢活性,为酚类化合物合成提供了充足前体物质。49个差异表达基因与苯丙烷素合成有关,其中,低温诱导34个相关基因的表达,却抑制15个相关基因的表达。被低温诱导的差异表达基因数量明显多于被抑制的,表明低温处理激活了苯丙烷生物合成途径。诱导苯丙烷类物质的生物合成和积累,可能是采后黄瓜应对低温胁迫的重要机制。
植物与病原菌互作相关基因表达与植物耐冷性密切相关[37]。低温处理显著诱导钙信号相关基因表达,且钙信号与一氧化氮(nitric oxide, NO)、活性氧(reactive oxygen species, ROS)和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号协作,共同调控植物耐冷性[38]。本研究中,76个与植物-病原菌互作有关的基因在低温处理后差异表达。其中,38个差异表达基因是钙信号相关基因,4个是RBOH基因(CsaV3_1G038860、CsaV3_5G002350、CsaV3_1G002910和CsaV3_3G043480),1个是NO信号相关基因(CsaV3_5G005200),4个是WRKY转录因子基因(CsaV3_3G008610、CsaV3_1G00 4720、CsaV3_3G033350和CsaV3_1G044520),4个是热激蛋白基因(heat shock protein, HSP)(CsaV3_3G017490、CsaV3_1G038710、CsaV3_1G038690、CsaV3_3G017480),4个是病程相关基因(CsaV3_1G045860、CsaV3_7G026140、CsaV3_2G009890和 CsaV3_3G010840)。低温处理诱导绝大多数的与病原菌互作有关的差异表达基因,且诱导强度随处理时间而加强;仅个别基因表达被低温处理抑制,比如低温处理只抑制 6个钙信号相关基因的表达。表明低温处理诱导了与病原互作有关基因的表达,诱导抗病相关基因表达可能有助于采后黄瓜适应低温胁迫。
此外,GO功能分类富集的结果显示,低温诱导的差异表达基因的功能还与蛋白磷酸化和泛素化、跨膜转运、亚细胞器组分、DNA和 ATP结合活性等有关,表明采后黄瓜响应并对低温胁迫作出抗性,是一个复杂的反应过程,涉及蛋白磷酸化修饰和泛素化降解、细胞器形态和组分改变、转录调控、能量代谢平衡等多种分子和生理活动。
综上所述,胁迫低温导致冷害指数和相对电导率增加,PSⅡ原初光能转化效率降低,表明可通过监测这 3个指标变化判断采后黄瓜冷害情况。与JA、ETH、ABA等植物激素信号感受有关的差异表达基因被短时的低温处理诱导,表明植物激素信号参与低温信号响应与转导。低温处理诱导了许多苯丙烷合成基因的表达,表明诱导苯丙烷类物质的合成积累,可能是采后黄瓜适应低温胁迫的重要防御机制。低温处理诱导了大量与病原菌互作有关基因的表达,表明低温诱导的抗病相关基因表达与采后黄瓜耐冷性有关。研究结果为采后黄瓜响应低温胁迫的分子机理提供了新见解。
