StEFR1正调控马铃薯对晚疫病的抗性
2023-02-27张卫娜余慧芳柳文凯康益晨石铭福杨昕宇张茹艳秦舒浩
张卫娜 余慧芳 安 珍 柳文凯 康益晨 石铭福 杨昕宇 张茹艳 王 勇 秦舒浩
正调控马铃薯对晚疫病的抗性
张卫娜 余慧芳 安 珍 柳文凯 康益晨 石铭福 杨昕宇 张茹艳 王 勇 秦舒浩*
甘肃农业大学园艺学院, 甘肃兰州 730070
马铃薯晚疫病是毁灭性卵菌病害, 对我国乃至全球的农业生产造成巨大的经济损失。本试验结合生物信息学分析、表达模式和功能验证, 分析了LRR-RLK家族成员调控晚疫病抗性的作用和潜在的调控机制。进化分析表明, StEFR1与拟南芥中功能已知的AtEFR序列相似度为53.9%。接种晚疫病菌3 d和elf18处理3 h, ‘大西洋’离体叶片中的表达分别上调至对照的1.87倍和2.31倍。瞬时过表达的叶片受到晚疫病菌侵染时抗性增强, 表现在叶片病斑面积较对照减小, 而叶片细胞活性较对照增强。此外, 与野生型相比, 过表达的叶片中3个PTI标记基因、SA和JA信号通路相关基因差异表达, 且呈不同程度的显著上调, 而ET信号通路相关基因的表达量无明显变化。综上所述,参与晚疫病菌诱导的PTI抗性, 且调控SA和JA激素信号相关基因的表达, 对晚疫病起正调控作用。本文为深入研究调控晚疫病免疫反应的分子机制奠定了基础, 并为晚疫病分子育种研究提供重要参考。
马铃薯晚疫病; LRR-RLK家族; 激素信号; 标记基因; 差异表达
由致病疫霉((Mont.) de Bary)引起的晚疫病是马铃薯产业的重大卵菌病害, 可致茎、叶、块茎等多个器官发病[1]。晚疫病被称作“植物杀手”, 在短短几周之内可使植株大范围感病, 造成严重减产甚至绝收。1847年的“爱尔兰大饥荒”致100多万人死亡, 200多万人逃亡海外[2]。我国马铃薯种植面积广, 产量需求高, 而晚疫病发病迅速, 危害严重。据统计, 全球每年因晚疫病造成的经济损失为60多亿美元, 在我国高达140多亿元[3]。生产中将品种选择、块茎消毒、合理密植等农业措施和生物菌剂及化学药剂的应用等防控途径相结合,已逐步形成了较为成熟的综合防控技术体系[4]。然而, 抗性育种仍是实现该病害绿色防控的根本途径, 而抗病机理的解析和主效抗病基因的鉴定是加快抗病育种进程的重要保障。
在长期进化过程中, 植物形成了复杂有序的免疫反应, 主要包括水平抗性和垂直抗性[5]。基因介导的抗性已被广泛应用于小麦和其他作物的育种中。同样, 研究者从马铃薯野生种中也鉴定出大量抗晚疫病的基因(~), 其中, 来源于的、、及均被导入到栽培品种中, 但其产生的抗性很容易被快速进化的生理小种克服, 从而使马铃薯晚疫病垂直抗性的利用愈加困难[6-8]。水平抗性无寄主特异性, 主要由位于细胞表面的模式识别受体(pattern recognization receptor, PRR)激发[9], 类受体激酶(receptor like kinase, RLK)和类受体蛋白(receptor like protein, RLP)是迄今发现最重要的2类PRRs[10]。PRRs识别的病原菌相关分子模式(Pathogen/microbe-associated molecular patterns, PAMP/MAMP)是病原菌结构组成相对保守的部分, 其介导的水平抗性被认为更加持久且具广谱性[11]。
RLKs被称为植物生命活动的“中央处理器”, 参与调控细胞几乎所有的生命活动, 在植物基因组中存在多达500至1000个家族成员, 可分为至少60个亚家族[12]。部分RLKs在植物调控免疫反应过程中的重要作用也被陆续证实[13-15], 如LysM亚家族成员CERK1和WAK亚家族成员WAK1分别识别几丁质和寡聚半乳糖醛酸信号[16-17], LRR-RLK亚家族成员FLS2、EFR、PEPR能够分别识别病原细菌鞭毛蛋白(flg22)、细菌PAMP延伸因子(EF-Tu)和拟南芥小分子肽(AtPeps)[18]。其中, 拟南芥编码的蛋白是富含亮氨酸重复的受体样激酶, 分子量约为113 kD[19], 转基因的烟草和番茄通过识别EF-Tu N端高度保守的18个氨基酸多肽elf18, 引起植株中强烈的氧爆发并诱导病程相关基因上调表达,从而提高植物的抗病性[20-21]。
前期工作中, 作者在马铃薯全基因组范围鉴定了RLKs, 发现LRR-RLK-XII亚家族成员(PGSC0003DMP400001888)在晚疫病侵染前后差异表达较为明显, 且与拟南芥亲缘关系较近。因此, 本研究拟结合表达分析、生物信息学分析和瞬时表达, 对该基因在晚疫病抗性中的作用和调控机制进行了初步研究, 为晚疫病抗病基因的挖掘和抗性机理的解析提供理论参考。
1 材料与方法
1.1 试验材料
本试验所用植物材料‘大西洋’马铃薯由本实验室种植, 具体条件为温度22℃, 光照条件为16 h光照和8 h黑暗, 湿度70%。待幼苗长到5~6周时用于瞬时转化和接种。本试验所用的晚疫病病原菌生理小种HB 09-16-2 (1.2.3.4.5.6.7.9.10.11)由华中农业大学田振东教授馈赠。
1.2 试验处理
将晚疫病病原菌(HB 09-16-2)接种于10 cm×10 cm的燕麦固体培养基上, 置于19℃培养箱培养12~14 d。接种前用灭菌的ddH2O将孢子洗脱并置于4℃冰箱约2~3 h, 使游动孢子充分释放, 将孢子浓度调整为7×104mL–1用于接种试验。选取长势良好、大小一致的5~6周的‘大西洋’第2到3片复叶, 叶片背面主脉左右两侧分别接种10 μL孢子悬浮液和10 μL ddH2O, 不同时间点采样用于测定的表达量。此外, 用100 nmol L–1elf18处理叶片, 不同时间点采样, 用液氮速冻后置于–80℃冰箱, 用于检测的表达量。
1.3 序列分析
根据马铃薯基因组数据库(PGSC v4.03, http:// solanaceae.plantbiology.msu.edu/pgsc_download.shtml)下载StEFR1的蛋白序列并在植物基因组在线网站(https://www.arabidopsis.org/)进行BLAST, 获得拟南芥和番茄中与该氨基酸序列同源性相近的蛋白序列。利用ClustalX1.83软件进行多序列比对, 并用进化分析软件MEGA5.0 (http://www.megasoftware. net/), 以邻接法(Neighbor-joining method)构建进化树, 执行参数为Poission模式(Poission Model)、部分删除(Partial deletion)和1000次重复有根树(Bootstrap replicated 1000)。
根据StEFR1的蛋白序列利用在线网站SMART (http://smart.emblheidelberg.de/)分析其结构域。此外, 从马铃薯基因组数据库提取起始密码子上游2000 bp序列, 利用PlantCARE数据库分析启动子区域顺式作用元件(-element)并进行统计。
1.4 StEFR1-pEGC5941过表达载体构建和叶片瞬时表达
根据的CDS序列, 分别设计上游(5¢-CTATGAAGTCTTTTAATGTTTTCCTTTGTG-3¢)和下游(5¢-TCTTAAGATAAAGTTT CTTTGACTAATTG-3¢)引物序列并加入酶切位点进行扩增。将扩增获得的基因片段整合至过表达载体pFGC5941, 经双酶切(I和II)和连接获得重组质粒pFGC5941-, 转入农杆菌GV3101备用。将携带重组质粒的农杆菌菌株活化后, 利用农杆菌渗入法在‘大西洋’叶片右侧瞬时表达, 叶片左侧注射含有空载体pFGC5941的农杆菌作为对照。2 d后在叶背主叶脉对应的注射部位各接种10 μL洗脱并调整好孢子浓度(7×104mL–1)的晚疫病菌孢子悬浮液, 于接种第3、4和5天后照相并统计病斑大小。同时, 取注射和接种后不同时间点的叶片, 用于细胞活性检测和基因表达分析。
1.5 细胞活性检测
取上述瞬时表达并接种病原菌的叶片, 用台盼蓝染色法测定细胞活性。台盼蓝染液配法如下: 将10 mL甘油、10 mL乳酸与10 mL无菌水混匀, 并加入10 mg台盼蓝粉末和10 g苯酚配置染液。将叶片在煮沸的台盼蓝溶液中煮1 min, 取出用无菌水冲洗放在2.5 g mL–1水合氯醛中脱色并照相。
1.6 基因表达分析
利用RNAout试剂盒(160906-50, Tiandz, 北京)提取马铃薯叶片的总RNA, 经凝胶电泳和超微量分光光度计质量检测合格后分别采用试剂盒PrimeScript RT reagent Kit with gDNA Eraser (RR047,TaKaRa, 大连)和SYBR Green ProHS预混型qPCR试剂盒(AG11718, TaKaRa, 大连)进行cDNA合成和qRT-PCR扩增。采用在线软件Primer 3.0 (http://primer3.ut.ee/)设计引物, 以elongation factor 1-α() (GenBank登录号为AB061263)作为内参基因, PTI标记基因(、和)[22-23]、SA信号通路标记基因(、和)、JA信号通路标记基因(和)和ET信号通路标记基因()[24]引物序列如表1所示。反应结束后分析荧光值变化曲线及熔解曲线, 并采用2–ΔΔCT计算基因的相对表达量[25], 试验设置3次独立重复。
1.7 统计分析
利用Microsoft Excel 2010软件处理原始数据, 利用-test (< 0.05)分析差异显著性, 采用软件OriginPro 8.0进行图形可视化。
2 结果与分析
2.1 StEFR1序列特征及进化分析
对PGSC0003DMP400001888进行结构域鉴定发现, 其具有胞外LRR结构域、跨膜区和激酶结构域, 具备典型的LRR-RLK结构, 为LRR-RLK家族成员(图1-A)。经氨基酸序列检索及进化分析表明, 该基因对应蛋白与番茄的7个蛋白(Solyc03g 096190、Solyc04g009040、Solyc07g018190、Solyc10g 085110、Solyc10g085120、Solyc07g018180和Solyc06 g076910)和拟南芥的6个蛋白(AT3G47110、AT5G39390、AT5G20480、AT3G47570、AT3G47580和AT3G47090)聚为同一个进化分支。其中, AT5G20480 (AtEFR)的功能已有相关研究, 因此把PGSC0003DMP400001888对应基因命名为(图1-B)。将StEFR1与AtEFR进行序列比对发现, 两者序列相似度为53.9% (图1-C), 说明StEFR1可能存在其特有的功能。

表1 实时荧光定量PCR引物
2.2 StEFR1响应病原菌信号
进一步分析了响应晚疫病菌和病原相关分子模体elf18的表达模式。与对照组相比, 接种晚疫病菌后该基因在‘大西洋’叶片中的表达量显著上调, 接种后第1、2、3和4天分别上调至对照的1.92、2.07、1.87和1.50倍, 且第3天时的相对表达量达最大值(图2-A)。elf18处理也可显著诱导该基因的表达, 处理1、3和6 h分别上调至ddH2O对照组的2.40、2.31和1.57倍, 而ddH2O对照组中的相对表达量变化不明显(图2-B)。表明该基因响应晚疫病菌侵染及elf18信号, 可能在调控马铃薯晚疫病抗性方面存在潜在功能。
2.3 StEFR1上游启动子区域存在响应逆境信号的顺式作用元件(cis-element)
为进一步分析的功能, 预测了启动子区域上游2000 bp的顺式调控元件, 发现启动子区域存在参与防御和应激反应的-element有2个, 参与脱落酸、干旱胁迫和玉米醇溶蛋白代谢响应的-element分别有2个、5个和1个, 暗示在马铃薯响应防御、激素和胁迫应答中存在潜在功能(表2)。
2.4 StEFR1正调控晚疫病抗性
通过农杆菌渗入法在‘大西洋’叶片中瞬时超表达(用OE表示), 于注射后1、2、2.5和3 d检测的表达情况。通过试验发现, 瞬时表达2 d时检测到的相对表达量达到最大, 是注射pFGC5941空载体对照组(用WT表示)的2.93倍(图3-A), 而注射2.5 d和3 d时目标基因的表达量有所下降。因此, 本试验在农杆菌渗入叶片2 d时, 在注射部位接种洗脱并调整好浓度的晚疫病菌, 发现第4天时WT组叶片接种部位发病症状严重, 而OE组叶片病变面积明显较小(图3-B)。对WT组和OE组叶片的病变面积进行统计发现, 接种晚疫病菌3、4和5 d时, WT病变面积分别为OE组的13.79、9.71和5.17倍(图3-C)。此外, 台盼蓝染色结果表明, WT组叶片的注射部位大量细胞被染成蓝色,而OE组叶片染成蓝色的细胞较少, 说明WT组中大量细胞呈死亡状态(图3-D)。表明, 瞬时超表达可显著减轻叶片的发病症状并减少死亡细胞的数量, 增强叶片对晚疫病菌侵染的抵抗性, 即正调控晚疫病抗性。

图1 StEFR1结构域鉴定、进化分析和序列比对
A: 对StEFR1进行结构域鉴定发现, 此基因为典型的LRR-RLK家族成员; B: StEFR1与拟南芥中功能已知的AT5G20480(AtEFR)亲缘关系相对较近; C: StEFR1与AtEFR序列相似性为53.9%。
A:is identified as a typical member of LRR-RLK family; B: StEFR1is closely related to AT5G20480 (AtEFR) in, which had known functions; C: the similarity between StEFR1 and AtEFR is 53.9%.

图2 StEFR1响应病原菌信号的表达模式
*、**分别表示在0.05和0.01概率水平差异显著。
* and ** mean significant difference at the 0.05 and 0.01 probability levels, respectively.

表2 StEFR1启动子区域顺式调控元件
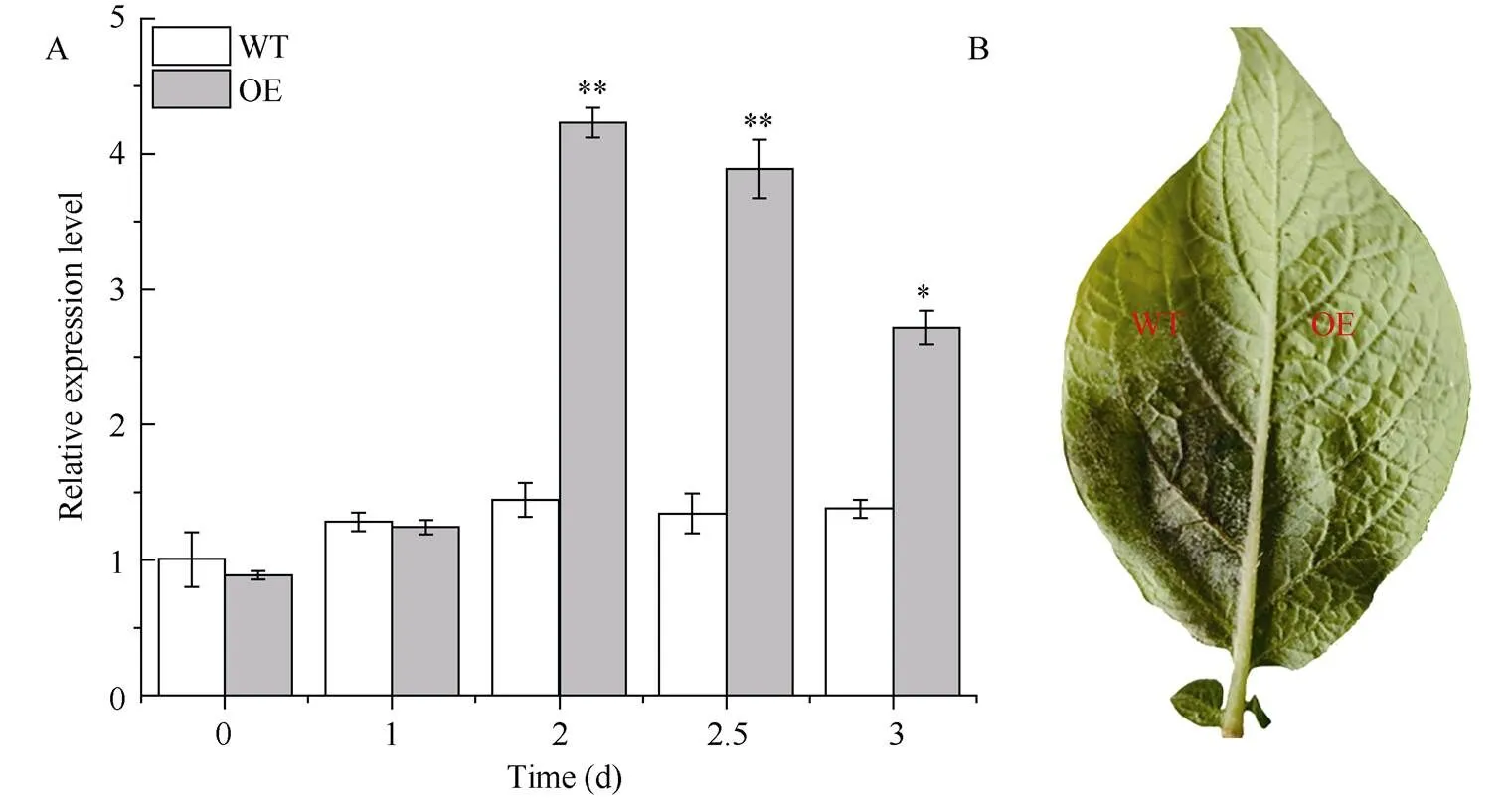
(图3)
A: 第2天时的相对表达量最高; B: 第4天时WT叶片发病症状严重; C: WT和OE组叶片的病斑面积; D: WT组大量细胞呈死亡状态。WT: 接种空载体pFGC5941对照组; OE: 接种-PFGC5941的处理组。*、**分别表示在0.05和0.01概率水平差异显著。
A: the relative expression level ofreached the maximum when injected for 2 days; B: the symptoms of WT leaves were more serious on the 4th day; C: the disease spot area in WT and OE; D: a large number of cells in WT group died. WT: the group injected with empty vector pFGC5941; OE: the group injected with-PFGC5941. * and ** mean significant difference at the 0.05 and 0.01 probability levels, respectively.
2.5 StEFR1参与晚疫病菌诱导的PTI抗性反应
为进一步分析是否参与PTI抗性反应, 本试验对晚疫病菌侵染后WT和OE叶片PTI标记基因的表达模式进行检测发现, 3个标记基因、和均呈现先上升后下降的表达趋势(图4)。接种第2天时, OE中和表达水平显著上调, 分别为WT的1.82倍和1.61倍; 而的表达水平在接种第2天时达到最高, 为WT的3.03倍, 第3天和第4天时,的相对表达量分别为WT的1.81倍和1.75倍。表明参与了晚疫病菌诱导的PTI抗性反应。
2.6 StEFR1调控SA和JA信号通路相关基因的表达
水杨酸(salicylic acid, SA)介导的信号传导途径在活体寄生菌感染后被激活, 而茉莉酸(jasmonic acid, JA)和乙烯(ethylene, ET)信号通路是植物被死体营养型病原体攻击后诱导的另一种独特的防御途径[26]。那么半活体寄生卵菌晚疫病菌侵染马铃薯后会激活哪条信号通路?本试验检测了WT和OE组叶片接种晚疫病菌后SA、JA和ET激素相关基因的表达模式。由图5可知, 接种1~2 d时, OE组中SA(、和)信号通路相关基因的表达显著增强。特别地, 接种第2天时, 上述3个基因在OE组中的相对表达量分别为WT组的4.06、12.42和2.45倍, 且呈显著水平; 而在第3至第4天时, 上述3个基因的相对表达量有所下降, 但均高于WT组。JA信号通路的相关基因在接种晚疫病菌第2天时显著上调(<0.01), 而和在接种第3天时达到最高水平, 分别为WT组的1.74倍和1.93倍。在整个接种过程中, WT和OE组中ET信号通路相关基因无明显差异。综上,可能通过调控SA和JA信号通路相关基因的表达, 影响马铃薯对晚疫病的抗性调控过程。
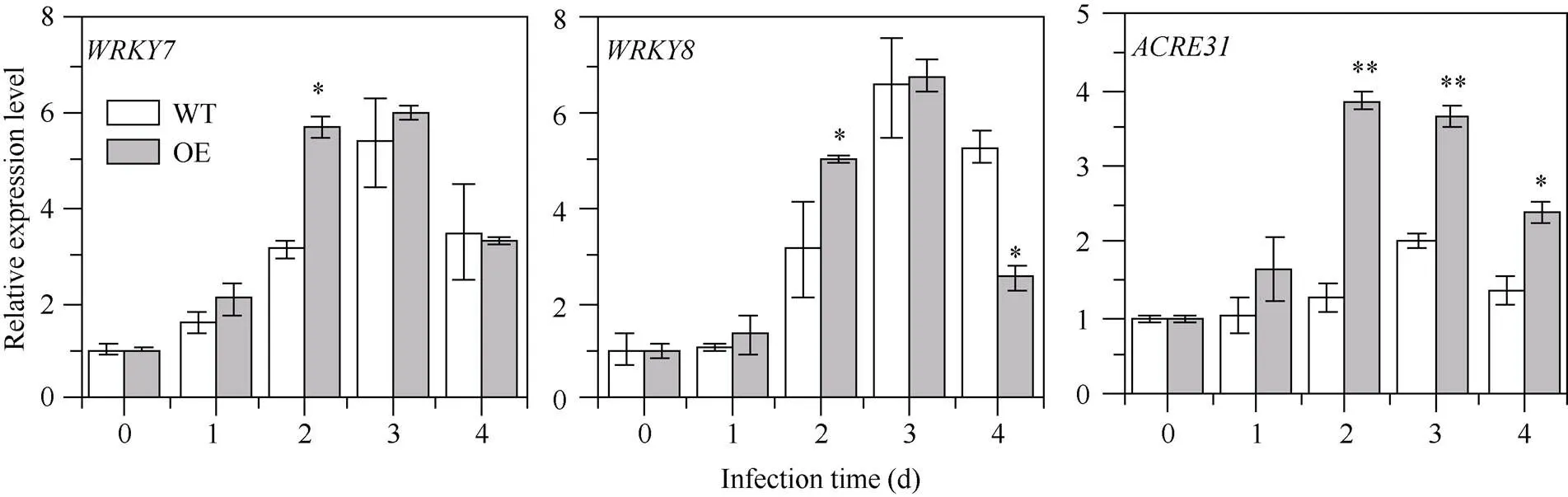
图4 接种晚疫病菌后WT和OE叶片中PTI 标记基因(WRKY7、WRKY8和ACRE31)的表达模式
WT: 接种空载体pFGC5941对照组; OE: 接种-PFGC5941的处理组。*、**分别表示在0.05和0.01概率水平差异显著。
WT: the group injected with empty vector pFGC5941; OE: the group injected with-PFGC5941. * and ** mean significant difference at the 0.05 and 0.01 probability levels, respectively.

图5 接种晚疫病菌后WT和OE叶片中SA (ChtA、PR-1B和PR-2)、JA (LOX和PAL-2)和ET (ERF3)信号通路相关基因的表达模式
WT代表接种空载体pFGC5941对照组; OE代表接种-PFGC5941的处理组。*、**分别表示在0.05和0.01概率水平差异显著。
WT: the group injected with empty vector pFGC5941; OE: the group injected with-PFGC5941. * and ** mean significant difference at the 0.05 and 0.01 probability levels, respectively.
3 讨论
结合生物信息学和进化分析, PGSC0003DMP 400001888被鉴定为典型的LRR-RLK亚家族成员, 且与拟南芥中功能已知的亲缘关系较近, 因此, 命名为。本试验分析了调控晚疫病抗性中的作用和潜在的调控机制。
EFR是拟南芥中可以识别细菌PAMP延伸因子(EF-TU)的模式识别受体[27],对elf18的响应在多种植物中已有报道, 如烟草、水稻、番茄、小麦等[19-21,28]。拟南芥中, elf18预处理能够引起强烈的氧爆发和乙烯的生成, 从而增强拟南芥对丁香假单胞菌(pv.DC 3000)的抗性[27]。水稻病原细菌的elf18可以被转基因水稻悬浮细胞识别并引起氧爆发、激活丝裂原活化蛋白激酶活性和病程相关基因的表达, 从而增强水稻对病原细菌的抗性, 而野生型水稻不能识别病原细菌的elf18[29]。而本试验对离体叶片分别接种晚疫病菌和注射elf18发现, 随着时间延长, 叶片中的表达显著上调, 说明该基因能够响应病原菌信号, 可能参与调控马铃薯晚疫病的抗性。
农杆菌介导的瞬时表达是一种快速分析基因功能的方法, 本试验借助此方法使在‘大西洋’离体叶片超量表达。当基因表达量达最高水平时接种晚疫病菌, 发现在WT组叶片背面出现霉层并有白色霉状物出现, 为晚疫病的典型症状, 但OE超表达叶片发病症状明显减轻并且病变面积显著减小。此外, 台盼蓝染色后WT组叶片上死亡细胞数量显著较OE组叶片多。以上结果表明,在马铃薯叶片中的超量表达, 可以增强叶片对晚疫病菌的抵抗性, 即正调控晚疫病抗性。类似的结果在小麦中已被报道, 当转入小麦后, 叶片的病变直径和病原细菌在叶片中的增殖数量减小[30]。
植物在与病原微生物长期的对抗过程中, 自身形成了复杂的免疫反应机制。在侵染初期, 植物通过模式识别受体PRRs识别病原菌相关分子模式, 激发PTI免疫反应, 其典型反应之一是引起病程相关基因表达上调, 从而抑制侵入植物的病原菌的生长、繁殖和扩散[10,31]。PRRs多分布于细胞膜, 主要由类受体激酶(receptor like kinase, RLK)或类受体蛋白(receptor like protein, RLP)组成, 其激发的PTI为基础免疫反应, 能提供广谱、持久抗性[9]。在RLK中, LRR-RLK家族成员数量庞大, 已有大量成员被确定为PRRs, 且参与植物和病原菌的互作方面的重要作用已被证实[31-33]。为典型的LRR-RLK, 当叶片接种晚疫病菌1~3 d时,的表达量显著上调, 说明此基因参与植物和病原菌的互作。超表达的马铃薯叶片(OE)受到晚疫病菌侵染时, PTI标记基因、和相对表达量显著上调, 特别是OE中和的表达水平在接种晚疫病菌第3天时达最高值, 而ACRE31的表达水平在接种第2天时达到最高, 为WT的3.03倍。PTI标记基因在不同物种和不同诱导物处理时, 响应时间各不相同。如马铃薯和本氏烟受细菌PAMP flg22诱导后,、和分别在1 h和3 h达最高表达, 而受几丁质诱导后, 3个PTI标记基因的表达在3 h达到最高值[22-23,34], 但马铃薯用Pep-13处理后, 3个PTI标记基因的表达1 h最大, 而本氏烟中则在0.5 h最高[35]。
启动子要正确调控基因的表达水平和表达模式, 需要核心启动子以及上下游的顺式作用元件协同作用。预测目的基因启动子区域上游顺式作用元件对了解目的基因在植物发育和抗逆的作用具有重要的指导意义。启动子区域存在响应激素、干旱、防御与应激反应相关等多个-elements, 推测可能通过响应不同的激素信号参与对晚疫病菌抗性的调控。马铃薯感染疮痂病链霉菌时, SA相关的基因(、和)和JA相关的基因()显著上调, 而ET相关基因()则下调[24]。本试验中, 当叶片受到晚疫病菌侵染时, OE组SA途径相关基因(、和)和JA途径相关的基因(和)表达水平均显著上调, 而ET途径相关基因的表达变化不显著, 推断OE叶片增强对晚疫病菌的抗性, 主要是通过激活SA和JA途径相关的抗病代谢过程而实现的, 此过程与ET途径相关性不大。而高抗晚疫病基因型JAM1-4 ()对致病疫霉超级毒力小种2013-18-306的免疫应答中发现, SA-JA-ET组成的多重信号转导途径协调调控植物的免疫抗性[36], 这与我们的试验结果略有不同。
通过以上试验初步断定, 当晚疫病菌侵染马铃薯叶片时, 产生的分泌蛋白被位于细胞膜上的PRR-识别, 随后激活下游的SA和JA激素信号通路来调控马铃薯对晚疫病菌的PTI抗性, 但具体分子机制还有待后续深入。
4 结论
本研究基于前期工作, 筛选并鉴定获得一个PRR-, 通过试验证明响应病原菌信号; 当受到晚疫病菌侵染时,过表达叶片中PTI marker基因、SA和JA途径相关基因的表达增强, 且病斑面积减小而细胞活性增加, 表明参与晚疫病菌诱导的PTI抗性, 且调控SA和JA激素信号相关基因的表达, 对晚疫病起正调控作用。
[1] Lal M, Arora R K, Maheshwari U, Rawal S, Yadav S. Impact of late blight occurrence on potato productivity during 2013–14., 2016, 12: 187–192.
[2] Lindqvist-Kreuze H, Gastelo M, Perez W, Forbes G A, Koeyer D, Bonierbale M. Phenotypic stability and genome-wide association study of late blight resistance in potato genotypes adapted to the tropical highlands., 2014, 104: 624–633.
[3] Haverkort A J, Boonekamp P M, Hutten R, Jacobsen E, Lotz L A P, Kessel G J T, Visser R G F, Vossen E A G. Societal costs of late blight in potato and prospects of durable resistance through cisgenic modification., 2008, 51: 47–57.
[4] 徐进, 朱杰华, 杨艳丽, 汤浩, 吕和平, 樊明寿, 石瑛, 董道峰,王贵江, 王万兴, 熊兴耀, 高玉林. 中国马铃薯病虫害发生情况与农药使用现状. 中国农业科学, 2019, 52: 2800–2808.
Xu J, Zhu J H, Yang Y L, Tang H, Lyu H P, Fan M S, Shi Y, Dong D F, Wang G J, Wang W X, Xiong X Y, Gao Y L. Status of major diseases and insect pests of potato and pesticide usage in China., 2019, 52: 2800–2808 (in Chinese with English abstract).
[5] Jones J D G, Dangl J L. The plant immune system., 2006, 444: 323–329.
[6] Park T H, Vleeshouwers V G A A, Jacobsen E, Van Der Vossen E, Visser R G F. Molecular breeding for resistance to(Mont.) de Bary in potato (L.): a perspective of cisgenesis., 2009, 128: 109–117.
[7] Bradshaw J E, Bryan G J, Lees A K, McLean K, Solomon- Blackburn R M. Mapping the R10 and R11 genes for resistance to late blight () present in the potato ()-gene differentials of black., 2006, 112: 744–751.
[8] Rodewald J, Trognitz B. Solanum resistance genes againstand their corresponding avirulence genes., 2013, 14: 740–757.
[9] Bigeard J, Colcombet J, Hirt H. Signaling mechanisms in pattern-triggered immunity (PTI)., 2015, 8: 521–539.
[10] Couto D, Zipfel C. Regulation of pattern recognition receptor signaling in plants., 2016, 16: 537–552.
[11] Zipfel C, Robatzek S. Pathogen-associated molecular pattern- triggered immunity: veni, vidi...?, 2010, 154: 551–554.
[12] Dievart A, Gottin C, Périn C, Ranwez V, Chantret N. Origin and diversity of plant receptor-like kinases., 2020, 71: 131–156.
[13] Angela C G, Wilkinson R C, Selena G I, Kim F, Coffey M D, Cyril Z, Rathjen J P, Sophien K, Sebastian S, Yang C H. The receptor-like kinase SERK3/BAK1 is required for basal resistance against the late blight pathogenin., 2011, 6: e16608.
[14] Montesano M, Kõiv V, Mäe A, Palva E T. Novel receptor-like protein kinases induced byand short oligogalacturonides in potato., 2010, 2: 339–346.
[15] Wu T, Tian Z D, Liu J, Xie C H. A novel leucine-rich repeat receptor-like kinase gene in potato, StLRPK1, is involved in response to diverse stresses., 2009, 36: 2365–2374.
[16] Erwig J, Ghareeb H, Kopischke M, Hacke R, Matei A, Petutschnig E, Lipka V. Chitin-induced and CHITIN ELICITOR RECEPTOR KINASE1 (CERK1) phosphorylation-dependent endocytosis ofLYSIN MOTIF-CONTAINING RECEPTOR- LIKE KINASE5 (LYK5)., 2017, 215: 382–396.
[17] Lee W S, Rudd J J, Hammond-Kosack K E, Kanyuka K. Mycosphaerella graminicola LysM effector-mediated stealth pathogenesis subverts recognition through both CERK1 and CEBiP homologues in wheat., 2014, 27: 236–243.
[18] Chinchilla D, Zipfel C, Robatzek S, Kemmerling B, Nuernberger T, Jones J D G, Felix G, Boller T. A flagellin-induced complex of the receptor FLS2 and BAK1 initiates plant defence., 2007, 448: 497–500.
[19] Boller T, Felix G. A renaissance of elicitors: perception of microbe-associated molecular patterns and danger signals by pattern-recognition receptors., 2009, 60: 379–406.
[20] Lacombe S, Rougon-Cardoso A, Sherwood E, Peeters N, Dahlbeck D, van Esse H P, Smoker M, Rallapalli G, Thomma B P H J, Staskawicz B. Interfamily transfer of a plant pattern-recognition receptor confers broad spectrum bacterial resistance., 2010, 28: 365–369.
[21] Schwessinger B, Bahar O, Thomas N, Holton N, Nekrasov V, Ruan D, Canlas P E, Daudi A, Petzold C J, Singan V R, Kuo R. Transgenic expression of the dicotyledonous pattern recognition receptor EFR in rice leads to ligand-dependent activation of defense responses., 2015, 11: e1004809.
[22] Turnbull D, Yang L, Naqvi S, Breen S, Welsh L, Stephens J, Morris J, Boevink P C, Hedley P E, Zhan J l, Birch Paul R J, Gilroy E. RXLR effector AVR2 up-regulates a brassinosteroid responsive bHLH transcription factor to suppress immunity., 2017, 174: 356–369.
[23] He Q, McLellan H, Boevink P C, Sadanandom A, Xie C, Birch P R J, Tian Z. U-box E3 ubiquitin ligase PUB17 acts in the nucleus to promote specific immune pathways triggered by., 2015, 66: 3189–3199.
[24] Arseneault T, Pieterse C, Gérin-Ouellet M, Goyer C, Filion M. Long-term induction of defense gene expression in potato bysp. LBUM223 and., 2014, 104: 926–932.
[25] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(−Delta Delta C(T)) method., 2001, 25: 402–408.
[26] Zhang L, Zhang F, Melotto M, Yao J, He S Y. Jasmonate signaling and manipulation by pathogens and insects., 2017, 68: 1371–1385.
[27] Zipfel C, Kunze G, Chinchilla D, Caniard A, Jones J D, Boller T, Felix G. Perception of the bacterial PAMP EF-Tu by the receptor EFR restricts Agrobacterium-mediated transformation., 2006, 125: 749–760.
[28] Lloyd S R, Schoonbeek H-J, Trick M, Zipfel C, Ridout C J. Methods to study PAMP-triggered immunity inspecies., 2014, 27: 286–295.
[29] 路粉. 水稻中表达拟南芥及水稻内源受体对细菌延伸因子EF-Tu识别的研究. 中国农业大学博士学位论文, 北京, 2015.
Lu F. Studies on Recognition of Bacterial Elongation Factor EF-Tu byand Endogenous Receptor in. PhD Dissertation of China Agricultural University, Beijing, China, 2015 (in Chinese with English abstract).
[30] Schoonbeek H, Wang H H, Stefanato F L, Craze M, Bowden S, Wallington E, Zipfel C, Ridout C J.EF-Tu receptor enhances bacterial disease resistance in transgenic wheat., 2015, 206: 606–613.
[31] Macho A P, Zipfel C. Plant PRRs and the activation of innate immune signaling., 2014, 54: 263–372.
[32] Greeff C, Roux M, Mundy J, Petersen M. Receptor-like kinase complexes in plant innate immunity., 2012, 3: 209.
[33] Liu P L, Du L, Huang Y, Gao S M, Yu M. Origin and diversification of leucine-rich repeat receptor-like protein kinase (LRR-RLK) genes in plants., 2017, 17: 47.
[34] McLellan H, Boevink P C, Armstrong M R, Pritchard L, Gomez S, Morales J, Whisson S C, Beynon J L, Birch P R J. An RxLR effector fromprevents relocalisation of two plant NAC transcription factors from the endoplasmic reticulum to the nucleus., 2013, 9: e1003670.
[35] 王海霞. 类受体激酶StLRPK1、StSERK3A/BAK和磷酸酶StBSLs在马铃薯晚疫病抗性免疫应答中的作用. 华中农业大学博士学位论文, 湖北武汉, 2018.
Wang H X. Investigation of Receptor Kinase StLRPK1, StSERK3A/BAK1 and Phosphotase StBSLs Functions in Potato Immunity Against Late Blight. PhD Dissertation of Huazhong Agricultural University, Wuhan, Hubei, China, 2018 (in Chinese with English abstract).
[36] 郑佳仪. 马铃薯高抗晚疫病资源筛选与抗病相关基因挖掘. 中国农业科学院硕士学位论文, 北京, 2020.
Zheng J Y. Identification of High Resistance Potato Resource to Late Blight and Mining of Resistance Related Genes. MS Thesis of Chinese Academy of Agricultural Sciences, Beijing, China, 2020 (in Chinese with English abstract).
regulates late blight resistance positively in potato ()
ZHANG Wei-Na, YU Hui-Fang, AN Zhen, LIU Wen-Kai, KANG Yi-Chen, SHI Ming-Fu, YANG Xin-Yu, ZHANG Ru-Yang, WANG Yong, and QIN Shu-Hao*
College of Horticulture, Gansu Agricultural University, Lanzhou 730070, Gansu, China
Potato late blight is a devastating oomycete disease, which causes great economic losses to agricultural production. In this study, we analyzed the role and potential regulatory mechanism ofin regulating late blight resistance by the relative expression pattern and functional verification combined with the bioinformatics methods. Evolutionary analysis showed that the sequence similarity between StEFR1 and AtEFR was 53.9%. After inoculated withfor 3 days and treatment with elf18 for 3 hours, the relative expression level ofin isolated leaves ofwas upregulated to 1.87 times and 2.31 times compared with the control, respectively. The late blight resistance significantly increased after the overexpression ofin the isolated leaves ofbyinfiltration method.Compared with the control, the area of leaf lesion size decreased and the activity of leaf cells increased. And the marker genes of PTI, SA, and JA signaling pathways in overexpressed leaves were significantly up-regulated to varied degrees, while the relative expression levels of ET related-genes did not change significantly. In conclusion,was involved in the PTI resistance and regulated the relative expression levels of SA and JA hormone signaling related genes, suggesting thatpositively regulated the potato late blight. This study lays a foundation for further revealing the molecular mechanism ofin regulating the immune response and provides important reference for the molecular breeding of late blight.
potato late blight; LRR-RLKs; hormonal signal; marker gene; differential expression
10.3724/SP.J.1006.2023.24062
本研究由甘肃农业大学科技创新基金(公招博士科研启动基金项目) (GAU-KYQD-2020-10), 甘肃省自然科学基金项目(21JR7RA827)和国家自然科学基金项目(32060441)资助。
This study was supported by the Science and Technology Innovation Fund of Gansu Agricultural University (Doctoral Research Start-up Fund Project for Public Recruitment) (GAU-KYQD-2020-10), the Natural Science Foundation of Gansu Province (21JR7RA827), and the National Natural Science Foundation of China (32060441).
秦舒浩, E-mail: qinsh@gsau.edu.cn
E-mail: zhangwn@gsau.edu.cn
2022-03-21;
2022-07-21;
2022-08-22.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220822.1504.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
