干扰lncRNA ROR1-AS1通过调节miR-504抑制人肝癌细胞株增殖、迁移和侵袭的研究
2023-02-24乌吉斯古楞张文华张彤
乌吉斯古楞,张文华,张彤
肝癌是全球范围内最常见的致命恶性肿瘤,发病率逐年增加,在发展中国家发病率较高[1-2]。探究肝癌的发病机制,并寻找分子靶向药物已成为当前的研究热点。长链非编码RNA(long non-coding RNA,lncRNA)可在肝脏微环境和慢性肝脏疾病的调节中发挥关键作用,能够调节免疫反应、肝脏再生和氧化还原信号,lncRNA失调可导致慢性肝炎、肝脏增生和氧化应激,最终导致肝癌的发生和进展[3]。长链非编码RNA酪氨酸蛋白激酶跨膜受体1反义RNA 1(tyrosine protein kinase transmembrane receptor 1 antisense RNA 1,ROR1-AS1)在肝细胞癌中表达上调,且与患者临床分期、T分期及N分期有关,ROR1-AS1高表达与不良预后有关[4]。但ROR1-AS1对肝癌细胞增殖、迁移、侵袭的调控机制尚不清晰。微小RNA-504(microRNA-504,miR-504)在肝细胞癌组织和细胞系中下调,miR-504通过介导FZD7/Wnt/β-catenin通路在肝癌中发挥抑癌作用[5]。基于上述研究推测ROR1-AS1可能通过靶向miR-504参与肝癌疾病进展,本研究对此展开探讨,报道如下。
1 材料与方法
1.1 材料 (1)组织标本:选取2019年6月—2021年5月于内蒙古医科大学附属医院肝胆外科收治肝癌患者32例,患者均无放、化疗史。术中收集患者癌组织及癌旁组织(距手术切缘≥3 cm,病理检测证实无癌细胞)标本。本项研究符合《世界医学协会赫尔辛基宣言》,且经医院伦理委员会审核、批准(20190711),患者及家属知情同意并签署知情同意书。(2)细胞系及试剂:人肝细胞癌MHCC97H细胞株(中国科学院上海细胞生物学研究所);si-NC、si-ROR1-AS1、miR-NC、miR-504 mimics、anti-miR-NC及anti-miR-504质粒均由上海吉玛制药技术有限公司提供;三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、细胞周期蛋白依赖性激酶抑制剂1A(p21)、基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)、MMP-9、上皮型钙黏附素(E-cadherin)兔单克隆抗体及Luciferase Reporter Assay底物试剂盒均由英国Abcam公司提供;LipofectamineTM2000试剂盒、Trizol试剂(美国Invitrogen公司);逆转录试剂盒(日本TaKaRa公司)。(3)仪器设备:显微镜(GMM-900,上海光密仪器有限公司);酶标仪(SpectraMax iD5,上海美谷分子仪器有限公司)。
1.2 实验方法 采用RPMI 1640培养基(含10%胎牛血清),在97%湿度、5%CO2、37℃环境下培养MHCC97H细胞。培养基每2~3 d更换1次,当细胞汇合度至80%~90%时,胰蛋白酶消化后传代。将对数期MHCC97H细胞接种于6孔板,密度调整至1×105个/孔,细胞汇合度达60%时,分别将si-ROR1-AS1、si-NC、miR-504 mimics、miR-NC、si-ROR1-AS1和anti-miR-504、si-ROR1-AS1和anti-miR-NC转染至MHCC97H细胞,记为si-ROR1-AS1组、si-NC组、miR-504 mimics组、miR-NC组、si-ROR1-AS1+anti-miR-504组及si-ROR1-AS1+anti-miR-NC组,采用LipofectamineTM2000试剂盒进行转染。24 h后更换培养基,继续培养24 h,收集细胞备用。
1.3 观测指标与方法
1.3.1 qRT-PCR检测ROR1-AS1、miR-504表达:将患者癌组织、癌旁组织标本移植于液氮预冷的研钵体中,研磨成粉末状,并收集人肝细胞癌MHCC97H细胞,经PBS清洗后,分别加入TRIzol试剂1 ml,然后上下翻动细胞、组织粉末,以保证混合均匀后,静置10 min,使核酸蛋白复合物完全分离。分别再加入氯仿、异丙醇,翻动混匀后静置5 min,离心吸取上清液于EP管中,留取RNA沉淀,最后提取MHCC97H细胞及患者癌组织、癌旁组织样本中总RNA,并检测其纯度和浓度,然后按逆转录试剂盒说明书操作合成cDNA,并采用荧光定量PCR试剂盒和PCR仪进行PCR反应,反应体系:cDNA 1 μl、SYBR Green Mix 10 μl、上下游引物各0.5 μl、ddH2O 8 μl。反应条件:95℃ 10 min、95℃ 15 s、58℃ 30 s、72℃ 30 s,共计30个循环。于荧光定量PCR仪上扩展,2-△△Ct法计算ROR1-AS1、miR-504的相对表达量。引物序列见表1。
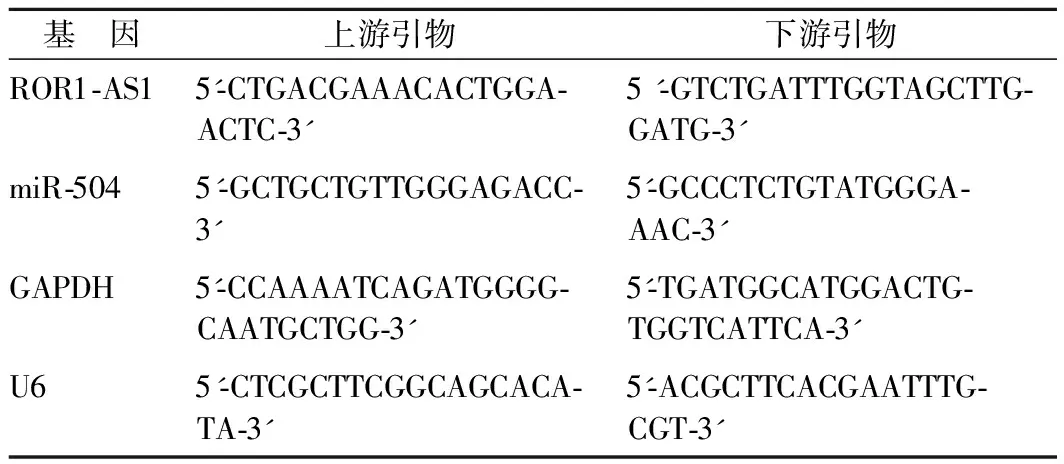
表1 ROR1-AS1、miR-504及相应内参GAPDH、U6的引物序列
1.3.2 细胞克隆形成实验:将转染相应质粒后的各组MHCC97H细胞接种于6孔板(5 000个/孔),培养基每2 d更换1次。培养14 d后,甲醛固定30 min,结晶紫染色1 h并风干。于显微镜下观察并记录细胞克隆数。
1.3.3 MTT法检测细胞增殖:将转染相应质粒后的各组MHCC97H细胞接种于96孔板(2.5×104个/孔),培养24 h,加入MTT(5 g/L)20 μl,孵育4 h,加入二甲基亚砜150 μl,低速震荡,于酶标仪490 nm处测定吸光度值(A),计算细胞存活率=A实验组/A对照组×100%。
1.3.4 Transwell检测细胞迁移、侵袭:向各组细胞中加入RPMI 1640培养基(不含胎牛血清),并调整细胞浓度为5×104个/ml。迁移实验:取上述细胞悬液100 μl加入Transwell小室上室中,RPMI 1640培养基(含10%胎牛血清)500 μl加入下室。培养48 h,经多聚甲醛固定、结晶紫染色后,倒置显微镜下观察、计数。侵袭实验:采用RPMI 1640培养基稀释预冷的Matrigel基质胶(8∶1),并铺于Transwell上室,晾干后加入上述细胞悬液100 μl。后续步骤与迁移实验相同。
1.3.5 Western-blot法检测MMP-2、MMP-9、p21及E-cadherin蛋白表达:RIPA试剂提取细胞总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度。将蛋白煮沸使其变性,行聚丙烯酰胺凝胶电泳,各泳道上样量为30 μg。蛋白分离后,移至聚偏(二)氟乙烯(PVDF)膜,5%脱脂奶粉封闭2 h,洗膜,分别置于MMP-2、MMP-9、p21、E-cadherin抗体孵育液中,4℃过夜。再加入二抗孵育液,37℃孵育2 h。ECL显影,Quantity One凝胶软件分析结果。
1.3.6 双荧光素酶报告实验验证ROR1-AS1与miR-504的靶向关系:Starbase数据库预测ROR1-AS1、miR-504是否存在结合位点。根据ROR1-AS1、miR-504结合区域序列,构建ROR1-AS1野生型(WT)及突变型(MUT)质粒,并分别转染miR-504 mimics、miR-NC,培养48 h后,检测荧光素酶活性。
2 结 果
2.1 肝癌组织与癌旁组织ROR1-AS1、miR-504的表达比较 肝癌患者癌组织中ROR1-AS1水平高于癌旁组织(P<0.01),miR-504水平低于癌旁组织(P<0.01),见表2。
表2 肝癌组织及癌旁组织中ROR1-AS1、miR-504表达比较
2.2 抑制ROR1-AS1对MHCC97H细胞增殖、迁移、侵袭及蛋白的影响 与si-NC组比较,si-ROR1-AS1组ROR1-AS1水平、克隆形成数、细胞存活率、迁移细胞数、侵袭细胞数、MMP-2、MMP-9蛋白水平下降(P<0.01),miR-504、p21蛋白、E-cadherin蛋白水平升高(P<0.01),见图1、2,表3、4。
表3 抑制ROR1-AS1对MHCC97H细胞增殖、迁移、侵袭的影响

图1 各组MHCC97H细胞克隆形成、迁移、侵袭情况比较(结晶紫染色,×200)

注:A.si-NC组;B.si-ROR1-AS1组;C.miR-NC组;D.miR-504 mimics组;E.si-ROR1-AS1+anti-miR-NC组;F.si-ROR1-AS1+anti-miR-504组
2.3 过表达miR-504对MHCC97H细胞增殖、迁移、侵袭的影响 与miR-NC组比较,miR-504 mimics组MHCC97H细胞的克隆形成数、细胞存活率、迁移细胞数、侵袭细胞数、MMP-2、MMP-9蛋白水平降低(P<0.01),miR-504、p21蛋白、E-cadherin蛋白水平增高(P<0.01),见图1、2,表5。
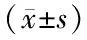
表4 抑制ROR1-AS1对MHCC97H细胞增殖、迁移、侵袭相关蛋白表达的影响
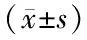
表5 过表达miR-504对MHCC97H细胞增殖、迁移、侵袭及相关蛋白的影响
2.4 ROR1-AS1靶向调控miR-504表达 Starbase数据库预测,ROR1-AS1与miR-504存在互补序列,见图3。双荧光素酶报告结果显示,与共转染WT-ROR1-AS1和miR-NC比较,共转染WT-ROR1-AS1和miR-504 mimics的荧光素酶活性降低(P<0.01),见表6。
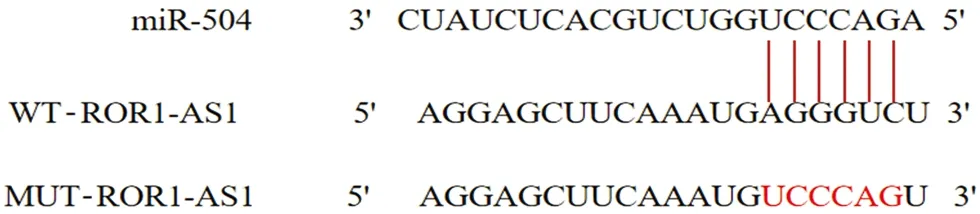
图3 ROR1-AS1与miR-504的靶向序列预测
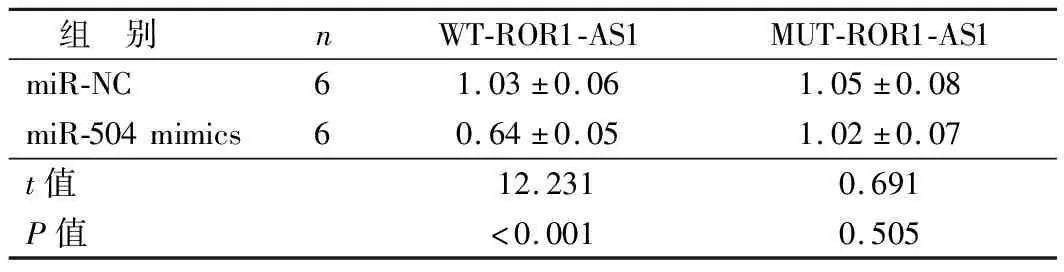
表6 2组细胞荧光素酶活性比较
2.5 干扰miR-504表达逆转ROR1-AS1对MHCC97H细胞增殖、迁移、侵袭及相关蛋白表达的作用 与si-ROR1-AS1+anti-miR-NC组比较,si-ROR1-AS1+anti-miR-504组细胞克隆形成数、细胞存活率、迁移细胞数、侵袭细胞数及MMP-2、MMP-9水平升高(P<0.01),miR-504、p21蛋白、E-cadherin蛋白水平下降(P<0.01),见图1、2,表7。
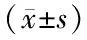
表7 干扰miR-504表达逆转ROR1-AS1对MHCC97H细胞增殖、迁移、侵袭及相关蛋白表达的影响
3 讨 论
肝癌中异常表达的lncRNA对miRNA、mRNA和蛋白质发挥多效作用,通过改变miRNA、mRNA的表达和稳定性,以及影响蛋白质表达、结构、降解或与转录调节因子的相互作用来影响多种癌症表型[6]。因此,探究lncRNA在肝癌中的分子机制,可为肝癌的靶向治疗提供新的方向。ROR1-AS1是近年来发现的lncRNA,主要位于细胞核中,可能参与基因转录的表观遗传调控过程,首次在套细胞淋巴瘤中被发现,可通过与EZH2和SUZ12相互作用发挥致癌作用[7]。Wang等[8]研究发现,ROR1-AS1在结肠癌组织或细胞系中均高表达,具有增强细胞增殖、加速细胞周期、抑制细胞凋亡的作用,可能通过与EZH2结合下调DUSP5影响结肠癌的发生发展。本研究结果显示,ROR1-AS1在肝癌组织中表达增高,提示ROR1-AS1在肝癌进展中可能起促进作用。此外,干扰ROR1-AS1表达后,MHCC97H细胞的克隆形成数、细胞存活率、迁移及侵袭细胞数降低,提示干扰ROR1-AS1表达可抑制肝癌细胞增殖、迁移和侵袭。MMP-2、MMP-9可参与细胞外基质、基底膜降解过程,对细胞迁移、侵袭具有促进作用[9]。p21能够参与调控细胞周期,发挥肿瘤抑制作用,其高表达可抑制细胞增殖[10]。E-cadherin表达下降可降低细胞间的黏附作用,从而导致细胞脱落、迁移[11]。本研究结果显示,与si-NC组比较,si-ROR1-AS1组MMP-2、MMP-9蛋白水平下降,p21、E-cadherin蛋白水平升高,提示干扰ROR1-AS1表达可能通过调控MMP-2、MMP-9、p21、E-cadherin蛋白水平从而抑制肝癌细胞增殖、迁移、侵袭。
lncRNA可充当miRNA“海绵”,抑制miRNA表达,并通过转录因子或修饰酶复合物调节基因转录[12-15]。通过搜索Starbase数据库发现,miR-504可能是ROR1-AS1的靶基因。此外,ROR1-AS1过表达可诱导骨肉瘤MG-63细胞迁移,促进N-钙黏蛋白和波形蛋白的表达,抑制E-钙黏蛋白的表达。双荧光素酶测定证明,ROR1-AS1与miR-504存在靶向关系,ROR1-AS1过表达可抑制MG-63细胞中miR-504的表达,miR-504过表达可消除ROR1-AS1对骨肉瘤细胞迁移和增殖的部分影响[16]。本研究亦通过双荧光素酶实验验证,miR-504是ROR1-AS1的靶基因。miR-504在胃癌组织中高表达,可通过靶向RBM4促进胃癌细胞增殖、抑制细胞凋亡[17];miR-504过表达可抑制胶质母细胞瘤细胞的迁移、侵袭、上皮间质转化等恶性行为,miR-504低表达与患者间充质亚型转变及较差的生存期有关[18]。以上研究显示,miR-504可在多种恶性肿瘤中发挥不同作用。本研究结果显示,肝癌组织中miR-504表达下调,提示miR-504在肝癌中发挥抑癌作用。同时,过表达miR-504可抑制肝癌细胞增殖、迁移、侵袭能力,并下调MMP-2、MMP-9蛋白表达,上调p21、E-cadherin蛋白表达,再次证明miR-504的抗肝癌作用,且这种抗癌作用可能与调控相关蛋白表达有关。此外,沉默ROR1-AS1可导致miR-504表达升高,而抑制miR-504表达可减弱沉默ROR1-AS1对MHCC97H细胞增殖、迁移、侵袭的影响,进一步证实miR-504是ROR1-AS1的靶基因。
综上所述,ROR1-AS1在肝癌组织中表达上调,抑制ROR1-AS1表达可能通过靶向miR-504抑制肝癌MHCC97H细胞的增殖、迁移及侵袭。
利益冲突:所有作者声明无利益冲突
作者贡献声明
乌吉斯古楞:课题实验设计,实施研究过程,论文审核;张文华:分析实验数据,论文撰写;张彤:论文终审,论文撰写
