饲粮半胱氨酸水平对离乳期梅花鹿瘤胃发酵参数和氨基酸代谢的影响
2023-02-23杨乾龙王金铭陈丽红张铁涛王晓旭王凯英
■杨乾龙 王金铭 陈丽红 张铁涛 吴 炎 王晓旭 鲍 坤 王凯英
(中国农业科学院特产研究所,特种经济动物分子生物学国家重点实验室,吉林长春 130112)
梅花鹿仔鹿是梅花鹿产业发展的未来,其生长状况能够影响鹿茸的品质及产业经济效益。研究发现,蛋白质和氨基酸的合理利用,能够保护环境,降低成本,促进仔鹿的健康生长发育[1-3]。为了更好的研究蛋白质和氨基酸,前人提出总代谢氨基酸的概念,分别是前胃和肠道内的蛋白质的分解以及氨基酸的代谢[4]。瘤胃游离氨基酸以及血清游离基酸能够在一定程度上反映出氨基酸的代谢状况。合理的氨基酸组成,能够提高蛋白质的利用效率,并且有利于动物的生长。半胱氨酸是重要的含硫氨基酸,是日粮中的主要氨基酸之一。直接参与氨基酸代谢,与动物生长和肠道健康密切相关[5-6]。适宜的半胱氨酸水平是满足身体含硫氨基酸需求的关键因素。半胱氨酸能够代谢产生牛磺酸、谷胱甘肽和硫化氢等[7],具有抗应激、缓解损伤和促生长等多种生理功能[7-8],对于不同健康状况和生长时期的动物均具有良好的作用[9-10]。研究发现,半胱氨酸可以增加大鼠肠道内乳酸菌和双歧杆菌水平,降低大肠杆菌水平[11];增加仔猪肠道菌群中的细菌数量[12]。半胱氨酸可能对于瘤胃发酵和氨基酸代谢同样具有重要的作用。因此,本试验主要研究饲粮半胱氨酸水平对梅花鹿仔鹿瘤胃发育过程中发酵状况及氨基酸代谢的影响,以期能够对氨基酸在动物体内代谢提供参考。
1 材料和方法
1.1 试验材料
L-半胱氨酸购自安徽洪昌生物科技有限公司;梅花鹿选自农业农村部长白山野生生物资源重点野外科学观测试验站。
1.2 试验设计和试验动物
采用单因素试验设计,将16只3月龄健康雄性梅花鹿(24.42±3.86)kg 分为4 组,每组4 个重复,每个重复1 只,组间体重差异不显著(P<0.05)。其中对照组半胱氨酸水平为2.8 g/kg(Ⅰ组,基础饲粮),试验组饲喂半胱氨酸水平为4.8 g/kg(Ⅱ组,基础日粮+2.0 g/kg半胱氨酸)、6.8 g/kg(Ⅲ组,基础日粮+4.0 g/kg 半胱氨酸)和10.8 g/kg(Ⅳ组,基础日粮+8.0 g/kg 半胱氨酸)的试验饲粮。
1.3 试验饲料与饲养管理
本试验基础饲粮组成及营养水平见表1。试验地点:农业农村部长白山野生生物资源重点野外科学观测试验站。试验时间:2020年9月20日~2020年11月5 日,其中试验预试期15 d,正试期30 d。每天7:30和15:30定量饲喂,自由饮水。

表1 基础饲粮组成及营养水平(风干基础)
1.4 测定指标与方法
1.4.1 瘤胃液发酵参数及游离氨基酸测定
试验最后1 天晨饲前对梅花鹿麻醉并参考崔学哲[13]方法收集瘤胃液。
瘤胃液挥发性脂肪酸测定:瘤胃5 400 r/min 4 ℃离心10 min,取上清液按5∶1(上清液∶内标液)加入含有内标物2-乙基丁酸(2EB)的25%偏磷酸溶液,混合均匀后-20 ℃低温冷冻过夜;10 000 r/min 4 ℃离心10 min,取上清液用气相色谱仪(GC-6800 气相色谱仪,北京北分天普仪器技术有限公司),配置Φ6 mm×2 m石英玻璃填充柱(固定相15% FFAP,担体80~100目Chromosorb)测定。
瘤胃液氨态氮浓度:采用碱性次氯酸钠-苯酚分光光度测定方法并参考T/TAIA 0004—2020标准。
微生物蛋白测定:采用考马斯亮蓝法,测定试剂盒购自南京建成科技有限公司,严格按照说明书进行操作。
瘤胃液氨基酸:将瘤胃液12 000 r/min、4 ℃离心15 min,取上清液与三氯乙酸(10%)1∶1 混合,12 000 r/min、4 ℃离心15 min 沉淀瘤胃蛋白,再取上清液过滤(滤膜,0.22 μm)至2 mL自动进样瓶中,使用日立氨基酸分析仪[L-8900(锂柱),天美(中国)科学仪器有限公司]生理体液分析方法进行测定。
1.4.2 氨基酸表观消化率的测定
试验结束前连续3 d 晨饲前收集部分粪样,每个组别收集4袋新鲜粪样,每袋大约收集100 g。去除鹿毛和沙砾,将收集的粪样喷洒10%稀硫酸固氮,先85 ℃灭菌2 h,再65 ℃烘干至恒重,粉碎后过40 目筛。半胱氨酸和蛋氨酸采用氧化酸水解法参照GB/T 15399—2018测定;赖氨酸、苏氨酸等采用酸水解法参照GB 5009.124—2016 测定。将处理的样品,使用日立氨基酸分析仪[L-8900(钠柱),天美(中国)科学仪器有限公司]固体样本分析方法进行测定。
某氨基酸表观消化率(%)=100-(100×A/A1×B1/B)
式中:A——饲粮中2 moL/L盐酸不溶灰分百分含量;
A1——粪中2 moL/L盐酸不溶灰分百分含量;
B1——粪中氨基酸百分含量;
B——饲粮中氨基酸百分含量,参照《动物营养学(第2版)》。
1.4.3 血清游离氨基酸测定
试验最后1 天晨饲前对梅花鹿麻醉并进行颈静脉采血,采集的血样在带有分离胶的促凝管中静置至血清析出,3 500 r/min离心10 min出血清。将血清与三氯乙酸(10%)1∶1 混合,12 000 r/min、4 ℃离心15 min沉淀血清蛋白,取上清液过滤至2 mL自动进样瓶,使用日立氨基酸分析仪[L-8900(锂柱),天美(中国)科学仪器有限公司]生理体液分析方法进行测定。
1.5 数据处理
试验数据先通过Excel 2016软件进行整理,然后采用统计软件SAS 9.4 进行one-way ANOVA 方差分析,并且采用Duncan’s法多重比较,所得到的结果采用“平均值±标准误差”表示,并且以P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 饲粮半胱氨酸水平对离乳期梅花鹿瘤胃发酵的影响
由表2可知,饲料半胱氨酸水平显著影响瘤胃液总挥发性脂肪酸和乙酸浓度(P<0.05),Ⅲ组和Ⅳ组显著低于Ⅰ组和Ⅱ组(P<0.05);饲料半胱氨酸水平显著影响异丁酸、异戊酸和戊酸的浓度(P<0.05),Ⅱ组显著高于Ⅰ组(P<0.05);各组之间丙酸、丁酸、微生物蛋白和氨态氮浓度未达到显著影响(P>0.05);各组间乙丙比影响未达到显著水平(P>0.05)。

表2 饲粮半胱氨酸水平对离乳期梅花鹿瘤胃发酵的影响
2.2 饲粮半胱氨酸水平对离乳期梅花鹿瘤胃液游离氨基酸及代谢物的影响
由表3可知,饲料半胱氨酸水平显著影响瘤胃液半胱氨酸浓度(P<0.05),Ⅳ组显著高于Ⅱ组和Ⅲ组(P<0.05);饲料半胱氨酸水平显著影响瘤胃液游离蛋氨酸、丝氨酸和鸟氨酸浓度(P<0.05),Ⅱ组和Ⅳ组显著低于Ⅰ组和Ⅲ组(P<0.05);饲料半胱氨酸水平显著影响瘤胃液游离甘氨酸、脯氨酸和胱硫醚浓度(P<0.05),Ⅱ组和Ⅳ组显著低于Ⅲ组(P<0.05);饲料半胱氨酸水平显著影响瘤胃液游离谷氨酸浓度(P<0.05),Ⅳ组显著低于Ⅰ组和Ⅲ组(P<0.05);饲料半胱氨酸水平显著影响瘤胃液游离赖氨酸和丙氨酸浓度(P<0.05),Ⅱ组和Ⅳ组显著低于Ⅲ组(P<0.05),Ⅳ组显著低于Ⅰ组(P<0.05);饲料半胱氨酸水平显著影响瘤胃液游离苏氨酸浓度(P<0.05),Ⅲ组显著高于其他各组(P<0.05);饲料半胱氨酸水平显著影响瘤胃液游离缬氨酸浓度(P<0.05),Ⅱ组显著低于Ⅲ组和Ⅳ组(P<0.05);饲料半胱氨酸水平显著影响瘤胃液游离异亮氨酸、亮氨酸和酪氨酸浓度(P<0.05),Ⅳ组显著低于Ⅲ组(P<0.05);饲料半胱氨酸水平显著影响瘤胃液游离苯丙氨酸浓度(P<0.05),Ⅳ组显著低于其他各组(P<0.05);饲料半胱氨酸水平显著影响瘤胃液游离天冬氨酸浓度(P<0.05),Ⅲ组显著高于其他各组(P<0.05),Ⅰ组显著高于Ⅳ组(P<0.05);饲料半胱氨酸水平显著影响瘤胃液游离组氨酸和α-氨基正丁酸浓度(P<0.05),Ⅰ组显著高于其他各组(P<0.05);各组间瘤胃液游离α-氨基乙二酸、β-丙氨酸、β-氨基异丁酸、γ-氨基正丁酸和磷酸丝氨酸浓度影响未达到显著水平(P>0.05)。

表3 饲粮半胱氨酸水平对离乳期梅花鹿瘤胃游离氨基酸及代谢产物的影响(nmoL/mL)
2.3 饲粮半胱氨酸水平对离乳期梅花鹿氨基酸表观消化率的影响
由表4可知,饲料半胱氨酸水平显著影响半胱氨酸和脯氨酸表观消化率(P<0.05),Ⅳ组显著高于其他各组(P<0.05);饲料半胱氨酸水平显著影响蛋氨酸表观消化率(P<0.05),Ⅲ组显著低于其他各组(P<0.05);饲料半胱氨酸水平显著影响丝氨酸表观消化率(P<0.05),Ⅱ组显著高于Ⅲ组(P<0.05);饲料半胱氨酸水平显著影响甘氨酸、精氨酸、赖氨酸、天冬氨酸和谷氨酸表观消化率(P<0.05),Ⅱ组显著高于Ⅲ组和Ⅳ组(P<0.05);饲料半胱氨酸水平显著影响异亮氨酸、亮氨酸和丙氨酸表观消化率(P<0.05),Ⅰ组和Ⅱ组显著高于Ⅲ组和Ⅳ组(P<0.05);各组之间缬氨酸、组氨酸、酪氨酸、脯氨酸和丝氨酸表观消化率影响未达到显著水平(P>0.05)。

表4 饲粮半胱氨酸水平对离乳期梅花鹿氨基酸表观消化率的影响(%)
2.4 饲粮半胱氨酸水平对离乳期梅花鹿血清游离氨基酸及代谢物的影响(见表5)
由表5可知,饲料半胱氨酸水平显著影响血清蛋氨酸、α-氨基乙二酸、鸟氨酸、3-甲基组氨酸和肌肽浓度(P<0.05),Ⅳ组显著高于其他各组(P<0.05);饲料半胱氨酸水平显著影响血清丝氨酸浓度(P<0.05),Ⅳ组显著低于Ⅲ组(P<0.05);饲料半胱氨酸水平显著影响血清牛磺酸浓度(P<0.05),Ⅲ组显著高于其他各组(P<0.05);饲料半胱氨酸水平显著影响血清赖氨酸、苏氨酸、缬氨酸、苯丙氨酸、异亮氨酸和亮氨酸浓度(P<0.05),Ⅲ组和Ⅳ组显著高于Ⅰ组和Ⅱ组(P<0.05);饲料半胱氨酸水平显著影响血清精氨酸、天冬氨酸(P<0.05),Ⅱ组显著低于Ⅲ组(P<0.05);饲料半胱氨酸水平显著影响血清氨和羟赖氨酸浓度(P<0.05),Ⅰ组显著高于其他各组;各组之间血清半胱氨酸、甘氨酸、组氨酸、酪氨酸、丙氨酸、脯氨酸、磷酸乙醇胺、α-氨基正丁酸、γ-氨基正丁酸、乙醇胺、1-甲基组氨酸、羟脯氨酸和磷酸丝氨酸未产生显著差异(P>0.05)。
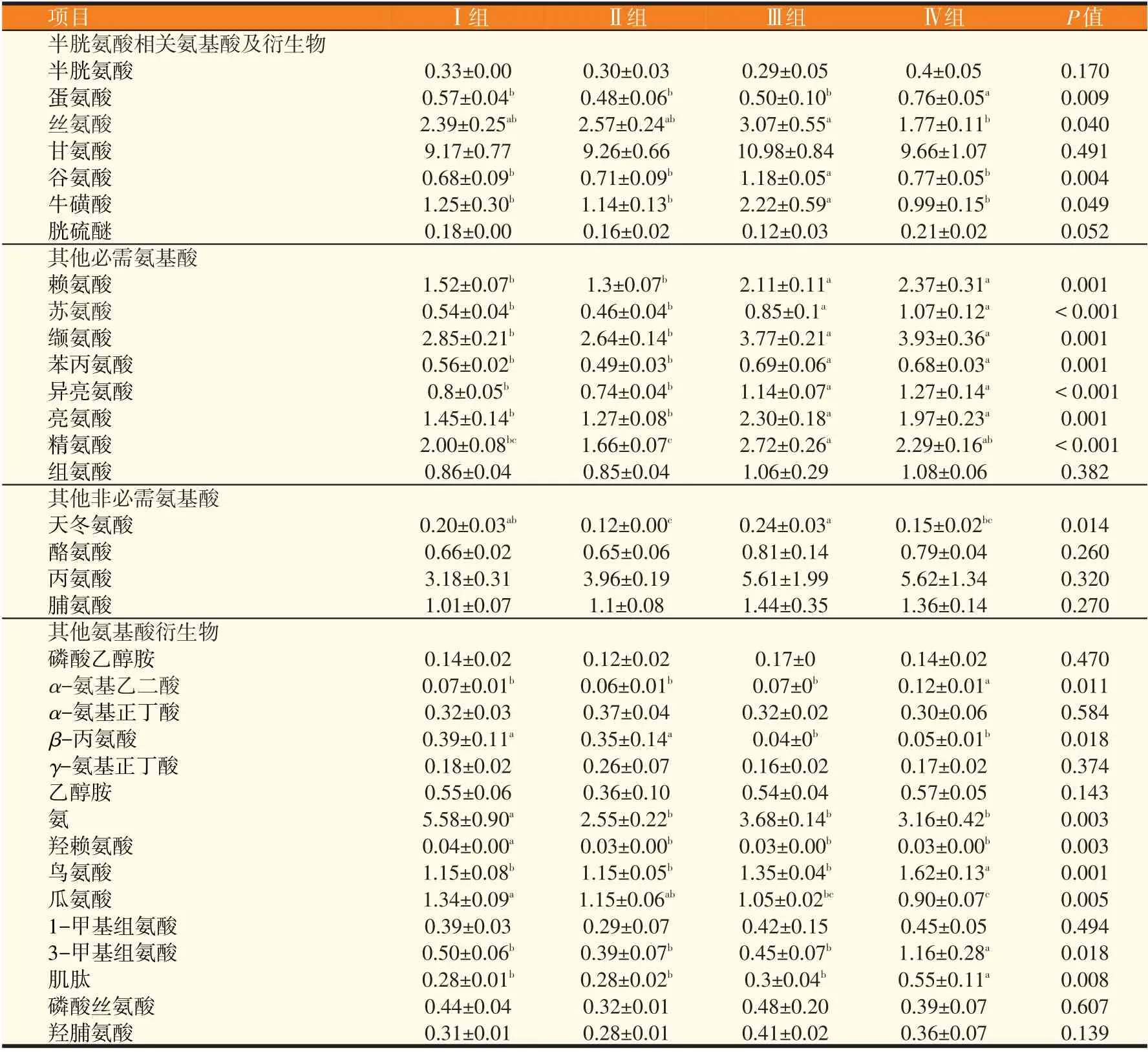
表5 饲粮半胱氨酸水平对离乳期梅花鹿血清游离氨基酸及代谢产物含量的影响(nmoL/mL)
3 讨论
3.1 饲粮半胱氨酸水平对离乳期梅花鹿瘤胃发酵的影响
氨态氮、微生物蛋白和挥发性脂肪酸浓度是研究瘤胃发酵的重要参数[3]。氨态氮浓度能够反映瘤胃微生物蛋白的合成效率,瘤胃微生物适合的氨态氮浓度大约为6~30 mg/mL,在合理的范围内微生物蛋白合成效率随氨态氮浓度的升高而加快[14-15]。微生物蛋白反映瘤胃微生物对含氮物质(氨基酸、蛋白质和非蛋白氮等)的有效利用,合成的微生物蛋白能够随食糜进入肠道被动物体消化吸收。研究发现,羔羊瘤胃内氨态氮和菌体蛋白浓度呈现正相关变化[16],本试验结果与之相同,氨态氮处于合理的范围内,Ⅱ组氨态氮以及微生物蛋白浓度分别比Ⅰ组提高24.45%和14.02%,两指标之间相互验证。仔鹿瘤胃内氨态氮浓度在合理的范围内提高,对机体的生长发育是有益的,同时也有利于仔鹿瘤胃发育和菌群结构的建立[3]。
挥发性脂肪酸主要包括乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸等短链脂肪酸,主要由碳水化合物(淀粉和纤维素等)发酵产生,其挥发性脂肪酸的高低表示瘤胃内能量的供应方式和代谢速率[17]。本试验中Ⅱ组异丁酸、戊酸和异戊酸的含量显著高于Ⅰ组,总挥发性脂肪酸和乙酸含量显著高于Ⅲ组和Ⅳ组,可能是过量的半胱氨酸导致采食量降低[18-19],无法为瘤胃微生物提供同等的发酵底物,从而导致挥发性脂肪酸的降低[20-21]。乙酸、丙酸和丁酸占总挥发性脂肪酸含量的95%以上,是主要的供能物质,其供能大小为丙酸>丁酸>乙酸[22]。因此,丙酸发酵能为动物提供更多的能量。Ren Shabat 等[23]研究表明,由乙酸型发酵向丙酸型发酵转变,能够提高能量及饲料的转化率。本试验结果中Ⅱ组乙丙比相对于Ⅰ组降低16.52%。可能是适宜的半胱氨酸水平比较有利于仔鹿瘤胃发酵模式向丙酸型发酵转变,为仔鹿提供更多的能量。
3.2 饲粮半胱氨酸水平对离乳期梅花鹿瘤胃液游离氨基酸及代谢物的影响
瘤胃液游离氨基酸能够在一定程度表示蛋白质或含氮化合物的分解和利用状况[24]。李仁德[2]认为在仔鹿中添加外源氨基酸能够对瘤胃氨基酸产生显著影响。本试验,外源添加半胱氨酸后导致仔鹿多种游离氨基酸呈现先下降再升高最后下降的趋势。蛋白质在反刍动物瘤胃内,首先被瘤胃微生物分解产生多肽,再进一步分解为游离氨基酸。多肽和游离氨基酸均能够被瘤胃微生物利用,合成微生物蛋白。微生物蛋白、游离氨基酸以及多肽还能随食糜进入肠道,被动物肠道消化吸收利用。除主要的微生物蛋白外,动物肠道更容易吸收多肽,有利于动物的生长发育。研究发现,氨基酸平衡性和瘤胃内游离氨基酸呈现负相关关系[24],本试验中与Ⅰ组相比,Ⅱ组瘤胃液游离氨基酸整体水平降低。第一,可能是在蛋白质降解过程中,主要以多肽的形式存在,减少游离氨基酸的产生。研究表明,瘤胃微生物蛋白的氨基酸组成稳定,且与多肽氨基酸组成类似,多肽可直接合成微生物蛋白,并且肽还能缩短细胞分裂周期,加速细菌的繁殖速度,促进瘤胃微生物达到最大生长效率[14];第二,可能是产生的游离氨基酸被加速利用,合成微生物蛋白。研究表明,半胱氨酸可以增加大鼠肠道内乳酸菌和双歧杆菌水平,降低大肠杆菌水平[11],增加仔猪肠道菌群中的细菌数量[12]。间接表明半胱氨酸可能对瘤胃内复杂菌群同样具有作用,且通过消耗游离的氨基酸促进瘤胃内有益菌的繁殖,需要我们进一步对瘤胃菌群进行研究;第三,可能是半胱氨酸脱羧后合成半胱胺,通过内分泌腺和消化腺的分泌,直接或间接作用于微生物从而促进瘤胃的代谢[25]。总之,无论以上何种途径发挥作用均有利于饲粮中蛋白质和氨基酸的利用。半胱氨酸是否影响瘤胃内复杂微生物的组成,以及通过影响哪些微生物发挥作用,需要进一步研究。
3.3 饲粮半胱氨酸水平对离乳期梅花鹿氨基酸表观消化率的影响
氨基酸是蛋白质的基本组成单位,氨基酸表观消化率在一定程度上能反映出饲粮蛋白质的利用以及氨基酸的平衡状况。氨基酸平衡时能达到最大的利用效率,黄健等[26]研究表明梅花鹿仔鹿饲粮中加入含硫氨基酸能够提高蛋氨酸的表观消化率,本试验中,加入含硫氨基酸,能够显著提高半胱氨酸的表观消化率。可能是晶体氨基酸减少蛋白质降解过程,有利于瘤胃微生物和肠道的利用。本试验中Ⅲ组蛋氨酸表观消化率低于对照组,可能是补充半胱氨酸替代部分蛋氨酸。除含硫氨基酸外,其余氨基酸表观消化率多呈现先上升后下降趋势,可能是半胱氨酸能够通过谷胱甘肽促进肠道上皮细胞的完整性[27];或改善空肠黏膜紧密连接蛋白的表达,促进黏膜的屏障功能,影响肠道黏膜对营养物质的吸收[28]。前人发现,2月龄梅花鹿仔鹿添加半胱胺能够促进粗蛋白的表观消化率[29],也可能是适量半胱氨酸脱羧后通过半胱胺促进消化酶的分泌,提高氨基酸表观消化率[30]。
3.4 饲粮半胱氨酸水平对离乳期梅花鹿血清游离氨基酸及代谢产物的影响
血清游离氨基酸及代谢产物能够反映蛋白质和氨基酸的吸收代谢状况,与动物的生长性能和健康状况密切相关[31]。研究发现,仔猪血清蛋氨酸和半胱氨酸水平会随着饲粮含硫氨基酸的增加而上升[32]。本试验结果与之不同,饲粮添加半胱氨酸后血清半胱氨酸水平各组间差异不显著,可能是饲粮半胱氨酸水平过高,导致采食量的降低,进而影响半胱氨酸总摄入量。本试验中血清蛋氨酸水平升高的主要原因,可能是添加半胱氨酸后,半胱氨酸会导致组织中胱硫醚β-合成酶活力降低,降低了蛋氨酸代谢[33]。谷胱甘肽和牛磺酸是半胱氨酸代谢产物[7]。研究表明,半胱氨酸水平达到一定水平向其产物生成[34]。谷胱甘肽由甘氨酸、谷氨酸和半胱氨酸合成。牛磺酸对幼龄动物的生长发育至关重要[35],Ⅲ组牛磺酸水平显著高于Ⅰ组,可能是半胱氨酸主要向牛磺酸方向代谢,但需要我们进一步研究。研究表明,仔猪中外源含硫氨基酸导致各必需氨基酸变化趋势不同[32]。而本试验中除血清蛋氨酸和精氨酸外的其他必需氨基酸大多呈先降低后升高趋势,可能是Ⅱ组饲粮半胱氨酸水平最为适宜,有利于机体各部位对必需氨基酸的利用,降低血清氨基酸浓度。支链氨基酸(缬氨酸、亮氨酸和异亮氨酸)与肠道细胞的快增殖密切相关,高水平半胱氨酸可能会致使肠道受损,阻碍对支链氨基酸的消耗,进一步导致支链氨基酸含量升高[32,36]。氨基酸代谢极其复杂,各氨基酸之间彼此联系又相互独立,仍需要深入探究。
4 结论
本试验条件下,饲粮半胱氨酸水平为4.8 g/kg时,能够提高瘤胃异丁酸、异戊酸和戊酸氨基酸的浓度,降低瘤胃液和血清游离氨基酸浓度。
