一株刺参肠道乳酸菌的发酵条件及其对刺参生长、非特异性免疫的影响
2023-02-23宋美玲程元秋邱少卿赵彦翠
■袁 磊 宋美玲 周 怡,3 程元秋 黎 叶 邱少卿 赵彦翠
(1.山东商务职业学院粮油食品学院,山东烟台 264670;2.胶州市农业农村局,山东青岛 266300;3.青岛玛斯特生物技术有限公司,山东青岛 266319;4.鲁东大学生命科学学院,山东烟台 264025)
刺参(Apostichopus japonicus)是我国重要的海水养殖经济动物之一,其养殖产量由2004 年的53 315 吨增加到2020 年的196 564 吨[1-2]。刺参养殖产量的快速增长的同时,养殖过程中其疾病也频发,例如:腐皮综合症、肿嘴病、排脏综合症等疾病[3-6],严重威胁刺参养殖产业绿色可持续高质量发展。在刺参疾病防治中,虽然抗生素的效果不错,但抗生素会使刺参免疫系统更加脆弱,增加了攻毒后刺参的死亡率[7],同时滥用抗生素引起抗生素残留、耐药性细菌的出现等相关问题[8-11],因此许多研究者将研究重点放在寻找绿色高效的方法来防治刺参的疾病,其中益生菌的研发与应用越来越受到重视[12-21]。
益生菌是活的、灭活的细菌细胞或者是细菌细胞的一部分,当益生菌通过饲料或者是养殖水体使用时,可改善养殖动物本身肠道菌群或养殖水体菌群,从而达到增强养殖动物抗病力、提高养殖动物健康、促进养殖动物生长、提高饲料利用率、提高养殖动物对外界刺激的耐受力等目的[22]。乳酸菌是常用的益生菌之一,其代谢产生的酸会形成一个不利于食源性致病菌与腐败菌的生存环境,代谢产生的过氧化氢、抗菌蛋白肽等物质对致病菌和腐败菌发挥抑制作用[23],在人和动物肠道中可以调节肠道微生态平衡,形成抗菌生物屏障,提高人与动物免疫力。目前,乳酸菌在水产动物中的研究与应用较多,但在刺参中应用研究较少,已报道外源性乳酸菌对刺参生长、免疫、抗病力的影响[19,24-27]。本研究从刺参肠道中筛选内源性乳酸菌菌株入手,在鉴定菌株、探索菌株发酵条件的基础上,研究饲料中添加筛选的菌株对刺参生长和非特异性免疫的影响,为开发潜在的内源性乳酸菌菌株,促进刺参养殖绿色可持续高质量发展提供基础参数。
1 材料与方法
1.1 菌株的分离鉴定
自然条件下放养的健康刺参(5头,平均体重150 g)取自山东东方海洋公司莱州分公司,加冰运输至实验室。无菌条件下,获得5 头刺参的肠道,将肠道与0.85%的无菌生理盐水按照重量∶体积比=1∶9的比例混合后,用玻璃匀浆器在冰上充分研磨,然后用无菌生理盐水按10 倍梯度逐级稀释,在MRS 琼脂培养基(青岛海博生物技术有限公司)上涂布,MRS培养基用海水配制,25 ℃、厌氧培养48 h。根据菌落形态,挑取单菌落划线分离至长出单一的单菌落,再挑取单菌落培养,用甘油生理盐水保种,-80 ℃保存备用。细菌提取DNA后,进行16S rRNA基因的扩增,具体操作步骤参考Govindaraj 等[28],序列的测定由生工生物工程(上海)股份有限公司完成。
得到的基因序列在Genebank中利用Blast进行同源性检索,获得同源性较高的细菌的16S rRNA 基因序列。用ClustalX(1.8)软件对从Genbank中获取细菌的16S rRNA 基因序列和本实验中菌株16S rRNA 基因的序列进行多序列比对,使用系统发生推断软件包MEGA4.0 进行数据统计和聚类分析,用Kimura 双参数模型计算各序列间的分化距离,其中缺少和不确定的位点在计算中都被省略。通过邻接法(neighbor joining methods)获得分支的系统树,并通过自检分析(boostrap),将自检数据集设为1 000 次,进行置信度的检测。
1.2 菌株的发酵条件
1.2.1 初始pH对菌株生长的影响
调节MRS 培养基的初始pH 分别为1.5、2.5、3.5、4.5、5.5、6.0、6.5、7.0,按1.0%的接种量,将菌株接种于MRS培养液中(10.0 mL),每个初始pH设3个重复,摇床培养24 h。以MRS培养基为空白,测定发酵菌液在600 nm处的吸光值(OD值)。
1.2.2 温度对菌株生长的影响
将菌株按1.0%的接种量,接种于装有10.0 mL MRS 培养基的试管中,分别放置于15.0、20.0、25.0、30.0、35.0 ℃下进行摇床培养,每个温度设3 个重复。36 h后,以MRS培养基为空白,测定发酵液的OD600nm值。
1.2.3 不同的碳源、氮源对菌株生长的影响
在优化培养液(酵母浸粉10.0 g/L,磷酸氢二钾2.0 g/L、柠檬酸钠2.0 g/L、七水合硫酸镁0.5 g/L、乙酸钠5.0 g/L、硫酸锰2.0 g/L、海水1 000.0 mL)中,分别添加麦芽糖、乳糖、葡萄糖、蔗糖4 种不同的碳源各20.0 g/L,每种碳源设3 次重复。在优化培养液(蔗糖20.0 g/L、磷酸氢二钾2.0 g/L、柠檬酸钠2.0 g/L、七水合硫酸镁0.5 g/L、乙酸钠5.0 g/L、硫酸锰2.0 g/L,海水1 000.0 mL)中,分别添加蛋白胨、酵母浸出粉、硝酸铵、硝酸钾、尿素5种不同的氮源各10.0 g/L,每种氮源设3次重复。以1.0%的接种量,将菌株接种于10.0 mL培养基中,25.0 ℃,摇床培养36 h。以液体培养基为空白,测定发酵液的OD600nm值。
1.2.4 碳源、氮源的正交优化
根据单因素实验结果进行正交实验。实验因素水平编码及设置见表1。将碳源、氮源按正交表L9(34)配比,添加到基础培养液(磷酸氢二钾2.0 g/L、柠檬酸钠2.0 g/L、七水合硫酸镁0.5 g/L、乙酸钠5.0 g/L、硫酸锰2.0 g/L,海水1000 mL)中,以1.0%的接种量,将菌株接种于10.0 mL培养基中,每个实验组合重复3次,25 ℃,摇床培养36 h。以液体培养基为空白,测定发酵液的OD600nm值。
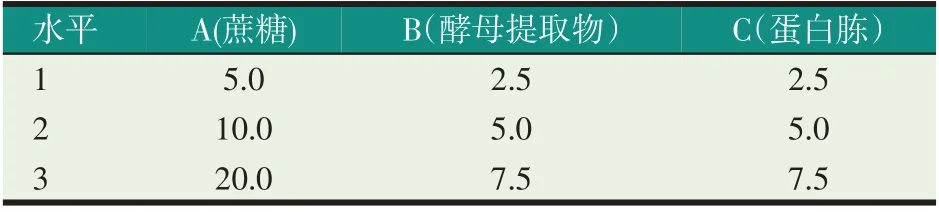
表1 正交实验因素和水平(g/L)
1.2.5 不同的接种密度对菌株生长的影响
初始接种菌液的浓度为4.70×105CFU/mL,得出最佳碳源和氮源后,用优化培养液(蔗糖20.0 g/L、酵母浸粉10.0 g/L、磷酸氢二钾2.0 g/L、柠檬酸钠2.0 g/L、七水合硫酸镁0.5 g/L、乙酸钠5.0 g/L、硫酸锰2.0 g/L,海水1 000.0 mL),以0.25%、0.5%、1.0%、2.0%的接种量(对应接种密度分别为1.18×105、2.35×105、4.70×105、9.40×105CFU/mL)分别接种于10.0 mL培养基中,每个接种密度重复3次,25 ℃,摇床培养36 h。
1.3 养殖实验与样本采集
健康刺参购买于山东省乳山市一水产公司,在实验室内投喂鼠尾藻粉暂养2 周,每日更换40.0%的海水。根据乳酸菌的添加量,设4个处理:M0(对照组)、M5、M7、M9,乳酸菌M2-4 的添加量分别为量0、1.0×105、1.0×107、1.0×109CFU/g。每组4个重复,每个重复随机放置25个大小相似的海参[(2.641±0.047)g]。M0组投喂鼠尾藻粉,其余各组在鼠尾藻粉中添加乳酸菌,将各组饲料与一定量的无菌海水混合后,制成直径为2~5 mm 的小球,投喂量为刺参体重的1.0%,每天下午18:00 投喂一次,投喂饲料前吸出残余饵料,更换40%的海水。海水的温度、盐度和pH 分别保持在15~18 ℃、30‰~32‰、7.8~8.0。
经过30 d的饲养实验,将刺参饥饿24 h。从每个重复中随机抽取6 头刺参,在无菌条件下进行解剖,收集肠道,去除呼吸树,用镊子排尽残余的粪便,迅速用0.85%无菌生理盐水漂洗肠道,漂洗完毕后,将6头刺参的肠道合并在一起放在无菌离心管中为一个样品。在无菌条件下将样品剪碎,进行标记并称重。按照肠道重量∶生理盐水体积为1∶9 的比例,将肠道和生理盐水混合,在冰上,用玻璃匀浆器研磨,研磨后用离心管收集匀浆液,匀浆液离心后得到上清液,上清液用于酸性磷酸酶、总一氧化氮合酶、溶菌酶的检测。
1.4 指标的测定
1.4.1 生长指标的测定
实验结束后,对每个处理各重复中所有刺参进行称重,计算平均终末体重、刺参增重率和特定生长率。养殖实验期间,各组刺参成活率均为100%。
增重率(%)=[(Wt-W0)/W0]×100
特定生长率(%/d)=[(LnWt-LnW0)/t]×100
式中:Wt和W0——分别为刺参的平均终末体重和平均初始体重(g);
t——养殖天数30 d。
1.4.2 非特异性免疫指标的测定
刺参肠道上清液蛋白质含量、酸性磷酸酶(ACP)、总一氧化氮合酶(T-NOS)、溶菌酶(LSZ)活力的测定均采用南京建成生物工程研究所有限公司生产的试剂盒,测定步骤执行试剂盒的操作说明。刺参肠道研磨上清液中蛋白质的测定采用考马斯亮蓝法;ACP的测定采用磷酸苯二钠方法;T-NOS的测定以精氨酸为底物进行测定;LSZ的测定采用溶壁微球菌自身对照法。
1.5 数据处理与分析方法
所有数据使用Excel整理,用SPSS 22.0软件进行单因素方差分析,当显著性水平P<0.05,采用Tukey's检验进行多重比较。正交实验进行正交实验方差分析。
2 结果与分析
2.1 菌株的分离与鉴定
M2-4 菌落在MRS 平板上呈不透明、圆形、乳白色菌落,菌落湿润,表面光滑、边缘整齐。经过16S rRNA基因测序,通过NCBI-balst进行同源性检索,从中选取6 株与M2-4 相似性较高的菌株(相关菌株的16S rRNA基因序列来源和数据库存取号见表2)进行聚类分析,建立系统发育树(见图1),菌株M2-4 与Lactobacillus rhamnosusstrain LE40b(KP090127.1)聚在一起,因此将菌株M2-4 鉴定为鼠李糖乳杆菌(Lactobacillus rhamnosus)。
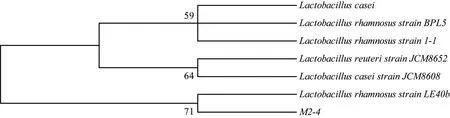
图1 菌株M2-4的16S rRNA序列聚类分析结果

表2 16S rRNA基因序列来源和数据库存取号
2.2 菌株的发酵条件
2.2.1 初始pH对菌株M2-4生长的影响
由图2 可知,在培养液初始pH<5.5 之前,菌株的生长量随着pH的上升而逐渐升高。而当培养液初始pH>5.5 之后,菌株的生长量则随着pH 的上升而逐渐降低。当培养液的初始pH为5.5,该菌株的生长量显著高于pH为1.5、2.5、3.5、4.5、6.5、7.0时的生长量(P<0.05),但与pH 为6.0 时的生长量差异不显著(P>0.05),所以菌株M2-4的最适pH为5.5~6.0。
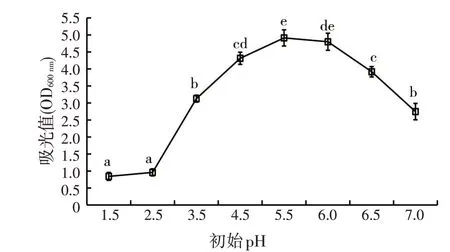
图2 初始pH对菌株M2-4生长的影响
2.2.2 温度对菌株M2-4生长的影响
由图3可知,20、25 ℃时菌株M2-4的生长量显著高于其他温度(P<0.05),而20、25 ℃时菌株M2-4 的生长量差异不显著(P>0.05),表明菌株M2-4 的最适温度范围为20~25 ℃。

图3 温度对菌株M2-4生长的影响
2.2.3 碳源、氮源对菌株M2-4生长的影响
如图4所示,菌株对乳糖及麦芽糖的利用能力较弱;对葡萄糖和蔗糖的利用能力较强。蔗糖为菌株M2-4 的最佳碳源,生长量显著高于葡萄糖、乳糖、麦芽糖(P<0.05)。如图5 所示,菌株对尿素、硝酸钾、硝酸铵3 种无机氮源的利用无显著差异(P>0.05);对酵母提取物和蛋白胨的利用较高,且显著高于3种无机氮源(P<0.05)。

图4 不同碳源对菌株M2-4生长的影响
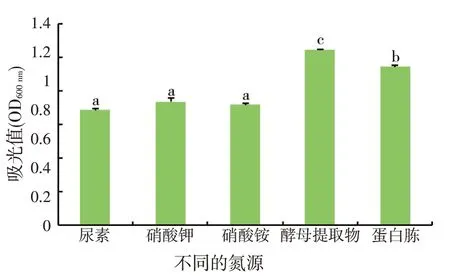
图5 不同氮源对菌株M2-4生长的影响
2.2.4 碳源、氮源的正交优化结果
由表3 可知,最佳组合为A3B2C1,OD 值达到了0.285,即蔗糖20.0 g/L、酵母提取物5.0 g/L、蛋白胨2.5 g/L。通过极差分析可知RA>RB>RC,各因素影响菌体生长程度从大到小依次为蔗糖、酵母提取物、蛋白胨。从方差分析P值(见表4)可以看出:蔗糖和酵母提取物对菌体的生长影响显著(P<0.05),而蛋白胨对菌体的生长影响不显著(P>0.05)。
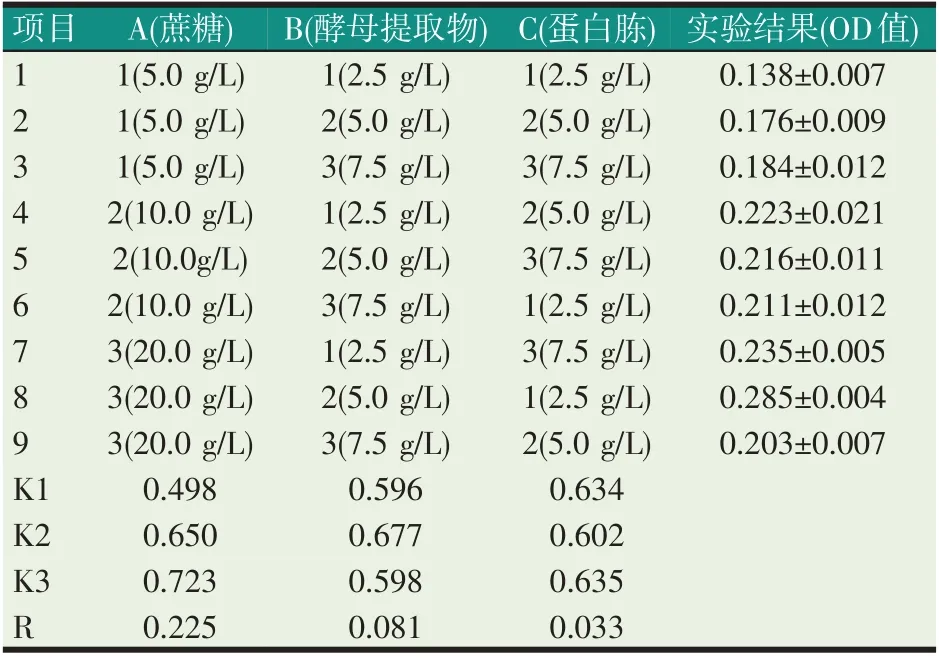
表3 正交实验指示结果

表4 正交实验方差分析
2.2.5 不同的接种密度对菌株M2-4生长的影响
如图6所示,当接种密度为4.70×105CFU/mL 时,菌株的生长量显著高于1.18×105、2.35×105CFU/mL(P<0.05),而高接种密度9.40×105CFU/mL 与4.70×105CFU/mL相比并未提高菌株的生长量(P>0.05),因此菌株M2-4的最适接种密度为4.70×105CFU/mL。

图6 不同的接种密度对菌株M2-4生长的影响
2.3 乳酸菌M2-4对刺参生长指标的影响
由表5 可知,投喂刺参含有乳酸菌M2-4 的饲料30 d 后,实验组(M5、M7、M9)刺参的增重率、特定生长率与对照组(M0)相比差异不显著。
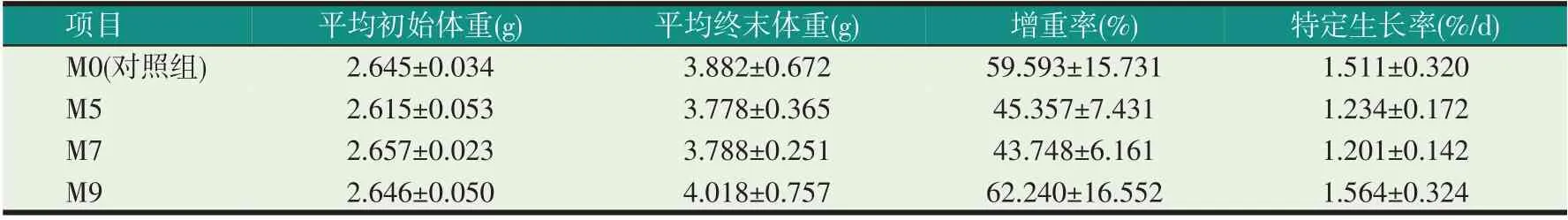
表5 饲料中添加乳酸菌M2-4对刺参生长的影响
2.4 非特异性免疫指标
由表6 可知,投喂刺参含有乳酸菌M2-4 的饲料30 d 后,与对照组相比,当乳酸菌添加量为105、107、109CFU/g 时,刺参肠道ACP、T-NOS 活力显著提升(P<0.05),当乳酸菌添加量为105、107CFU/g 时LSZ活力显著提高(P<0.05)。当添加量为109CFU/g 时ACP活力最高,LSZ活力以添加量为107CFU/g时最高。

表6 饲料中添加乳酸菌M2-4对刺参肠道免疫酶活性的影响(U/g prot.)
3 讨论
随着饲料全面禁抗,养殖中减抗、限抗,抗生素的替代成为水产养殖研究力求突破的瓶颈。益生菌作为安全、绿色、有效防治水产动物疾病的生物产品,是非常有前景的替抗产品。乳酸菌是在水产养殖上尤其是鱼类[29]和虾类[30-31]上被广泛研究和应用的一类益生菌。近几年,乳酸菌在刺参上的应用研究也越来越受到重视。研究表明,刺参健康的养殖池发现了乳酸菌[32],刺参发病池未检测到乳酸菌,说明乳酸菌对维持刺参的健康有重要作用。乳酸菌可以促进刺参的生长[19,24-25]、提高其肠道消化酶活力[19,26]、改善刺参肠道菌群[24,26-27]、提高刺参免疫酶活性[24-26]、促进相关免疫基因的表达[25]、增强其抗病能力[26]。但相对于鱼类和虾类上的研究,仍然缺乏刺参内源性乳酸菌的开发。本实验从健康刺参肠道分离出一株内源性乳酸菌,通过16S rRNA 基因测序及同源性分析将其鉴定为鼠李糖乳杆菌,并初步探明了其发酵条件包括最适初始pH、适宜温度、适宜碳源和氮源、氮源和氮源正交、接种密度等,为此菌的后续研究及其在刺参养殖上应用开发提供基础资料。
该研究发现在鼠尾藻粉中添加该菌对刺参的生长并没有显著提高的作用。这与在饲料中添加嗜酸乳杆菌并未提高刺参生长[27]的研究结果一致。也有研究发现,在养殖池泼洒商业乳酸菌制品(屎肠球菌和植物乳杆菌的混合制品)可以明显促进刺参的生长[24];植物乳杆菌LL11、粪肠球菌LC3 可以促进刺参的生长[25];一定量的灭活植物乳杆菌L-137 也可以促进刺参的生长[19]。因此乳酸菌对刺参的生长是否有显著的促进作用,可能与乳酸菌的种属有关,对生长的促进作用可能具有菌株特异性。本养殖实验仅进行了30 d,更长周期的添加实验有待开展,以更全面地验证该株鼠李糖乳杆菌M2-4对刺参生长的影响。
刺参的免疫主要依靠非特异性免疫来抵抗病原的入侵。ACP、NOS、LSZ等酶活力都是反映刺参非特异性免疫能力的重要指标。在刺参的免疫体系中起着重要的作用[24]。ACP 作为一种重要的溶酶体酶的组成部分,是溶酶体的标志酶,在无脊椎动物的免疫系统中发挥着重要作用,可以消化入侵生物体的异物[33]。NOS调控一氧化氮(NO)的生成,NO是动物体内重要的信使分子、效应分子、免疫调节分子,参与多种生理活动。免疫细胞受到外源刺激时,可以诱导NOS的表达,进而促进生物体合成NO,NO 可以与机体内的超氧阴离子结合生成过氧化氮,过氧化氮是带有高度毒性的产物,可以通过非特异性的方式来杀死入侵机体的病原,增强动物的免疫能力[34]。LSZ 是一种碱性蛋白,可以通过破坏细胞壁中的肽聚糖从而水解细菌的细胞壁,在刺参的非特异性免疫中有着重要作用[35]。和对照组相比,当乳酸菌添加量为105、107、109CFU/g时,刺参肠道ACP、T-NOS活力显著提升,当乳酸菌添加量为105、107CFU/g时LSZ活力显著性提高,这表明该乳酸菌在一定的添加水平上可以通过提高刺参肠道的ACP、T-NOS、LSZ 活力,从而促进刺参对体内异物的分解、促进刺参NO 的生成、提高刺参的杀菌能力,从而增强机体的免疫力。
4 结论
①该研究通过MRS海水培养基从自然放养的健康刺参肠道中筛选出一株乳酸菌菌株M2-4,经分子生物学鉴定,确定其为鼠李糖乳杆菌。
②该菌株的发酵条件研究表明:其发酵最适初始pH 为5.5~6.0;最适发酵温度为20~25℃;最适碳源为蔗糖;最适氮源为酵母提取物;最优的碳源、氮源组合为蔗糖20.0 g/L、酵母提取物5.0 g/L、蛋白胨2.5 g/L;发酵最适接种密度为4.70×105CFU/mL。
③在鼠尾藻粉中添加1.0×105、1.0×107、1.0×109CFU/g 乳酸菌M2-4投喂刺参30 d,虽然刺参的生长没有显著变化,但刺参肠道ACP、T-NOS、LSZ 活力提高,根据以上酶活力指标判断该菌在鼠尾藻粉中的适宜添加量为105~107CFU/g。
