酶解豆粕饲料对草鱼肠道微生物菌群结构的影响
2023-02-23胡雪晴郎宇曦吕福军黄紫薇潘雨佳李应东
■胡雪晴 郎宇曦 吕福军 黄紫薇 潘雨佳 李应东*
(1.沈阳农业大学畜牧兽医学院,辽宁沈阳 110866;2.沈阳波尔莱特饲料有限公司,辽宁沈阳 110000)
草鱼(Ctenopharyngodon idellus)是我国重要的淡水养殖鱼类,养殖产量和养殖面积近年来均处于鱼类养殖之首[1],并且在我国水产饲料体量中,草鱼料的容量也是最大的(600万吨/年)[2]。因此,寻求价格低廉、来源广泛、回报率高的草鱼饲料,对于草鱼养殖业的发展具有重要作用。豆粕(SM)中蛋白质含量高、价格实惠,被常用来作为水产饲料中的植物性蛋白源,但豆粕中含胰蛋白酶抑制因子、非淀粉多糖和植物血凝素等抗营养因子会降低饲料蛋白质消化率,影响水产动物的健康生长[3]。叶元土等[4]研究发现,豆粕饲料喂养的草鱼血清谷草转氨酶、谷丙转氨酶活力显著高于对照组,显示肝胰脏可能受到一定程度的影响。当添加量到达60%时,引起草鱼肝胰脏代偿性增大,肝胰脏的蛋白酶活力显著下降,推测是由一种或几种抗营养因子引起的[5]。豆粕经发酵或酶解处理后,营养价值会显著提高,酶解豆粕(ESM)中的抗营养因子被彻底去除,将大豆蛋白水解为更容易被机体利用的小分子肽类物质,产生对动物体有积极作用的活性物质,更适于水产动物的喂养,是水产动物饲料中理想植物蛋白[6]。ESM对珍珠龙胆石斑鱼幼鱼蛋白质合成代谢有促进作用,可改善脂肪蓄积,提高幼鱼抗氧化能力[7]。ESM替代鱼粉对大口黑鲈的生长性能和消化酶活力均有较好的促进作用[8]。ESM替代鱼粉及添加包膜氨基酸和植酸酶可提高花鲈的生长性能,降低养殖水质中氨氮、亚硝酸盐氮和磷的排放,改善花鲈养殖水质[9]。肠道是草鱼重要的消化器官,肠道微生物组成易受饲料的影响,进而影响草鱼的多种生理进程。饲料中添加大蒜能有效提高草鱼肠道非特异免疫因子能力和改善肠道结构[10]。饲料中添加杆菌七肽能促进草鱼生长,改善肠道健康[11]。饲料中ESM添加水平对草鱼肠道微生物菌群的影响尚不清楚。本研究以草鱼为研究对象,分析了不同比例ESM饲料对草鱼生长及肠道微生物菌群的影响,为ESM在草鱼及其他鱼类饲料中的应用提供参考。
1 材料与方法
1.1 实验饲料的制作及概略养分测定
实验设计豆粕(SM)含量为32%基础饲料(A)作为对照组,然后采用ESM分别替代基础饲料中的普通豆粕和鱼粉,组成了32% ESM 组(B)、36% ESM 组(C)和40% ESM 组(D),其中C 组和D 组饲料中鱼粉添加量分别为8%和4%,实验饲料组成及营养水平见表1。酶解豆粕、矿物质预混料和维生素预混料均由沈阳市波尔莱特饲料有限公司提供。所有原料均经过齿爪式粉碎机粉碎(9FC-28,农百顺)后过20 目筛网,按照实验配方称重后充分手动混匀,加入10%水后采用颗粒饲料压制机(农百顺)在120 ℃制成粒径2.5 mm 的沉性颗粒饲料,用50 ℃的烘干箱(XMTD-8222)烘干2 h 后,在阴凉通风处降温,储存于4 ℃水箱中备用。饲料样品水分测定采用105 ℃烘箱干燥恒重法(GB/T 6435—2014)测定,粗蛋白、粗脂肪和粗灰分含量依次采用凯氏定氮法(GB/T 6432—2018)、索氏抽提法(GB/T 6433—2006)和马福炉550 ℃灼烧法(GB/T 6438—2007)测定。
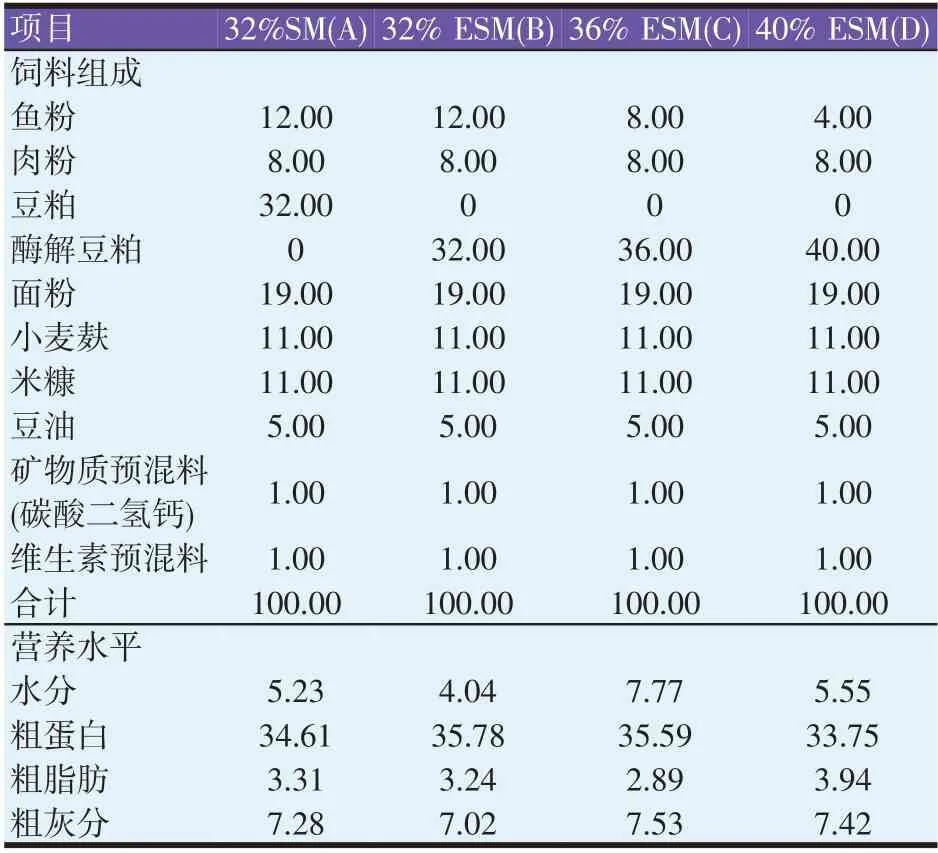
表1 实验饲料组成及营养水平(风干基础,%)
1.2 SDS-PAGE电泳分析
采用聚丙烯酰胺凝胶电泳(SDS-PAGE)对制备得到的普通豆粕(SM)和酶解豆粕(ESM)分离蛋白分子组成进行分析(见图1)。电泳条件为:浓缩胶浓度5%,分离胶浓度10%,150 V 电压跑胶52 min。采用低分子质量的标准蛋白,用考马斯亮蓝R-250 染色30 min后加热快速脱色,脱色后保存并拍照。

图1 普通豆粕(SM)和酶解豆粕(ESM)蛋白聚丙烯酰胺凝胶电泳图
1.3 试验动物及饲养管理
试验草鱼于2021 年10 月25 日购于沈阳市苏家屯养殖户,后转运至沈阳农业大学动物科学与医学学院水产养殖实验室。试验正式开始之前进行两周的暂养,暂养期间投喂草鱼基础饲料(沈阳禾丰水产饲料有限公司)。试验共设4个饲料处理组,每组3个平行,每个平行草鱼25尾,初始体重(55.39±1.82)g,养殖桶的尺寸为1.2 m×0.8 m,水深1 m。对草鱼进行24 h的饥饿处理后,挑选体格健壮、体表无伤、规格均匀的草鱼,随机分配到桶中,每天投喂一次(17:00),投喂量为体重的2%左右,根据摄食情况调整,养殖期间24 h连续充氧,每两周称重一次。养殖实验为期8 周,期间每天换水1/2,并清理池底粪便,保证水质条件如下:氨氮<0.1 mg/L,亚硝态氮<0.01 mg/L,溶解氧>5 mg/L,pH 7.8±0.3,水温(20±1.8)℃。
1.4 草鱼生长指标的测定
试验期间,分别在第3周、5周和8周对每只鱼体进行称重。试验结束后计算生长指标。
存活率(SR,%)=100×试验结束鱼尾数/试验初鱼尾数
增重率(WGR,%)=100×(终末均重-初始均重)/初始均重
特定生长率(SCR,%/d)=100×(终末体重-初始体重)/饲养时间。
1.5 草鱼肠道微生物指标的测定
饲养试验结束后,在各组中随机选取3 尾鱼,在实验室无菌条件下进行解剖,采用0.9%生理盐水冲洗鱼体表面,进行解剖后,采取全肠,放置冻存管中并标记后,立即置于液氮中冷冻,随后干冰运送到上海派森诺公司进行肠道微生物16S rRNA V3-V4区宏基因组分类测序,引物序列为:正向:ACTCCTACGGGAGGCAGCA 反向:GGACTACHVGGGTWTCTAAT。采用Illumina 平台对群落DNA 片段进行双端(Paired-end)测序。测序原始数据以FASTQ 格式保存,切除序列的引物片段,弃去未匹配引物的序列,然后调用DADA2 进行质控、去噪、拼接、去嵌合体。在97%相似度水平对高质量序列聚类,分别输出代表序列和OTU表。使用RDP FrameBot软件,对核酸序列中的插入和缺失错误进行纠正,获得校正的核酸序列和蛋白序列。利用QIIME2(2019.4)软件与参考序列数据库进行比对。利用QIIME2(2019.4)软件计算样本Alpha多样性指数,以Chao1和Observed species指数表征丰富度,以Shannon 和Simpson 指数表征多样性,以Goods_coverage指数表征覆盖度,计算Beta多样性。
1.6 数据处理分析
结果用“平均值±标准差”表示。用SPSS Statistics26.0 对测得数据进行单因素方差分析(one-way ANOVA)和Duncan’s 法多重比较。以P<0.05 作为差异显著性判断标准。
2 结果与分析
2.1 不同比例ESM对草鱼生长性能的影响
由表2可知,饲料中添加32%ESM使草鱼增重率显著高于其他组(P<0.05),36%ESM 组和对照组无显著差异(P>0.05),40%ESM 组末重和增重率显著低于其他组。试验期间,4组草鱼存活率均达到100%。

表2 不同时期草鱼的体重
2.2 肠道微生物样高通量测序结果分析
由表3可知,经16S rDNA测序,共得到1 119 294条有效序列。由图2可见,12个样品中共产生7 921个OTU,共同拥有OTU数为804,占其总数的10.15%。

图2 草鱼肠道微生物群落组成Venn图

表3 不同样本草鱼肠道细菌的序列数量统计
2.3 肠道微生物群落多样性指数分析
由图3可知,饲料中高添加量ESM对草鱼道微生物的丰富度和多样性有显著影响。饲料中添加32%ESM草鱼肠道菌群Alpha多样性指数与对照组无显著影响(P>0.05),随着酶解豆粕替代比例的增高,36%ESM 组Simpson 显著低于对照组(P<0.05),40%ESM组Pielou_e指数也显著降低(P<0.05)。

图3 不同比例ESM对草鱼肠道微生物Alpha多样性指数的影响
2.4 肠道微生物群落组成分析
由图4可知,在门水平下,4个处理组中优势菌门由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和梭杆菌门(Fusobacteria)5个门组成。A组与B组菌类组成在门水平上无显著差别,梭杆菌随着ESM添加量的增高而降低,而拟杆菌则相反。当ESM比例为40%时,放线菌门(Actinobacteria)在草鱼肠道菌群中的相对丰度最高(20.25%)。
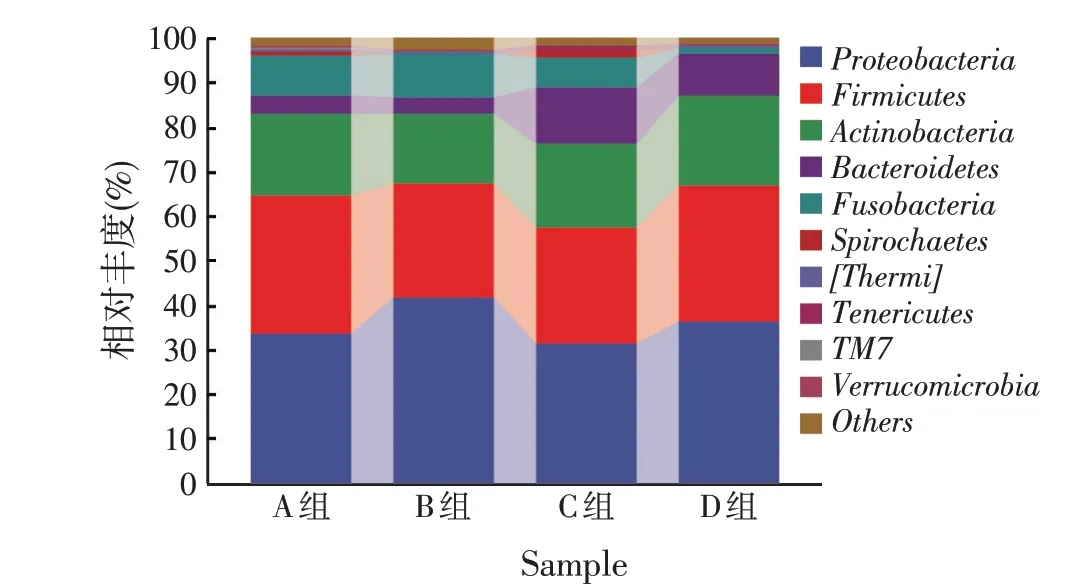
图4 不同ESM添加量下草鱼肠道菌群门水平组成
2.5 肠道微生物群落相对丰度
由图5草鱼肠道微生物种水平聚类热图表明,嗜黏蛋白阿克曼菌(Akkermansia muciniphila)随着ESM添加量的增加而增多。马氏副球菌(Paracoccus marcusii)、噬氨副球菌(Paracoccus aminovorans)、普拉梭菌(Faecalibacterium Prausnitzii)在32%ESM 组显著高于其他组。

图5 不同ESM添加量下草鱼种水平聚类热图
2.6 PCA组成分布分析
由图6可知,A组与B组分离不明显,C组、D组分离明显,36%和40%比例ESM组与对照组和32%比例ESM组差异较大。

图6 属水平下PCA相对丰度分析
3 讨论
对于水产养殖动物而言,豆粕中含有大量植物过敏源和抗营养因子,使蛋白质的消化率和生物学效价远不及鱼粉等动物源性蛋白质,影响机体的对营养物质的利用率[12]。降低或消除豆粕中的抗营养因子、提高水产动物消化率是当前渔用饲料工业发展的重要问题之一。ESM 可以有效去除豆粕中的部分抗营养因子,从而可以提水产动物对豆粕中营养物质的消化、吸收及利用[6]。本研究结果表明,与对照组普通豆粕相比,等量的ESM 替代饲料显著增加了草鱼的体重、特定生长率等生长性能。而ESM替代比例为40%时,生长性能下降。这与其他鱼类的研究结果类似,李学丽[7]发现,过高的ESM 添加量会抑制珍珠龙胆石斑鱼幼鱼的生长。在饲料中使用50%ESM 替代鱼粉会导致黑鲈生长率、饲料转化率显著降低[13]。蛋白饲料是水生动物日粮中的重要组成部分,配比、含量、种类在很大程度上会影响动物的生长性能及其品质。适宜的植物蛋白比例,对水生动物的生长和饲料转化率的效果最佳,超过适宜比例则会引起其机体生长性能急剧下降[14]。未来可通过对酶解技术的改进,进一步提高易消化吸收的小肽含量,或且同时补充低成本动物性营养元素,如利用黑水虻幼虫继续处理酶解后豆粕等方法,使水生动物对ESM中营养物质的表观消化率的进一步提升[15]。
鱼类的肠道微生物在物质能量代谢方面的重要作用,对于深入研究鱼类与食物之间的关系尤为重要[16-17]。目前,围绕草鱼肠道微生物与饲料添加剂间关系的研究较多,饲料中添加大蒜和茯苓[10]、丁酸钠[18]、大豆油[19]和木聚糖酶[20]等,均可以改善和优化草鱼肠道菌群结构。ESM 中含有小肽、益生菌、有机酸等丰富营养物质,适宜的比例可提高肠道微生物多样性,为不同菌群生长繁殖提供舒适的环境。何娇娇等[21]发现,发酵豆粕替代鱼粉对大黄鱼肠道微生物的香农多样性指数、辛普森指数和覆盖率没有显著影响。本研究发现,32%ESM饲料草鱼肠道微生物多样性指数略有上升,但无显著差异。这些不同的结果,可能与所用ESM 的种类、发酵菌种、代谢产物和替代鱼粉的比例以及环境等因素有关。然而,当添加量超过36%时,多样性指数显著降低。
草鱼肠道中优势菌门主要有变形菌、厚壁菌、放线菌、拟杆菌和梭杆菌[16],与本研究结果相同。但不同处理组中,优势菌门比例不同,A组与B组菌类组成在门水平上无显著差别,梭杆菌随着ESM添加量的增高而降低,而拟杆菌则相反。Koren等[22]认为,低密度的脂蛋白胆固醇和总胆固醇与梭杆菌门中的菌群的含量成正比,推测梭杆菌门相对丰度的降低可能会促进动物机体对饲料中脂类的利用。与其他鱼类相比,草鱼动物更容易积累拟杆菌。欧洲鳇肠道菌群中拟杆菌门的丰度随饲料中植物棉籽蛋白的增加而升高[23]。当ESM 比例为40%时,放线菌门(Actinobacteria)在草鱼肠道菌群中的相对丰度最高(20.25%)。
索氏鲸杆菌属广泛存在于淡水鱼肠道中,其可通过代谢产物乙酸激活副交感神经系统,从而促进鱼类胰岛素表达和糖利用能力,对鱼体健康起重要调控作用[24]。本试验中ESM 比例为32%时鲸杆菌属的丰度最高,可以促进维生素B12的合成,为机体提供营养需要保持机体健康稳定[25]。随着ESM比例提升,草鱼肠道中梭杆菌门和鲸杆菌属丰度下降,后壁菌门则上升,与Catalán 等[26]对大西洋鲑的研究结果相似。此外,普拉梭菌也在B 组丰度最高,其为丁酸的重要生产者之一,具有抗炎作用,维持细菌酶的活性,保护消化系统免受肠道病原体的侵害[27]。
