4 种昆虫蛋白粉对草鱼生长和免疫功能的影响
2023-02-23余维鹏陈延娜张玉茹林梦君徐歆歆曹香林卢荣华
■余维鹏 陈延娜 张玉茹 林梦君 徐歆歆 曹香林 卢荣华
(河南师范大学水产学院,河南新乡 453007)
据2021 中国渔业统计年鉴数据,2020 年中国养殖水产品产量高达5 224.2万吨,其中草鱼(Ctenopharyngodon idellus)养殖产量达557.1万吨[1],养殖水产品产量的持续增加导致鱼粉和豆粕的需求量不断增加,价格居高不下。此外,在世界范围内大豆的大量使用也造成了严重的环境问题,如水资源不足以及农药滥用[2]等,限制了其在水产饲料中的应用,因此亟需寻找可持续利用的优质蛋白源。
昆虫被认为是一种鱼粉或豆粕的良好替代品[3],其养殖环境简单,土地需求面积小,不仅可以将大量的有机废物转化为动物蛋白,还可以净化环境等[4]。双翅目昆虫由优质蛋白(高达干物质的74.4%)和平衡的氨基酸组成,优于豆粕,与鱼粉相当[5-6]。黄粉虫的粗蛋白含量(干重)达到45%以上,黑水虻幼虫粉(Black soldier fly larvae meal, BSFLM50)和蝇蛆粉(House fly maggot meal, HF25)的粗蛋白含量分别为40%和65%左右,蚕蛹蛋白粉(Silkworm chrysalis meal, SC50)含量接近60%[7-8]。研究表明,黑水虻幼虫蛋白粉完全替代豆粕不影响草鱼的生长,且可提高草鱼的抗氧化能力,但当替代水平超过50%时,可能对肠道造成一定损伤[9]。饲料中加入适量的黄粉虫蛋白粉(Tenebrio molitormeal, TM30)不影响金头鲷(Sparus aurata)、黑斑鲷(Pagellus bogaraveo)和虹鳟(Oncorhynchus mykiss)的生长性能[10-12],甚至提高了欧洲黑鲈(Dicentrarchus labrax)的蛋白质消化率[13]。此外,昆虫可以抵抗微生物、真菌和病毒等的侵袭,如黄粉虫粉可以增强黄颡鱼(Pelteobagrus fulvidraco)的先天免疫反应[14]。黑水虻蛋白粉还能调节大西洋鲑(Salmo salar)白细胞抗氧化和应激相关基因的表达[15]及改善虹鳟中由豆粕引发的肠炎[16]。
鉴于同一试验中评估不同昆虫粉替代鱼粉或豆粕的效果相对较少[17]。本研究旨在评估4种昆虫蛋白粉替代豆粕后对草鱼生长性能、体成分以及脂多糖(Lipopolysaccharides, LPS)、聚肌胞苷酸(Polyinosinic acid:polycytidylic acid, poly I:C)处理4种昆虫粉饲喂的草鱼肝细胞后免疫相关基因的表达变化等,以期为昆虫蛋白粉作为水产动物饲料蛋白源提供理论依据。
1 材料与方法
1.1 饲料
采用4 种不同昆虫蛋白粉替代草鱼饲料中的部分豆粕,配制5种等氮等脂(粗蛋白水平为32%,粗脂肪水平为4.9%)的试验饲料。其中黄粉虫蛋白粉购于青岛新农康源生物工程有限公司(粗蛋白46.44%、粗脂肪3.32%),黑水虻幼虫蛋白粉由西安洁姆环保科技有限责任公司惠赠(粗蛋白42.0%,脱脂产品),蝇蛆蛋白粉购于鱼笑痴饵料商城(粗蛋白42.0%,脱脂产品),蚕蛹蛋白粉购自宏越饲料鱼粉商贸公司(粗蛋白42.88%、粗脂肪1.88%)。文献调研发现黑水虻幼虫蛋白粉在草鱼饲料替代豆粕的适宜比例为50%[9],蚕蛹粉、黄粉虫以及蝇蛆粉在鱼类饲料中的适宜用量50%、25%~50%和25%~30%[7,18-27]。因此,本试验设计4种昆虫蛋白粉在草鱼饲料中替代豆粕的量分别为0(SM)、50%(SC50)、50%(BSFLM50)、30%(TM30)和25%(HF25)5个水平,最后保持配合饲料中的粗蛋白和粗脂肪含量相同。使用长条制粒机将所有饲料制成粒径为2 mm的颗粒。在阴凉通风处晾干,收集并储存于-20 ℃冰箱中。饲料配方及营养水平见表1。

表1 试验饲料配方及营养水平(g/kg)
1.2 饲养管理
购买的草鱼(河南省新乡市延津县渔场)用高锰酸钾溶液消毒处理后在河南师范大学水产养殖基地的小型养殖池中暂养2周,暂养期间每天饱食饲喂草鱼商品饲料(河南康达尔农牧科技有限公司,粗蛋白含量30.0%、脂肪含量4.0%)3 次。试验开始前,将试验鱼禁食24 h 后称重,挑选规格一致的450 尾草鱼幼鱼[初始体质量为(7.85±0.27)g],分为5个试验组,每组3个重复,随机分配至15个循环养殖桶(高为62 cm,直径为52 cm,130 L),每个重复30尾鱼。养殖周期为8周,每天分别在8:30,12:30和17:30三个时间点按体重的3%进行投喂。
正式养殖试验在室内循环水养殖系统中进行,养殖用水为曝气晾晒的地下水,每日换水一次,换水量为养殖水体积的1/3,水温维持在(26.3±1)℃,pH 为6.5~7.8,溶氧量6~8 mg/L,氨氮含量小于0.2 mg/L,亚硝酸盐含量小于0.1 mg/L,光照周期为12L∶12D。
1.3 样品采集
养殖试验结束后禁食24 h,使用间氨基苯甲酸乙酯甲磺酸盐(MS-222,60 mg/L)麻醉草鱼。称取体质量和测量体长后的试验鱼进行尾静脉取血,并在每桶随机选取6 尾草鱼分离其内脏团和肝胰脏并称其质量。每桶随机选取9尾鱼,取肝胰脏和背部肌肉液氮速冻,-80 ℃保存用于氨基酸和脂肪酸的测定。
1.4 LPS和poly(I:C)孵育草鱼原代肝细胞
养殖试验结束后,每桶随机选3尾草鱼分离肝细胞并接种到含10%胎牛血清、青链霉素各1×104U/L的MEMα的培养板中,每孔接种8×105个细胞,置于28 ℃,5% CO2细胞培养箱中培养。24 h 后用含有100 ng/mL 的LPS 或50 ng/mL poly(I∶C)的培养液孵育细胞24 h收集样品(对照组为不含LPS和poly I∶C的培养液)。
1.5 生长性能的测定
增重率(WGR,%)=(末体质量-初体质量)/初体质量×100
特定生长率(SGR,%/d)=(ln末体质量-ln初体质量)/饲喂天数×100
饲料系数(FCR)=每个重复饲料消耗量/(鱼末体质量+死亡鱼体质量-鱼初体质量)
存活率(SR,%)=存活个体数/初始总个体数×100
1.6 血清生化指标的测定
采用ADVIA®2400 Chemistry System 分析仪测定草鱼血清生化指标,包括总蛋白(Total protein,TP)、白蛋白(Albumin,ALB)、碱性磷酸酶(Alkaline Phosphatas, AKP)、谷 丙 转 氨 酶(Alaninetransaminase,ALT)、谷草转氨酶(Aspartate transaminase,AST)、葡萄糖(Glucose,GLU)和高密度脂蛋白胆固醇(High density liptein cholesterol,HDL-C)。
1.7 脂肪酸的测定
将保存于-80 ℃的肌肉和肝胰脏组织块冷冻干燥24 h,称取0.1 g 样品充分研磨,倒入含有10 mL 氯仿-甲醇溶液(2∶1)的试管中振荡混匀使其充分溶解后,4 ℃、5 000 r/min离心15 min,取6 mL上清液于新离心管并置于冰上。在管中加入浓度1.6%的CaCl2溶液2 mL(分离氯仿和甲醇),充分振荡混匀,4 ℃、3 000 r/min 离心10 min,取下层溶液3 mL 于新的玻璃管中,氮气吹干后在玻璃管中加入300 μL 氯仿和浓度2.5%的H2SO4-甲醇溶液1 mL,充入氮气并盖上盖子,70 ℃水浴1 h 后取出,静置冷却15 min。加入200 μL 正己烷,再加入1.5 mL 超纯水,振荡混匀,4 ℃、3 000 r/min 离心2 min,吸取1 mL 上清(切勿吸到下层水相),0.22 μm 滤膜过滤2 次,采用气相色谱仪(Agilent 7820a, Agilent Technologies, Santa Clara,CA, USA)测定。
1.8 氨基酸的测定
称取0.1 g 冷冻干燥的肌肉样品,加入6 mol/L 的稀盐酸10 mL,110 ℃酸解24 h,冷却后漏斗过滤,转入容量瓶定容至50 mL,取1 mL 于脱酸仪中干燥,然后加入2 mL 样品稀释液,0.22 μm 滤膜过滤2 次,采用氨基酸自动分析仪(S-433D,Sykam,Germany)检测,上样量为20 μL。
1.9 数据处理
数据结果以“平均值±标准差(mean±SD)”表示。所有数据分析采用SPSS 22 软件进行,包括方差分析和多重比较,肝细胞中免疫基因表达统计分析采用2×2-way ANOVA 分析方法。当P<0.05 时,认为每个组差异显著。
2 结果与分析
2.1 4种昆虫蛋白粉对草鱼生长性能的影响
如表2所示,与SM组相比,昆虫粉部分替代豆粕组草鱼的末体质量、增重率、特定生长率和饲料系数等变化均不显著(P>0.05)。
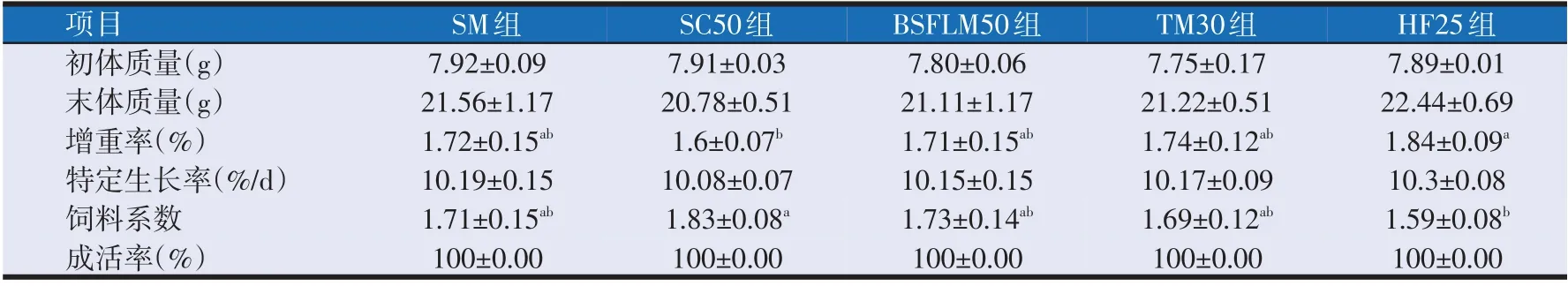
表2 4种昆虫蛋白粉对草鱼生长性能的影响
2.2 4种昆虫蛋白粉对草鱼血清生化指标的影响
如表3所示,与SM组相比,TP、AKP、ALT、AST的数值均未产生显著变化(P>0.05);与SM 组相比,BSFLM50、SC50 和HF25 组的葡萄糖显著升高(P<0.05);HF25组的HDL-C显著高于SM组(P<0.05)。

表3 4种昆虫蛋白粉对草鱼血清生化指标的影响
2.3 4 种昆虫蛋白粉对草鱼肌肉氨基酸和脂肪酸含量的影响
由表4可知,与SM组相比,除TM30组外,BSFLM50、SC50 和HF25 组的肌肉中∑n-3 PUFA(Polyunsaturated fatty acid, PUFA)的含量均显著升高(P<0.05),∑n-3/∑n-6 PUFA 也显著升高(P<0.05)。在肌肉氨基酸成分上(见表5),HF25组的谷氨酸含量显著高于SM 组(P<0.05);但SC50 组的苯丙氨酸和TM30 组的亮氨酸均显著低于SM组(P<0.05)。

表4 4种昆虫蛋白粉对草鱼肌肉组织脂肪酸含量的影响(%)

表5 4种昆虫蛋白粉对草鱼肌肉组织氨基酸含量的影响
2.4 LPS和poly(I∶C)对4种昆虫蛋白粉饲喂的草鱼肝细胞免疫相关基因的表达影响
如图1所示,与其他各组相比,SC50组的肝细胞经LPS诱导后TGF-β1基因的表达量显著升高(P<0.05)。与对照相比较,BSFLM50、TM30以及HF25组NF-κB的表达量经LPS处理后均显著降低(P<0.05)(见图2)。

图1 4种昆虫蛋白粉饲喂的草鱼肝细胞用LPS和poly(I∶C)处理24 h后TGF-β1基因的表达变化

图2 4种昆虫蛋白粉饲喂的草鱼肝细胞用LPS和poly(I∶C)处理24 h后NF-κB基因的表达
3 讨论
3.1 4种昆虫蛋白粉对草鱼生长性能的影响
本研究表明,黄粉虫粉、黑水虻幼虫粉、蚕蛹粉、蝇蛆粉按一定比例替代草鱼基础饲料中的豆粕后均不会影响草鱼的生长性能。在黄鳝(Monopterus albus)、建鲤(Cyprinuscarpio Var.Jian)以及吉富罗非鱼(Oreochromis niloticus)的研究中也发现采用蚕蛹粉或者发酵蚕蛹替代鱼粉的25%~50%时对其生长没有负面影响[18-21];脱脂黑水虻幼虫粉替代50%的大豆浓缩蛋白饲喂罗非鱼,发现二者有相似的特定生长率和饲料转化效率[22];BSFLM完全替代豆粕对草鱼生长没有影响[23];用黄粉虫替代非洲鲶饲料中的鱼粉,其替代比例可达60%(鱼粉含量为26%),而不影响其生长性能和饲料利用率[24]。蝇蛆粉分别替代饲料中50%或100%的鱼粉,饲喂非洲鲶鱼(Clarias gariepinus)10周,其生长性能不会受到影响,蛋白质效率也得到了改善[25]。也有研究发现饲料中使用12%~30%的脱脂黑水虻蛋白粉能显著降低斑点叉尾鮰(Ictalurus punctatus)、大菱鲆(Scophthalmus maximus)和虹鳟的生长性能[26]。用黄粉虫替代金头鲷(Sparus aurata)日粮中的鱼粉,当替代比例超过50%时,鱼体生长性能受到负面影响[27]。这些结果显示,适宜的替代比例不会影响试验对象的生长性能。脱脂黑水虻粉在斑点叉尾鮰、虹鳟和大菱鲆的研究与本试验结果不一致,这可能是因为试验条件、动物种类、饲养的时间、替代的蛋白种类和比例以及脂肪含量不同所致。
3.2 4种昆虫蛋白粉对草鱼血清生化指标的影响
血液中AST 和ALT 酶活性升高是评价肝功能受损的敏感指标[28]。黄颡鱼幼鱼饲料中使用黑水虻幼虫粉替代30%鱼粉,可显著降低血清中AST、ALT 活性及尿素氨、三酰甘油的含量[29]。在本研究中,不同昆虫源饲料对血清中AST 和ALT 的活性没有显著影响。在哺乳动物中,日粮中添加n-3 PUFA可减少肝脏炎症和纤维化,并可通过降低促炎性因子TNFα的表达水平起到保护肝脏的作用[30]。在鱼类中饲喂PUFA后可降低肝脏酶活性[31-32]。本研究结果显示,除TM30组外,其他昆虫粉替代豆粕后均提高了饲料中n-3 PUFA 含量,这可能是草鱼血清中AST 和ALT 活性变化不显著的重要原因之一,且用黑水虻蛋白粉替代豆粕时AST和ALT活性呈下降趋势,这和在建鲤饲料中用黑水虻蛋白粉替代鱼粉[33-34]、或在鳜饲料中用黄粉虫粉替代鱼粉[35]的结果相类似。脱脂黑水虻蛋白粉代替欧洲鲈鱼饲料中的鱼粉后其血液中的血红蛋白、血细胞比容、平均红细胞体积和平均红细胞血红蛋白等含量无显著变化,白细胞、淋巴细胞、单核细胞和中性粒细胞的含量也没有显著变化[36]。本研究中除TM30 组外,其他的昆虫粉替代后均导致了血糖含量增加,这与家蚕(Bombyx mori)、黄粉虫等的作用不同[37],也有学者研究显示,蝇蛆粉替代鱼粉可提高黄颡鱼血糖的含量[38],这可能与不同食性鱼类对糖的利用能力有关。与SM 相比,摄食HF25 饲料的草鱼血清中HDL-C 显著升高,显示蝇蛆粉替代豆粕可以改善草鱼的脂质代谢,这与文远红等[38]发现的养殖家蝇幼虫蛋白具有降低血清胆固醇和三酰甘油的作用类似。
3.3 4 种昆虫蛋白粉对草鱼肌肉脂肪酸和氨基酸含量的影响
本研究显示,与对照组相比,BSFLM50组、SC50组以及HF25 组的草鱼肌肉组织中∑n-3 PUFA 的含量显著增加。在氨基酸组成上,本研究结果显示草鱼肌肉氨基酸组成对日粮组成的反应较小,这可能是草鱼的肌肉蛋白质合成率较低的缘故[39]。仅是HF25组的肌肉组织中谷氨酸含量显著高于SM组,但SC50组肌肉中苯丙氨酸和TM30组的亮氨酸均显著低于SM组,产生这些差异的原因可能与日粮中氨基酸的含量、试验对象的规格以及替代比例不同等。
3.4 昆虫蛋白粉对草鱼肝脏免疫相关基因表达的影响
昆虫含有丰富的抗菌肽[40]。到目前为止,超过150个具有抗菌活性的昆虫蛋白质被发现[41]。采用蝇蛆粉饲喂青鱼(Mylopharyngodon piceus)后,嗜水气单胞菌(Aeromonas hydrophila)丰度降低,其溶菌酶和补体活性均有改善,死亡率降低[42]。饲喂低水平的家蝇幼虫可激活红海鲷(Pagrus major)的先天性免疫系统,保护其免受爱德华斯氏菌的迟发性感染,并认为这可能是由于家蝇体内存在的几丁质或抗菌物质等[43]。在大西洋鲑的饲料中用昆虫粉代替鱼粉,养殖结束后用病毒和细菌模拟物处理其头肾细胞后发现,相比于对照组,昆虫粉组头肾细胞中促炎基因的转录水平没有变化,但细胞中抗氧化和应激相关基因Mn-SOD、GPx1、HSP27和HSP70的表达下调[15]。饲喂黄粉虫可以改善欧洲鲈鱼的抗菌和抗寄生虫的能力[44]。研究表明,低水平的几丁质能刺激金头鲷(Sparus aurataL.)(<0.01%)[45]和鲤(<1%)[46]的内源性免疫系统。本试验结果显示,LPS 处理后,除SC50组外,促炎症因子NF-κB的基因表达量均显著低于对照组,这可能是昆虫所含的几丁质刺激机体内源性免疫系统,增强了机体的抵抗力。
4 结论
4 种昆虫粉替代豆粕均不会影响草鱼的生长,HF25 组替代豆粕可提高草鱼血清HDL-C 及肌肉中谷氨酸的含量,且可以降低促炎基因NF-κB的表达量。若以生长指标为依据,4种不同比例的昆虫粉均可成功替代草鱼饲料中的豆粕,且HF25 组的替代效果最佳。
