5-ARs抑制HCT116侵袭、转移机制的相关研究
2023-02-18冯晓楠董欣宇
李 恒,马 硕,冯晓楠,董欣宇,宋 伟,李 海,杨 春
结直肠癌(CRC)是世界上第三大最常见的癌症之一,其发病率为10.2%,死亡率为9.2%。结直肠癌的发展经息肉腺瘤或扁平腺瘤过渡而癌变并发展为进展性癌甚至向远处扩散,历时可达20多年。因此结直肠发生发展有明显的时间窗,这也为结直肠癌的早期预防提供了可能[1]。近年来的研究表明,麦麸在预防结肠癌方面具有重要作用,并逐渐成为研究热点。烷基间苯二酚(ARs)是在小麦、黑麦中发现的一类特殊的酚类脂,研究结果提示,食用麦麸可降低结直肠癌发病风险。但有关5-ARs抑制结直肠癌的机制尚未阐明,本实验旨在探讨5-ARs对HCT116侵袭、转移的影响,分析谷氨酸-半胱氨酸连接酶修饰剂(GCLM)、谷氨酸-半胱氨酸连接酶催化亚基(GCLC)及核因子类红细胞相关因子2(Nrf2)可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验试剂:细胞培养液购自GIBCO,山羊抗兔二抗、山羊抗鼠二抗购自ABCAM,FBS购自Hyclone,PS、PAGE、SDS、CCK-8试剂盒、BCA蛋白提取试剂盒、BCA蛋白定量试剂盒购自凯基生物,脱脂牛奶、ECL、TEMED购自Thermo,0.45μmPVDF膜购自密理博,GCLM、GCLC、Nrf2和β-actin抗体购自Abcam,5-ARs C17:0购自Abcam,甲醇、TBST、Tris-甘氨酸缓冲液购自海利克斯;PBS购自海利克斯,30%聚丙烯酰胺购自奥林巴斯。
1.1.2 实验仪器:CO2培养箱(美国Bio-Rad,型号:02793-867);高速冷冻离心机(CBS,型号2236),凝胶成像仪(美国Bio-Rad,GELDOC2015);倒置相差荧光显微镜(美国Bio-Rad,型号665);紫外可见酶标仪(美国Bio-Rad Laboratories,型号Discover.V39)。
1.1.3 细胞系:人结直肠细胞(HCT116)购自美国ATCC细胞库(Manassas,VA);细胞培养条件:10%胎牛血清的McCoy′5A培养基、PS(100 U/mL链霉素和100 μg/mL青霉素,双抗),置于37℃,95% O2、5%CO2细胞恒温室培养箱中培养。
1.2 方法
1.2.1 细胞复苏与培养:取出液氮罐中冻存的HCT116细胞,放入37.5 ℃恒温水浴锅中,摇动促细胞悬浮液融化,待细胞悬浮液完全融化后消毒转移至超净台,并用培养基重新悬浮细胞吸取至10 mL离心管中离心(1 000 r/min,5 min),弃上清,加入含有10% FBS的McCoy′5A培养基重新悬浮细胞,再将细胞悬液转移至含有完全培养基的培养皿中,将培养基置于37 ℃、5% CO2培养箱中培养,相差显微镜下观察细胞的贴壁生长情况,隔1~2d换1次培养液,当细胞密度达到90%左右时,用不含EDTA的胰酶消化收集细胞,按1∶3传代,取对数生长期的细胞继续下一步实验用。
1.2.2 药物干预:设多组药物干预组,分别选用浓度为0、15、30、60、90、120、150、180、210 μg/mL的5-ARs干预HCT116细胞,于37℃、5% CO2培养箱中培养24h,相差显微镜观察不同浓度的5-ARs对HCT116细胞增殖的影响及细胞形态的变化。
1.2.3 CCK-8实验:细胞悬液在计数板计数下不同分组细胞数,接种到96孔板内,按比例1∶2依次用培养基稀释成一个细胞浓度,按表1的药物浓度梯度分别干预孔板内的细胞,每组4个复孔。接种后在恒温箱培养2~4 h使细胞贴壁,加入CCK,培养24 h,37 ℃干燥温箱孵育1 h,待变色后放置于酶标仪上选择450 nm测定光吸收值OD值并计算。细胞抑制率=(对照孔OD值-实验孔OD值)/对照孔OD值×100%,计算最佳抑制的5-ARs的浓度,用于继续实验。
1.2.4 细胞蛋白的提取与浓度测定:将HCT116细胞于37℃、5% CO2培养箱中培养至细胞密度90%左右,用BCA提取试剂盒(胞浆和胞核蛋白提取试剂盒)在低温下提取细胞蛋白,再用BCA蛋白定量试剂盒测定蛋白浓度,将蛋白稀释成同一浓度备用。按照每4μL蛋白样品加入1 μL 5×SDS-PAGE蛋白上样缓冲液的比例,混合蛋白样品和蛋白上样缓冲液,于100 ℃恒温金属浴中加热5min左右使蛋白质充分变性,分装至-80 ℃冰箱以继续下一步实验用。
1.2.5 Western-blot实验:根据目标蛋白的分子量大小以及结构调整分离胶和浓缩胶至合适比例,将蛋白样品加入经聚丙烯酰胺凝胶上样孔,在120 V电泳至分离胶,100 V电泳约1.5 h,然后电转液中湿性电转80 V、1.5 h,电转至PVDF膜,4%脱脂奶粉37 ℃封闭1.5 h,摇床摇匀,洗净,分别加入各目标抗体:GCLC抗体(1∶1000稀释)、GCLM抗体(1∶1500稀释)、Nrf2抗体(1∶2000稀释)、β-actin(1∶1500稀释),4 ℃摇床60 r/min 12 h。1%TBST洗膜三次每次5min,加入相应二抗(鼠抗和兔抗1∶3 000稀释),室温孵育1.5 h左右,再给予1% TBST洗膜后加入适宜剂量ECL显色液在暗室凝胶成像仪下曝光成像,记录并留图,用Image J软件进行图像分析实验结果。
1.2.6 Transwell实验:取出试剂盒,将所需数目的小室置于新的24孔板中,上室加100 μL无血清培养基,37 ℃培养箱中放置1 h。制备无血清细胞悬浮液,并计数,细胞数根据预实验调整,一般为105/孔(24孔板)。小心除去上室中培养基并加入100 μL细胞悬液,下室内加入600 μL 30%FBS培养基。37 ℃培养箱培养一段时间。倒扣小室于吸水纸上以去除培养基,用棉拭子轻轻移去小室内非转移细胞,将小室置于4%多聚甲醛固定液中固定0.5 h。固定后,将小室捞出,用吸水纸吸干小室表面固定液,滴入1~2滴染色液到膜的下表面染色转移细胞1~3 min后,将小室浸泡冲洗数次,空气晾干。显微镜拍照:每个Transwell小室,随机选取视野,拍100X照片4张,以100X的照片来计数,进行数据分析。比较实验组和对照组细胞转移能力的差异,计算各组转移细胞数(Migratory cells per field),标准差。T-Test分析得到P值,判断是否有显著性差异。
1.3 统计学方法:采用SPSS 20.0统计软件,2组间比较采用两样本t检验,多组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 5-ARs能够抑制HCT116增殖:将不同浓度5-ARs干预HCT116后,置于37 ℃、5% CO2培养箱中培养24h,倒置相差显微镜下观察细胞的数量及形态变化。结果显示,与对照组相比,HCT116组随着5-ARs作用时间的延长,细胞数明显减少。
2.2 CCK-8法测定不同浓度5-ARs诱导人HCT116细胞系的抑制率:将5-ARs预先设置成0~210 μg/mL(组距为15 μg/mL的倍数),分别干预各组细胞,置于37 ℃、5% CO2培养箱中培养2 4h,CCK8法检测细胞抑制率与空白对照组相比差异有统计学意义(P<0.05)。与阴性对照组相比,HCT116-5-ARs抑制率明显增加;随着5-ARs的浓度升高,可不同程度地抑制HCT116增殖(P<0.05),见表1。
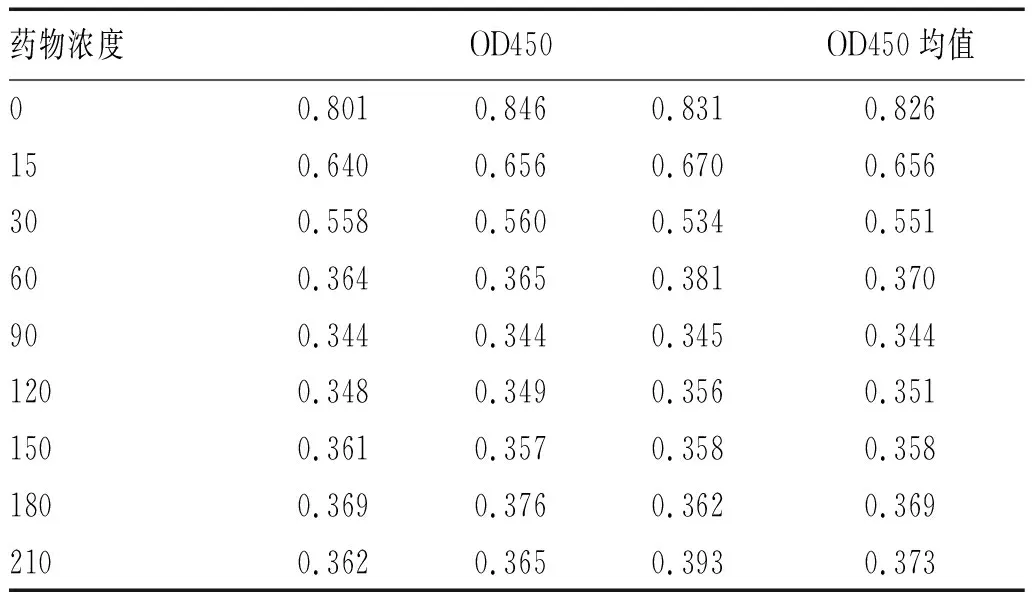
表1 不同浓度5-ARs处理HCT116的OD值(μg/mL)
计算细胞IC50值可得出结论,在5-ARs两个恒基组成浓度为33.01μg/mL抑制人HCT116细胞系效果尤为明显。并将此浓度值作为下一步实验用的最佳浓度值。
2.3 Transwell侵袭实验验证5-ARs处理过的HCT116细胞的侵袭能力:上述浓度的5-ARs处理HCT116细胞后,随着时间的延长其抑制HCT116细胞侵袭转移能力。
2.4 Western- blot检测上述浓度的5-ARs处理后HCT116细胞系的GCLC和GCLM的变化:5-ARs在48 h后可明显抑制HCT116中GCLC和GCLM表达,差异具有统计学意义(P<0.05)。
2.5 Western-blot检测上述浓度的5-ARs处理后HCT116细胞系的Nrf2的变化:上述浓度的5-ARs处理的HCT116细胞系随着5-ARs作用时间的延长,Nrf2的表达量在8 h内明显过量表达,8 h后受抑制,并且24 h后受抑制呈现明显,差异具有统计学意义(P<0.05)。将上述浓度的5-ARs处理HCT116细胞系分别提取胞浆Nrf2和核内Nrf2蛋白经Western-blot检测,在24 h内,Nrf2在胞浆内表达明显上升,而在胞核内明显受抑制,24 h后则呈现Nrf2在胞浆内表达明显降低,而在胞核内明显增高。
3 讨论
结直肠癌是临床常见的消化道恶性肿瘤,其发病率呈逐年上升的趋势。麦麸在预防结肠癌方面具有重要作用,研究表明食用麦麸可降低大肠癌发病风险。ARs特殊的两亲性使其具有抑菌、提高生物膜的稳定性、抗肿瘤、抗氧化等多种生理功能,其作为摄入小麦、黑麦等全谷物食品特殊的生物标记受到研究者的广泛关注。Howe和Trock等学者的研究结果提示增加食用纤维量可以显著降低结直肠癌的发生率。Freudenheim等学者也发现增加谷物来源的不溶性纤维比增加蔬菜和水果来源的可溶性纤维能降低大肠癌的发病风险。虽然很多病例对照研究表明麦麸能降低大肠癌发病风险,但麦麸油的主要成分5-烷基间苯二酚(5-ARs)抑制结肠癌细胞的具体研究机制报道较少。
据报道,GCLC在肿瘤组织中表达异常增高[2-3]。已发现GCLC在结直肠癌的肝转移中过度表达并促进癌细胞存活[4]。氨基酸合成GSH涉及两个需要ATP的酶促步骤:第一步是限速和GCL由一个催化(GCLC)和一个改性剂(GCLM)两个恒基组成,GCLM与癌症发生发展有着密切的关系[5-6]。γ-谷氨酰半胱氨酸合成酶(GCL)活性[7]与多种癌症[8]升高的GSH水平密切相关。作为GCL的成员,GCLC是一种限速酶,参与GSH生物合成的第一步。在参与维持细胞内氧化还原平衡的酶系统中,GSH扮演着主要角色,它不仅参与抗氧化防御系统,还参与许多代谢过程。活性氧(ROS)[9]是需氧细胞在生理上产生的,在细胞损伤的情况下,它们的产量会增加。高水平的活性氧(ROS)或受损的抗氧化防御系统引起的氧化应激可能在癌症的形成[10]和进展中发挥重要作用[11]。氧化应激长期以来一直与癌症的发展和进展有关,这表明抗氧化治疗可能提供预防癌症的保护。实验表明[9,12],ARs可负向调控肿瘤细胞的迁移、侵袭、转移能力,并经Bax/Bcl-2/caspase通路调控其凋亡[13]。
GCLC是受Nrf2调控的典型靶基因之一[14-15],高水平的GCLC与关键抗氧化剂GSH的含量相关。核因子类红细胞相关因子2(Nrf2)是一种氧化还原敏感转录因子,可促进一系列抗氧化基因和细胞保护酶,这些酶构成了对氧化应激的防御[16]。Nrf2是癌症新兴治疗靶点[17],其参与肿瘤细胞的氧化应激和铁代谢作用[18]。Nrf2通过其启动子中的抗氧化反应元件调节众多基因的表达,以中和自由基并加速清除环境毒素。[15]可减少疾病发作或改善预后。Nrf2还负向调节TGF-β1、ECM和p21的表达。[14]Nrf2转移到细胞核中以促进多种细胞保护基因的表达[19],例如 HO1、NAD(P)H醌氧化还原酶1(NQO1)和谷氨酸-半胱氨酸连接酶修饰剂(GCLM)。Nrf2是一种重要的转录因子,它通过与启动子中的抗氧化反应元件(ARE)结合来调节多种抗氧化基因的表达[18,20],有研究表明癌症患者的Nrf2高表达与不良预后相关[21]。
众所周知,小麦、黑麦等麦类中含有大量的ARs,干燥的麦粒中其含量为0.015%~0.3%。小麦等谷物类中的ARs通过改善细胞的抗氧化[22]和抑制糖脂代谢[23]增加抗肿瘤的作用。5-ARs能够降低一些间接诱导物质的诱导性[24],与花青素相比较,ARs能够有效地抑制淋巴细胞培养中诱导物的诱导速率和频率。Gasiorowski等学者通过埃姆斯实验发现ARs能够显著降低四种标准诱导物的诱导效应。进一步研究发现,ARs不仅能够促进具有遗传毒性的被损伤细胞的死亡速率加快,还能够抑制癌细胞形成。进一步的研究表明ARs抑制由过氧化氢引起的结肠癌细胞氧化损伤,在癌细胞中加入ARs,与结肠癌直接相关的排泄物的生殖毒性有所降低[21]。
本研究结果表明,在适宜的干预浓度(33.01 μg/mL)下,5-ARs可明显抑制人结直肠癌细胞HCT116的侵袭和转移能力(P<0.05),并抑制GCLC和GCLM蛋白表达水平从而抑制谷胱甘肽代谢通路,并且5-ARs在时间和空间上抑制Nrf2的表达方式,从而调控HCT116细胞的凋亡(P<0.05)。具体来说,5-ARs随着作用HCT116细胞时间的延长,其抑制HCT116细胞的生长能力及其侵袭能力效果更加明显。进一步研究发现,在33.01 μg/mL 5-ARs 的最佳作用浓度下,24 h后可抑制GCLC和GCLM蛋白的表达,进而抑制肿瘤细胞HCT116的生长繁殖以及侵袭能力。我们还发现在33.01 μg/mL的5-ARs 作用下8 h后HCT116细胞内的Nrf2蛋白表达明显受抑制,并且存在时空上的差异化表达。本研究发现在细胞质中和细胞核内Nrf2蛋白受5-ARs 蛋白的调控存在时间的不同,即在作用24 h内,Nrf2在胞浆内表达量明显上升,而在胞核内表达量明显受抑制,24 h后则呈现Nrf2在胞浆内表达量明显降低,而在胞核内表达量明显过量,从而实现5-ARs蛋白不同方式抑制HCT116的抗凋亡作用,具体调控方式的机制有待深入研究。
