红曲中红曲菌的鉴定及优质菌的筛选
2023-02-17周康熙陈思鹏王泽楠吕旭聪
周康熙,陈思鹏,王泽楠,吴 俐,吕旭聪,倪 莉*
(1 福州大学石油化工学院 福州 350108 2 福州大学食品科学技术研究所 福建省食品生物技术创新技术研究中心 福州 350108)
红曲又称“丹曲”,以熟米为原料经红曲菌发酵而成,在中国已有上千年的食用和药用历史,现今常作为着色剂、发酵剂、功能性添加剂和食品防腐剂[1-2]。 红曲菌对有益代谢物的代谢能力决定了红曲的应用价值,因此优质红曲菌的选育尤为重要。福建省是红曲的重要产区,为中国市场提供了85%以上的红曲,然而,这些红曲多采用古法技艺制备,其质量参差不齐[2-4]。
为提高红曲质量,需对红曲菌进行分离鉴定并筛选优质菌株。然而,当前红曲菌的分类鉴定和优质菌株筛选方法尚有不足。 红曲菌泛指红曲菌属(Monascus),在分类学中属于真菌门(Eumycophyta)、子囊菌亚门(Ascomycotina)、不整囊菌纲(Plectomycetes)、散囊菌目(Eurotiales)、红曲菌科(Monascaceae),是红曲菌科中唯一的隶属分类单元[5]。 红曲菌的鉴定主要在于种水平的鉴定。 红曲菌的鉴定方法较多,常用的是形态学鉴定和分子生物学鉴定,由于不同鉴定方法的原理和标准不同,因此对红曲菌的物种分类不尽相同,容易造成鉴定分类上的混淆,进而可能对某一类菌种的特性造成误判[6-8]。此外,红曲色素是红曲菌分泌的应用价值较高的次级代谢产物,具有着色、保健、防腐等功效[9]。 在筛选高产红曲色素的优质红曲菌时,还要考虑真菌毒素桔霉素的产量[10]。 色素与桔霉素的前端代谢通路相同,在合成四酮体之后分化为2 条代谢通路[11-13],使得色素产量与桔霉素产量间并无直接关联。 如何合理地筛选高产红曲色素而低产桔霉素的优质红曲菌成为研究重点。
本研究以福建省红曲主产区收集的红曲为样本,研究快速分离纯化红曲菌的方法,构建福建省区域红曲菌菌株库。 采用红曲菌形态学鉴定、ITS分子生物学鉴定和18S 分子生物学鉴定3 种方法鉴定红曲菌,将鉴定结果数字化并进行相关性分析,为红曲菌的分类、鉴定提供数据支持。 最后对所分离的菌株进行色素和桔霉素测定,结合产量换算方法筛选出优质红曲菌,为红曲菌种质资源的挖掘提供借鉴。
1 材料与方法
1.1 材料与试剂
红曲,福建省各产区的红曲厂;米粉,由福州市闽侯县上街镇粮油站购置的籼米,经过磨粉,过100 目筛而得;马铃薯琼脂培养基(PDA)、察氏琼脂培养基(CYA)、麦芽浸膏琼脂培养基(MEA)、麦芽汁琼脂培养基(Wa)等红曲菌培养基,青岛海博生物技术有限公司;25%甘油硝酸盐琼脂(G25N)是在察氏琼脂培养基的基础上,添加了25%质量分数的甘油配制而成; 真菌DNA 提取试剂盒、引物、PCR 试剂盒、DNA Maker,上海生物工程有限公司;其它试剂均购自国药集团,分析纯级。
1.2 仪器与设备
ZHJH-C1112B 型超净工作台、ZWY-2102C型摇床,上海智城;SHP-150 型生化培养箱,上海精宏;TC-512 型PCR 仪,TECHNE 公司; 琼脂糖水平板电泳仪,北京六一;JS-380C 型凝胶成像系统,上海培清;SpectraMax i3x 型酶标仪,美谷分子;Ultimate 3000 UHPLC 液相色谱仪,美国赛默飞。
1.3 试验方法
1.3.1 红曲菌的快速分离纯化 取红曲样品于限制性液态培养基中,30 ℃,200 r/min 培养24 h 后,在PDA 培养基中涂布分离,挑取形态不同的红曲菌进行菌种保藏。所述限制性液态培养基包含15 g/L 米粉、5 g/L 葡萄糖、3.98%体积分数的乳酸、6.24%体积分数的乙醇和0.1 g/L 氯霉素。
1.3.2 红曲菌的形态学鉴定 将已分离纯化的红曲菌分别在PDA、CYA、MEA、G25N、Wa 中进行菌种点样,于25 ℃中培养7 d,并拍照观察。
1.3.3 红曲菌的分子生物学鉴定 用真菌DNA提取试剂盒对红曲菌进行DNA 提取,提取后进行PCR 扩增及琼脂糖凝胶电泳,检测扩增效果,将扩增后的PCR 产物送至上海生工进行DNA 测序。所测片段为ITS 序列和18S 序列,其中,ITS 序列引物为ITS1 (5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3'),18S序列引物为NS1 (5'-GTAGTCATATGCTTGTC TC-3') 和FR1 (5'-AGCCATTCAATCGGTAGT-3'),PCR 反应体系及扩增程序参照文献[14]中的方法执行。 测序结果于美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中进行核酸序列比对,并选取同源性高的菌株的ITS rDNA 序列和18S rDNA 序列,利用MEGA 6.0 软件绘制系统发育树。
1.3.4 形态学鉴定与分子生物学鉴定数据的数字化转化和关联性分析 形态学的数字化转化采用积分制。 将鉴定培养基中红曲菌的菌落形态与李钟庆等[15]的红曲菌分类检索表进行比对,参考颜色与形态规律2 个因素,每个因素符合描述积0.5分,不符合描述积0 分,使已分离的红曲菌与形态分类学中的标准菌株之间形成形态学数字矩阵,对该数字矩阵用R 语言软件绘制带聚类分析的热图。
分子生物学鉴定的数字化转化亦采用积分制。 以1.3.3 节中构建的系统发育树为数据基础,以系统发育树中的同源性参考菌株为参照物,根据亲缘关系亲疏进行积分,亲缘关系最近的前5株参考菌株分别积5,4,3,2,1 分,形成分子生物学数字矩阵。
最后用形态学数字矩阵与分子生物学数字矩阵进行关联性分析,用R 语言软件绘制相关性热图。
1.3.5 红曲菌代谢产物的测定 用生理盐水将PDA 平板中已纯化的红曲菌孢子转接至液态发酵培养基中进行发酵,接种量为10%体积分数,孢子悬液浓度1×106CFU/mL,液态发酵培养基包含40 g/L 米粉和4 g/L 甘油,发酵参数30 ℃,200 r/min,7 d。 发酵结束后取0.5 mL 发酵液加5 mL 的75%体积分数的乙醇,于60 ℃中提取色素和桔霉素,提取时间120 min,提取结束后4 500 r/min 离心15 min,取上清液过0.45 μm 滤膜,作为色素和桔霉素的待测液。色素的测定方法参照文献[16]的方法执行,桔霉素的测定方法参照国标《GB 5009.222-2016 食品中桔青霉素的测定》中第一法关于红曲类产品中桔青霉素的HPLC 测定方法执行[17]。
2 结果与分析
2.1 福建红曲菌菌株库的构建
福建红曲产区地理位置分布较为集中,以宁德市为主,福州、南平、泉州、龙岩等地少量分布[2-3]。所收集的红曲样品来源于宁德、福州、泉州、南平四市,且重点涵盖了屏南、古田两县的红曲主产区(图1),表明样品来源的可靠性。 红曲菌对乳酸和乙醇具有良好的耐受性[18-19],在米浆培养基中,添加一定浓度的乳酸和乙醇能实现红曲菌的定向分离、纯化[20],基于此方法快速地从红曲中获得了148 株红曲菌(表1)。由于曲坊多沿用传统技艺制曲,红曲的制作过程并未严格控菌,因此单个红曲中可能会出现多种红曲霉(图2),表1 中红曲菌数远大于红曲样品数也证明了这一点。
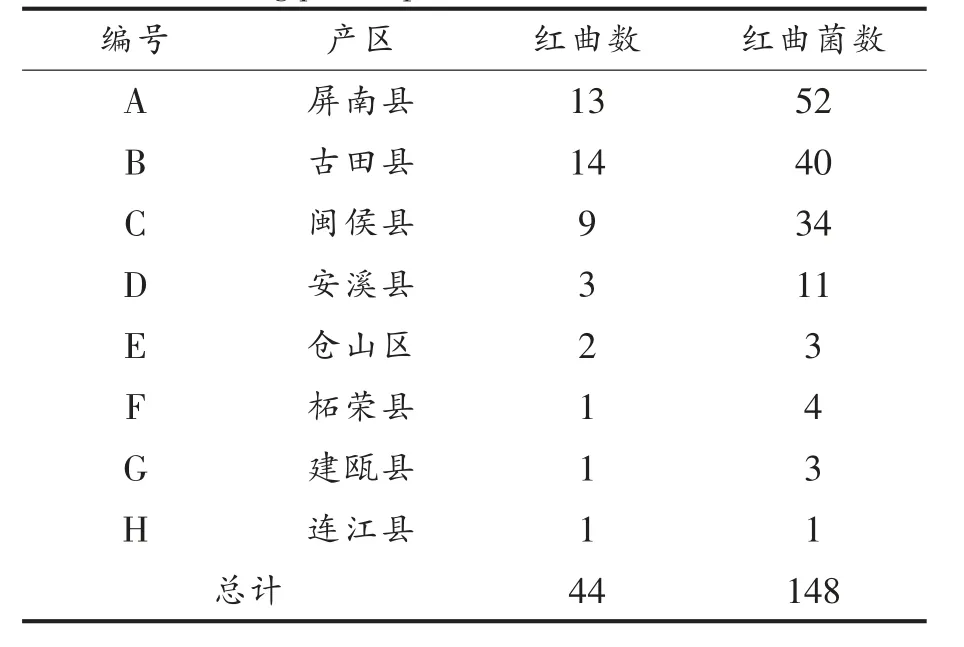
表1 红曲及所分离红曲菌的数量区域分布Table 1 Regional and quantitative distribution of Hongqu samples and their Monascus

图1 红曲样品产区分布Fig.1 Production area of Hongqu samples
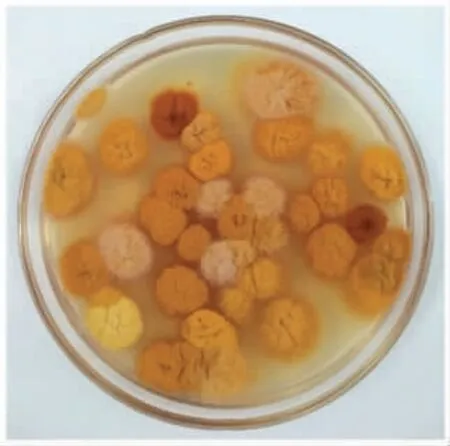
图2 红曲BHQ44 中的红曲菌Fig.2 Monascus species in Hongqu BHQ44
2.2 红曲菌的鉴定方案
2.2.1 红曲菌的形态学鉴定 由于不同红曲菌对不同底物的利用能力不同,因此它们在不同鉴定培养基中所呈现的形态也不同,基于此可直接从红曲菌的形态来区分不同的红曲菌。 在形态学鉴定方面,李钟庆等[15]在前人的基础上改进了红曲菌形态学鉴定方法(联合使用MEA、CYA、G25N、Wa、PDA 中的4 种培养基,不同菌所用的鉴定培养基略有差异),完善了红曲菌的形态学分类检索表,被许多学者认可[21-23]。 对所分离的148 株红曲菌进行形态学分型,可得到45 种形态不同的红曲菌(图3)。 将这45 株红曲菌与李钟庆等[15]的红曲菌形态学分类检索表中的标准菌株进行对照并数字化积分,可得图4。 由图3 及图4 可知,所分离的红曲菌的形态均与标准菌株的形态差异较大,形态学积分满分为4 分,而实际上的得分均不超过2 分。通过积分聚类得知,大多数红曲菌与紫色红曲菌(M.purpureus)、橙色红曲菌(M.aurantiacus)及丛毛红曲菌(M.pilosus)形态相似。 然而单独使用形态学鉴定难以判断红曲菌的物种类别,还需要结合分子生物学方法进行鉴定。

图3 红曲菌的形态学分型Fig.3 Morphological typing of Monascus
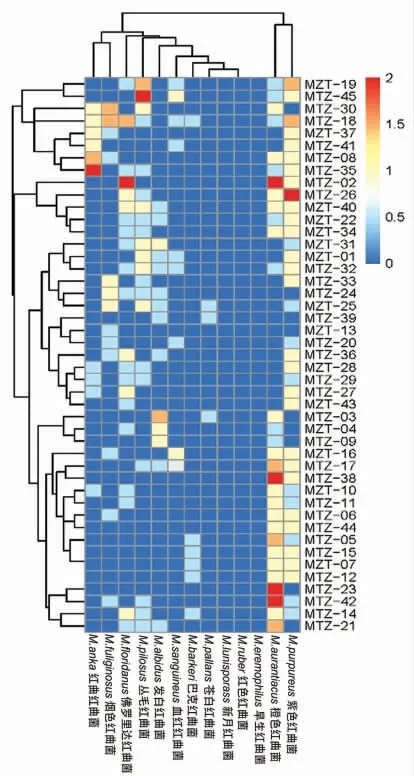
图4 红曲菌的形态学积分聚类热图Fig.4 Clustered heatmap of morphology scores for Monascus
2.2.2 红曲菌的分子生物学鉴定 红曲菌的分子生物学鉴定方法有两种,即DNA 测序分析和DNA 标记分析。DNA 标记分析的目标基因组范围较广,对标记的序列进行扩增后通过序列的多态性来区分不同物种[24]。 然而该技术需要将分析物种与参照物种同时进行基因标记,才能准确分析目标物种的亲缘关系,在实际操作过程中,将面临参照物种价格高昂,非保守序列遗传不稳定等问题。 现今常用的DNA 测序分析通过测定和比对rDNA 上的保守序列来判断物种的亲缘关系,所需的参照物种的基因序列信息能在基因数据库中便捷获取[25]。 在DNA 测序分析过程中,红曲菌常用的是ITS rDNA 和18S rDNA 测序。对45 株不同形态学分型的红曲菌进行DNA 序列比对(图5 和图6),测序片段不同可能会导致不同的鉴定结果,例如红曲菌(Monascus)MZT15 在ITS rDNA 系统发育树中与白色红曲菌(M.albidulus)CGMCC 3.568 亲缘关系最近,而在18S rDNA 系统发育树中与烟色红曲菌(M.fuliginosus)Q5 亲缘关系最近;此外,红曲菌(Monascus)MZT15 的形态学分型又与紫色红曲菌 (M.purpureus)、橙色红曲菌 (M.aurantiacus) 和巴克红曲菌(M.barkeri)较为接近(图4),多种鉴定方法难以统一,这使得红曲菌的鉴定变得复杂。
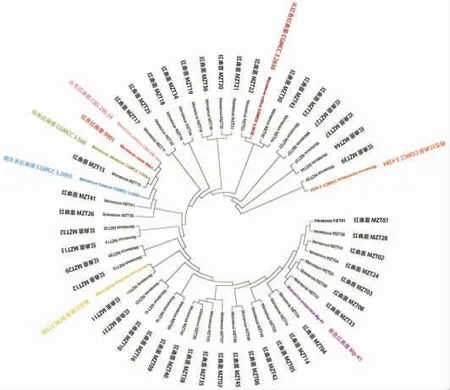
图5 基于ITS rDNA 序列构建的系统发育树Fig.5 Phylogenetic tree constructed based on ITS rDNA sequences
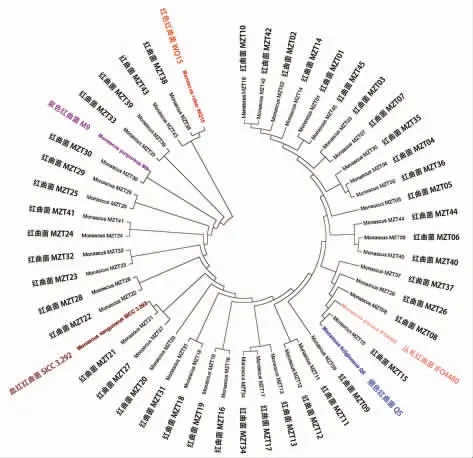
图6 基于18S rDNA 序列构建的系统发育树Fig.6 Phylogenetic tree constructed based on 18S rDNA sequences
2.2.3 红曲菌的形态学鉴定与分子生物学鉴定的对比分析 红曲菌的形态学鉴定、ITS rDNA序列比对及18S rDNA 序列比对3 种鉴定方法难以统一,其原因除了鉴别原理存在显著差别外,另一个重要原因是3 种方法的参照菌株库不相重合。 由表2 可知,形态学鉴定、ITS rDNA 鉴定和18S rDNA 鉴定的参照菌株库中红曲霉的种类分别为13,19,5 种,形态学鉴定和ITS rDNA 鉴定中的参照菌株种类较多,且重合度较高,而18S rDNA 鉴定参照菌株的物种数量偏少。菌株库的不重合除了体现在种类上,还体现在同一种类的数量上。在形态学鉴定中,各参照菌株均使用首次发现的模式菌株,因此各菌数量仅有1 株,而ITS rDNA 鉴定和18S rDNA 鉴定中的参照菌株不局限于模式菌株,基因库中的基因序列来自于全球各研究机构所分离鉴定的菌株,因此会出现对比库中某些红曲霉同种多株的情况。 早期在Hawksworth 等[26]的红曲菌分类检索表中红曲菌仅有丛毛红曲菌(M.pilosus)、紫色红曲菌(M.purpureus)和红色红曲菌(M.ruber)3 种,后来陆续发现红曲菌新种,分类检索表不断更新,然而从表2中可看出这3 种红曲菌较为常见,也使用较为频繁,未知红曲菌在鉴定时被匹配到这3 种的可能性较大。
为了更好地对比分析红曲菌的3 种鉴定方法,将所分离的45 株红曲菌的形态学数字矩阵和分子生物学数字矩阵进行相关性分析(图7)。 尽管所测的ITS rDNA 和18S rDNA 是不同的基因片段,但两种分子生物学鉴定方法具有较好的正相关性。 此外,ITS rDNA 序列分析相比于18S rDNA 序列分析更接近于形态学鉴定的结果,这可能与ITS rDNA 序列分析中参照红曲菌的种类和数量较为丰富有关。结合图7 和表2 的结果,大部分菌株适用形态学和分子生物学联合鉴定,由于形态学鉴定易受培养基成分和培养环境的影响,当两类鉴定方法存在冲突时,建议优先选择分子生物学鉴定的结果,尤其是ITS rDNA 序列分析的结果。
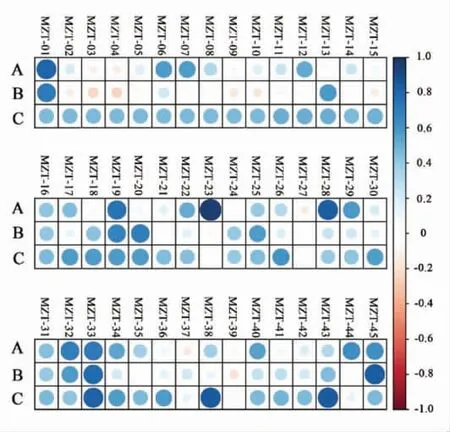
图7 形态学鉴定与分子生物学鉴定的相关性分析Fig.7 Correlation analysis of morphological identification and molecular biological identification

表2 不同红曲菌鉴定方法的参照菌株的种类及其数量对比Table 2 Comparison of species and quantity of reference strains in different identification methods of Monascus
2.3 高产色素低产桔霉素优质菌的筛选
对45 株红曲菌进行色素和桔霉素的测定,并根据其含量高低进行分级,用不同颜色进行等级区分。 由图8a 和图8b 中可知,Monascus MZT23和Monascus MZT01 为高产色素菌,Monascus MZT20、Monascus MZY15 和Monascus MZT24 为低产桔霉素菌,而色素产量与桔霉素产量之间并不存在直接关系,很难从图8a 和图8b 中寻找高产色素低产桔霉素的优质菌。日本对桔霉素的限量以红曲色素为基准,即色价超过500 U/g 的红曲中桔霉素含量不得超过0.2 mg/kg[27],借鉴此方法,以色素产量为基准,对桔霉素产量进行换算,可得图8c。 对图8a~8c 的前3 个最优等级的菌进行分析,可发现Monascus MZT27 为高产色素、低产桔霉素的目标菌,其色素产量为83.3 U/mL,桔霉素产量为81.5 ng/mL。 此外,当前红曲色素市场对红曲黄色素需求巨大[28],优选高产黄色素的红曲菌也具有现实意义。 再次使用产量换算方法,计算45 株红曲菌的黄色素产量与总色素产量的比值,由图8d 可知Monascus MZT39 为高产黄色素的红曲菌 (黄色素占比为70.06%),其红曲色素乙醇提取液基本为黄色(图9),说明此换算方法符合实际,并能用于目标菌株的筛选。

图8 45 株红曲菌的色素及桔霉素产量Fig.8 Pigment and citrinin production of 45 Monascus strains

图9 高产色素菌与高产黄色素菌的色素提取液Fig.9 Pigment extracts of high-yield pigment Monascus and high-yield yellow pigment Monascus
3 结论
福建红曲中红曲菌种类丰富,由于沿袭了传统红曲制备技艺,单个红曲中可能包含多株红曲菌。对福建红曲中的红曲菌进行分离纯化,构建了包含45 个不同形态学分型共计148 株红曲菌的菌株库。对菌株库中45 株不同形态学分型的红曲菌进行形态学鉴定和分子生物学鉴定(ITS rDNA 序列分析和18S rDNA 序列分析),这些鉴定方法的结果并不一致,可能是鉴定原理和参照菌株库不同所致。 将形态学分析、ITS rDNA 序列分析和18S rDNA 序列分析的结果转化为数字矩阵并做相关性分析,大部分菌株适用形态学和分子生物学联合鉴定,且两种分子生物学鉴定方法相关性程度较高,由于形态学鉴定易受干扰、18S rDNA 序列分析参照菌株库较少,当多种鉴定方法之间存在冲突时,建议优选ITS rDNA 鉴定结果。最后,采用产量换算方法对45 株形态不同的红曲菌进行优质菌的筛选,对所有检测指标进行分级,取色素产量、 桔霉素产量和色素产量与桔霉素产量的比值这3 个指标的前3 个最优等级进行比较分析,可获得高产色素、 低产桔霉素的优质菌Monascus MZT27,同时还能再次通过产量换算方法可获得高产黄色素的红曲菌Monascus MZT39。
