黏玉米谷氨酰胺酶的酵母表达及其对乳蛋白的作用
2023-02-17韩秀娥秦兰霞任浩威
韩秀娥,秦兰霞,任浩威
(东北农业大学食品学院 哈尔滨 150030)
谷氨酰胺转胺酶(TGase)能催化蛋白质与多肽链中谷氨酰胺残基的γ-酰胺基与一级氨基之间的酰胺基转移反应,即催化蛋白质之间的交联反应[1-7]。 TGase 作用的底物包括乳清蛋白、麦胚蛋白、大豆蛋白、牛肌球蛋白和家禽肌动球蛋白等[7-20]。在乳制品中,其能提高奶酪的产量、酸奶的品质;在肉制品和鱼制品中,可以改善产品的外观和质构;并通过引入赖氨酸提高蛋白质的营养价值,使蛋白类食品在营养、质构、外观和风味等方面得到改善,满足人们日益增长的对食品的口感、风味和营养的需求[21-29]。 随着食品工业的蓬勃发展,对食品添加剂的需求量也逐年增加,而谷氨酰胺转胺酶是蛋白质,作为食品添加剂可以直接被人体消化吸收,与其它人工合成添加剂相比,具有无法比拟的优越性[29-35]。 本文研究的TGase,是理想的天然食品添加剂,可以替代目前使用的人工食品添加剂。目前,谷氨酰胺转胺酶在中国食品工业中还没有得到广泛应用,主要是由于产量与来源受限,不能满足市场需求。 急需获得1 株高产谷氨酰胺转胺酶的菌株。
本研究目的是利用生物化学和分子生物学的技术和手段,克隆玉米氨酰胺转胺酶基因,将其连接入毕赤酵母表达载体,并在酵母中表达,筛选获得高产菌株,并对酶的生物功能特性进行研究。采用酶技术来改善传统蛋白食品的功能特性和营养特性,具有极大的发展潜力。 这是因为酶反应专一,条件温和,易于控制,越来越受到食品领域的重视。应用生物酶制剂进行蛋白质的生物改性,提高食品的营养、质构、风味,是未来发展趋势。
1 材料与方法
1.1 菌种与试剂
巴斯德毕赤酵母(Pichia pastoris)GS115 和质粒酵母表达载体pPIC9K-TGase 由东北农业大学乳品重点实验室保存;酵母基因组DNA 提取试剂盒,TIANGEN(中国);ExTaq DNA 聚合酶、EcoR I、Not I、Sac I,中国大连TaKaRa 公司。胰蛋白胨、酵母提取物,OXOID 公司(英国);异丙基硫代半乳糖苷(IPTG),中国上海华舜生物工程有限公司;N'N'亚甲基双丙烯酰胺、丙烯酰胺、十二烷基磺酸钠(SDS)、Tris-Base、四甲基已二铵(TEMED)、二硫苏糖醇(DTT)、过硫酸铵(APS)、甘氨酸、酵母氮源培养基(YNB),GIBCO 公司(美国);蛋白分子量标准,Fermentas;TritonX-100、EB(溴化乙锭),Sigma 公司(美国)。
1.2 方法
1.2.1 重组质粒pPIC9K-TGase 的PCR 鉴定 以质 粒pPIC9K -TGase,以上游引物:5' -ATC GAATTCATGGCTCATCGTGGACATCTAGA-3' 和下游引物 :5' -GTCAGCGGCCGCGATTTCAC CATATTTGTCTGC-3'为引物进行PCR 扩增,扩增片段长度为1 630 bp。 使用高保真的ExTaq DNA聚合酶,进行PCR。条件为:94 ℃2 min,94 ℃35 s,62 ℃40 s,72 ℃100 s,29 个循环;72 ℃ 延伸11 min。 反应结束,用1%的琼脂糖凝胶电泳对产物进行鉴定。
1.2.2 质粒pPIC9K-TGase 的双酶切鉴定 用EcoR I 和Not I 双酶切质粒pPIC9K-TGase。 酶切反应条件:37 ℃酶切2 h。反应结束后,取酶切产物5 μL 进行琼脂糖凝胶电泳,在紫外灯光下观察电泳结果并拍照。
1.2.3 质粒pPIC9K-TGase 的线性化及电转化 将经酶切、PCR 鉴定后的重组表达质粒pPIC9KTGase,用Sac I 进行单酶切线性化反应。 然后,将线性化产物电转化至感受态细胞毕赤酵母GS115中。 取转化物均匀涂布于含100 μg/mL 博莱霉素(Zeocin)的YPDS 选择平板上。
1.2.4 粘玉米TGase 基因在酵母中的表达 接种一单菌落到25 mL 的BMGY 培养基中,培养到OD600nm=2~6;离心(12 000 r/min,10 min),收集细胞,移入BMMY 培养基中,置28 ℃遥床培养;每24 h 向培养基中添加100%甲醇,使其最终体积分数达0.5%; 每隔一段时间取样1 mL 分析表达水平,以确定最佳诱导时间。取样时间点为(h):0,24(1 d),48(2 d),72(3 d),96(4 d);在样品中加入100 μL ddH2O,混匀并加入25 μL 5×SDS 凝胶加样缓冲液,混合20 s。 样品经沸水浴处理后进行SDS-PAGE 电泳分析。
1.2.5 酵母表达产物的纯化 将酵母工程菌GS115/pPIC9k-TGase 诱导表达,培养液(BMMY)4℃10 000 r/min 离心10 min,将上清液上样于经50 mmol/L,pH 5.0 磷酸钠缓冲液预平衡的SP Sepharose Fast Flow 阳离子交换层析柱,然后以含0.2 mol/L 氯化钠的0.02 mol/L pH 6.5 的磷酸钠缓冲液梯度洗脱,收集含目的蛋白的洗脱液,凝胶过滤后,收集到的活性峰溶液较稀,离子强度大,需经过浓缩和透析,经0.02 mol/L pH 6.5 的磷酸钠缓冲液透析后,采用阳离子交换柱HiPrep16/10 纯化,平衡缓冲液为0.02 mol/L pH 6.5 的磷酸钠缓冲液,上样结束后用平衡液洗至基线,进行氯化钠梯度洗脱,以含0.2 mol/L 氯化钠的0.02 mol/L pH 6.5 的磷酸钠缓冲液梯度洗脱。收集含目的蛋白的洗脱峰。 以考马斯亮蓝染色法对纯化后的目的蛋白进行浓度测定,SDS-PAGE电泳。
1.2.6 酵母表达的TGase 对酪蛋白的改性 取0.2%(体积分数)pH 6.5 的酪蛋白溶液2 mL,纯化的TGase 酵母表达蛋白浓缩液2 mL,于37 ℃反应2.0 h,取60 μL 反应液,加入等体积的2×SDS 样品缓冲液,沸水浴6 min,然后进行SDS-PAGE 凝胶电泳。
1.2.7 酵母表达的TGase 对酸奶超微结构的改变
酵母表达的TGase 按一定比例加入酸奶中,以不加TGase 为对照,于43 ℃恒温箱中进行保温发酵,大约2.5 h 后,pH 值达到4.7 左右时,停止发酵,在4 ℃冰箱中贮存待用。 然后,按要求制作电镜样品,在扫描电镜下观察、拍照。
2 结果与分析
2.1 重组质粒pPIC9K-TGase 的双酶切鉴定
将pPIC9K-TGase 质粒转化大肠杆菌JM109感受态细胞中,提取质粒用EcoR I 和Not I 双酶切鉴定,鉴定结果如图1 所示。
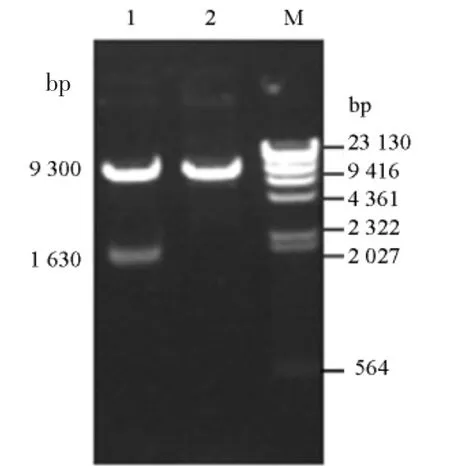
图1 重组质粒pPIC9K-TGase 的双酶切鉴定Fig.1 Identification of recombinant plasmid pPIC9K-TGase by double digestion
2.2 重组质粒pPIC9K-TGase 的PCR 鉴定
以质粒pPIC9K-TGase 为模板,以TGase-up和TGase-down 为引物进行PCR 扩增,电泳结果见图2,扩增的DNA 条带大小约为1 630 bp,与预期大小相符。结果表明,目的基因已插入到表达载体pPIC9K 中。
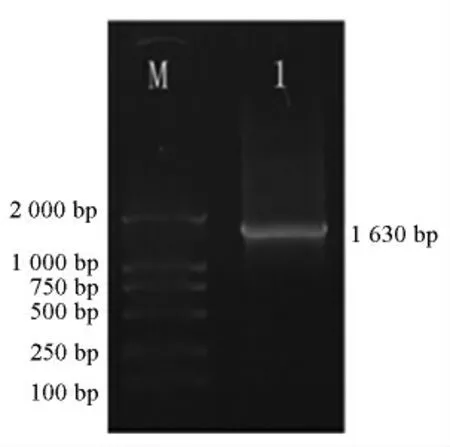
图2 重组质粒pPIC9K-TGase 的PCR 鉴定Fig.2 PCR identification of recombinant plasmid pPIC9K-TGase
2.3 重组酵母的诱导表达
与对照组比较,重组菌诱导表达上清液在分子质量约60 ku 处,有明显特征性条带出现(图3中箭头所示),与预期的TGase 分子质量大小相符,表明TGase 蛋白在酵母中得到表达。通过对蛋白浓度计算,培养基中目的蛋白表达量为85 mg/L,酶活为6.5 U/mL。
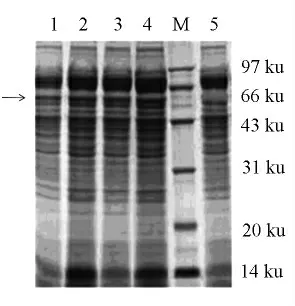
图3 酵母转化子表达上清SDS-PAGEFig.3 SDS-PAGE of yeast transformant expressing supernatant
2.4 重组蛋白的纯化
酵母工程菌GS115/pPIC9k-TGase 表达的上清,经SP Sepharose Fast Flow 阳离子交换层析柱,阳离子交换柱HiPrep16/10 纯化后,上样于聚丙烯凝胶上进行SDS-PAGE 电泳,结果见图4。酵母工程菌GS115/pPIC9k-TGase 培养液上清,经凝胶过柱后,可以得到纯化蛋白。 经薄层扫描分析,纯化蛋白的纯度可达85%。
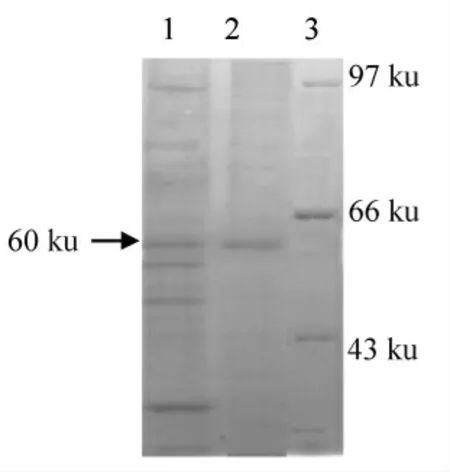
图4 纯化蛋白的SDS-PAGE 电泳Fig.4 SDS-PAGE electrophoresis of purified proteins
2.5 毕赤酵母表达的TGase 对酪蛋白的改性
毕赤酵母表达的TGase 对酪蛋白具有很强的聚合作用,使酪蛋白交联成较大的聚合物,很大部分聚集在浓缩胶和分离胶的界面,小部分形成了不同分子质量的蛋白聚合物,分布在分子质量在45 ku 以上,结果见图5。
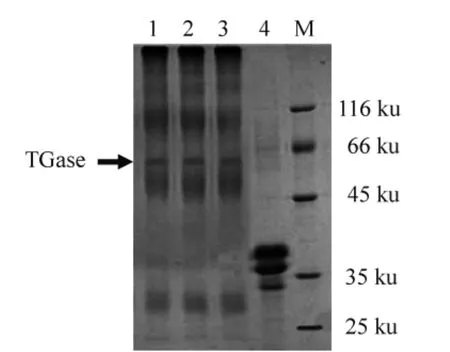
图5 酵母表达的TGase 催化酪蛋白聚合反应Fig.5 Casein polymerization catalyzed by TGase expressed by yeast
2.6 毕赤酵母表达的TGase 对酸奶超微结构的改变
将酵母表达的TGase 加入酸奶中,酸奶样品经处理后,放于扫描电镜下观察。 结果见图6a 和图6b,放大倍数为5 000 倍。由图6a 可知,没有加酶的酸奶形成大孔径的纤维网络结构,这些网络结构是由变性的酪蛋白微粒以丛状、 链状连接在一起堆积而成,这些微孔的直径一般在9 μm 以上;图6b 可见,添加酵母表达的TGase,网络结构变得较致密,空隙直径在3 μm 左右。

图6 酸奶的超微结构Fig.6 Ultrastructure of yogurt
3 结论
本研究将前期已经构建好的重组质粒pPIC9K-TGase 经双酶切及PCR 鉴定正确后,Sac I 线性化处理,电转入巴斯德毕赤酵母GS115,利用1%(体积分数) 甲醇诱导其分泌表达。 SDSPAGE 电泳可检测到特异的蛋白带。 通过对蛋白浓度的计算,培养基中目的蛋白表达量为85 mg/L,酶活为6.5 U/mL。通过酪蛋白改性试验证明:毕赤酵母表达的TGase,都能使酪蛋白聚合生成不同分子质量的聚合物;通过扫描电镜观察:添加酵母表达TGase 的酸奶凝胶网络结构变得较致密,孔隙也变得较小。
