环糊精衍生物的分子形态及其构筑策略研究进展
2015-08-19沈海民方红果武宏科纪红兵史鸿鑫
沈海民,方红果,武宏科,纪红兵,史鸿鑫
(1浙江工业大学化学工程学院,浙江 杭州 310014;2杭州娃哈哈集团有限公司,浙江 杭州 310009; 3中山大学化学与化学工程学院,广东 广州 510275)
环糊精(cyclodextrin,简称CD)主要是指环糊精糖基转移酶(CGTase)作用于淀粉得到的降解产物,为典型的可再生资源,并且无毒可生物降解,结构上是由D-(+)-吡喃葡萄糖单元通过α-1,4-糖苷键连接而成的环状低聚糖,呈截顶圆锥状。其家族中各成员由于所含D-(+)-吡喃葡萄糖单元数目的不同而不同,可以分别含有6个、7个、8个、9个、10个……甚至20个D-(+)-吡喃葡萄糖单元,但其中3个主要成员分别含有6个、7个和8个D-(+)-吡喃葡萄糖单元,即α-环糊精、β-环糊精和γ-环糊精,其中β-环糊精(如图1所示)价廉易得,应用最广。在环糊精分子中,D-(+)-吡喃葡萄糖单元的羟基位于截顶圆锥的两个边缘,C-3和C-5上的H原子位于截顶圆锥的内部空腔,因而使得环糊精具有“内腔疏水,外壁亲水”的特殊结构和性质[1-2],在水相中能够像酶一样作为主体分子为客体分子提供疏水环境,广泛应用于吸附[3-5]、催化[6-8]、增溶[9-11]等领域。但是,由于环糊精分子结构中只含有羟基一种官能团,并且具有一定的刚性,使其作用于具有各种分子形态的客体分子时很难在结构上发生相应的拓扑变化,应用受到了一定的限制。为克服上述不足,可以借助环糊精羟基官能团的化学反应,对环糊精进行化学修饰,增加其分子结构中的官能团种类并打破环糊精母体本身的分子内氢键网络,提高其拓扑性能,拓展其应用领域[12-16]。
通过对环糊精进行化学修饰,构筑环糊精衍生物以拓展其应用领域,已成为目前环糊精应用的主流,也使环糊精衍生物的分子形态有了进一步的丰富与发展。目前,环糊精衍生物根据分子结构与形态的不同大体可以分为以下6类:单取代环糊精衍生物、双取代环糊精衍生物、多取代环糊精衍生物、二聚体环糊精衍生物、多聚体环糊精衍生物和环糊精聚合物(包括固载化环糊精)。尽管目前已有如此丰富的环糊精分子结构形态,但根据环糊精衍生物的分子结构形态对其进行分类并介绍其构筑策略,还未见相应的综述性文章。本综述结合作者本人基于β-环糊精构筑超分子仿酶的研究[17-22],针对目前环糊精衍生物总量极大但无明确分类标准并且还没有关于环糊精衍生物合成全面系统的综述性文章的现状,系统介绍了环糊精衍生物的分类及其构筑策略,对基于环糊精构筑各种功能材料,尤其是基于环糊精构筑水相超分子仿酶,具有重要的参考价值和指导意义;对充分利用可再生资源、以促进化学工业的可持续发展和“绿色化”意义重大。
1 单取代环糊精衍生物
单取代环糊精衍生物主要指分子结构中含有一个环糊精单元,并且环糊精母体中一个羟基被取代得到的环糊精衍生物,环糊精母体可以是α-环糊精,也可以是β-环糊精和γ-环糊精,修饰基团取代位置可以是环糊精的C-6位置,也可以是环糊精C-2和C-3位置,但以修饰基团在环糊精C-6位置的单取代环糊精衍生物居多。如图2中β-环糊精衍生物CD-1[23]和CD-2[24]中,修饰基团位于β-环糊精母体的C-6位置;而β-环糊精衍生物CD-3[25]和CD-4[26]中,修饰基团分别位于β-环糊精母体的C-2和C-3位置。修饰基团的位置不同,所得到的单取代环糊精衍生物在有机合成中往往具有不同的调控性能,修饰基团位于C-6位置的单取代环糊精衍生物合成相对比较简单,在有机合成中应用较广[27-31]。
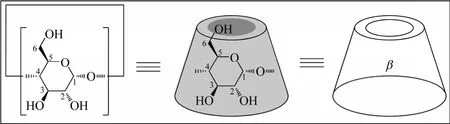
图1 β-环糊精的结构式
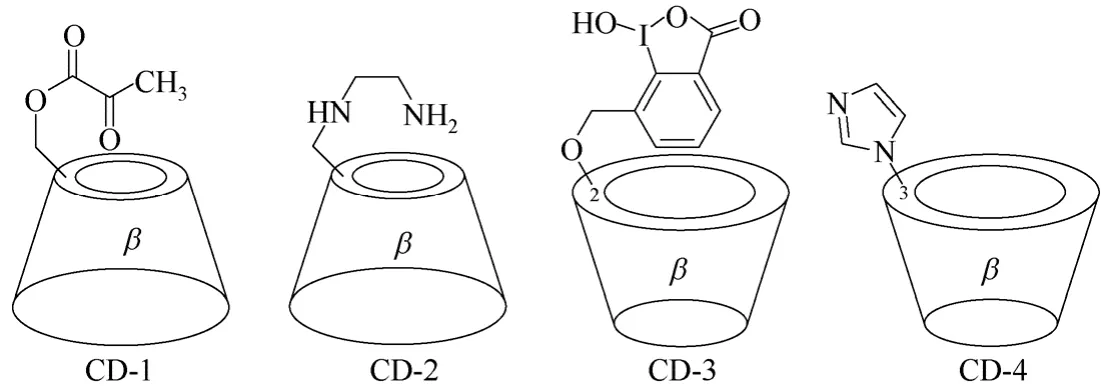
图2 β-环糊精衍生物CD-1~CD-4的结构式
单取代环糊精衍生物的合成,首先需要对环糊精分子结构中众多羟基中的一个进行选择性地活化,与p-甲苯磺酰氯反应生成单(6-O-p-甲苯磺酰基)-α,β,γ-环糊精是目前比较常用的活化方法,将羟基转化成离去性能更好的p-甲苯磺酰基,从而引进各种目标修饰基团。以β-环糊精为例,在碱性水溶液或在吡啶中,均可与p-甲苯磺酰氯高选择性生成单(6-O-p-甲苯磺酰基)-β-环糊精(β-环糊精衍生物CD-5)(图3 Equ. 1所示)[32-34]。以单(6-O-p-甲苯磺酰基)-β-环糊精为基础,通过亲核取代反应,可以生成一系列单取代β-环糊精衍生物,如CD-6~CD-13(图4 所示)[35-41]。除了发生亲核取代反应,单(6-O-p-甲苯磺酰基)-β-环糊精还可以通过氧化反应向β-环糊精母体引入醛基,生成β-环糊精衍生物CD-14,进一步氧化可得具有羧基的单取代β-环糊精衍生物CD-15(图5 Equ. 2所示)[42]。β-环糊精衍生物CD-14中,醛基具有较高的反应活性,可以通过各种化学转化进一步向β-环糊精的C-6位置引入一系列修饰基团,构筑β-环糊精衍生物,如Equ. 3所示,通过氨基与醛基的加成和对生成烯胺的还原,将卟啉衍生物引入到β-环糊精的C-6位置,合成了β-环糊精衍生物CD-16(图6所示),细胞色素P-450酶模型[43]。
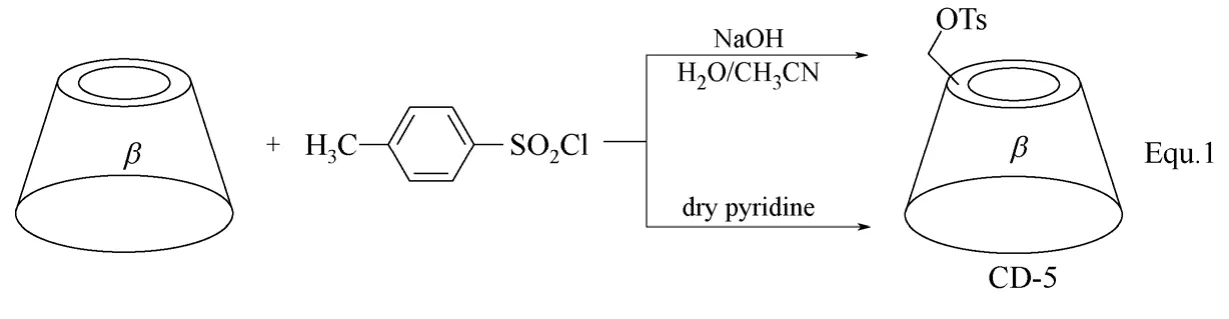
图3 β-环糊精衍生物CD-5的合成
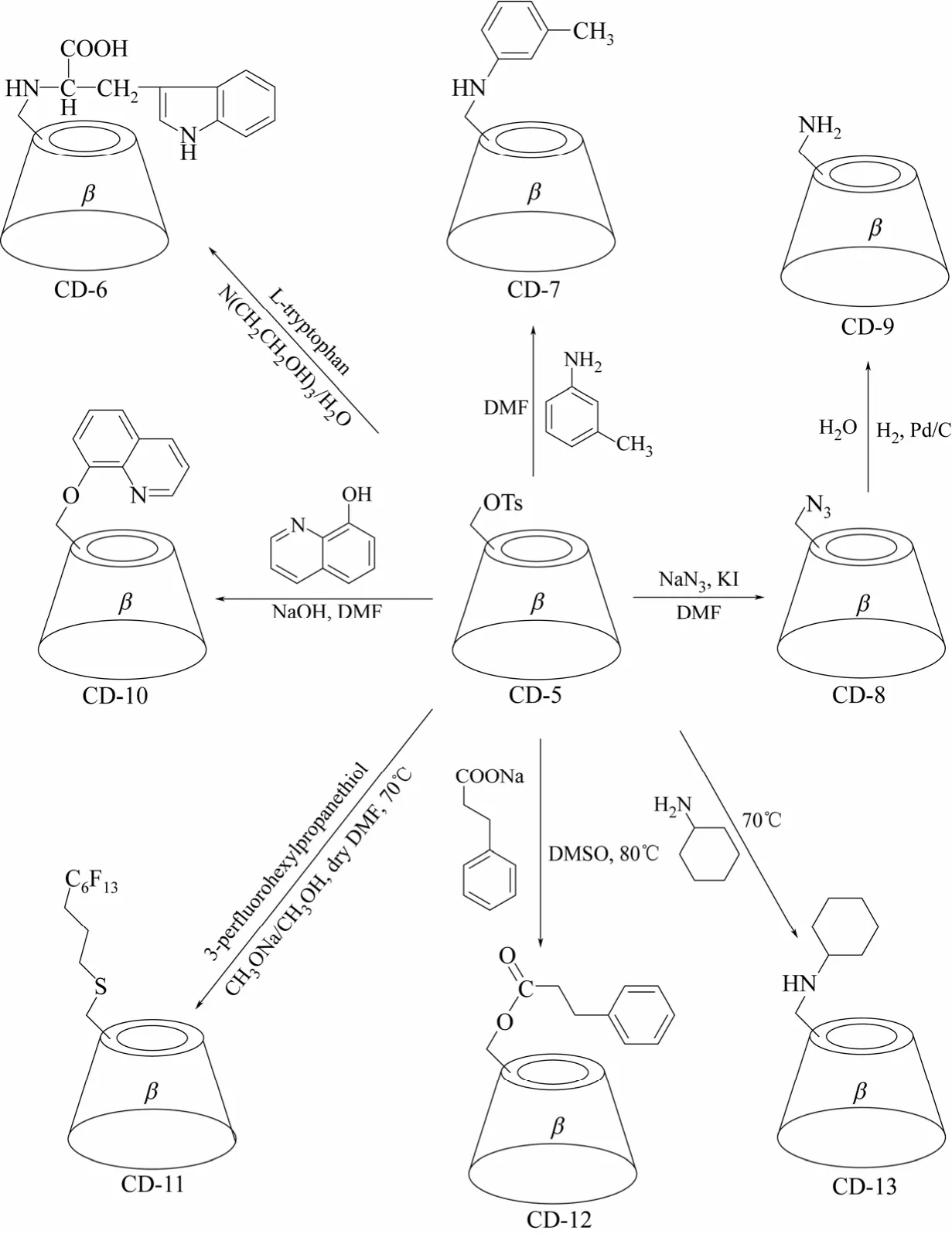
图4 β-环糊精衍生物CD-5的衍生化
目前,单取代环糊精衍生物的修饰基团大多集中在环糊精母体的C-6位置,修饰基团位于C-2和C-3位置的单取代环糊精衍生物相对较少,其合成过程同样需要首先将环糊精母体中的羟基活化。以二丁基氧化锡(Bu2SnO)为催化剂,p-甲苯磺酰氯可高选择性地将β-环糊精C-2位置上的羟基单酯化,生成β-环糊精衍生物CD-17,经亲核取代反应,可向β-环糊精母体的C-2位置引入各种目标修饰基团,构筑β-环糊精衍生物,如CD-18和CD-19(图7 Equ. 4所示)[44]。β-环糊精衍生物CD-17在碱性条件下可于β-环糊精同一个D-(+)-吡喃葡萄糖单元上发生2,3-环氧化,生成β-环糊精衍生物CD-20,进一步与各种亲核试剂发生开环加成反应,可将修饰基团引入到β-环糊精母体的C-3位置,如β-环糊精衍生物CD-21的合成(图8 Equ. 5所示)[45]。尽管环糊精分子结构中具有众多羟基,但无论是对C-2、C-3还是C-6位置上的羟基,均可实现高选择性的化学修饰,进而构筑各种单取代环糊精衍生物。单取代环糊精衍生物,主要是单取代β-环糊精衍生物,在目前基于环糊精构筑人工合成酶和人工合成金属酶的水溶性配体中占有较大的比例,其合成方法的研究也较为全面。
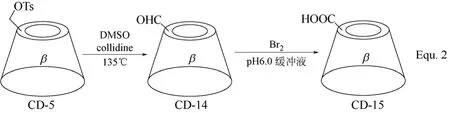
图5 β-环糊精衍生物CD-14和CD-15的合成
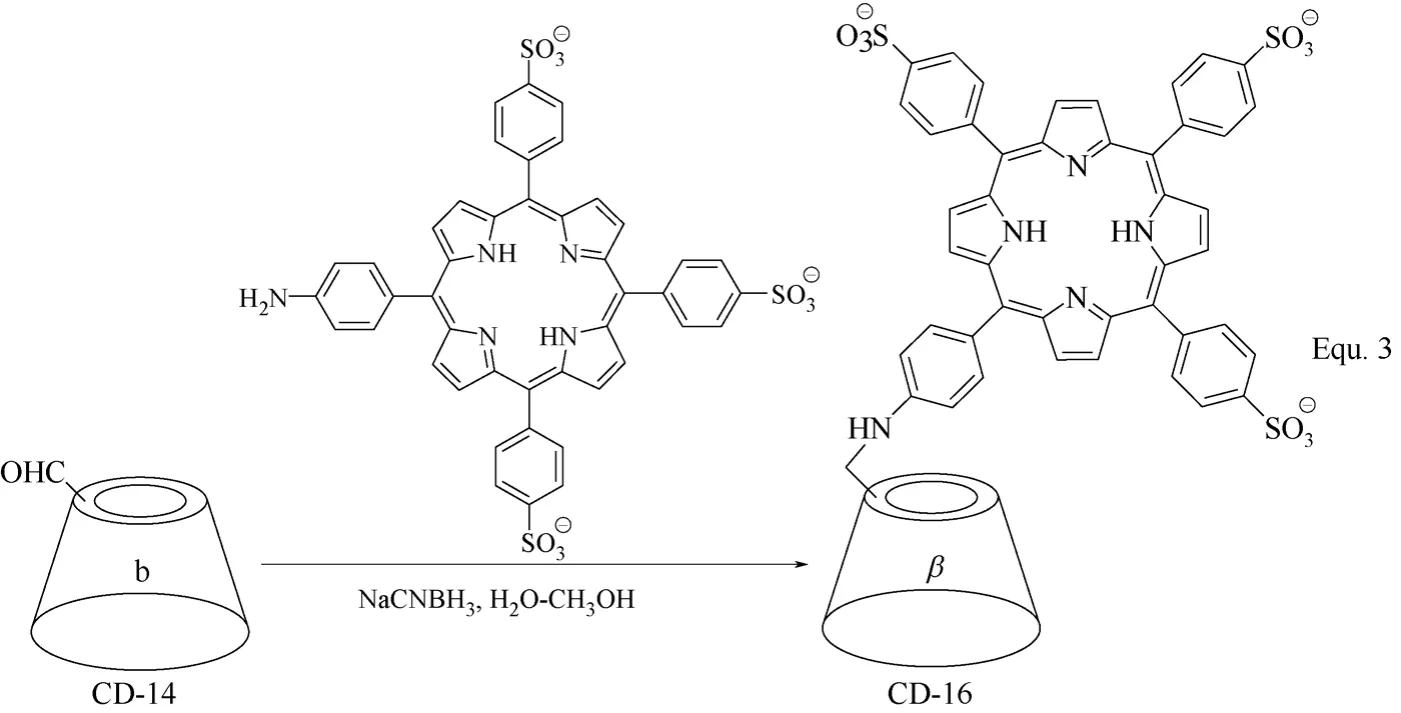
图6 β-环糊精衍生物CD-16的合成
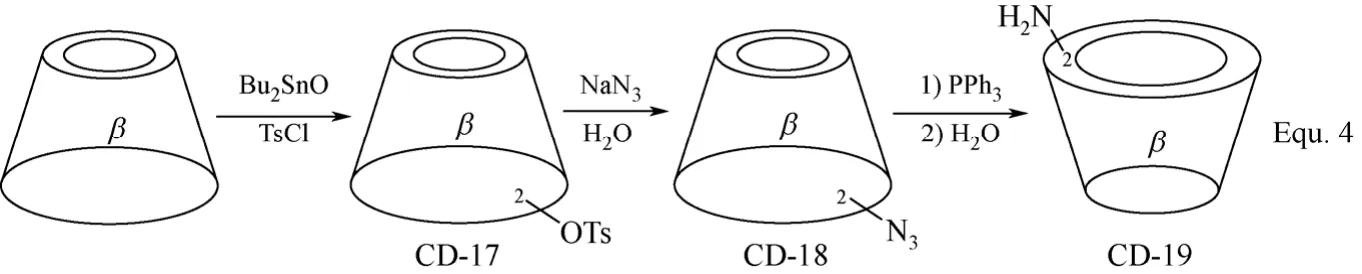
图7 β-环糊精衍生物CD-17、CD-18和CD-19的合成
2 双取代环糊精衍生物
双取代环糊精衍生物主要是指分子结构中含有一个环糊精单元,并且环糊精母体中的两个羟基被取代得到的环糊精衍生物,环糊精母体可以是α-环糊精,也可以是β-环糊精和γ-环糊精,修饰基团的取代位置基本以环糊精的C-6位置为主。两个修饰基团可以相同,也可以不同,还可以是桥状的修饰基团,可以位于环糊精相邻的两个D-(+)-吡喃葡萄糖单元上,也可以位于不相邻的两个D-(+)-吡喃葡萄糖单元上。如果将组成α-环糊精、β-环糊精和γ-环糊精的D-(+)-吡喃葡萄糖单元分别以A~F、A~G和A~H表示,则两个取代基分别位于环糊精A、D两个D-(+)-吡喃葡萄糖单元上的双取代环糊精衍生物居多。如图9所示,α-环糊精衍生物CD-22[46]中,位于A、D两个D-(+)-吡喃葡萄糖单元上的修饰基团相同;而α-环糊精衍生物CD-23[46]中,位于A、D两个D-(+)-吡喃葡萄糖单元上的修饰基团不同。而在β-环糊精衍生物CD-24[47]中,具有桥状结构的修饰基团分别连于β-环糊精A、D两个D-(+)-吡喃葡萄糖单元上,在γ-环糊精衍生物CD-25[48]中,两个修饰基团不仅可以位于A、D两个D-(+)-吡喃葡萄糖单元上,也可以位于A、B,A、C和A、E两个D-(+)-吡喃葡萄糖单元上。通过控制和调节修饰基团在环糊精上的取代位置,可以得到性能各异的环糊精衍生物,满足各种应用需求[49-51]。
双取代环糊精衍生物的合成主要是对环糊精分子结构中的两个羟基进行选择性地化学修饰,两个羟基基本位于环糊精的同一面,并且双取代环糊精衍生物以β-环糊精衍生物为主,以修饰基团位于β-环糊精母体的第一面居多,其合成策略主要有两种。其一是以芳香族磺酰氯对β-环糊精C-6位置上的两个羟基进行选择性的酯化活化,以A~G代表β-环糊精母体中的7个D-(+)-吡喃葡萄糖单元,则由于所用酯化试剂的不同,活化的两个羟基可分别位于β-环糊精母体上A、B,A、C和A、D两个D-(+)-吡喃葡萄糖单元上,如图10 Equ. 6所示[52-54]。以所得β-环糊精衍生物CD-26为基础,与单取代β-环糊精衍生物的合成相似,可以进行一系列的化学转化,构筑新的β-环糊精衍生物,如图11 Equ. 7和图12 Equ. 8所示[36,42]。
双取代环糊精衍生物合成的另一策略是以全苄基化环糊精的选择性脱苄基化为基础,以二异丁基氢化铝(i-Bu2AlH)催化全苄基化环糊精脱苄基,无论是全苄基化α-环糊精、β-环糊精,还是γ-环糊精,均可选择性地使全苄基化α-环糊精、β-环糊精和γ-环糊精A、D两个D-(+)-吡喃葡萄糖单元C-6羟基上的苄基脱除(图13 Equ. 9所示)[55]。在环糊精衍生物CD-32中,只有两个等同的羟基,可以方便地对其进行各种化学转化,并且完成化学转化后,其余的苄基可以方便地脱除,进而构筑新的环糊精衍生物,如具有桥状修饰基团的α-环糊精衍生物CD-34的合成(图14 Equ. 10所示)[55]和双取代β-环糊精衍生物CD-37的合成(图15 Equ. 11所示)[56]。其中Equ. 11比较有代表性地表示出该合成策略的一般流程,首先将β-环糊精的羟基全部苄基化,然后由二异丁基氢化铝(i-Bu2AlH)催化选择性脱苄基,得到的两个C-6羟基通过适当的化学转化构筑需要的目标修饰基团,最后在Pd/C和H2的存在下将其余的苄基脱除,得到目标β-环糊精衍生物。双取代环糊精衍生物作为人工合成酶或人工合成金属酶的水溶性配体催化有机合成反应时,两个修饰基团往往具有协同作用,可以显著提高催化反应的反应速率和区域选择性,甚至反应的对映选择性。
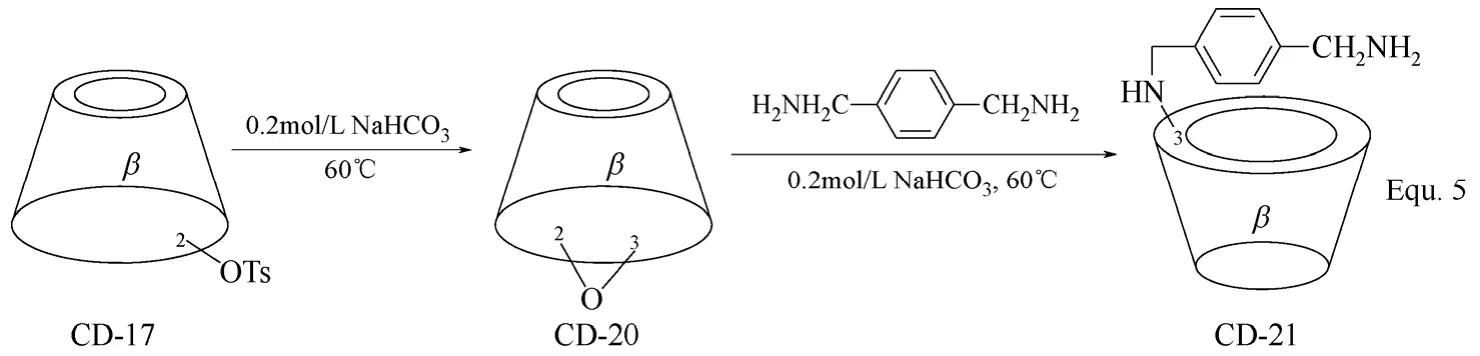
图8 β-环糊精衍生物CD-20和CD-21的合成
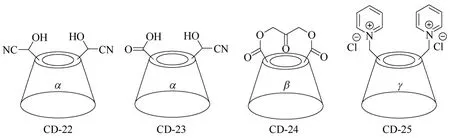
图9 β-环糊精衍生物CD-22~CD-25的结构式
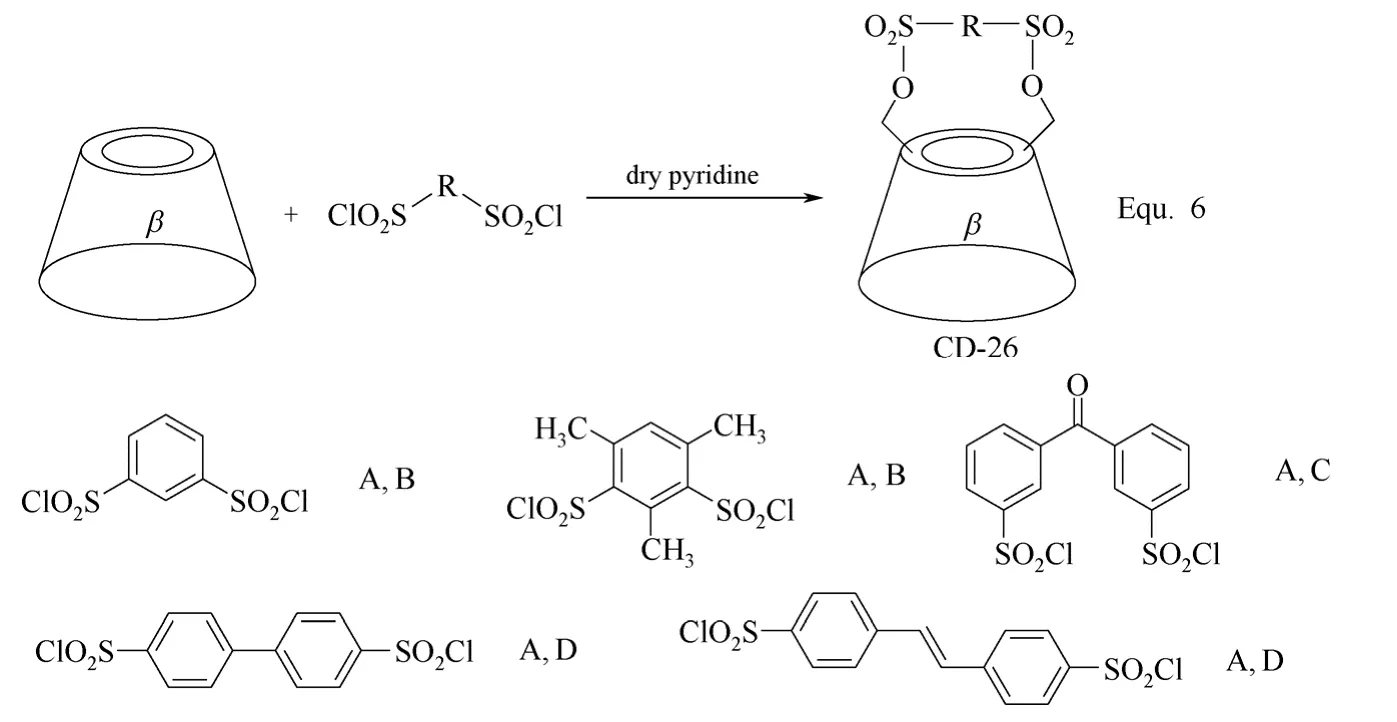
图10 β-环糊精衍生物CD-26的合成
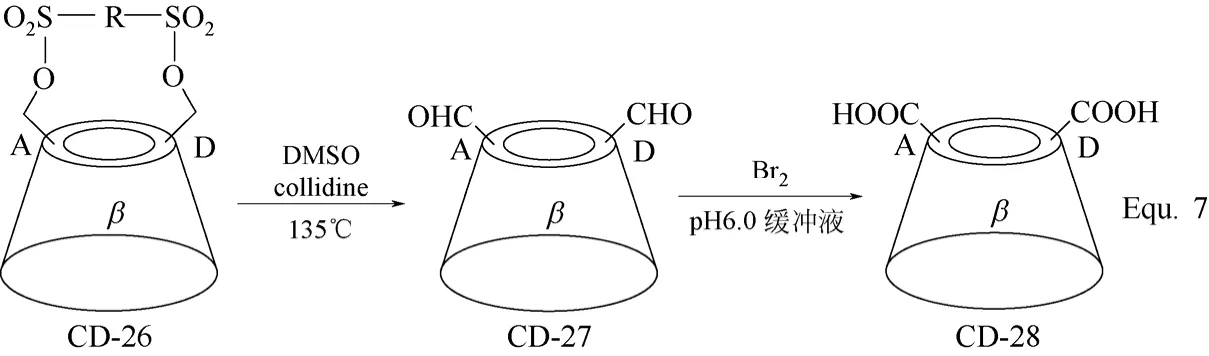
图11 β-环糊精衍生物CD-27和CD-28的合成
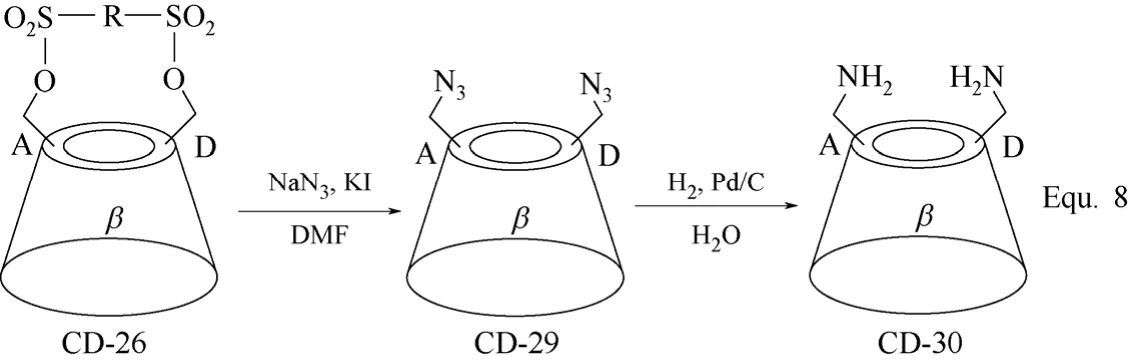
图12 β-环糊精衍生物CD-29和CD-30的合成
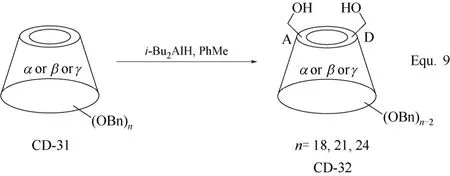
图13 环糊精衍生物CD-32的合成
3 多取代环糊精衍生物
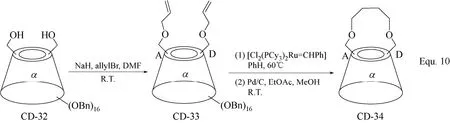
图14 α-环糊精衍生物CD-33和CD-34的合成
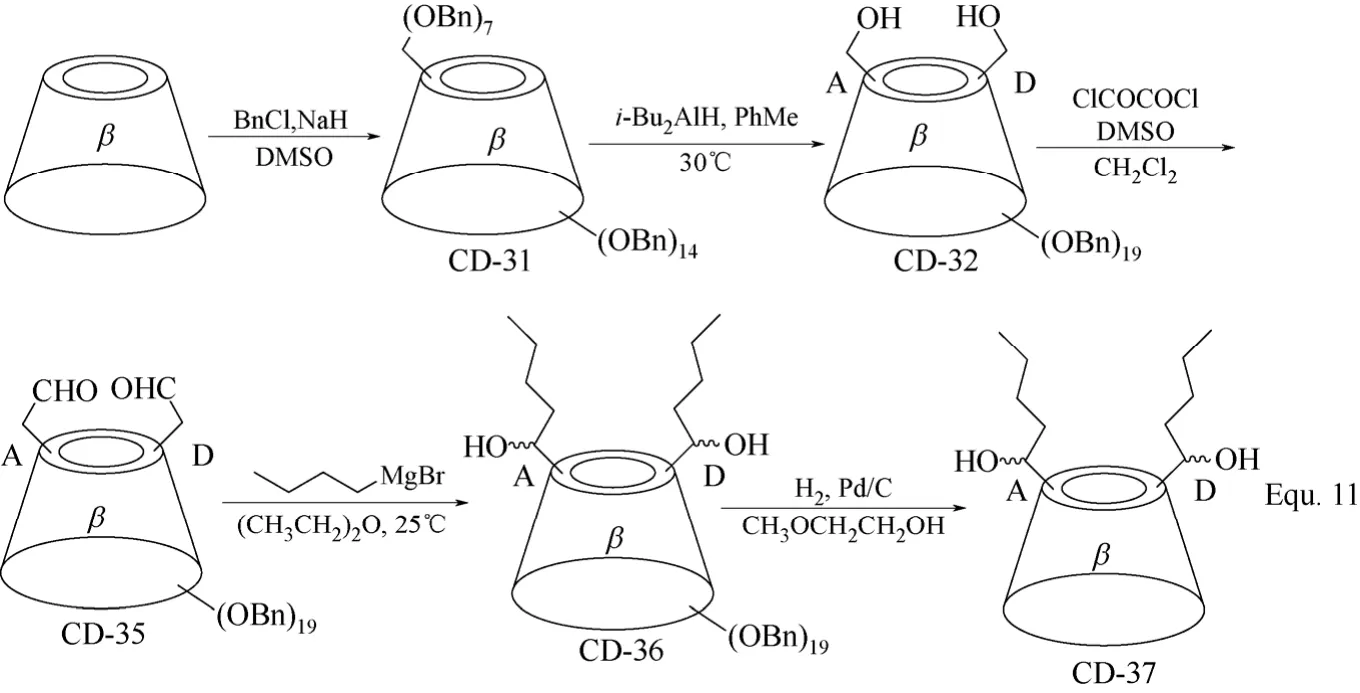
图15 β-环糊精衍生物CD-31、CD-32、CD-35、CD-36和CD-37的合成
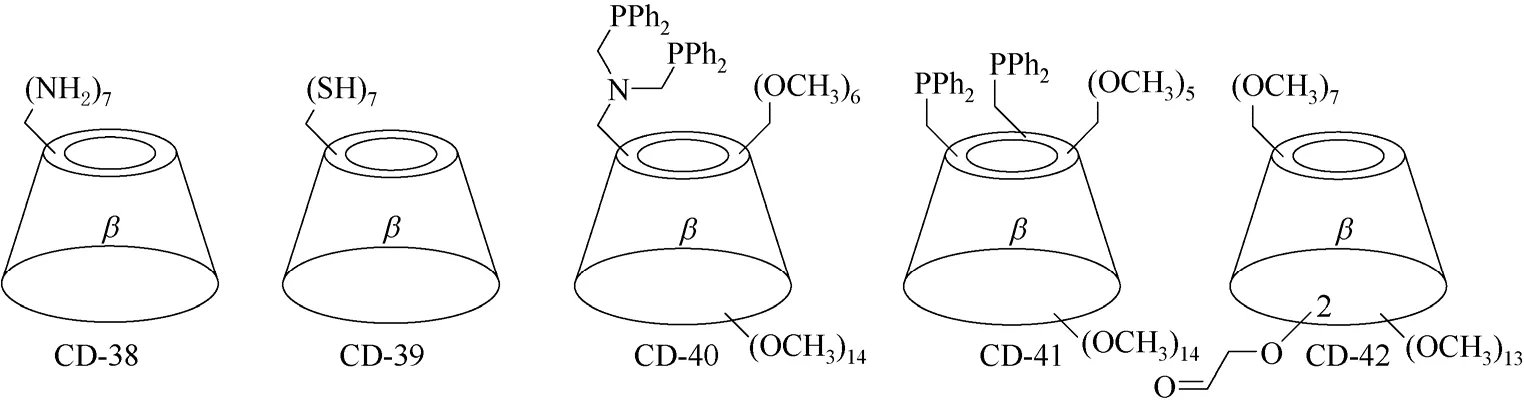
图16 β-环糊精衍生物CD-38~CD-42的结构式
多取代环糊精衍生物主要是指分子结构中含有一个环糊精单元,并且环糊精母体中的多个羟基被取代得到的环糊精衍生物,环糊精母体可以是α-环糊精,也可以是β-环糊精和γ-环糊精,修饰基团的取代位置可以全部是环糊精的C-6位置,也可以同时分布在环糊精的第一面和第二面,修饰基团的数目可以是确定的,也可能是一个范围。如图16 所示β-环糊精衍生物CD-38[57-58]和CD-39[59]中,修饰基团全部位于β-环糊精母体的第一面,修饰基团的数目为确定数字。在β-环糊精衍生物CD-40[60]、CD-41[61]和CD-42[62]中,修饰基团同时位于β-环糊精母体的第一面和第二面,修饰基团的数目也为确定数字。而在常见的环糊精衍生物甲基化环糊精、羟丙基环糊精、羧甲基环糊精等中,修饰基团的位置虽然也可以同时位于环糊精的第一面和第二面,但每个环糊精衍生物分子中,修饰基团的数目不一定相同,修饰基团的数目为一个范围,称为环糊精衍生物的取代度。这类修饰基团位置不确定,数目为一个范围的环糊精衍生物合成方法相对比较简单,反应条件的控制不需要十分严格,目前来源较丰富,大规模应用较多。
多取代环糊精衍生物的合成主要是针对环糊精分子结构中三类羟基具有不同的反应活性,选择性的对其中的一类或两类,甚至全部进行化学修饰,合成环糊精衍生物,其合成策略同样需要将环糊精分子结构中的羟基进行选择性的活化或保护。环糊精分子结构中C-6羟基具有较高的反应活性,三苯基膦(PPh3)催化碘(I2)对环糊精C-6羟基的全取代和甲磺酰氯(CH3SO2Cl)对环糊精C-6羟基的全酯化,均可选择性地将环糊精C-6位置上的羟基全部活化,而保持C-2和C-3位置上的羟基不发生变化,进而向环糊精的C-6位置引进各种修饰基团,得到C-6位置羟基被全部取代的多取代环糊精衍生物,如图17 Equ. 12[41]和图18 Equ. 13[63]所示。
环糊精分子结构中的C-6羟基除了选择性活化外,也可以进行选择性地保护,从而实现对环糊精分子结构中反应活性相对较差的C-2和C-3羟基的修饰,修饰完成后,C-6位置的修饰基团可以通过适当的化学转化脱除。二甲基t-丁基氯化硅(t-BuMe2SiCl)是目前环糊精,尤其是β-环糊精C-6羟基选择性保护常用的试剂。如图19 Equ. 14[64]所示,以二甲基t-丁基氯化硅(t-BuMe2SiCl)对β-环糊精C-6羟基进行保护,从而实现对β-环糊精C-2和C-3羟基的选择性修饰。在四丁基氟化铵(Bu4NF)存在下,经二甲基t-丁基氯化硅(t-BuMe2SiCl)修饰的β-环糊精C-6羟基实现脱保护,得到C-2和C-3羟基选择性修饰的β-环糊精衍生物CD-50。经二甲基t-丁基氯化硅(t-BuMe2SiCl)保护的β-环糊精C-6羟基不仅可以通过脱保护还原,也可以进行进一步的化学转化,向β-环糊精的C-6位置引入新的官能团,得到分子结构中羟基被全部取代的β-环糊精衍生物,如图20 Equ. 15[65-66]所示。
另外,也有一些多取代环糊精衍生物如羟丙基β-环糊精、甲基化β-环糊精、羧甲基化β-环糊精等,其分子结构中取代基的取代位置和取代数目不确定,取代度为一个范围,其合成过程大多在碱性条件下,使环糊精分子结构中的羟基转变为亲核性很强的氧负离子,进而同各种亲电试剂发生反应,合成多取代环糊精衍生物。该类多取代环糊精衍生物合成过程相对简单,反应条件的控制也不需要十分严格。
4 二聚体环糊精衍生物
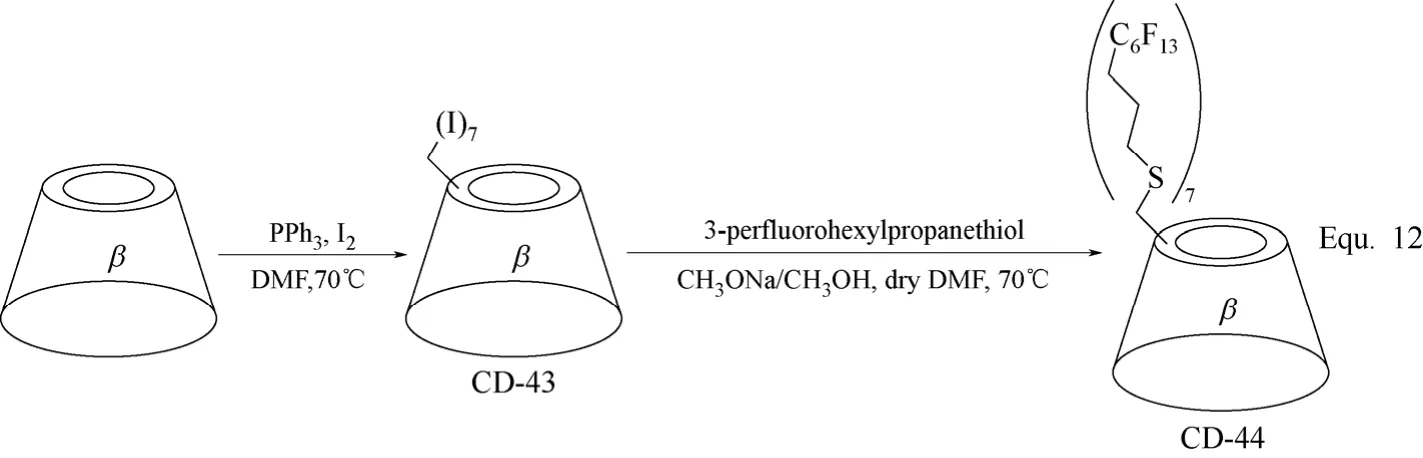
图17 β-环糊精衍生物CD-43和CD-44的合成
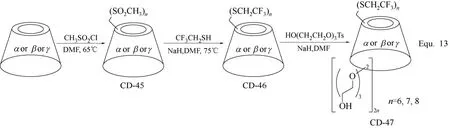
图18 环糊精衍生物CD-45、CD-46和CD-47的合成
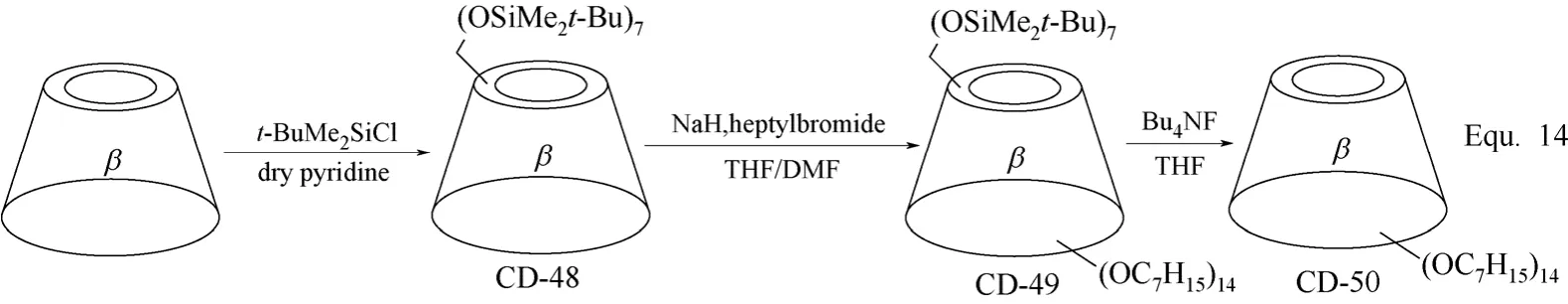
图19 β-环糊精衍生物CD-48、CD-49和CD-50的合成
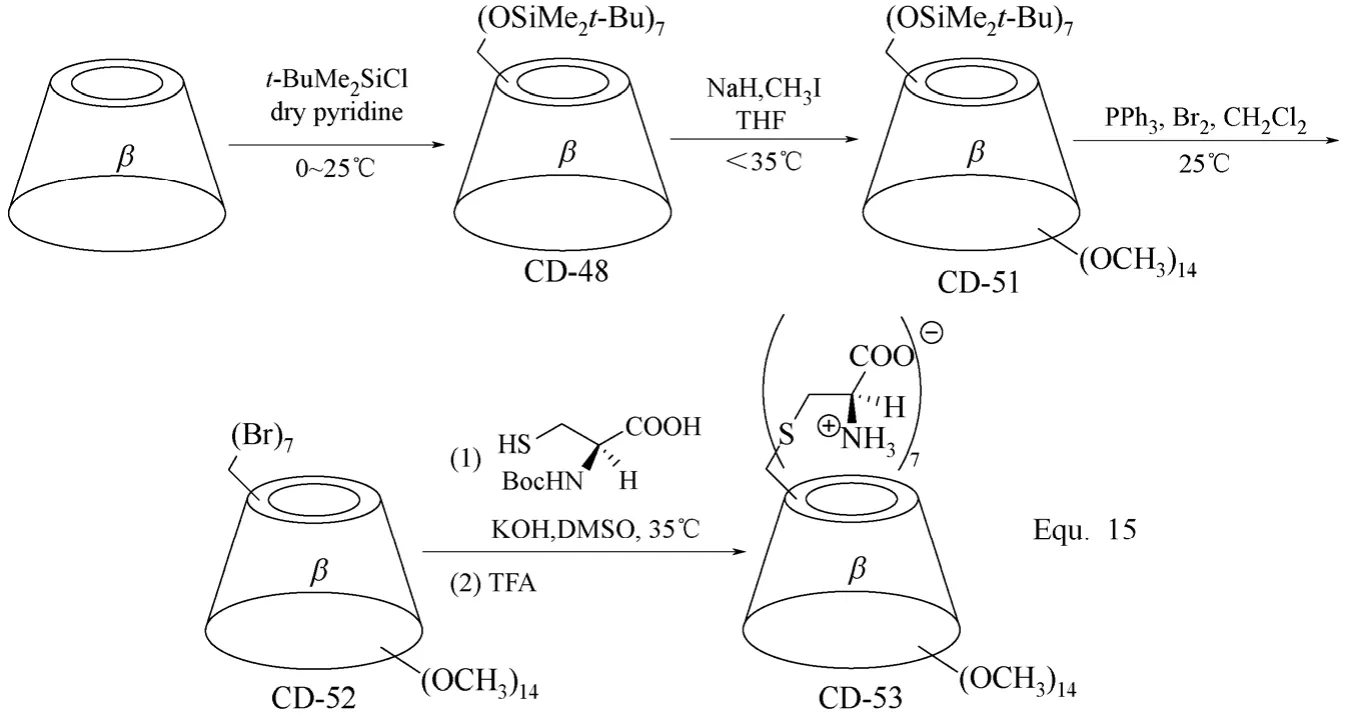
图20 β-环糊精衍生物CD-48、CD-51、CD-52和CD-53的合成
二聚体环糊精衍生物主要是指分子结构中含有两个环糊精单元的环糊精衍生物,目前报道的二聚体环糊精衍生物主要是β-环糊精二聚体,起连接作用的修饰基团可以连接在两个β-环糊精单元的C-6位置,也可以连接在两个β-环糊精单元的C-2位置,也有修饰基团一端连接在β-环糊精单元的C-6位置,一端连接在β-环糊精单元的C-2位置的二聚体环糊精衍生物。如图21所示,β-环糊精二聚体CD-54[67]中,修饰基团的两端分别连接在两个β-环糊精单元的C-6位置,形成β-环糊精二聚体;β-环糊精二聚体CD-55[68]中,修饰基团的两端分别连接在两个β-环糊精单元的C-2位置,形成β-环糊精二聚体;而在β-环糊精二聚体CD-56[69]中,修饰基团一端连接在β-环糊精单元的C-6位置,一端连接在β-环糊精单元的C-2位置,形成环糊精二聚体。二聚体环糊精衍生物参与有机合成反应,由于具有两个包结部位,与底物形成包结络合物后对底物具有一定的拉伸作用,并将底物的反应部位固定在催化活性中心附近,往往可以显著提高催化反应的反应速率及区域选择性[70-74]。
二聚体环糊精衍生物的合成主要是以具有双反应官能团的化合物为连接基团,将两个环糊精单元连接起来,两个环糊精单元基本为价廉易得的β-环糊精单元,并且其分子结构中的一个羟基基本已经过适当的化学转化,转化为反应活性更高的反应基团。如β-环糊精二聚体CD-57[75](图22所示)和CD-59[76-77](图23所示)的合成。如果单取代环糊精衍生物的修饰基团可以进行二聚反应,也可以以单取代环糊精衍生物为单体,通过二聚反应合成二聚体环糊精衍生物。如图24 Equ. 18[78]所示,在H2O2存在下,单(6-巯基-6-脱氧)-β-环糊精发生二聚反应,生成β-环糊精二聚体CD-61。
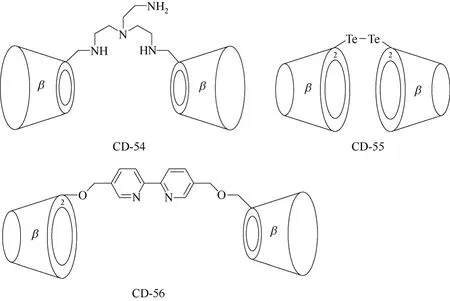
图21 β-环糊精衍生物CD-54~CD-56的结构式
在一定程度上,二聚体环糊精衍生物的合成与单取代环糊精衍生物的合成大体相似,区别主要是二聚体环糊精衍生物的修饰基团需要同时具有两个可以与环糊精单元进行反应的官能团,并且两个官能团必须分别同两个环糊精单元发生反应,构筑环糊精二聚体。二聚体环糊精衍生物分子结构中具有两个环糊精单元,作为人工合成酶或人工合成金属酶的水溶性配体参与有机合成反应,对反应底物具有更加优异的包结性能,对有机合成反应的促进和调控性能更佳[17-18]。
5 多聚体环糊精衍生物
多聚体环糊精衍生物主要是指分子结构中含有3个或4个环糊精单元的环糊精衍生物,该类环糊精衍生物相对较少,如β-环糊精衍生物CD-62[79](图25所示)、环糊精衍生物CD-63[80](图26所示)、β-环糊精衍生物CD-64[81](图27所示)和CD-65[82](图28所示),主要用于构筑基于环糊精的超分子仿生催化剂,由多个环糊精单元模拟自然界中存在的天然酶的疏水性口袋。通过多个环糊精单元与底物形成包结络合物,精确控制底物与催化活性中心的相对空间几何位置,实现高选择性的化学转化过程,进而研究模拟生物体内高选择性有机转化过程的转化机理。但是多聚体环糊精衍生物合成较难,目标产物收率低,副产物多,报道相对较少,基本停留在理论研究阶段。
多聚体环糊精衍生物的合成与二聚体环糊精衍生物的合成相似,主要策略就是以合适的修饰基团将3个或3个以上的环糊精单元连接起来,构筑目标环糊精衍生物。为了提高反应活性,环糊精单元的羟基往往被转化为反应活性更高的修饰基团,如β-环糊精三聚体CD-67[83](图29所示)和β-环糊精四聚体CD-69和CD-70[84](图30所示)的合成。 “Click”化学反应在环糊精衍生物合成中的应用,为多聚体环糊精衍生物的合成提供了更多便利,如Equ. 21中α-环糊精五聚体CD-75的合成[85](图31所示),通过炔基与叠氮基的1,3-偶极环加成反应, 顺利将5个α-环糊精单元连接在一起,并且该多聚体环糊精衍生物还具有可进一步反应的活化基团 —OMs,可进一步通过同样的反应增加α-环糊精单元的数目。
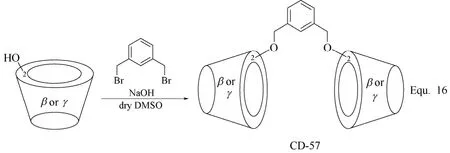
图22 环糊精衍生物CD-57的合成
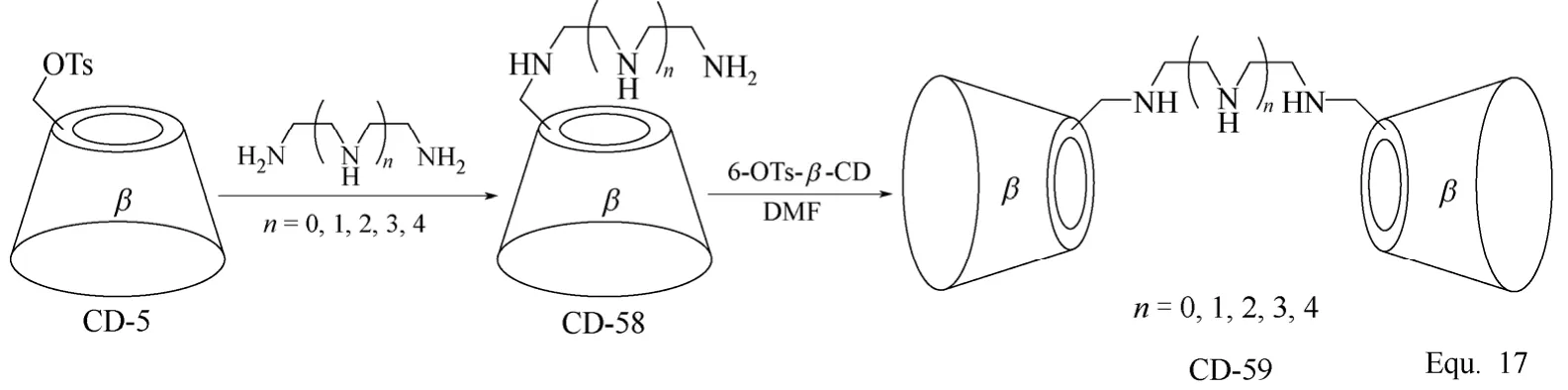
图23 β-环糊精衍生物CD-58和CD-59的合成
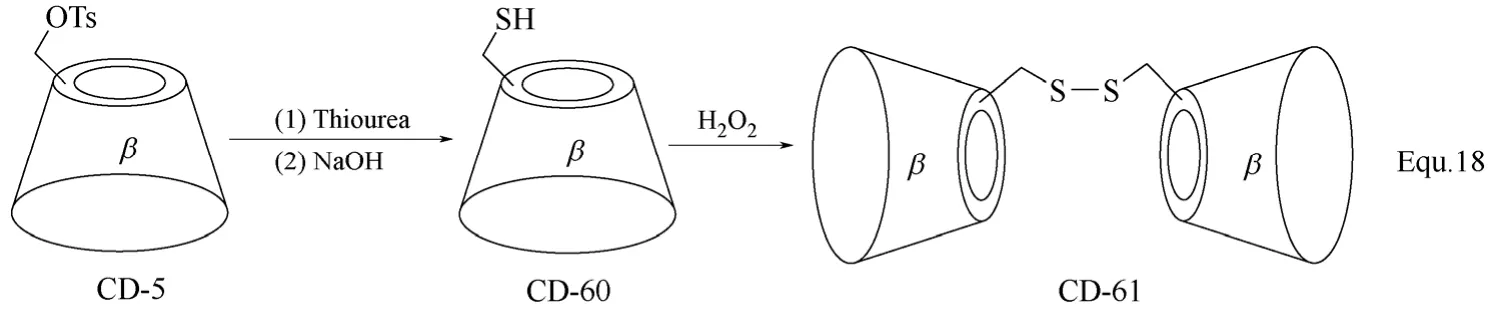
图24 β-环糊精衍生物CD-60和CD-61的合成
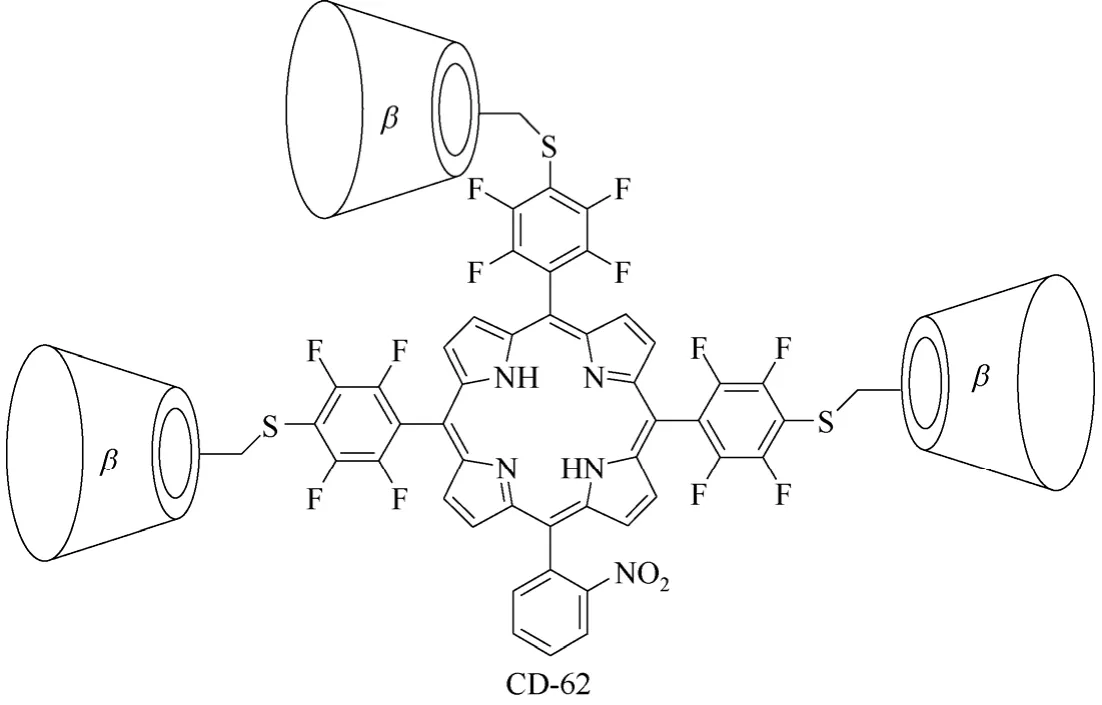
图25 β-环糊精衍生物CD-62的结构式
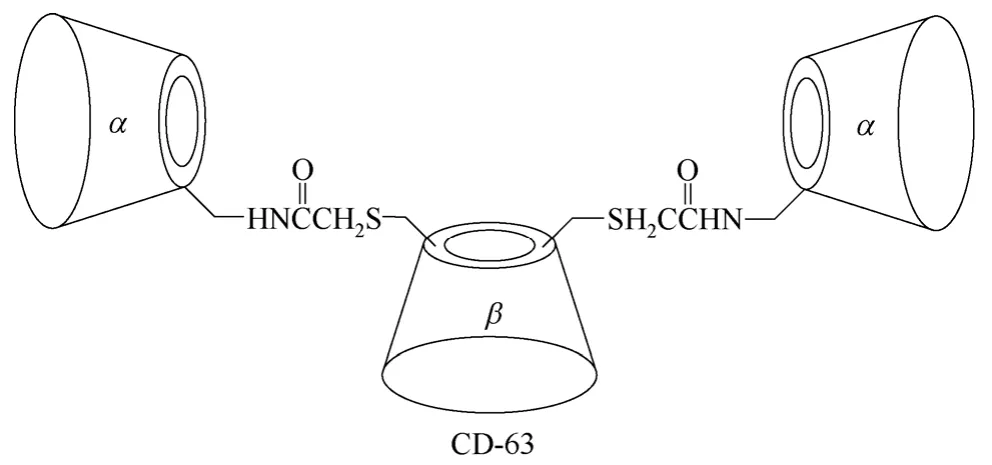
图26 β-环糊精衍生物CD-63的结构式
6 环糊精聚合物(包括固载化环糊精)
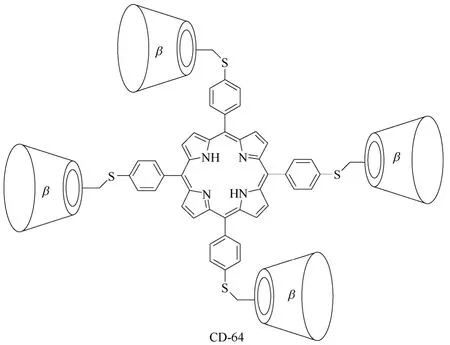
图27 β-环糊精衍生物CD-64的结构式
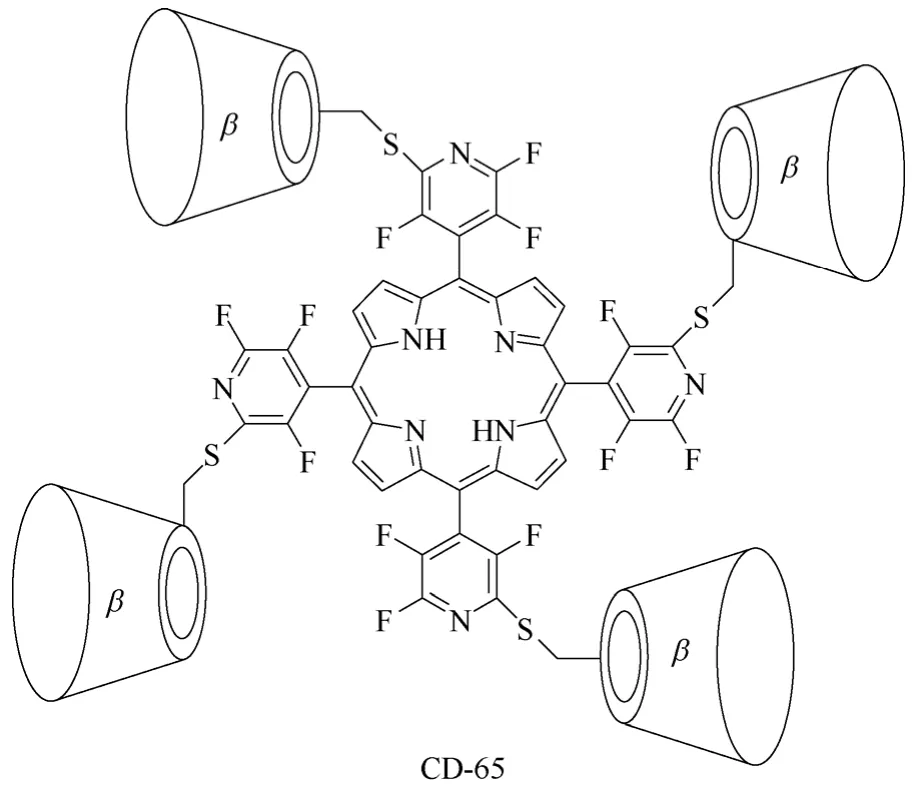
图28 β-环糊精衍生物CD-65的结构式
环糊精聚合物(包括固载化环糊精)主要是指环糊精母体分子与交联试剂交联共聚而成的高分子化合物和将环糊精分子固载在有机或无机载体上形成的高分子化合物,所用交联试剂主要是3-氯-1,2-环氧丙烷、甲苯-2,4-二异氰酸酯、甲苯-2,6-二异氰酸酯、1,2-乙二醇二环氧甘油醚、1,4-丁二醇二环氧甘油醚、六亚甲基-1,6-二异氰酸酯等一系列双官能团试剂。用于固载环糊精的载体可以是纤维素、壳聚糖等一系列天然高分子化合物,也可以是涤纶、锦纶、腈纶等一系列合成纤维,还可以是一些无机材料,如多孔硅[86-87]、四氧化三铁[88-89]等。与环糊精交联聚合物相比,通过固载技术得到的环糊精聚合物中,环糊精单元的含量相对偏低,但无论是环糊精通过交联试剂形成的环糊精聚合物,还是将环糊精固载在适当的载体上,都需尽量保持环糊精的性质不发生大的变化,尤其是其“内腔疏水,外壁亲水”的空腔结构需要保留。环糊精形成聚合物后,无论其在水中还是在有机溶剂中的溶解性均降低,有利于其从使用体系中分离出来,重复使用,大规模应用前景较好。
至于环糊精聚合物(包括固载化环糊精)的合成,主要是以适当的交联试剂与环糊精母体进行交联或将环糊精单元通过适当的连接基团连接到有机或无机高分子载体上。无论是环糊精交联聚合物的合成还是固载化环糊精的制备,目前均已有相关的综述性文献报道[90-93],这里不再赘述。
7 结语与展望
环糊精来源于可再生资源,无毒,可生物降解,并且具有“内腔疏水,外壁亲水”的特殊结构和性质,已成为构筑各种功能材料的优良结构单元,尤其是超分子仿酶的构筑,借助环糊精的疏水空腔模拟酶的疏水性口袋,对有机底物进行包结络合,将有机合成反应从有机相转移到水相,并提高反应的反应速率,区域选择性,甚至对映选择性。本综述结合作者本人基于β-环糊精构筑超分子仿酶的研 究[17-22],根据目前环糊精衍生物分子结构形态的不同,对环糊精衍生物进行了合理的分类,并对其构筑策略进行了系统介绍,旨在全面开启基于环糊精构筑可有效调控水相不对称反应以及易于回收的超分子仿酶的系统研究。以可再生资源构筑超分子仿酶,于水相中高选择性开展有机合成反应,不仅完全符合“绿色化学”理念,对化学工业的“绿色化”发展具有重要的推动作用,并且基于环糊精构筑的高效超分子仿酶还可以帮助人们模拟了解生命体中各种化学转化的具体过程,对生命科学的研究也具有重要的指导作用。鉴于环糊精衍生物的构筑是上述超分子仿酶及其他功能材料构筑的基础及必要步骤,对目前环糊精衍生物进行比较合理的分类并全面详细地介绍其构筑策略,对化学工业的“绿色化”发展及深入了解生命科学中的各种化学转化具有重要的参考价值和指导意义,对其他功能材料的构筑也具有重要的指导意义。基于环糊精构筑可有效调控水相不对称反应,并且易于回收的超分子仿酶,是今后实现化学工业“绿色化”发展的重要研究方向之一。
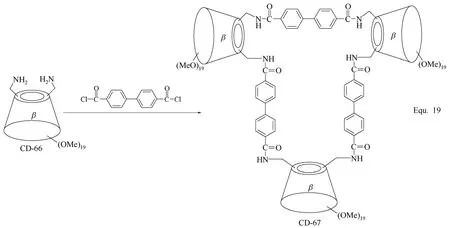
图29 β-环糊精衍生物CD-67的合成
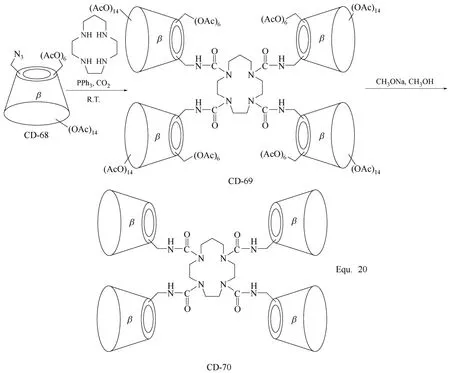
图30 β-环糊精衍生物CD-69和CD-70的合成
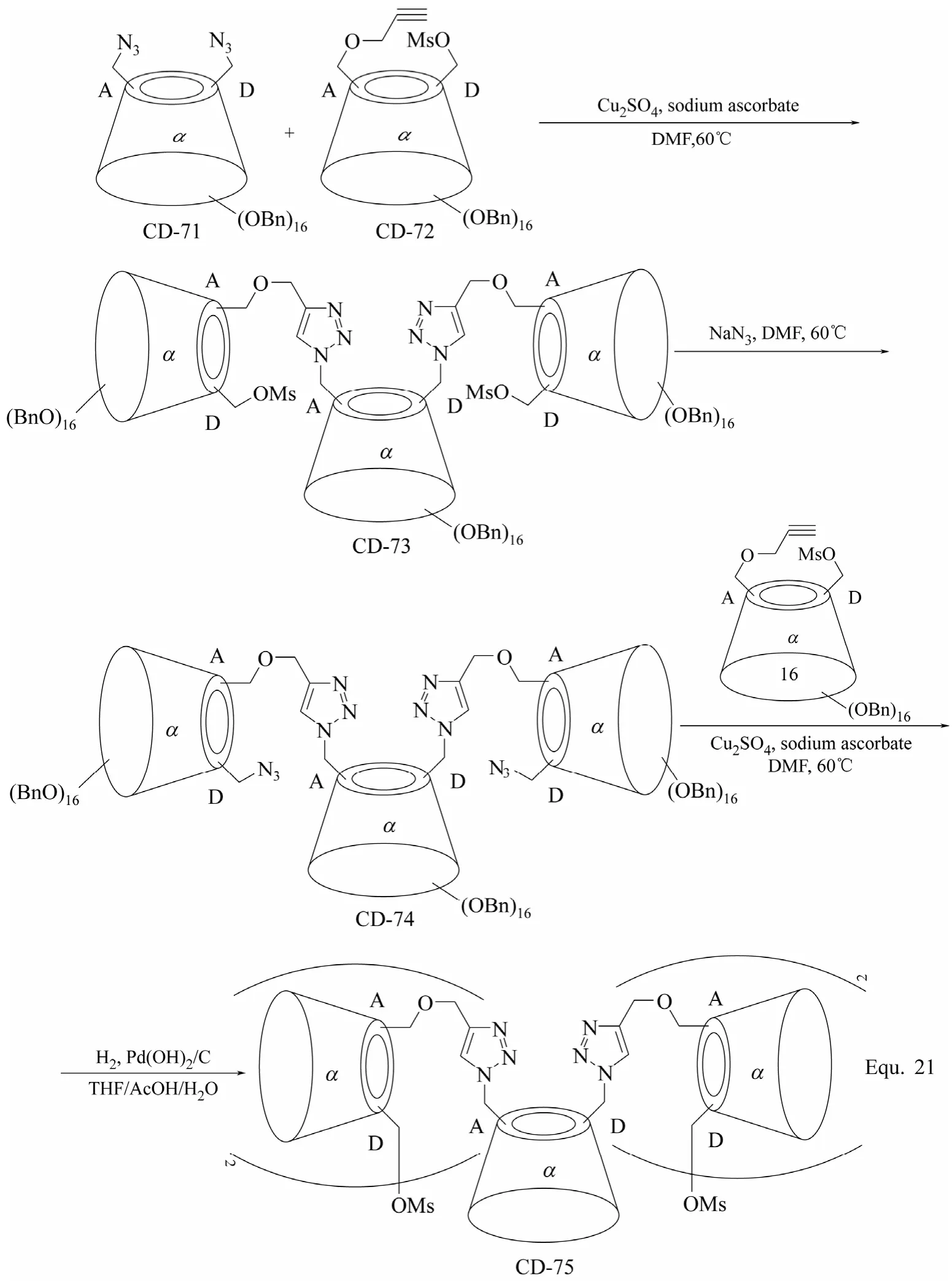
图31 α-环糊精衍生物CD-73、CD-74和CD-75的合成
[1] Szejtli J. Introduction and general overview of cyclodextrin chemistry[J].Chemical Reviews,1998,98(5):1743-1753.
[2] Sallas F,Darcy R. Amphiphilic cyclodextrins:Advances in synthesis and supramolecular chemistry[J].European Journal of Organic Chemistry,2008(6):957-969.
[3] Flaherty R J,Nshime B,De La Marre M,et al. Cyclodextrins as complexation and extraction agents for pesticides from contaminated soil[J].Chemosphere,2013,91(7):912-920.
[4] Liu H H,Cai X Y,Chen J W. Mathematical model for cyclodextrin alteration of bioavailability of organic pollutants[J].EnvironmentalScience & Technology,2013,47(11):5835-5842.
[5] Sanchez-Trujillo M A,Lacorte S,Villaverde J,et al. Decontamination of polycyclic aromatic hydrocarbons and nonylphenol from sewage sludge using hydroxypropyl-beta-cyclodextrin and evaluation of the toxicity of leachates[J].Environmental Science and Pollution Research,2014,21(1):507-517.
[6] Takahashi K. Organic reactions mediated by cyclodextrins[J].Chemical Reviews,1998,98(5):2013-2033.
[7] 纪红兵,黄丽泉,石东坡,等.β-环糊精超分子催化剂用于液相有机合成[J].有机化学,2008,28(12):2072-2080.
[8] Bricout H,Hapiot F,Ponchel A,et al. Cyclodextrins as mass transfer additives in aqueous organometallic catalysis[J].Current Organic Chemistry,2010,14(13):1296-1307.
[9] Kakran M,Sahoo N G,Li L,et al. Dissolution enhancement of artemisinin with beta-cyclodextrin[J].Chemical & Pharmaceutical Bulletin,2011,59(5):646-652.
[10] Dong L N,Liu M,Chen A J,et al. Solubilities of quercetin in three beta-cyclodextrin derivative solutions at different temperatures[J].Journal of Molecular Liquids,2013,177:204-208.
[11] He J,Chipot C,Shao X G,et al. Cyclodextrin-mediated recruitment and delivery of amphotericin B[J].Journal of Physical Chemistry C, 2013,117(22):11750-11756.
[12] Khan A R,Forgo P,Stine K J,et al. Methods for selective modifications of cyclodextrins[J].Chemical Reviews,1998,98(5):1977-1996.
[13] Engeldinger E,Armspach D,Matt D. Capped cyclodextrins[J].Chemical Reviews,2003,103(11):4147-4173.
[14] Bellia F,La Mendola D,Pedone C,et al. Selectively functionalized cyclodextrins and their metal complexes[J].Chemical Society Reviews,2009,38(9):2756-2781.
[15] Dong Z Y,Luo Q,Liu J Q. Artificial enzymes based on supramolecular scaffolds[J].Chemical Society Reviews,2012,41(23):7890-7908.
[16] Martinez A,Mellet C O,Fernandez J M G. Cyclodextrin-based multivalent glycodisplays:Covalent and supramolecular conjugates to assess carbohydrate-protein interactions[J].Chemical Society Reviews,2013,42(11):4746-4773.
[17] 沈海民,纪红兵.环糊精衍生物在液相有机合成中的应用[J].有机化学,2011,31(6):791-803.
[18] 沈海民,纪红兵.环糊精衍生物在金属催化有机合成中的应用[J].有机化学,2012,32(6):975-985.
[19] 沈海民,纪红兵.β-环糊精衍生物诱导Na2MoO4催化H2O2不对称氧化苯甲硫醚[J].有机化学,2012,32(9):1684-1689.
[20] Shen H M,Ji H B. Biomimetic asymmetric aldol reactions catalyzed by proline derivatives attached to beta-cyclodextrin in water[J].Tetrahedron Letters,2012,53(28):3541-3545.
[21] Shen H M,Ji H B. Amino alcohol-modified beta-cyclodextrin inducing biomimetic asymmetric oxidation of thioanisole in water[J].Carbohydrate Research,2012,354:49-58.
[22] Shen H M,Ji H B. Cyclodextrin-[RuCl2(Arene)]2conjugates:Another way to enhance the enantioselectivity of aromatic ketones reduction by aromatic ligands′ volume[J].Tetrahedron,2013,69(39):8360-8367.
[23] Chan W K,Yu W Y,Che C M,et al. A cyclodextrin-modified ketoester for stereoselective epoxidation of alkenes[J].Journal of Organic Chemistry,2003,68(17):6576-6582.
[24] Barr L,Easton C J,Lee K,et al. Metallocyclodextrin catalysts for hydrolysis of phosphate triesters[J].Tetrahedron Letters,2002,43(43):7797-7800.
[25] Masurier N,Estour F,Froment M T,et al. Synthesis of 2-substitutedβ-cyclodextrin derivatives with a hydrolytic activity against the organophosphorylester paraoxon[J].European Journal of Medicinal Chemistry,2005,40(7):615-623.
[26] Hamasaki K,Ueno A. Significant enantioselectivity in alanine ester hydrolysis catalyzed by imidazole attachedβ-cyclodextrins[J].Chemistry Letters,1995(9):859-860.
[27] Hu S S,Li J Y,Xiang J F,et al. Asymmetric supramolecular primary amine catalysis in aqueous buffer:Connections of selective recognition and asymmetric catalysis[J].Journal of the American Chemical Society,2010,132(20):7216-7228.
[28] Mojr V,Herzig V,Budesinsky M,et al. Flavin-cyclodextrin conjugates as catalysts of enantioselective sulfoxidations with hydrogen peroxide in aqueous media[J].Chemical Communications,2010,46(40):7599-7601.
[29] Mojr V,Budesinsky M,Cibulka R,et al. Alloxazine-cyclodextrin conjugates for organocatalytic enantioselective sulfoxidations[J].Organic & Biomolecular Chemistry,2011,9(21):7318-7326.
[30] Doyaguez E G,Fernandez-Mayoralas A. Proline-cyclodextrin conjugates:Synthesis and evaluation as catalysts for aldol reaction in water[J].Tetrahedron,2012,68(36):7345-7354.
[31] Zhang G F,Luan Y X,Han X W,et al. A palladium complex with functionalized beta-cyclodextrin:A promising catalyst featuring recognition abilities for Suzuki-Miyaura coupling reactions in water[J].Green Chemistry,2013,15(8):2081-2085.
[32] Petter R C,Salek J S,Sikorski C T,et al. Cooperative binding by aggregated mono-6-(alkylamino)-β-cyclodextrins[J].Journal of the American Chemical Society,1990,112(10):3860-3868.
[33] Shen B J,Tong L H,Jin D S. Synthesis and characterization of novel multifunctional host compounds. 1.β-Cyclodextrin derivative bearing diethanolamine moiety[J].Chinese Chemical Letters,1991,2(3):205-208.
[34] Brown S E,Coates J H,Coghlan D R,et al. Synthesis and properties of 6A-amino-6A-deoxy-α- and -β-cyclodextrin[J].Australian Journal of Chemistry,1993,46(6):953-958.
[35] Liu Y,Zhang Y M,Qi A D,et al. Molecular recognition study on a supramolecular system. 10. Inclusion complexation of modifiedβ-cyclodextrins with amino acids:Enhanced enantioselectivity for L/D-Leucine[J].Journal of Organic Chemistry,1997,62(6):1826-1830.
[36] Cotner E S,Smith P J. Phosphotyrosine binding by ammonium- and guanidinium-modified cyclodextrins[J].Journal of Organic Chemistry,1998,63(5):1737-1739.
[37] Liu Y,Han B H.,Li B,et al. Molecular recognition study on supramolecular system. 14. Synthesis of modified cyclodextrins and their inclusion complexation thermodynamics with l-tryptophan and some naphthalene derivatives[J].Journal of Organic Chemistry,1998,63(5):1444-1454.
[38] Liu Y,Han B H,Sun S X,et al. Molecular recognition study on supramolecular systems. 20. Molecular recognition and enantioselectivity of aliphatic alcohols by L-tryptophan-modifiedβ-cyclodextrin[J].Journal of Organic Chemistry,1999,64(5):1487-1493.
[39] Hoshino T,Miyauchi M,Kawaguchi Y,et al. Daisy chain necklace:Tri[2]rotaxane containing cyclodextrins[J].Journal of the American Chemical Society,2000,122(40):9876-9877.
[40] Liu Y,Kang S Z,Zhang H Y. Synthesis ofβ-cyclodextrin derivative bearing a cyclohexylamino moiety and its inclusion complexation with organic dye molecules[J].Microchemical Journal,2001,70(2):115-121.
[41] Peroche S,Parrot-Lopez H. Novel fluorinated amphiphilic cyclodextrin derivatives:Synthesis of mono-,di- and heptakis-(6- deoxy-6-perfluoroalkylthio)-β-cyclodextrins[J].Tetrahedron Letters,2003,44(2):241-245.
[42] Yoon J,Hong S,Martin K A,et al. A general method for the synthesis of cyclodextrinyl aldehydes and carboxylic acids[J].Journal of Organic Chemistry,1995,60(9):2792-2795.
[43] Carofiglio T,Fornasier R,Gennari G,et al. Synthesis and spectroscopic properties of a water - soluble porphyrin-modifiedβ-cyclodextrin compound[J].Tetrahedron Letters,1997,38(45):7919-7922.
[44] Muderawan I W,Ong T T,Lee T C,et al. A reliable synthesis of 2- and 6-amino-β-cyclodextrin and permethylated-β-cyclodextrin[J].Tetrahedron Letters,2005,46(46):7905-7907.
[45] Park K K,Kim Y S,Lee S Y,et al. Preparation and self-inclusion properties ofp-xylylenediamine-modified beta-cyclodextrins:Dependence on the side of modification[J].Journal of the Chemical Society,Perkin Transactions 2,2001(11):2114-2118.
[46] Ortega-Caballero F,Bols M. Cyclodextrin derivatives with cyanohydrin and carboxylate groups as artificial glycosidases[J].Canadian Journal of Chemistry,2006,84(4):650-658.
[47] Marinescu L,Molbach M,Rousseau C,et al. Supramolecular oxidation of anilines using hydrogen peroxide as stoichiometric oxidant[J].Journal of the American Chemical Society,2005,127(50):17578-17579.
[48] Ikeda H,Nihei T,Ueno A. Template-assisted stereoselective photocyclodimerization of 2-anthracenecarboxylic acid by bispyridinio-appendedγ-cyclodextrin[J].Journalof Organic Chemistry,2005,70(4):1237-1242.
[49] Yang C,Ke C F,Liang W T,et al. Dual Supramolecular photochirogenesis:Ultimate stereocontrol of photocyclodimerization by a chiral scaffold and confining host[J].Journal of the American Chemical Society,2011,133(35):13786-13789.
[50] Lindback E,Zhou Y,Pedersen C M,et al. Artificial enzymes based on cyclodextrin with phenol as the catalytic group[J].Tetrahedron Letters, 2012,53(37):5023-5026.
[51] Zhou Y,Pedersen C M,Bols M. Artificial enzyme activity from cyclodextrins with cyanohydrins on the secondary rim[J].Tetrahedron Letters,2013,54(20):2458-2461.
[52] Tabushi I,Yamamura K,Nabeshima T. Characterization of regiospecific A,C- and A,D-disulfonate capping ofβ-cyclodextrin. Capping as an efficient production technique[J].Journal of the American Chemical Society,1984,106(18):5267-5270.
[53] Tabushi I,Kuroda Y,Yamada M,et al. A-(modified B6)-B-[ω-amino(ethylamino)]-β-cyclodextrin as an artificial B6 enzyme for chiral aminotransfer reaction[J].Journal of the American Chemical Society,1985,107(19):5545-5546.
[54] Yuan D Q,Yamada T,Fujita K. Amplification of the reactivity difference between two methylene groups of cyclodextrinsviaa cap[J].Chemical Communications,2001,24:2706-2707.
[55] Pearce A J,Sinay P. Diisobutylaluminum-promoted regioselective de-O-benzylation of perbenzylated cyclodextrins:A powerful new strategy for the preparation of selectively modified cyclodextrins[J].Angewandte Chemie International Edition,2000,39(20):3610-3612.
[56] Hardlei T,Bols M. Unusual hydrogen-bonding differences in stereoisomeric 6-C-alkylated cyclodextrins[J].Journal of the Chemical Society,Perkin Transactions1,2002,24:2880-2885.
[57] Suresh P,Pitchumani K. Per-6-amino-β-cyclodextrin catalyzed asymmetric Michael addition of nitromethane and thiols to chalcones in water[J].Tetrahedron:Asymmetry,2008,19(17):2037-2044.
[58] Suresh P,Pitchumani K. Per-6-amino-β-cyclodextrin as an efficient supramolecular ligand and host for Cu(Ⅰ)-catalyzedN-arylation of imidazole with aryl bromides[J].Journal of Organic Chemistry,2008,73(22):9121-9124.
[59] Strimbu L,Liu J,Kaifer A E. Cyclodextrin-capped palladium nanoparticles as catalysts for the Suzuki reaction[J].Langmuir,2003,19(2):483-485.
[60] Reetz M T,Waldvogel S R.β-Cyclodextrin-modified diphosphines as ligands for supramolecular rhodium catalysts[J].Angewandte Chemie International Edition,1997,36(8):865-867.
[61] Wong Y T,Yang C,Ying K C,et al. Synthesis of a novelβ-cyclodextrin- functionalized diphosphine ligand and its catalytic properties for asymmetric hydrogenation[J].Organometallics,2002,21(9):1782-1787.
[62] Fenger T H,Bjerre J,Bols M. Cyclodextrin aldehydes are oxidase mimics[J].Chembiochem,2009,10(15):2494-2503.
[63] Becker M M,Ravoo B J. Highly fluorinated cyclodextrins and their host-guest interactions[J].Chemical Communications,2010,46(24):4369-4371.
[64] Badi N,Jarroux N,Guegan P. Synthesis of per-2,3-di-O-heptyl-βandγ-cyclodextrins:A new kind of amphiphilic molecules bearing hydrophobic parts[J].Tetrahedron Letters,2006,47(50):8925-8927.
[65] Ashton P R,Koeniger R,Stoddart J F,et al. Amino acid derivatives ofβ- cyclodextrin[J].Journal of Organic Chemistry,1996,61(3):903-908.
[66] Roehri-Stoeckel C,Dangles O,Brouillard R. A simple synthesis of a highly water soluble symmetricalβ- cyclodextrin derivative[J].Tetrahedron Letters,1997,38(9):1551-1554.
[67] Tastan P,Akkaya E U. A novel cyclodextrin homodimer with dual-mode substrate binding and esterase activity[J].Journal of Molecular Catalysis A:Chemical,2000,157(1-2):261-263.
[68] Dong Z Y,Liu J Q,Mao S Z,et al. Aryl thiol substrate 3-carboxy-4 -nitrobenzenethiol strongly stimulating thiol peroxidase activity of glutathione peroxidase mimic 2,2′-ditellurobis(2-deoxy-β- cyclodextrin)[J].Journal of the American Chemical Society,2004,126(50):16395-16404.
[69] Yan J M,Breslow R. An enzyme mimic that hydrolyzes an unactivated ester with catalytic turnover[J].Tetrahedron Letters,2000,41(13):2059-2062.
[70] Tang S P,Zhou Y H,Chen H Y,et al. Ester hydrolysis by a cyclodextrin dimer catalyst with a tridentateN,N′,N′-Zinc linking group[J].Chemistry A:Asian Journal,2009,4(8):1354-1360.
[71] Huang X,Liu X M,Luo Q A,et al. Artificial selenoenzymes:Designed and redesigned[J].Chemical Society Reviews,2011,40(3):1171-1184.
[72] Tang S P,Chen S,Wu G F,et al. Ester catalytic hydrolysis by a tridentateN,N′,N′-copper bridged cyclodextrin dimer[J].Inorganic Chemistry Communications,2011,14(1):184-188.
[73] Hu P,Liu G F,Ji L N,et al. Efficient promotion of phosphate diester cleavage by a face-to-face cyclodextrin dimer without metal[J].Chemical Communications,2012,48(44):5515-5517.
[74] French R R,Holzer P,Leuenberger M G,et al. A supramolecular enzyme mimic that catalyzes the 15,15′ double bond scission ofβ,β-carotene[J].Angewandte Chemie International Edition,2000,39(7):1267-1269.
[75] Ishimaru Y,Masuda T,Iida T. Synthesis of secondary face-to-face cyclodextrin dimers linked at each 2-position[J].Tetrahedron Letters,1997,38(21):3743-3744.
[76] Liu Y,You C C,Li B. Synthesis and molecular recognition of novel oligo(ethylenediamino) bridged bis(β-cyclodextrin)s and their copper(Ⅱ) complexes:Enhanced molecular binding ability and selectivity by multiple recognition[J].Chemistry A:European Journal,2001,7(6):1281-1288.
[77] Gao H,Wang Y N,Fan Y G,et al. Interactions of some modified mono-and bis-beta-cyclodextrins with bovine serum albumin[J].Bioorganic and Medicinal Chemistry,2006,14(1):131-137.
[78] Tang B,Liang H L,Xu K H,et al. An improved synthesis of disulfides linkedβ-cyclodextrin dimer and its analytical application for dequalinium chloride determination by spectrofluorimetry[J].Analytica Chimica Acta,2005,554(1-2):31-36.
[79] Yang J,Gabriele B,Belvedere S,et al. Catalytic oxidations of steroid substrates by artificial cytochrome P-450 enzymes[J].Journal of Organic Chemistry,2002,67(15):5057-5067.
[80] Nakajima H,Sakabe Y,Ikeda H,et al. Cyclodextrin trimers as receptors for arranging ester and catalyst at optimized location to achieve enhancement of hydrolytic activity[J].Bioorganic and Medicinal Chemistry Letters,2004,14(7):1783-1786.
[81] Breslow R,Zhang X,Xu R,et al. Selective catalytic oxidation of substrates that bind to metalloporphyrin enzyme mimics carrying two or four cyclodextrin groups and related metallosalens[J].Journal of the American Chemical Society,1996,118(46):11678-11679.
[82] Breslow R,Yan J M,Belvedere S. Catalytic hydroxylation of steroids by cytochrome P-450 mimics. Hydroxylation at C-9 with novel catalysts and steroid substrates[J].Tetrahedron Letters,2002,43(3):363-365.
[83] Sasaki K,Nagasaka M,Kuroda Y. New cyclodextrin dimer and trimer:Formation of biphenyl excimer and their molecular recognition[J].Chemical Communications,2001(24):2630-2631.
[84] Charbonnier F,Humbert T,Marsura A. A convenient one-pot synthesis of cyclam-β-cyclodextrins new ligands[J].Tetrahedron Letters,1998,39(21):3481-3484.
[85] Rawal G K,Zhang P,Ling C C. Controlled synthesis of linear alpha-cyclodextrin oligomers using copper-catalyzed huisgen 1,3-dipolar cycloaddition[J].Organic Letters,2010,12(13):3096-3099.
[86] 童林荟.环糊精化学-基础与应用[M]. 北京:科学出版社,2001.
[87] Qiu H B,Yang C,Inoue Y,et al. Supramolecular photochirogenesis with cyclodextrin-silica composite. Enantiodifferentiating photocyclodimerization of 2-anthrancenecarboxylate with mesoporous silica wall-cappedγ-cyclodextrin[J].Organic Letters,2009,11(8):1793-1796.
[88] Tudisco C,Oliveri V,Cantarella M,et al. Cyclodextrin anchoring on magnetic Fe3O4nanoparticles modified with phosphonic linkers[J].European Journal of Inorganic Chemistry,2012(32):5323-5331.
[89] Badruddoza A Z M,Rahman M T,Ghosh S,et al. beta-Cyclodextrin conjugated magnetic,fluorescent silica core-shell nanoparticles for biomedical applications[J].Carbohydrate Polymers,2013,95(1):449-457.
[90] Wang Y Q,Han B H. Cyclodextrin-based porous nanocapsules[J].Chinese Journal of Chemistry,2013,31(5):569-576.
[91] Concheiro A,Alvarez-Lorenzo C. Chemically cross-linked and grafted cyclodextrin hydrogels:From nanostructures to drug-eluting medical devices[J].Advanced Drug Delivery Reviews,2013,65(9):1188-1203.
[92] 沈海民,武宏科,纪红兵,等.β-环糊精-Fe3O4超分子体系的构筑及其应用研究进展[J]. 有机化学,2014,34(4):630-646.
[93] 沈海民,纪红兵,武宏科,等.β-环糊精的固载及其应用最新研究进展[J]. 有机化学,2014,34(8):1549-1572.
