基于JAK-STAT信号通路的溃结宁膏对HT-29细胞炎症模型的影响
2023-02-15陈凯朱莹
陈凯,朱莹
湖南中医药大学第一附属医院,湖南 长沙 410007
溃疡性结肠炎(ulcerative colitis,UC)是常见的胃肠道慢性炎症性疾病,近年来发病率逐年上升[1],且呈现年轻化趋势,给患者生活质量造成严重影响。UC病情缠绵难愈,且易复发,肠道炎症状态日久有并发结直肠癌的风险。
现代医学认为,UC与遗传、机体免疫、肠道微生态等密切相关[1-2],病理表现为局部炎性细胞浸润,黏膜糜烂,散在性溃疡。白细胞介素(IL)是由多种细胞产生并参与机体多种生理病理反应的细胞因子。研究表明,IL-13、IL-6分泌量与肠道炎症水平呈正相关,而抗炎因子IL-10与肠道炎症水平呈负相关[3-4]。凋亡作为一种细胞程序性死亡方式,能够加重肠道炎症,进一步诱导肠道上皮细胞凋亡,二者相互影响[5-7]。JAK-STAT信号通路与细胞增殖、凋亡、分化等密切相关,IL-13、IL-6等细胞因子均能通过JAK-STAT信号通路进行转导,从而调控下游靶基因表达,影响UC病情[8-9]。
课题组前期以三硝基苯磺酸(TNBS)诱导UC大鼠模型,采用溃结宁膏进行干预,发现其能降低IL-6、肿瘤坏死因子(TNF)-α等细胞因子分泌[10]。基于此,本实验以脂多糖(LPS)诱导人结肠癌HT-29细胞炎症模型,采用溃结宁膏穴位敷贴血清进行干预,观察其对HT-29细胞炎症反应及凋亡的影响,从JAK-STAT信号通路探讨其作用机制,为溃结宁膏治疗UC提供实验依据。
1 实验材料
1.1 动物及细胞
6~8周龄SD雄性大鼠18只,体质量180~220 g,湖南斯莱克景达实验有限公司提供,饲养于湖南中医药大学第一附属医院动物房,本实验经湖南中医药大学第一附属医院伦理委员会审批(ZYFY20190814-1)。HT-29细胞,中国科学院细胞库。
1.2 药物及试剂
溃结宁膏穴位敷贴(炮附子、细辛、丁香、芥子、延胡索、赤芍、生姜按1∶1∶1∶1∶1∶1∶2比例组成),湖南省中医院制备;柳氮磺吡啶(SASP)肠溶片,批号09190501,上海信谊。McCoy” s 5a培养基、胎牛血清、青霉素-链霉素(双抗)、胰蛋白酶,批号分别为PM150710、164210-50、PB180120、PB180226,武汉普诺赛;TUNEL试剂盒,批号40306ES50,上海翊圣生物;mRNA反转录试剂盒,批号CW2569,北京康为世纪;Trizol,批号15596026,美国Thermo;信号传导与转录激活因子(STAT)3抗体,批号ab31370,英国Abcam;p-STAT3抗体,批号ab76315,英国Abcam;Janus激酶(JAK)2抗体,批号ab39636,英国Abcam;JAK1抗体,批号ab133666,英国Abcam;HRP标记山羊抗小鼠IgG,批号SA00001-1,美国Proteintech;HRP标记山羊抗兔IgG,批号SA00001-2,美国Proteintech;电泳缓冲液,批号AWB0083,长沙艾碧维;蛋白酶抑制剂,批号583794,北京金泰宏达;显影液,批号BW-61,上海佳信;CCK8试剂盒,批号C0009,上海碧云天;IL-6、IL-10、IL-13试剂盒,批号分别为CSB-E08008r、CSB-E08005r、CSB-E08006r,武汉华美生物工程有限公司。
1.3 主要仪器
摇床(型号TS-92,海门其林贝尔),恒温箱(型号DYY-6C,北京贝一),荧光显微镜(型号BA410T,厦门Motic),台式冷冻离心机(型号H1650R,湖南湘仪),荧光定量PCR仪(型号PIKOREAL96,美国Thermo),生物样品均质仪(型号BioPrep-24,杭州奥盛),电泳仪(型号DYY-6C,北京六一),电泳槽(型号DYCZ-24DN,北京六一),化学发光成像系统(型号ChemiScope6100,上海勤翔)。
2 实验方法
2.1 细胞培养及造模
HT-29细胞用McCoy” s 5a完全培养基(含10%胎牛血清、1%双抗)置于37 ℃、5%CO2培养箱中培养。取对数生长期细胞,胰蛋白酶消化制成细胞悬液,以1×105个/mL接种于6孔板中,置于培养箱中贴壁过夜,加入1 μg/mL LPS处理24 h建立炎症模型。ELISA检测细胞培养液IL-6、IL-13含量,高于对照组(不加LPS处理)表明造模成功。
2.2 含药血清制备
大鼠适应性饲养1周后随机分为空白组、穴位敷贴组和SASP组,每组6只。空白组予生理盐水灌胃,穴位敷贴组予生理盐水灌胃及溃结宁膏穴位敷贴,具体穴位及操作参考课题组前期研究[10],1次/d,2 h/次,每次贴于一侧,左右交替,连续14 d。SASP组予10 mg/mL SASP灌胃,灌胃体积5 mL/kg。末次给药2 h后腹主动脉采血,室温静置2 h,4 ℃、3 500 r/min离心10 min,吸取血清,灭菌、过滤后于-20 ℃贮存备用。
2.3 含药血清浓度筛选
将HT-29细胞按5×104个/mL接种至96孔板,每孔100 μL,置于培养箱培养过夜。将细胞分为空白组、模型组、5%空白血清组、10%空白血清组、15%空白血清组、5%溃结宁膏血清组、10%溃结宁膏血清组、15%溃结宁膏血清组,每组4个复孔,除空白组外,加入含1 μg/mL LPS的完全培养基处理24 h。弃去培养基,更换含相应浓度血清的完全培养基继续培养24 h。每孔加入CCK8试剂10 μL,培养箱中孵育2 h,以不含细胞、只加培养基孔作为空白对照,酶标仪450 nm波长检测各孔吸光度(OD值),计算细胞存活率。细胞存活率(%)=(实验组OD值-空白对照OD值)÷(空白组OD值-空白对照OD值)×100%。
2.4 分组及干预
筛选出最佳含药血清浓度后,将细胞分为空白组、模型组、空白血清组、溃结宁膏血清组和SASP血清组,加入含1 μg/mL LPS的完全培养基处理24 h,更换相应浓度血清继续培养24 h。空白血清组和SASP含药血清组使用与溃结宁膏血清组相同浓度的血清进行干预,空白组和模型组均使用完全培养基进行培养。
2.5 CCK8法检测
将HT-29细胞按5×104个/mL接种至96孔板,每孔100 μL,按“2.4”项下方法处理,加入CCK8试剂孵育2 h,检测各孔OD值并计算细胞存活率。
2.6 TUNEL染色
在24孔板中制作细胞爬片,按“2.4”项下方法处理,细胞爬片用多聚甲醛进行固定,依次加入Proteinase K工作液、TdT酶反应液、Streptavidin-TRITC标记工作液,DAPI工作液染细胞核,缓冲甘油封片,荧光显微镜下观察,计算细胞凋亡率(凋亡细胞数÷总细胞数×100%)。
2.7 ELISA检测
收集培养后的细胞上清液,按试剂盒说明书检测IL-6、IL-10、IL-13含量。
2.8 RT-PCR检测
收集HT-29细胞,使用Trizol、三氯甲烷、异丙醇提取细胞总RNA,紫光分光光度计测定RNA浓度和纯度。配制反转录反应体系,将RNA反转录为cDNA,PCR进行定量扩增,2-ΔΔCt法计算目的基因相对表达量。引物序列见表1。

表1 各基因PCR引物序列
2.9 Western blot检测
收集HT-29细胞,预冷RIPA裂解液裂解,BCA法测定蛋白浓度,配制10%分离胶和4.8%浓缩胶,样本煮沸备用。75 V电泳至溴酚蓝到达分离胶底部时停止电泳,200 mA转膜1.5 h,5%脱脂奶粉封闭90 min,加入JAK2一抗(1∶750)、STAT3一抗(1∶750)、p-STAT3一抗(1∶5 000)、JAK1一抗(1∶2 000)、β-actin一抗(1∶5 000),4 ℃孵育过夜。膜室温放置30 min,加入HRP标记山羊抗小鼠 IgG(1∶5 000)、HRP标记山羊抗兔IgG(1∶6 000),室温孵育60 min,ECL显色液显色曝光,凝胶成像系统成像,使用Image J软件进行分析,以目的蛋白与内参蛋白(β-actin)灰度值比值计算蛋白相对表达量。
3 统计学方法
采用GraphPad Prism 8软件进行统计分析。数据以表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 溃结宁膏穴位敷贴血清浓度筛选
与空白组比较,模型组和各浓度血清组细胞存活率明显降低(P<0.05);与模型组比较,5%、10%、15%空白血清组细胞存活率差异无统计学意义(P>0.05),5%、10%、15%溃结宁膏血清组细胞存活率明显升高(P<0.05);与5%、15%溃结宁膏血清组比较,10%溃结宁膏血清组细胞存活率明显升高(P<0.05)。见表2。因此用10%溃结宁膏血清进行后续实验。
表2 不同血清浓度的HT-29细胞存活率比较(,%)
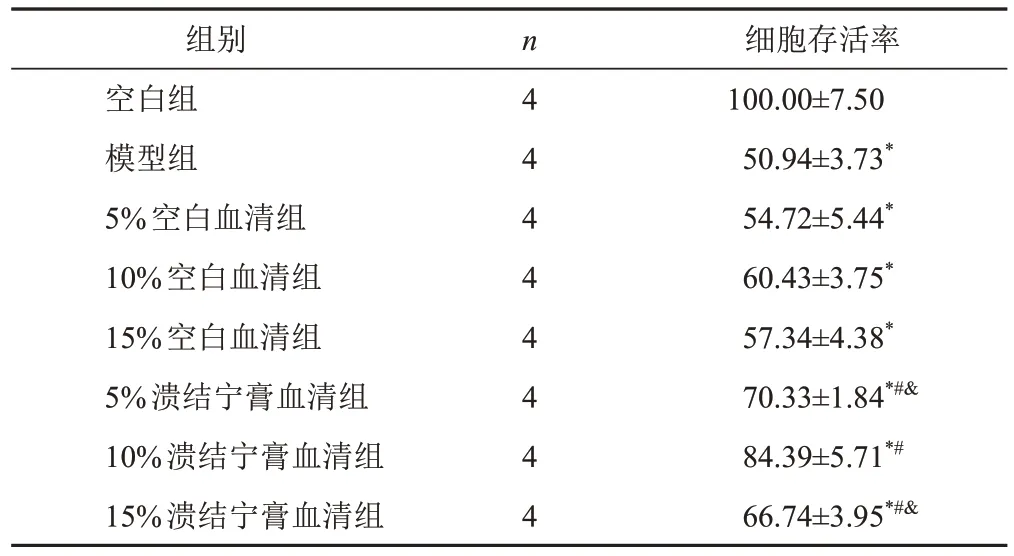
表2 不同血清浓度的HT-29细胞存活率比较(,%)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与10%溃结宁膏血清组比较,&P<0.05
细胞存活率100.00±7.50 50.94±3.73*54.72±5.44*60.43±3.75*57.34±4.38*70.33±1.84*#&84.39±5.71*#66.74±3.95*#&组别空白组模型组5%空白血清组10%空白血清组15%空白血清组5%溃结宁膏血清组10%溃结宁膏血清组15%溃结宁膏血清组n 4 4 4 4 4 4 4 4
4.2 溃结宁膏对HT-29细胞存活率的影响
与空白组比较,模型组和不同血清组细胞存活率明降低(P<0.05);与模型组和空白血清组比较,溃结宁膏血清组和SASP血清组细胞存活率明显升高(P<0.05)。见表3。
表3 各组HT-29细胞存活率比较(,%)

表3 各组HT-29细胞存活率比较(,%)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与空白血清组比较,&P<0.05
细胞存活率100.00±5.00 57.22±4.67*61.46±1.92*83.26±3.78*#&86.58±5.03*#&组别空白组模型组空白血清组溃结宁膏血清组SASP血清组n 4 4 4 4 4
4.3 溃结宁膏对HT-29细胞凋亡的影响
与空白组比较,模型组和空白血清组细胞凋亡率明显升高(P<0.05);与模型组和空白血清组比较,溃结宁膏血清组和SASP血清组细胞凋亡率明显降低(P<0.05)。见图1、表4。
表4 各组HT-29细胞凋亡率比较(,%)

表4 各组HT-29细胞凋亡率比较(,%)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与空白血清组比较,&P<0.05
组别空白组模型组空白血清组溃结宁膏血清组SASP血清组n 5 5 5 5 5细胞凋亡率3.68±0.46 11.28±1.51*9.49±1.72*4.29±0.56#&4.24±0.61#&

图1 各组HT-29细胞凋亡阳性表达(TUNEL染色,×200)
4.4 溃结宁膏对HT-29细胞上清液白细胞介素-6、白细胞介素-10、白细胞介素-13含量的影响
与空白组比较,模型组和空白血清组细胞上清液IL-6、IL-13含量明显增加,IL-10含量明显减少(P<0.05);与模型组和空白血清组比较,溃结宁膏血清组和SASP组细胞上清液IL-6、IL-13含量明显减少(P<0.05),IL-10含量明显增加(P<0.05)。见表5。
表5 各组HT-29细胞上清液IL-6、IL-10、IL-13含量比较(,pg/mL)

表5 各组HT-29细胞上清液IL-6、IL-10、IL-13含量比较(,pg/mL)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与空白血清组比较,&P<0.05
组别空白组模型组空白血清组溃结宁膏血清组SASP血清组IL-13 20.72±1.64 39.41±4.36*36.39±5.10*25.17±2.97#&23.49±3.37#&n 5 5 5 5 5 IL-6 25.12±3.05 53.41±3.52*47.19±2.74*31.17±6.09#&29.49±4.18#&IL-10 36.49±7.63 20.40±2.63*22.80±2.93*33.49±5.99#&31.80±4.24#&
4.5 溃结宁膏对 HT-29 细胞 JAK1、JAK2、STAT3、STAT6基因表达的影响
与空白组比较,模型组和空白血清组细胞JAK1、JAK2、STAT3、STAT6基因表达明显升高(P<0.05);与模型组和空白血清组比较,溃结宁膏血清组和SASP血清组细胞JAK1、JAK2、STAT3、STAT6基因表达明显降低(P<0.05)。SASP血清组和溃结宁膏血清组各指标差异无统计学意义(P>0.05)。见表6。
表6 各组HT-29细胞JAK1、JAK2、STAT3、STAT6基因表达比较()

表6 各组HT-29细胞JAK1、JAK2、STAT3、STAT6基因表达比较()
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与空白血清组比较,&P<0.05
组别空白组模型组空白血清组溃结宁膏血清组SASP血清组STAT6 1.35±0.41 7.31±1.36*5.62±0.77*2.76±1.01#&2.50±0.86#&n 5 5 5 5 5 JAK1 1.07±0.15 4.00±0.72*3.47±0.28*1.82±0.51#&1.71±0.39#&JAK2 1.29±0.22 3.80±0.91*3.35±0.71*2.06±0.41#&1.81±0.41#&STAT3 1.01±0.20 3.80±0.51*3.27±0.42*1.76±0.52#&1.67±0.38#&
4.6 溃结宁膏对 HT-29细胞 JAK1、JAK2、STAT3、p-STAT3蛋白表达的影响
与空白组比较,模型组和不同血清组细胞JAK1、JAK2、STAT3、p-STAT3蛋白表达明显升高(P<0.05);与模型组和空白血清组比较,溃结宁膏血清组和SASP血清组细胞JAK1、JAK2、STAT3、p-STAT3蛋白表达明显降低(P<0.05)。见图2、表7。
表7 各组HT-29细胞JAK1、JAK2、STAT3、p-STAT3蛋白表达比较()

表7 各组HT-29细胞JAK1、JAK2、STAT3、p-STAT3蛋白表达比较()
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与空白血清组比较,&P<0.05
组别空白组模型组空白血清组溃结宁膏血清组SASP血清组p-STAT3 0.21±0.02 0.55±0.03*0.52±0.02*0.38±0.03*#&0.34±0.03*#&n 5 5 5 5 5 JAK1 0.21±0.02 0.70±0.03*0.59±0.07*#0.37±0.06*#&0.38±0.06*#&JAK2 0.20±0.01 0.71±0.03*0.64±0.08*0.44±0.04*#&0.36±0.04*#&STAT3 0.20±0.01 0.70±0.02*0.65±0.08*0.47±0.03*#&0.37±0.03*#&
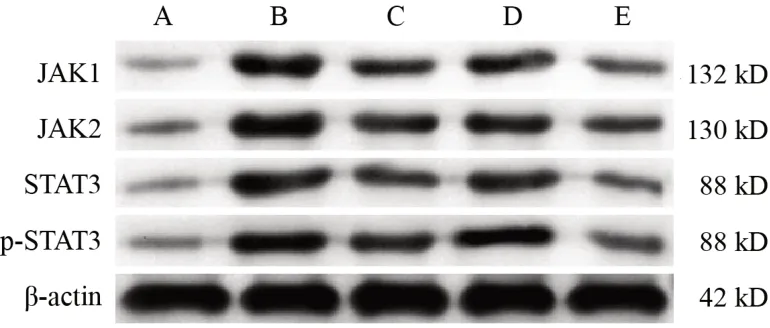
图2 各组HT-29细胞JAK1、JAK2、STAT3、p-STAT3蛋白免疫印迹
5 讨论
UC属中医学“泄泻”“痢疾”等范畴,病变早期以湿热蕴结为主,病情缠绵难愈,久病损伤机体阳气,高龄患者常兼有不同程度阳虚表现[11]。脾为仓廪之官,主饮食与水液代谢,水液代谢失衡,液体不循肠道,故出现腹泻。脾为后天之本,肾为先天之本,后天阳气病久影响先天阳气,故脾肾阳气亏虚是UC常见病机。阳气虚弱,血液运行不畅,气血瘀阻,通则不痛,故出现腹部疼痛不适。中药穴位敷贴通过药物刺激机体经络穴位,使皮肤血管扩张,促进药物吸收入血,进而调节机体功能,对改善UC患者腹痛、腹泻等症状具有一定作用[12-13]。溃结宁膏由课题组负责人朱莹教授根据UC脾肾阳虚证病机研制,由炮附子、细辛、丁香、芥子、延胡索、赤芍、生姜组成,具有温脾补肾、活血化瘀之效。前期研究表明,溃结宁膏治疗脾肾阳虚型UC临床效果显著[14-15]。动物实验表明,溃结宁膏穴位敷贴能通过抑制结肠黏膜炎症反应,进而控制UC病情发展[10]。
IL-6最初被发现是作为调节IgG产生的B细胞刺激因子,可由巨噬细胞、淋巴细胞、肿瘤细胞等一系列细胞产生,在先天免疫和适应性免疫中发挥多效性活性。IL-6作为重要的促炎因子,其表达量与UC严重程度呈正相关。采用IL-6拮抗剂托珠单抗进行治疗能够有效缓解UC患者症状体征,改善内镜评分[16-18]。IL-13在Th2免疫应答中发挥关键作用,被认为与肠道疾病有关[19]。IL-13由Th2细胞、自然杀伤T细胞、先天淋巴细胞和先天免疫细胞产生,有助于触发和维持慢性特发性肠道炎症。同时IL-13能促进UC肠道上皮细胞凋亡,破坏肠道黏膜屏障。IL-10具有广泛的抗炎作用,通过抑制炎症反应和促炎因子释放,从而参与机体炎症反应的多个阶段。研究表明,IL-10对维持肠道稳态、调节机体免疫平衡具有重要作用[3,20]。UC病变组织上皮细胞凋亡程度明显高于正常组织,上皮细胞凋亡导致肠道屏障破坏,肠道微生物紊乱,加重肠道炎症反应,加重UC病情[21-22]。JAK-STAT信号通路对调节IL-6、IL-13、IL-10等炎症因子传导及肠道黏膜细胞凋亡有重要作用,抑制JAK-STAT信号通路活性可有效降低UC炎症因子分泌及肠道细胞凋亡[23-25]。
HT-29细胞是研究UC病理或药理机制的常用细胞之一,可以模拟UC相关炎症及凋亡因子分泌,已被用于UC体外实验多年,其可靠性已得到验证[26-28]。本实验结果显示,造模后细胞上清液IL-6、IL-13含量增加,表明炎症模型制备成功。采用溃结宁膏穴位敷贴血清进行干预,能增加HT-29细胞存活率,抑制细胞凋亡及减少促炎因子分泌,增加抗炎因子分泌,从而发挥抗炎作用。进一步检测JAK-STAT信号通路相关基因和蛋白表达发现,溃结宁膏能够降低细胞JAK1、JAK2、STAT3、STAT6基因及JAK1、JAK2、STAT3、p-STAT3蛋白表达,提示其可能通过抑制JAK-STAT信号通路发挥治疗UC作用。
综上所述,溃结宁膏可能通过降低JAK-STAT信号通路活性抑制HT-29细胞炎症反应及凋亡。本课题组从体外UC炎症角度出发,为溃结宁膏穴位敷贴的临床应用及UC的治疗提供实验依据。
