基于整合药理学及体外实验探索生血补髓汤治疗股骨头坏死作用机制
2023-02-15周毅赵赫然章晓云张璇陈跃平陈雷雷
周毅 ,赵赫然 ,章晓云 ,张璇 ,陈跃平 ,陈雷雷
1.广西中医药大学,广西 南宁 530011; 2.广州中医药大学,广东 广州 510378;3.广西中医药大学附属瑞康医院,广西 南宁 530011; 4.广州中医药大学第三附属医院,广东 广州 510378;5.广东省中医骨伤研究院,广东 广州 510378
股骨头坏死(osteonecrosis of the femoral head,ONFH)是临床常见的骨科难治疾病,以髋关节疼痛和功能障碍为临床表现[1]。流行病学研究显示,目前全世界有ONFH患者约2 000多万例,其中,中国约有800万例,并且以每年10~20万例的速度增加[2-3]。ONFH与脂质代谢异常、血管内凝血、成脂分化、细胞凋亡自噬、骨质疏松、基因多态性等密切相关[4]。ONFH属中医学“骨蚀”“骨痹”“骨痿”范畴,与肝肾亏虚、外邪侵袭、气滞血瘀密切相关,治疗以活血化瘀为主,辅以通络止痛、健脾化湿、补肾健骨等[5-6]。
生血补髓汤出自《伤科补要》,具有益气补血、补髓壮骨之功。谢本渊等[7]运用生血补髓汤配合膏药外敷治疗早期ONFH,发现该方可通过补益气血,调节免疫功能,改善股骨头血运,取得良好疗效。本研究采用超高效液相色谱-四极杆飞行时间质谱法(UPLC-QTOF-MS)对生血补髓汤汤剂进行成分鉴定,再运用中医药整合药理学研究平台(TCMIP)2.0进行网络药理学分析,基于质谱鉴定、网络药理学预测结果和文献分析,构建生血补髓汤单体复方,进行体外实验验证,以探究生血补髓汤干预ONFH的作用机制。
1 仪器、试药与细胞
Ultimate3000超高效液相色谱仪(赛默飞世尔有限公司),TripleTOF®5600(美国AB Sciex公司),Analyst TF1.7工作站(美国AB Sciex公司),5810R型离心机(SIGMA公司),DMI3000B型倒置显微镜(德国Leica公司),CFX96 Touch型荧光定量PCR仪(美国BioRad公司),T100型梯度PCR仪(美国BioRad公司)。
TRAP染色试剂盒(武汉塞维尔生物科技有限公司,批号G1050-50T),CCK-8试剂盒(江苏凯基生物技术股份有限公司,批号KGA317-1),胎牛血清(依科赛生物科技有限公司,批号FSS100),巨噬细胞集落刺激因子(M-CSF,苏州近岸蛋白质科技股份有限公司,批号CB34),小鼠RANKL(派普泰克生物科技有限公司,货号315-11C),活性氧(ROS)检测试剂盒(索莱宝生物科技有限公司,批号CA1410),总RNA小量提取试剂盒(广州亿涛生物科技有限公司,批号EK1300), TB Green®Premix Ex TaqTMqPCR Kit(Takara,批号RR420Q),反转录试剂盒(艾科瑞生物工程有限公司,批号AG11706),高糖DMEM培养基(赛默飞世尔有限公司,批号PM150210P)。对照品阿魏酸、绿原酸、梓醇、芍药苷、槲皮素、山柰酚,索莱宝生物科技有限公司,批号分别为SF8030、SC8210、SC8150、SP8030、SQ8030、SB8020,纯度均不低于98%。
RAW264.7细胞,武汉普诺赛公司,批号CL-0190。
2 方法
2.1 供试品溶液制备
生血补髓汤(生地黄12 g,白芍9 g,川芎6 g,黄芪9 g,盐牛膝9 g,盐杜仲9 g,红花5 g,南五加皮9 g,当归9 g,盐续断9 g)饮片,购于广西中医药大学附属瑞康医院中药房,加1 000 mL水浸泡30 min后煮沸,继续煎煮30 min,得头煎液300 mL,药渣加500 mL水,同法获得二煎液200 mL,合并2次煎液,室温放凉,混匀后取50 mL样品,1 000 r/min离心20 min,取上清液,即得。
2.2 色谱条件和质谱条件
色谱条件:Waters ACQUITY UPLC HSS T3色谱柱(1.8 μm,2.1 mm×100 mm),柱温40 ℃,上样量3 μL,流速400 μL/min,流动相正离子模式为0.1%甲酸水(A)-0.1%甲酸乙腈(B),负离子模式为2 mmol/L乙酸铵(A)-乙腈(B),梯度洗脱(0~1.5 min,5%B;1.5~2.5 min,10%B;2.5~14.00 min,10%~40%B; 14.00~22.00 min, 40%~95%B; 22.00~25.00 min,95%B;25.00~26.00 min,95%~5%B;26.00~30.00 min,5%B)。
采用Analyst TF 1.7软件中的IDA功能进行一、二级质谱数据采集,在每个数据采集循环筛选出强度最强且>100的分子离子,以获得相应的二级质谱数据。一级质谱采集范围m/z 50~1 200,轰击能量30 eV,每50 ms 10张二级谱图。电喷雾离子源(ESI),雾化气压60 psi,辅助气压60 psi,气帘气压35 psi,离子源温度650 ℃,喷雾电压5.0 kV(正)、-4.0 kV(负)。
2.3 活性成分鉴定
将原始数据导入MSDIAL4.6软件进行峰寻找、峰对齐等处理,利用前期建立的生血补髓汤10味中药化学成分、质谱数据库,同时整合Metlin、MassBank、MoNA和HMDB公共数据库,扣除空白样品得到鉴定结果。鉴定过程中进行一级质谱数据比对(相对误差<10 ppm),在此基础上通过二级质谱分析及文献[8-17]比对,进一步对活性成分进行确认。
2.4 生血补髓汤治疗股骨头坏死潜在靶点
将初步鉴定得到生血补髓汤活性成分导入TCMIP2.0,使用活性成分靶点预测功能,以相似性分数≥0.8为标准进行筛选[18];以“Osteonecrosis of the Femoral Head”“Femur Head Necrosis”为关键词,通过“疾病相关分子挖掘及其功能分析模块”收集相关靶点;使用“中医药关联网络挖掘”版块的“疾病-方剂”网络模块,分别上传生血补髓汤和ONFH的候选靶点群。以度值(degree)、介度值(betweenness)和紧密度(closeness)作为筛选指标,以三者均大于中位数的节点作为分析靶点。同时,选取该靶点群中的生血补髓汤和ONFH共有靶点作为生血补髓汤治疗ONFH靶点。
2.5 蛋白相互作用网络分析
将核心靶点上传到STRING11.0平台进行蛋白相互作用(PPI)网络分析,并将TSV格式文件输入Cytoscape3.7.2软件进行网络构建和拓扑学分析,计算PPI网络中各节点的度值和介度值。度值越大表明该节点在网络中的重要性越强,介度值越大表明该节点在网络信息传递中发挥的作用越重要,即靶点越处于网络中心。
2.6 GO生物过程和KEGG通路富集分析
利用DAVID6.8数据库,通过GO富集分析核心靶点的生物过程,KEGG富集分析其相关通路,选取P<0.05的富集结果,并使用R语言软件绘图。
2.7 多维网络分析
根据药物活性成分及其预测靶点,结合KEGG通路富集分析结果,采用Cytoscape3.7.2软件构建生血补髓汤治疗ONFH的中药-成分-靶点-通路多维网络,并进行网络拓扑分析。
2.8 细胞实验
2.8.1 生血补髓汤单体复方制备
根据质谱分析和TCMIP预测结果,选取满足以下条件的单体组成新的单体复方用于实验:①生血补髓汤组方药物的主要活性成分或质量标志物且在质谱分析中检测出的成分,如梓醇为生地黄质量控制的指标性成分,阿魏酸为当归和川芎的主要活性成分[19],绿原酸为五加皮的主要活性成分[20-21],芍药苷为白芍的主要活性成分[22];②TCMIP预测结果中存在较多治疗靶点的活性成分(如槲皮素、山柰酚均有13个靶点);③排除氨基酸、核苷类、生物碱类广泛存在于各种药材中不具备代表性的活性成分。
参考活性成分使用说明书制备生血补髓汤单体复方。①低浓度:梓醇1.5 μg/mL、芍药苷17 μg/mL、阿魏酸1.25 μg/mL、绿原酸17.5 μg/mL、槲皮素15 μg/mL、山柰酚14 μg/mL;②中浓度:梓醇3 μg/mL、芍药苷31 μg/mL、阿魏酸2.5 μg/mL、绿原酸35 μg/mL、槲皮素30 μg/mL、山柰酚28 μg/mL;③高浓度:梓醇6 μg/mL、芍药苷62 μg/mL、阿魏酸5 μg/mL、绿原酸70 μg/mL、槲皮素60 μg/mL、山柰酚56 μg/mL。
2.8.2 CCK-8法检测细胞活力
取对数生长期RAW264.7细胞,以6×103个/孔接种于96孔板,每孔加入100 μL细胞液,培养过夜。实验分为空白对照组(含10%胎牛血清的高糖培养基H-DMEM)、RANKL组(RANKL 100 ng/mL+M-CSF 50 ng/mL+含10%胎牛血清的高糖培养基H-DMEM)和单体复方组(不同浓度生血补髓汤单体复方+RANKL 100 ng/mL+M-CSF 50 ng/mL+含10%胎牛血清的高糖培养基H-DMEM),每组4个复孔,干预6、12、24 h,每孔加入含10 μL CCK-8的培养基,37 ℃、5%CO2条件下避光培养1 h,于酶标仪450 nm波长处检测各孔吸光度(OD值)。
2.8.3 分组及干预
取生长状态良好的RAW264.7细胞,以6×103细胞量接种到6孔板中,置于37 ℃、5%CO2培养箱中培养,分为空白对照组(含10%胎牛血清的高糖培养基H-DMEM)、RANKL组(RANKL 100 ng/mL+M-CSF 50 ng/mL+含10%胎牛血清的高糖培养基H-DMEM)、高浓度单体复方组(高浓度生血补髓汤单体复方+RANKL 100 ng/mL+M-CSF 50 ng/mL+含10%胎牛血清的高糖培养基H-DMEM),过夜后按以上分组进行破骨细胞诱导,持续5 d。
2.8.4 TRAP染色检测细胞破骨分化
各组细胞于12孔板干预5 d,按TRAP染色试剂盒使用说明进行染色,置于显微镜下观察、拍照,多核(细胞核≥3个)、胞体较大、酒红色细胞为成熟破骨细胞。
2.8.5 活性氧清除实验
各组细胞干预48 h,按1∶800比例用无血清培养基稀释DCFH-DA,去除细胞培养基,每孔加入100 μL稀释好的DCFH-DA,置于37 ℃细胞培养箱内培养30 min,洗涤细胞3次,荧光显微镜下观察绿色荧光。采用Image J软件进行图像分析,计算平均荧光强度。
2.8.6 RT-qPCR检测相关靶点mRNA表达
各组细胞干预1、3、5 d,收集RNA,进行RT-qPCR,采用2-ΔΔCt法计算目的基因表达量。引物购自铂尚生物技术有限公司,各基因引物信息见表1。

表1 RT-qPCR各基因引物信息
2.8.7 统计学方法
采用SPSS22.0统计软件进行分析,GraghPad9.0软件进行绘图。数据以表示,符合正态分布且方差齐的2组数据用非配对t检验,多组数据用方差分析,并采用Bonferroni法进行两两比较。P<0.05表示差异有统计学意义。
3 结果
3.1 生血补髓汤活性成分
生血补髓汤溶液正离子和负离子全扫描模式质谱图见图1。根据质谱检测结果得到质谱碎片,将理论值与实测值进行比对(计算相对误差),正、负离子模式下鉴别出46个活性成分,见表2。

表2 生血补髓汤化学成分鉴定
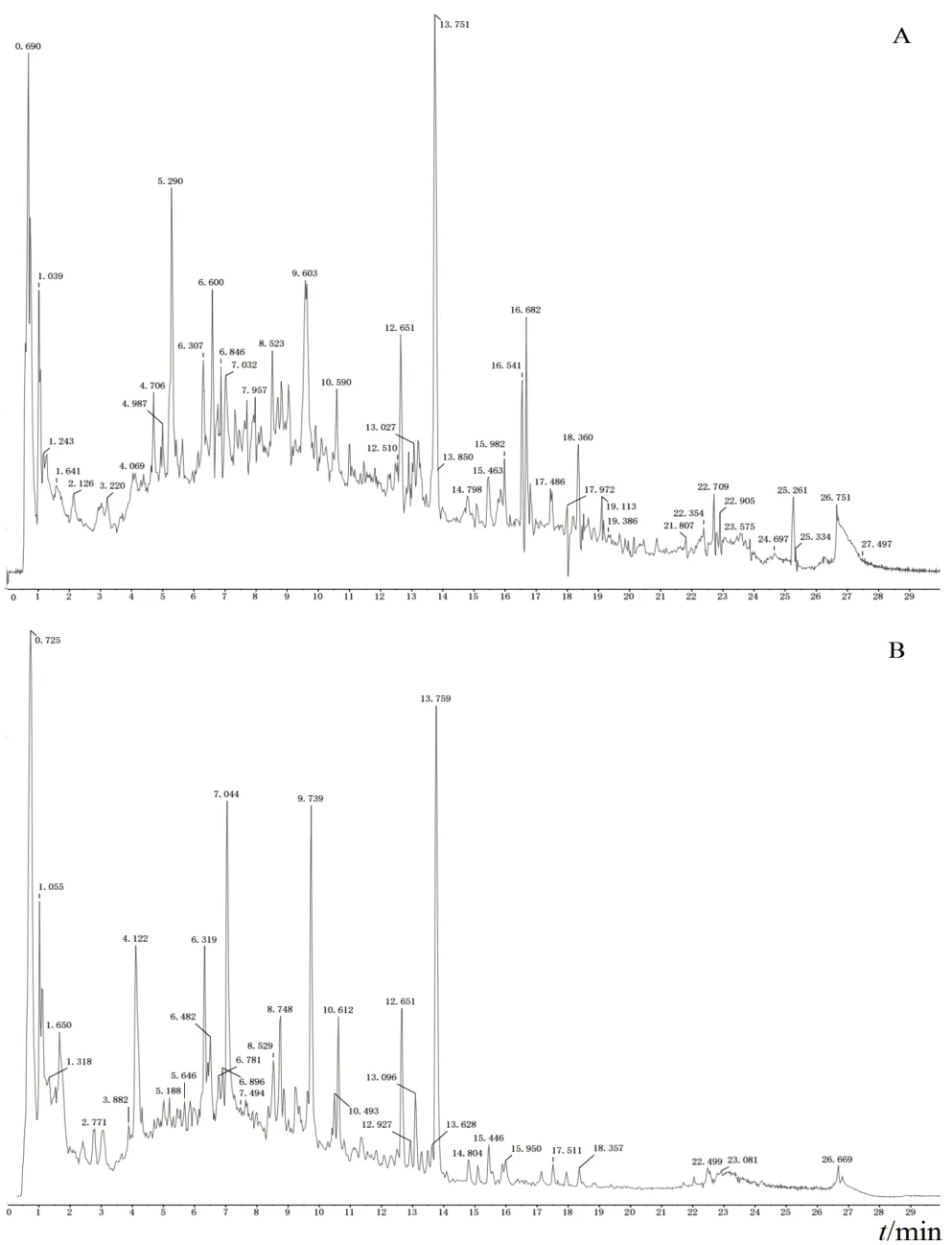
图1 生血补髓汤溶液正离子和负离子全扫描模式质谱图
3.2 生血补髓汤治疗股骨头坏死靶点
将筛选得到的活性成分按所属药物归类,其中生地黄8个、白芍5个、川芎3个、当归9个、杜仲9个、红花8个、牛膝11个、黄芪17个、五加皮12个、续断1个,合并、去重后获得46个活性成分,得到预测靶点共732个。检索获得ONFH靶点1 386个。筛选得到生血补髓汤和ONFH靶点群中度值、介度值和紧密度均大于中位数的核心节点317个,其中二者交集靶点有48个,即为生血补髓汤治疗ONFH靶点。
3.3 蛋白相互作用网络
将48个交集靶点通过STRING数据库构建靶蛋白PPI网络,将结果导入Cytoscape3.7.2软件,使用CytoNCA插件,以度值、介度值为参数进行分析。PPI网络见图2。度值和介度值排名前20位的靶点有甘油醛-3-磷酸脱氢酶(GAPDH)、人内源性肌动蛋白(ACTB)、蛋白激酶1(AKT1)、转录因子AP-1(JUN)、胰岛素基因(INS)、丝裂原活化蛋白激酶3(MAPK3)、雌激素受体1(ESR1)、肿瘤坏死因子(TNF)、HRas原癌基因(HRAS)、胱天蛋白酶3(CASP3)、白细胞介素6(IL6)、丝裂原活化蛋白激酶14(MAPK14)、白细胞介素1β(IL-1β)、前列腺素G/H合酶2(PTGS2)、糖原合成酶激酶3β(GSK3B)、基质金属蛋白酶9(MMP9)、转录因子p65(RELA)、转录因子p50(NFKB1)、磷脂酰肌醇-3-激酶催化亚基α(PIK3CA)、雄激素受体(AR)。

图2 生血补髓汤治疗ONFH靶点PPI网络
3.4 GO和KEGG通路富集分析结果
GO富集分析获得生物过程(biological process,BP)条目共1 383个(P<0.05),主要与炎症反应、氧化应激和信号传导过程等相关,前20个条目见图3。KEGG通路富集分析得到相关通路共157条(P<0.05),主要涉及TNF信号通路、IL-17信号通路、PI3K信号通路、HIF-1信号通路,前20条通路见图4。

图3 生血补髓汤治疗ONFH靶点GO BP富集分析
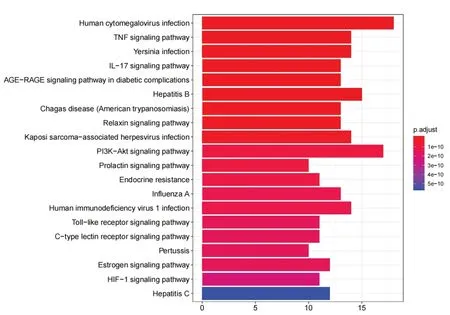
图4 生血补髓汤治疗ONFH靶点KEGG通路富集分析
3.5 多维网络关系
将48个交集靶点相关活性成分和药物及主要KEGG通路导入Cytoscape3.7.2软件,构建中药-成分-靶点-通路多维网络,见图5。该网络中包括9个药物、26个活性成分节点、48个作用靶点及靶点富集的20条信号通路,共有478条边。分析网络拓扑参数,节点平均度值为13.31,节点度值排名前5位的活性成分是绿原酸、槲皮素、木犀草素、山柰酚、腺苷。

图5 生血补髓汤治疗ONFH中药-成分-靶点-通路多维网络
3.6 实验验证结果
3.6.1 单体复方浓度对RAW264.7细胞活力的影响
与RANKL组比较,RAW264.7细胞经低浓度、中浓度、高浓度生血补髓汤单体复方处理6、12、24 h,其活力无明显变化(P>0.05),见表3。选取高浓度单体复方作为后续实验的干预浓度。
表3 各组不同时点RAW264.7细胞活力比较(,OD值)

表3 各组不同时点RAW264.7细胞活力比较(,OD值)
组别空白对照组RANKL组低浓度单体复方组中深度单体复方组高浓度单体复方组n 3 3 3 3 3 6 h 0.256±0.003 0.424±0.002 0.456±0.001 0.476±0.007 0.442±0.004 12 h 0.252±0.002 0.545±0.005 0.565±0.003 0.565±0.006 0.548±0.005 24 h 0.248±0.001 0.706±0.009 0.751±0.012 0.714±0.014 0.678±0.005
3.6.2 单体复方对RAW264.7细胞破骨分化的影响
RANKL组显微镜下可见多核细胞、单核细胞,其中破骨细胞体积较大,胞浆丰富、呈酒红色,多核。与空白对照组比较,RANKL组TRAP阳性细胞数量显著增加(P<0.01);与RANKL组比较,高浓度单体复方组阳性细胞数量明显减少(P<0.01)。见图6、表4。

图6 各组RAW264.7细胞破骨分化(TRAP染色,×40)
表4 各组RAW264.7细胞TRAP阳性数量比较()

表4 各组RAW264.7细胞TRAP阳性数量比较()
注:与空白对照组比较,##P<0.01;与RANKL组比较,**P<0.01
TRAP+nuclei 0 452.7±19.7##55.7± 9.4**组别空白对照组RANKL组高浓度单体复方组n3 3 3
3.6.3 单体复方抑制RANKL诱导的活性氧活性
各组RAW264.7细胞干预48 h,用DCFH-DA荧光探针检测细胞内ROS含量。与空白对照组比较,RANKL组细胞荧光强度明显增强,表明RAW264.7细胞内产生大量ROS(P<0.05);与RANKL组比较,高浓度单体复方组细胞有少量荧光(P<0.05),表明生血补髓汤单体复方可显著抑制RAW264.7细胞内ROS的产生。见表5。
表5 各组RAW264.7细胞ROS含量比较(,荧光强度)

表5 各组RAW264.7细胞ROS含量比较(,荧光强度)
注:与空白对照组比较,#P<0.05;与RANKL组比较,*P<0.05
ROS 11.82±0.86 21.72±2.21#12.84±0.96*组别空白对照组RANKL组高浓度单体复方组n 3 3 3
3.6.4 单体复方对RAW264.7细胞IL6、PTGS2、TNFα、RELAmRNA表达的影响
KEGG富集分析结果提示,TNF信号通路是富集程度最高且与生血补髓汤治疗ONFH密切相关的通路,因此,选取该通路相关靶点IL6、PTGS2、TNFα、RELA,检测其mRNA表达。分别于干预1、3、5 d检测各组细胞IL6、PTGS2、TNFα、RELA mRNA表达。干预1 d,与RANKL组比较,高浓度单体复方组RAW264.7细胞破骨分化中IL6 mRNA表达水平显著下调,差异有统计学意义(P<0.01);干预3 d,与RANKL组比较,高浓度单体复方组RAW264.7细胞破骨分化中IL6、TNFα mRNA表达水平显著下调,差异均有统计学意义(P<0.05,P<0.01);干预5 d,与RANKL组比较,高浓度单体复方组RAW264.7细胞破骨分化中IL6、PTGS2、TNFα、RELA mRNA表达水平显著下调,差异均有统计学意义(P<0.05,P<0.01)。见表6。
表6 各组RAW264.7细胞干预不同时点IL6、PTGS2、TNFα、RELA mRNA表达比较()
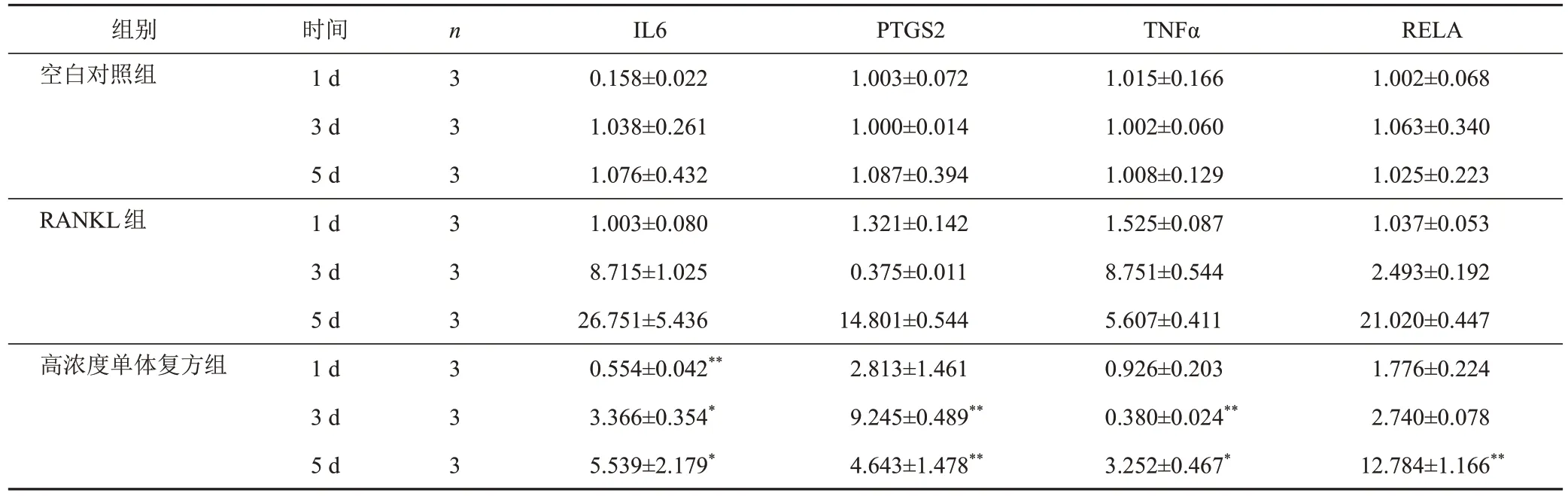
表6 各组RAW264.7细胞干预不同时点IL6、PTGS2、TNFα、RELA mRNA表达比较()
注:与RANKL组同时点比较,*P<0.05,**P<0.01
RELA 1.002±0.068 1.063±0.340 1.025±0.223 1.037±0.053 2.493±0.192 21.020±0.447 1.776±0.224 2.740±0.078 12.784±1.166**组别空白对照组RANKL组高浓度单体复方组时间1 d 3 d 5 d 1 d 3 d 5 d 1 d 3 d 5 d n 3 3 3 3 3 3 3 3 3 IL6 0.158±0.022 1.038±0.261 1.076±0.432 1.003±0.080 8.715±1.025 26.751±5.436 0.554±0.042**3.366±0.354*5.539±2.179*PTGS2 1.003±0.072 1.000±0.014 1.087±0.394 1.321±0.142 0.375±0.011 14.801±0.544 2.813±1.461 9.245±0.489**4.643±1.478**TNFα 1.015±0.166 1.002±0.060 1.008±0.129 1.525±0.087 8.751±0.544 5.607±0.411 0.926±0.203 0.380±0.024**3.252±0.467*
4 讨论
依据临床分期、病灶范围和位置,ONFH可予髋关节置换术和保髋治疗,保髋治疗包括手术保髋和非手术保髋。中医药治疗在预防股骨头塌陷、坏死,延缓髋关节置换术的时间有独特优势,中国ONFH病例的中医药治疗率达72%[23]。ONFH病理过程包括股骨头发生缺血坏死,以及之后出现的坏死区的修复[24]。组织病理学研究结果显示,坏死区骨组织骨小梁表面成骨细胞数量显著减少、骨形成功能减弱,而破骨细胞数量异常增加、骨吸收功能增强[25-26]。在ONFH的早期阶段可发现破骨细胞活性呈显著增强状态,若不加干预,随着破骨细胞活性升高,其发展成晚期ONFH将极为迅速[27]。破骨细胞在分化成熟过程中会分泌大量炎性因子,升高骨髓微环境中炎症水平,而这些炎性因子又可进一步促进破骨分化,炎性因子与破骨分化存在密切联系[28-30]。在ONFH早期,炎性因子大量释放,导致免疫细胞浸润大血管区域,诱发血管区域的免疫炎性反应,继续损害血管,加重病情[31-32]。
本研究基于UPLC-Q-TOF-MS技术分析生血补髓汤46种活性成分,并使用TCMIP2.0对鉴定的活性成分进行分析,找到生血补髓汤中关键成分如阿魏酸、绿原酸、芍药苷、梓醇、槲皮素、山柰酚等。阿魏酸是当归、川芎的主要活性成分[19]。吴建良等[33]发现阿魏酸能降低一氧化氮浓度,效果与药物浓度呈正相关,可有效抑制炎症因子如IL-1β、IL-6和TNF-α表达。绿原酸是刺五加、五加皮、红毛五加皮的主要活性成分,具有抗氧化和抗炎特性[20-21]。绿原酸可通过清除细胞内ROS,抑制P-p38 MAPK磷酸化和上调NF-κB信号通路而抑制IL-8产生,从而起到抗炎作用[34]。芍药苷是白芍的主要有效成分,其镇痛作用可能与升高血清和大脑皮层中β-内啡肽水平、减少大脑皮层前列腺素E2(PGE2)生成或释放有关[22,35]。梓醇是生地黄质量筛选的主要活性成分,在“成骨-破骨”共育体系中促进成骨细胞增殖,增强成骨细胞碱性磷酸酶活性,抑制破骨细胞活性,上调成骨细胞雌激素受体β mRNA表达[36-37]。槲皮素类黄酮成分包括槲皮素及山柰酚等,槲皮素类成分具有抗氧化、抗炎等药理作用[38]。研究发现,山柰酚对脂多糖诱导的巨噬细胞RAW264.7中PGE2的产生有明显抑制作用[39]。
根据活性成分对应的靶点进行分析,构建药物-成分-靶点-通路多维网络,对治疗靶点进行GO和KEGG富集分析,得到生血补髓汤治疗ONFH的信号通路,其中富集最显著且与ONFH密切相关的是TNF信号通路,IL6、PTGS2、TNF、RELA是多维网络中与该信号通路密切相关的靶点。炎性因子如IL-6、IL-4和TNF-α可能是ONFH疼痛症状的主要诱因,ONFH患者血清TNF-α和IL-6水平较健康志愿者偏高[31,40]。TNF-α在炎症条件下直接或通过增加成骨细胞和基质细胞的RANKL和M-CSF表达刺激破骨细胞形成和激活[41]。研究发现,股骨头坏死标志基因PTGS2主要参与炎症免疫反应,这可能是疾病中期疼痛加重、功能受限的原因之一[42]。ROS是破骨细胞分化和形成的关键因素,抗氧化剂可以通过抑制ROS水平和抑制破骨细胞延缓ONFH进展[43]。Cheng等[44]研究发现,可以通过抑制PTGS2和PI3K-Akt途径抑制ROS产生并发挥抑制破骨细胞活性的作用。RELA能够阻断RANKL诱导的JNK-Bid凋亡通路,从而促进破骨细胞分化[45]。TNF信号通路具有调节破骨细胞活性及骨吸收的作用,其中分离出的糖蛋白骨保护素(OPG)对骨形成也具有积极的保护作用[46]。而RANKL/RANK/OPG信号通路在调节骨重塑、破骨细胞分化和多种病理状态过程中起着关键作用。由于其能够调节成骨细胞和破骨细胞之间的平衡,以及骨髓间充质干细胞中成骨细胞和成脂的异常转分化,因此被认为在ONFH的分子机制中起着核心作用[47]。
以上结果提示,生血补髓汤治疗ONFH靶点主要与炎症反应和氧化应激相关,相关靶点主要富集在炎症相关信号通路,而炎症反应是ONFH中晚期的典型表现。本研究采用RANKL诱导RAW264.7细胞破骨分化模型,并予生血补髓汤单体复方进行干预,同时检测RAW264.7细胞破骨分化过程中ROS含量及IL6、PTGS2、TNFα、RELA mRNA表达。结果显示,生血补髓汤单体复方可显著减少RANKL诱导RAW264.7细胞破骨分化中成熟破骨细胞数量、细胞浆内ROS含量及IL6、PTGS2、TNFα、RELA mRNA表达。
本研究通过UPLC-Q-TOF-MS技术对生血补髓汤中的活性成分进行快速、全面识别,可为进一步研究生血补髓汤干预ONFH及阐明生血补髓汤药理作用提供依据;同时,基于TCMIP2.0使用网络药理学研究方法和细胞实验验证探究其治疗ONFH的作用机制,可为后续研究提供指导。
