HLA-E基因表达沉默对人乳腺癌细胞生物学行为的影响
2023-02-14吴振村
吴振村,周 艳
(1.张家口市妇幼保健院,河北 张家口 075000;2.河北北方学院,河北 张家口 075000)
乳腺癌(breast cancer,BC)是女性最常见的恶性肿瘤之一,尽管早期诊断和治疗方法的进步使乳腺癌死亡率下降了38%[1],但肿瘤的异质性、治疗中的耐药性、肿瘤的转移和复发,对乳腺癌的治疗提出了新的挑战[2],为此临床和科研工作者也在不断尝试新的治疗方法。对乳腺癌分子基础的研究发现,癌基因和抑癌基因等多种基因参与了乳腺癌发生发展,基因治疗成为乳腺癌治疗的一个策略[3]。目前采用RNA 干扰技术靶向沉默特定基因在乳腺癌治疗研究中取得了较好的效果。郭智慧[4]和管海涛[5]等采用小分子RNA 干扰(small interfering RNA,siRNA)技术分别沉默乳腺癌细胞DEK和survivin基因,结果均发现可显著抑制乳腺癌细胞的增殖并诱导其凋亡。我们前期研究发现人类白细胞抗原-E(human leukocyte antigen-E,HLA-E)基因多态性可能与乳腺癌遗传易患性相关[6-7];Szekely等[8]分析了原发性和转移性乳腺癌样本中免疫相关基因水平,发现HLA-E基因在乳腺癌转移灶表达水平较高,是潜在的治疗靶点。本研究拟采用小分子RNA技术沉默乳腺癌细胞HLA-E基因表达,探讨其对乳腺癌细胞增殖、凋亡、侵袭和迁移的影响,为乳腺癌的靶向治疗提供新思路。
1 材料与方法
1.1 材 料
1.1.1 主要试剂Vigofect 转染试剂购自北京威格拉斯生物技术有限公司;DMEM 干粉购自Gibco 公司;SuperRT cDNA Synthesis Kit 和UltraSYBR Mixture(Low ROX)均购自北京康为世纪生物有限公司;鼠抗人HLA-E 单克隆抗体(ab11821)购自Abcam 公司;CCK-8 试剂盒和ECL 化学发光试剂盒购自碧云天公司;Transwell侵袭小室购自美国Corning公司;
1.1.2 仪器化学发光成像仪购自北京原平皓生物公司;生物安全柜购自美国Thermo公司;荧光定量PCR仪购自美国伯乐公司;琼脂糖水平电泳仪购自北京六一公司;CO2培养箱购自美国Napco公司。
1.1.3 细胞培养人乳腺癌细胞MDA-MB-231 由本室保存,常规培养于含10%胎牛血清的DMEM培养液中,置于37 ℃、CO2体积分数为5%的培养箱进行细胞培养和传代。
1.2 方 法
1.2.1 siRNA 的设计从NCBI GenBank 数据库中获取人HLA-E mRNA 序列(GenBank 登录号:X56841.1),利用siRNA在线设计软件DSIR(http://biodev.extra.cea.fr/DSIR/DSIR.html)及RNA 二级结构分析软件RNAdraw 设计并筛选出与HLA-E mRNA 容易结合的siRNA序列,作为HLA-E siRNA,采用随机打乱的方法设计阴性对照siRNA序列。
1.2.2 转染siRNA至乳腺癌细胞实验设立空白对照组(不加任何试剂)、阴性对照组(转染阴性对照siRNA)、 脂 质 体 组 (只 加 2 μL 转染 试 剂 Vigofect)、HLA-E siRNA组(转染HLA-E siRNA)。取对数生长期的人乳腺癌细胞MDA-MB-231,调整细胞浓度为4×105个/mL,接种于6孔板,培养细胞至汇合度为70%~80%。取HLA-E siRNA序列及阴性对照siRNA分别经转染试剂Vigofect 介导转染至细胞,方法如下:5 μg siRNA 序 列 加 入 100 μL 生 理 盐 水 混 匀 , 2 μL Vigofect 转染试剂加入100 μL 生理盐水混匀,将siRNA 溶液逐滴加入转染试剂溶液,轻轻混匀,室温孵育15 min后逐滴加入细胞培养液中,轻轻混匀,继续培养至48 h。
1.2.3 实时荧光定量PCR 检测HLA-E mRNA 表达水平收集转染48 h的各组细胞,TRIzol裂解法提取细胞总RNA,Eppendorf 核酸定量仪检测RNA 浓度和纯度,并行1.5%琼脂糖凝胶电泳鉴定RNA 的完整性。取1 μg 总RNA,反转录合成cDNA,实时荧光定量PCR(quantitative real-time PCR, qPCR)检 测 HLA-E mRNA 表达。HLA-E上游引物 5′-CACGTGCCATGTG CAGCA-3′,下游引物 5′-CACAGCTCCAGAGACCA-3′;内参GAPDH上游引物 5′-TCAACGACCACTTTGT CAAGCTCA-3′ , 下 游 引 物 5′- GCTGGTGGTCCAG GGGTCTTACT-3′。反应过程为:95 ℃预变性5 min,95 ℃ 、15 s,60 ℃、1 min 进行 40 个循环,收集荧光数据,采用2-ΔΔCT法分析HLA-E mRNA 的相对表达水平。
1.2.4 Western blot 法检测HLA-E 蛋白表达水平收集转染48 h 的各组细胞,用预冷的RIPA 裂解液提取细胞总蛋白,BCA 法测定蛋白浓度,按每孔80 μg上样量进行10% SDS-PAGE凝胶电泳,将电泳分离后蛋白转移至PVDF 膜,5%脱脂奶粉封闭2 h,HLA-E单抗(1∶2 000 稀释) 4 ℃孵育过夜,PBS-T 洗涤后,加入HRP-羊抗鼠二抗(1∶5 000 稀释)室温孵育2 h,PBS-T洗涤后,加入ECL底物显色。
1.2.5 CCK-8 法检测细胞增殖抑制率转染48 h 的各组细胞中加入10 μL CCK-8 溶液,继续培养2 h,酶标仪测定450 nm处吸光度值D(450),按下式计算细胞增殖抑制率。
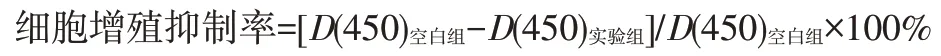
1.2.6 流式细胞术检测细胞凋亡率收集转染48 h的各组细胞,调整细胞浓度为1×106个/mL,细胞悬液加入Annexin V-FITC/PI(碘化丙啶)染色后,流式细胞术检测各组细胞凋亡情况。
1.2.7 Transwell 实验检测细胞侵袭和迁移能力收集转染48 h 的各组细胞,调整细胞浓度为1×105个/mL,取150 μL 加入预先用Matrigel 包被基底膜的Transwell小室的上室中,24孔板下室内加入含血清的完全培养基500 μL,培养24 h后,取出小室,PBS洗涤两次,用棉签小心擦去微孔膜内层细胞,95%乙醇固定5 min,4 g/L 结晶紫染色,倒置显微镜下计数,随机计数5 个视野,观察各组细胞侵袭能力。细胞迁移能力检测步骤与上述相同,只是小室的上室中不需要Matrigel包被基底膜。
1.2.8 统计学分析应用SPSS 19.0 统计软件,采用单因素方差分析进行数据分析,两组之间比较采用LSD法。以α=0.05为检验水准。
2 结 果
2.1 HLA-E siRNA的设计
利用siRNA 在线设计软件DSIR 及RNA 二级结构分析软件RNAdraw,筛选出3 条HLA-E siRNA 序列(siRNA-1、siRNA-2、siRNA-3),如表 1 所示。将这些序列与阴性对照siRNA序列送上海生工生物合成。

表1 靶向HLA-E基因的siRNA序列
2.2 转染HLA-E siRNA 可抑制细胞中HLA-E mRNA表达
提取的细胞总RNA 行1.5%琼脂糖凝胶电泳,结果如图1 所示,电泳图每条泳道有3 条清晰条带,分别是28 S、18 S 和5 S,说明提取的总RNA 完整性好。qPCR 检测各组乳腺癌细胞HLA-E mRNA 的表达水平,结果如图2 所示,转染HLA-E siRNA-1、siRNA-2和siRNA-3组细胞HLA-E mRNA水平显著低于空白对照组、阴性对照组及脂质体组(均为P<0.01)其中siRNA-2 组HLA-E mRNA 水平最低,空白对照组、阴性对照组及脂质体组HLA-E mRNA 表达水平差异无统计学意义(P>0.05)。这表明,课题组设计的HLA-E siRNA 转染可明显抑制乳腺癌细胞HLA-E mRNA 表达。本研究选取siRNA-2 为有效的siRNA 用于后续实验,记为HLA-E siRNA。

图1 琼脂糖凝胶电泳鉴定提取的细胞总RNA完整性

图2 qPCR检测乳腺癌细胞HLA-E mRNA表达水平
2.3 转染HLA-E siRNA 可抑制细胞中HLA-E 蛋白表达
Western blot 检测结果见图3,可见转染48 h 后,HLA-E siRNA 组细胞未检测到HLA-E 蛋白表达,空白对照组、阴性对照组及脂质体组均有HLA-E蛋白表达。这表明,转染HLA-E siRNA 可抑制乳腺癌细胞HLA-E蛋白表达。

图3 Western blot检测乳腺癌细胞HLA-E蛋白的表达
2.4 转染HLA-E siRNA可显著抑制乳腺癌细胞生长
CCK-8 法检测各组细胞增殖情况,结果见图4,阴性对照组和脂质体组细胞增殖抑制率分别为(5.89±0.62)%和(8.18±0.83)%,HLA-E siRNA 转染组的细胞增殖抑制率为(49.83±6.65)%,显著高于阴性对照组和脂质体组,差异具有统计学意义(P<0.01)。由此可见,转染HLA-E siRNA可明显抑制乳腺癌细胞增殖。
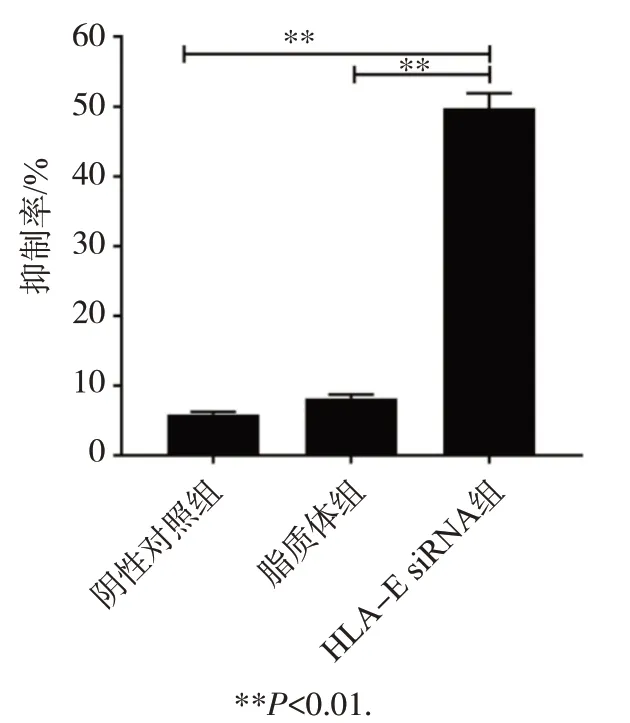
图4 CCK-8法检测乳腺癌细胞生长的抑制作用
2.5 转染HLA-E siRNA可诱导乳腺癌细胞凋亡
利用流式细胞术检测各组乳腺癌细胞凋亡率,结果如图5 所示,空白对照组细胞凋亡率为(2.14±0.98)%,阴性对照组细胞凋亡率为(2.76±0.68)%,脂质体组细胞凋亡率为(3.21±1.05)%,HLA-E siRNA 转染组细胞凋亡率为(12.63±1.50)%,显著高于空白对照组和脂质体组,差异具有统计学意义(P<0.01)。由此可见,转染HLA-E siRNA可显著诱导乳腺癌细胞凋亡。

图5 流式细胞术检测乳腺癌细胞的凋亡率
2.6 转染HLA-E siRNA可抑制乳腺癌细胞侵袭及迁移能力
HLA-E siRNA 转染 MDA-MB-231 细胞 48 h 后,Transwell 实验检测细胞侵袭能力,结果如图6 所示,HLA-E siRNA 转染组穿过Matrigel 包被的微孔膜的细胞数目是(31.1±2.2)个,显著少于空白对照组(52.3±2.0)个、阴性对照组(49.2±1.5)个和脂质体组(48.4±3.1)个,且后面3组之间的差异无统计学意义(P>0.05)。这表明转染HLA-E siRNA可明显抑制乳腺癌细胞MDA-MB-231的侵袭能力。

图6 Transwell实验检测HLA-E siRNA转染后MDA-MB-231细胞的侵袭能力
Transwell 实验检测细胞迁移能力结果如图7 所示,HLA-E siRNA 转染组穿过Matrigel 未包被的微孔膜的细胞数目是(29.2±3.1)个,显著少于空白对照组(48.3±2.1)个、阴性对照组(46.3±1.4)个和脂质体组(47.2±2.3)个,且后面3组之间的差异无统计学意义(P>0.05)。说明转染HLA-E siRNA 可明显抑制乳腺癌细胞MDA-MB-231的迁移能力。

图7 Transwell实验检测HLA-E siRNA转染后MDA-MB-231细胞的迁移能力
3 讨论
HLA-E由主要组织相容性复合体(major histocompatibility complex,MHC)编码,属于非经典的HLA-I类基因(HLA-Ib)[9]。其具有多态性有限[10]、组织分布广泛、正常细胞表面低表达等特点,但在肿瘤、骨髓移植、自身免疫性疾病等病理条件下,常检测到HLA-E 的异常表达[7]。HLA-E 在乳腺癌组织表达的相关研究发现[11],约27%乳腺浸润性导管癌组织高表达HLA-E,且约21%高异型性核病变中高表达HLA-E。De Kruijf等[12]也发现,瘤组织HLA-E高表达会导致乳腺癌无复发期恶化,乳腺癌可通过上调或下调经典HLA-Ia 类基因和非经典HLA-Ib 类基因逃避宿主免疫系统的清除作用。提示HLA-E可能是预测乳腺癌患者预后的重要因素。相似的是,我们前期研究分析HLA-E基因多态性及血浆可溶性HLA-E水平与乳腺癌相关性,也发现HLA-E可能是乳腺癌的易感基因[6-7]。Yazdi等[13]分析了197例非小细胞肺癌组织CD8+T细胞浸润与HLA-E 表达,发现HLA-E 可能是非小细胞肺癌患者总生存率的独立负性预后因素,研究认为HLA-E高表达阻碍了CD8+T细胞的作用,可作为预测免疫治疗反应的标志物。Hiraoka 等[14]研究也发现,HLA-E高表达与胰腺导管腺癌患者生存期较短呈显著相关。Huang[15]和Ozgul[16]等也发现,结直肠癌(瘤)组织HLA-E高表达可能是肿瘤免疫逃逸的一种机制,是结直肠癌(瘤)免疫治疗的靶点。
因此,我们采用siRNA 技术,靶向乳腺癌细胞HLA-E基因。首次探讨抑制HLA-E基因对乳腺癌细胞增殖、侵袭、迁移的影响,以期为乳腺癌免疫治疗提供新靶点。siRNA 是由外源或内源性的双链RNA(double strand RNA,dsRNA)导入细胞而引起的与dsRNA 同源的mRNA 降解,进而高效、特异地阻断体内相应的基因表达[17]。研究[18]发现,利用siRNA 技术分别沉默人乳腺癌细胞SKBR3 的HER2基因和乳腺癌细胞ZR75-l 的uPAR基因均可显著抑制乳腺癌细胞增殖并诱导凋亡;siRNA 技术靶向沉默趋化因子受体CXCR4基因可明显降低乳腺癌细胞MDA-MB-231 的侵袭性[19-20];利用siRNA 技术沉默多药耐药基因,还可明显提高人乳腺癌细胞MCF-7耐药株对化疗药物长春新碱、阿霉素及紫杉醇的敏感性[21]。我们研究也发现,HLA-E siRNA 转染至人乳腺癌细胞系MDAMB-231 后可显著抑制乳腺癌细胞HLA-E 表达,且可明显抑制乳腺癌细胞增殖、侵袭及迁移能力,诱导癌细胞凋亡。因此,采用siRNA技术靶向抑制HLA-E表达可能是潜在的乳腺癌基因治疗的又一新方法。
我们研究的不足之处是未能分析siRNA 技术抑制HLA-E 表达及抑制乳腺癌细胞增殖、侵袭迁移的机制。Li 等[18]研究发现,siRNA 技术沉默乳腺癌细胞HER2和uPAR表达引起了MAPK信号通路的抑制,导致ERK活性降低及p38/ERK活性比值升高从而抑制了癌细胞生长和诱导癌细胞凋亡。因此我们后续研究需将抑制HLA-E表达进而抑制乳腺癌细胞增殖、侵袭及迁移的机制是否影响信号通路分子MAPK等作为重点。
