SPON2在甲状腺乳头状癌中的表达及其临床意义
2023-02-14胡学义苏才武
胡学义,沈 丰,武 伦,苏才武,魏 涧
(湖北医药学院附属国药东风总医院普外科,湖北 十堰 442000)
甲状腺癌(thyroid cancer,TC)是全球范围最常见的恶性内分泌肿瘤,1990—2019年,甲状腺癌的发病率显著上升,增速在所有的恶性肿瘤中位居第一,甲状腺癌分为多种类型,其中甲状腺乳头状癌(papillary thyroid carcinoma,PTC)占比约为85%,是甲状腺最常见的病理类型[1-4]。脊椎蛋白2(spondin 2,SPON2)又称为M-spondin 或者DIL-1,该蛋白分泌至细胞外基质,在先天性免疫和适应性免疫应答中发挥着重要的作用。近年来相关研究表明,SPON2 蛋白在前列腺癌、直肠癌、卵巢癌等肿瘤组织中均高表达[5]。目前未见SPON2与甲状腺癌预后关系的报道。本研究以PTC为例研究SPON2 在甲状腺癌及癌旁组织中的表达情况,利用相关的生物信息学数据库,分析SPON2与甲状腺癌临床分期、预后及免疫细胞浸润之间的关系,以期寻找SPON2作为甲状腺癌潜在治疗靶点的证据。
1 材料与方法
1.1 标本来源
收集2020-07-04—2020-11-24 湖北医药学院附属国药东风总医院PTC 及其癌旁组织新鲜手术标本7例,立即冻存于-80 ℃冰箱备用。并收集2019-01-01—2020-12-17该院病理科存档PTC手术切除石蜡标本68 例以及所对应的PTC 癌旁标本(距肿瘤边缘至少2 cm)。纳入标准:①病理明确诊断为PTC;②此前未接受手术、放化疗、靶向药物治疗等抗肿瘤相关治疗;③临床病理资料完整。排除标准:①合并其他部位肿瘤;②合并其他类型甲状腺癌。68例入组病例中男性病例19 例,女性49 例。该研究获湖北医药学院附属国药东风总医院伦理委员会批准(伦理审批编号LW-2022-005)。
1.2 主要试剂及仪器
SPON2 抗体购自 Protein Tech 公 司 , HRP 标 记 的山羊抗兔IgG抗体购自Gene Tex公司,总RNA提取试剂盒和一步法-反转录荧光定量PCR(quantitative real-time PCR,qPCR)试剂盒均购自TIANGEN公司。
1.3 PTC组织SPON2 mRNA表达的检测
取冻存于-80 ℃冰箱中的新鲜PTC 癌及癌旁组织标本,用总RNA提取试剂盒提取总RNA,分光光度计测量总RNA 的浓度及纯度。然后用一步法qPCR 试剂盒检测PTC 癌及癌旁组织中SPON2 的mRNA 表达水平。引物由上海生工生物工程有限公司合成,上游引物 序 列 为 5′-GATTGTAGACAGCGCCTCAGTTCC-3′,下游引物为5′-GACGCACTCAGCCTCTTCTTCG-3′;内参 基 因β-actin的 上 游 引 物 为 5′-ACTATCGGCAAT GAGCGGTTCC-3′,下游引物为 5′-CTGTGTTGGCAT AGAGGTCTTTACG-3′。qPCR 反应条件为:50 ℃、30 min(逆转录),95 ℃、3 min(预变性),95 ℃、15 s、60 ℃、30 s(40个循环)。每个样本设3个复孔,取平均CT值作为该样本的最终CT值。以2-ΔΔCT表示组织SPON2 mRNA相对表达水平。
1.4 PTC组织中SPON2蛋白表达的检测
取PTC 及其癌旁石蜡标本,切片后放置于60 ℃烤箱中烤片3 h,二甲苯脱蜡后放入柠檬酸抗原修复液中进行热修复,使用H2O2室温静置孵育10 min,滴加SPON2 兔多克隆抗体(1∶500 稀释)于4 ℃冰箱孵育过夜;滴加辣根过氧化物酶标记的山羊抗兔二抗(1∶500 稀释),室温孵育30 min;室温下用显色剂(DAB)显色8 min后用自来水冲洗1 min;苏木素复染,梯度乙醇脱水,封片。用PBS 代替一抗作为阴性对照,人前列腺增生组织作为阳性对照。结合文献[5],使用显微镜(×400)随机选择5个视野进行评分。阳性细胞比例≤0%记 1 分,10%~50%(含)记 2 分,50%~75%(含)记 3分,>75%以上记4 分;观察染色强度,不着色记1分,弱染色记2分,中等强度染色记3分,强染色记4分。综合两者结果,以细胞阳性比例与染色强度乘积得分判断结果:积分≤4 分为阴性,乘积>4 分则为阳性。
1.5 Kaplan Meier-Plotter 分析 SPON2 mRNA 表达与甲状腺癌临床预后的关系
使用Kaplan Meier-Plotter(http://kmplot.com/analysis/)数据库[6]分析SPON2 mRNA 表达水平与甲状腺癌患者的预后关系。在平台中选择“start KM Plotter for pan-cancer”,检索“SPON2”基因,肿瘤类型选择“thyroid carcinoma”, 绘 制 甲 状 腺 癌 “SPON2”mRNA 表达高低与预后相关的总生存率(overall survival,OS)曲线。
1.6 GEPIA 数据库分析SPON2 mRNA 与甲状腺癌临床分期的关系
使用GEPIA(http://gepia.cancer-pku.cn/)数据库[7],检索“SPON2”,选择“Expression DIY”中的“Stage plot”,选择肿瘤名称为“THCA”,然后绘制图形。
1.7 TIMER 数据库分析SPON2 mRNA 在甲状腺癌中的表达与免疫细胞浸润的相关性
进入TIMER(https://cistrome.shinyapps.io/timer/) 数据库[8],使用Gene 模块及Correlation 模块分析在甲状腺癌中SPON2 mRNA 表达和免疫细胞浸润及M2 巨噬细胞标志物之间的关系。
1.8 统计学方法
采用SPSS 23.0 统计分析软件处理数据,GraphPad 8 软件绘制统计图,Kaplan-Meier 法检验比较组间生存率差异,计数资料采用χ2检验及连续校正卡方检验,计量资料采用配对t检验,P<0.05 为差异具有统计学意义。
2 结 果
2.1 PTC中SPON2 mRNA表达水平
qPCR结果见图1,显示PTC组织中SPON2 mRNA相对表达水平为1.705±0.724,明显高于癌旁组织的0.929±0.278,差异具有统计学意义(t=2.698,P=0.036)。

图1 SPON2 mRNA在PTC及其癌旁组织中表达的差异
2.2 PTC中SPON2蛋白的表达与定位
免疫组化检测结果见图2,SPON2 蛋白表达于细胞质及细胞外基质。68例PTC癌组织中,SPON2阳性表达率为82.35%(56/68);在配对的PTC 癌旁组织中,SPON2 阳 性 表 达 率 为 19.12%(13/68)。SPON2 蛋 白在PTC 组织中的表达显著高于相应癌旁组织,差异具有统计学意义(P<0.01)。
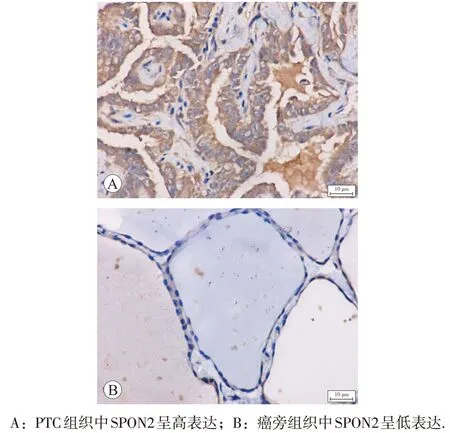
图2 SPON2蛋白在PTC组织及其癌旁组织中的表达(×200)
2.3 SPON2与甲状腺癌临床病理特征的关系
免疫组化分析结果见表1,SPON2 蛋白表达水平与PTC患者年龄、肿瘤最大直径、病灶数、淋巴结是否转移无明显相关(P>0.05)。但在GEPIA 数据库中(图3),SPON2 mRNA 表达水平与甲状腺临床分期相关,III~IV 期SPON2 mRNA 表达水平明显高于I~II 期,差异具有统计学意义(P=0.002)。

图3 SPON2 mRNA 在GEPIA 数据库中不同甲状腺癌临床分期中的表达水平

表1 68例甲状腺癌患者SPON2蛋白表达与临床病理指标的关系
2.4 SPON2 mRNA表达与甲状腺癌患者预后的关系
Kaplan Meier-Plotter 在线平台分析结果见图4,在数据库502个甲状腺癌病例中,SPON2 mRNA 高表达患者较低表达患者的预后更差,OS更短,差异具有统计学意义(P=0.026)。
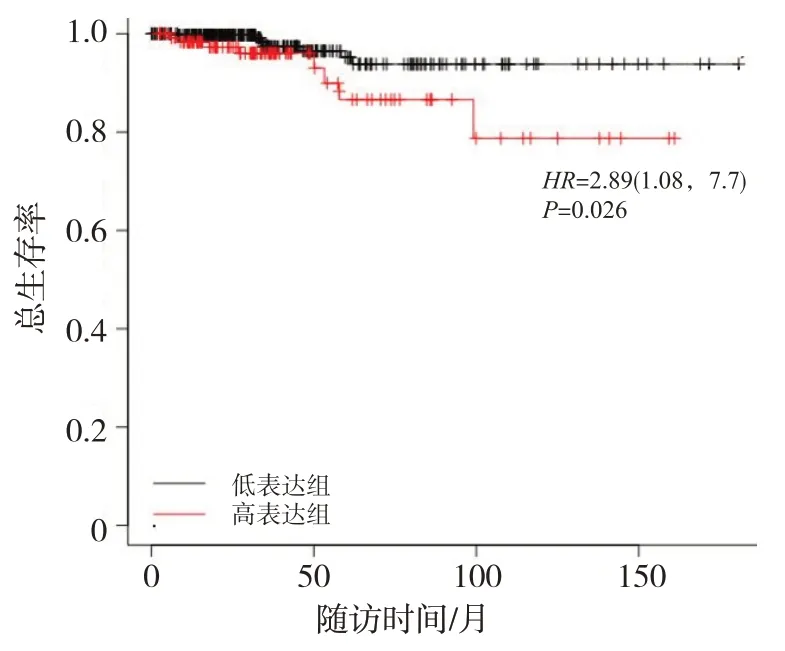
图4 Kaplan Meier-Plotter 分析SPON2 mRNA差异表达与甲状腺癌预后的关系
2.5 SPON2 mRNA表达与甲状腺癌中免疫细胞浸润的相关性
用TIMER 数据库分析在甲状腺癌中SPON2 mRNA 表达与免疫细胞之间的关系,结果见图5,SPON2 mRNA 表达与肿瘤纯度(tumor purity)无明显相关性(P=0.135),而与 B 细胞、CD8+T 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞、树突状细胞浸润呈正相关(均为P<0.01);与 CD68、CD163、CD206 呈正相关(均为P<0.01)。

图5 TIMER数据库中SPON2 mRNA与甲状腺癌免疫细胞浸润的关系
3 讨论
肿瘤的进展与转移涉及诸多因素,其中肿瘤微环境发挥着重要的作用。细胞外基质是肿瘤微环境中的重要构成部分,通过细胞外基质,肿瘤细胞可以加强运动和侵袭能力,并能通过重构后的细胞外基质发生远处转移[9]。
SPON2 作为一种细胞外基质,参与先天免疫反应[10],SPON2 具有招募炎症细胞、激活固有免疫应答等多种功能[11-12]。近年来,SPON2 与肿瘤相关性研究逐渐增多。研究表明,SPON2 蛋白在肺癌、结直肠癌、卵巢癌、乳腺癌等多种肿瘤中呈高表达状态,有望成为癌症新的治疗靶点[13-15]。SPON2 能促进胃癌细胞的增殖、迁移和侵袭[12];沉默SPON2 能够降低小鼠胃癌细胞生长增殖能力,而过表达SPON2可加强肿瘤细胞生长增殖能力[16];SPON2 在胃癌中高表达,是患者不良预后的危险因素[17]。敲除SPON2基因能够抑制肾透明细胞癌细胞的侵袭和迁移能力[18]。上述这些研究提示SPON2可能与肿瘤的恶性进展有关。
本研究通过免疫组化和qPCR 方法检测甲状腺癌中最常见病理类型PTC癌组织及癌旁组织中SPON2的表达情况,结果发现,SPON2在PTC癌组织中表达显著升高。通过GEPIA数据库分析发现,SPON2 mRNA表达差异与甲状腺临床分期相关,分期越高其表达水平越高,表明SPON2在甲状腺癌的进展中可能扮演着重要的角色。利用Kaplan Meier-Plotter 数据库对502例甲状腺癌样本分析发现,高表达SPON2 mRNA的甲状腺癌患者预后差于低表达患者,SPON2 mRNA高表达是甲状腺癌患者不良预后的危险因素。进一步通过TIMER 数据库分析在甲状腺癌中SPON2 mRNA 表达与免疫细胞之间的关系,结果显示,SPON2在甲状腺癌中与B 细胞、CD8+T 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞、树突状细胞浸润呈正相关;与CD68、CD163、CD206 呈正相关。而 CD68 是巨噬细胞表面标志物,CD163、CD206则为M2型巨噬细胞的特异性标志物[19-21]。
肿瘤组织由癌细胞、血管、免疫细胞、细胞外基质及信号分子等成分组成[22-23]。免疫细胞中的肿瘤相关巨噬细胞,可分为M1 型和M2 型,M1 型巨噬细胞能抑制及杀灭癌细胞;而M2 型巨噬细胞能分泌多种细胞因子,可促进肿瘤的生长及转移[24]。研究表明,SPON2 在结直肠癌中促进M2 极化的肿瘤相关巨噬细胞浸润和癌症进展[25]。侯飞等[26]报道,M2巨噬细胞在甲状腺癌的发生与发展中起促进作用。本研究发现,SPON2 在甲状腺癌中与M2 巨噬细胞特异性标志物呈正相关,表明SPON2 可能通过M2 巨噬细胞促进甲状腺癌进展。有研究发现,癌细胞可以降低自身抗原性,以逃避特异性T 细胞的清除,肿瘤细胞可下调肿瘤抗原的表达,从而逃脱免疫细胞的杀伤[27]。而肿瘤组织周围浸润的免疫细胞能释放促炎性细胞因子及趋化因子,以加强肿瘤细胞的生长增殖能力[28]。甲状腺癌SPON2高表达患者肿瘤中除巨噬细胞外,其他免疫细胞也随SPON2表达升高而增多,表明SPON2可能也通过除巨噬细胞外的其他免疫细胞在甲状腺肿瘤免疫微环境中发挥了作用。而甲状腺癌中SPON2与其他免疫浸润细胞之间的关系鲜见报道,有待进一步深入研究探索。
综上所述,SPON2 在PTC 癌组织中高表达,SPON2 蛋白可能成为临床甲状腺癌诊断新的标志物,并对评判肿瘤临床分期、预后具有重要意义,是一种甲状腺癌的潜在治疗靶点。SPON2 在甲状腺癌中与M2 巨噬细胞特异性标志物正相关,表明SPON2 可能通过M2 巨噬细胞促进甲状腺癌进展。SPON2 还可能通过B 细胞、CD8+T 细胞、CD4+T 细胞、中性粒细胞、树突状细胞在肿瘤的进展中发挥作用,为SPON2在肿瘤中的研究提供了新的方向。
