屠宰过程中滩羊胴(屠)体表面微生物污染水平的变化
2023-02-14邹昊臧明伍乔晓玲白京李贺楠史宇璇吴嘉佳徐晨晨
邹昊,臧明伍*,乔晓玲*,白京,李贺楠,史宇璇,吴嘉佳,徐晨晨
(1.中国肉类食品综合研究中心,北京 100068;2.肉类加工技术北京市重点实验室,北京 100068)
宁夏盐池的滩羊,因其肉质细嫩,无腥膻味,被列为宁夏“五宝”之一[1]。自2005年成功注册“盐池滩羊”国字号驰名品牌以后,盐池滩羊肉的价格一路上涨,滩羊产业也逐渐成为盐池县经济发展的支柱[2]。尽管如此,目前盐池的滩羊产业仍存在许多问题,限制着其进一步的发展。其中之一就是当地的滩羊屠宰加工企业在生产过程中对微生物污染的控制意识较差,导致宰后胴体表面的微生物污染水平较高,生产的生鲜滩羊肉产品货架期很短,绝大部分产品只能以冻品的形式销往外省[3]。
国内有关牛羊屠宰加工过程中胴(屠)体表面微生物污染情况的研究相对较少,且研究结果对企业改进其屠宰工艺,降低宰后胴体表面微生物污染水平的指导性不强。其原因主要在于,首先,国内的相关研究中均没有对采样企业的屠宰加工流程、工艺和条件进行详细描述,导致所得数据和结论的研究条件不明确[4-11];其次,绝大部分研究仅对一个或几个环节中胴(屠)体表面的微生物污染情况进行了分析,缺少对整个屠宰加工过程的研究。最后,部分研究中采集的样本数量过少,易导致数据代表性差,统计发生偏移和所得结论与事实不符等问题[5,7,10]。
国外的相关研究较多,有研究人员对不同企业宰后的羊胴体进行采样,研究了不同屠宰规模和工艺对宰后羊胴体表面微生物污染水平的影响[12-18];还有学者对羊胴(屠)体平均菌落总数(aerobic plate count,APC)在整个屠宰过程中的动态变化[19-21]及各部位APC在扯皮、去内脏、冲洗和排酸等一个或几个环节前后的变化[21-23]进行了研究。然而,由于国外的屠宰加工企业在生产规模、机械化程度、屠宰工艺和条件等方面与国内企业有较大区别,其研究结果对国内企业的指导意义十分有限。因此,通过对盐池当地的滩羊屠宰加工企业进行采样,以胴(屠)体平均APC作为指示指标,研究整个屠宰加工过程中滩羊胴(屠)体表面微生物污染水平的变化,对当地企业发现生产过程中的微生物污染隐患,改进生产工艺和条件,降低宰后胴体表面的微生物污染水平是很有必要的。
本研究通过对盐池当地某屠宰加工企业日常生产过程中各个环节的滩羊胴(屠)体的不同部位进行微生物采样,以胴(屠)体平均APC作为指示指标进行统计和分析,探究滩羊胴(屠)体表面微生物污染水平在整个屠宰加工过程中的变化规律并结合该企业的屠宰加工工艺和条件,对导致变化的主要原因进行分析。以期帮助该企业发现生产过程中的微生物污染隐患,同时也为其他有类似屠宰加工流程、工艺和条件的滩羊屠宰加工企业提供经验,促进盐池滩羊产业的进一步发展。
1 材料与方法
1.1 材料与试剂
氯化钠(分析纯):国药集团化学试剂有限公司;营养琼脂(CM107):北京路桥技术股份有限公司;15 mL离心管(430790):美国Corning公司;一次性无菌棉签(8 cm):石家庄康尔泰医疗器械有限公司;一次性无菌培养皿(90 mm)、一次性无菌采样板(5 cm×5 cm):常德比克曼生物科技有限公司。
1.2 仪器与设备
电子天平(BSA822-CW):德国Sartorius公司;自然对流培养箱(BD260):德国BINDER公司;生物安全柜(AIRSTREAM ClassⅡ):新加坡ESCO公司;高压灭菌器(GI54DWS):致微(厦门)仪器有限公司。
1.3 方法
本研究中与样本接触的医用棉签、采样板和生理盐水等试剂耗材均经过环氧乙烷、辐照或121℃,15 min的湿热灭菌;涉及的操作,除采样和培养外,均在生物安全柜内完成。
1.3.1 采样企业的屠宰加工流程、工艺和条件
该企业的日屠宰量平均为300头左右,宰前羊胸部、腹部和四肢的皮毛均较为干燥且黏附有明显的污物,各部位所携带污物水平与文献[24]类似。该企业的屠宰加工流程、工艺和条件如表1所示,整个屠宰加工过程中,胴(屠)体始终倒挂在生产线上;从宰杀放血到剥皮,屠宰线自动将屠体运送到下一个环节;从扯皮到冷却,工人用手分只或分批将胴(屠)体推到下一个环节,在此过程中,工人的手会与胴(屠)体的背部接触。

表1 采样企业的屠宰加工流程、工艺和条件Table 1 The processing links,practice and techniques of the sampling plant
1.3.2 样本采集
由于剥皮与扯皮,取白脏与取红脏,修整与称重,去尾与燎毛之间的时间间隔仅有3 s~5 s且空间有限,为了尽可能减少采样对企业日常生产的影响,本研究将这些环节各视为一个环节进行采样。此外,为了探究将屠体存放在车间内对其表面微生物污染水平和分布的影响,修整称重后的样品是在去尾燎毛前(即修整称重后3 h~4 h)采集的;其他环节的样品则是在该环节后立即采集的。
采样时的季节为秋季(11月),屠宰车间内的温度为8℃~10℃,相对湿度为60%~80%。每天随机选取一个屠宰加工环节进行采样,每个环节随机选取50个胴(屠)体,每个胴(屠)体包括5个采样部位(后腿、背部、胸部、前腿和颈部),每个部位包括左右对称两个采样点(具体位置如图1所示),采样点的位置为通过前期观察,在该企业的屠宰加工过程中与人手、刀具、皮毛、血污、粪污和内脏接触较多的位置。

图1 滩羊胴(屠)体上的采样部位Fig.1 The sampling sites on the Tan sheep carcass(body)
采样时,首先在每个部位左右对称的两个采样点中随机选取一个;然后将采样板附在选取的采样点上,取两根沾湿生理盐水的棉签,分别在采样板的方框内从上向下和从左向右各擦拭5次,5次擦拭覆盖的区域为采样板方框内的全部区域;最后将两根棉签折断,使棉头落入到装有10 mL生理盐水的离心管中并拧紧离心管盖,振荡离心管并将其放入装有冰袋的保温箱中保存。
1.3.3 样本APC的测定
所有样本采集完成后10 min内,按照GB 4789.2—2016《食品安全国家标准食品微生物学检验菌落总数测定》中的方法对样本的APC进行测定[25]。若样本所有稀释度的平板上均无菌落生长,则将该样本的APC记为1 CFU/cm2。每个胴(屠)体平均APC为该胴(屠)体5个采样部位APC的算术平均值。
1.4 数据的统计与分析
应用Microsoft office 2016对样本进行常用对数值转换、统计和绘图;应用IBM SPSS statistics 25对数据进行分析。对本研究的多组数据进行Levene’s检验和Shapiro-Wilk检验后发现,各组数据均呈正态分布且方差齐性,所以使用单因素ANOVA检验对多组数据间差异的显著性进行分析,使用Duncan检验对多组数据进行两两比较,P<0.05。
2 结果与分析
不同屠宰环节后胴(屠)体平均APC如表2和图2所示。

表2 不同屠宰环节后胴(屠)体的平均APCTable 2 Mean APC on carcass(body) at different processing links lg(CFU/cm2)
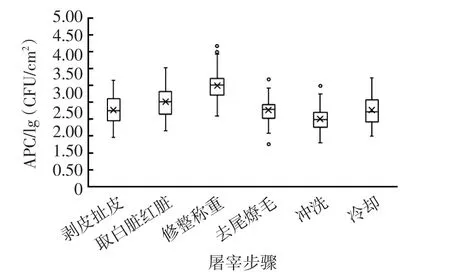
图2 胴(屠)体的平均APC在屠宰过程中的变化趋势Fig.2 Trend of mean APC on carcass(body) during processing
由表2和图2可知,剥皮扯皮后,屠体平均APC为2.27 lg(CFU/cm2),低于相关研究中扯皮后屠体的平 均 APC[2.90 lg(CFU/cm2)~4.00 lg(CFU/cm2)][19-21]。其原因可能在于,与相关研究中采样企业的日屠宰量(1000 头 /天)相比[19],该企业的日屠宰量(300 头 /天)相对较小,所以工人在剥皮时有更充足的时间来主动避免将皮毛、刀具和手上的污物转移到屠体上[13,26]。
取白脏红脏后屠体的平均APC上升了0.25 lg(CFU/cm2),显著高于剥皮扯皮后(P<0.05)。 文献[19-21]的研究发现,取白脏红脏后,屠体平均APC比扯皮后高了 0.14 lg(CFU/cm2)~0.30 lg(CFU/cm2),与本研究结果相近。在此环节中,导致屠体平均APC上升的原因可能在于,首先,宰前无致晕导致宰后活羊的挣扎和剥皮扯皮环节中对皮毛的抖动使大量皮毛上的微生物悬浮于屠宰车间的空气中,这些微生物会附着在剥皮扯皮后湿润的屠体表面上;其次,扯皮后,工人会用手将屠体推到取白脏处,然后再推到取红脏处,在此过程中,皮毛上的微生物会通过人手转移到屠体上。
修整称重后屠体平均APC为3.01 lg(CFU/cm2),显著高于取白脏红脏后(P<0.05)。Gill等[19]在其研究中发现,修整后,屠体平均APC仅比取白脏红脏后高了0.07 lg(CFU/cm2),远低于本研究的 0.49 lg(CFU/cm2)。其原因可能在于,首先,在Gill等[19]的研究中,采样是在修整后马上进行的,与取白脏红脏后采样之间的时间间隔很短。而在本研究中,采样是在修整称重后3 h~4 h才进行的,在此期间,屠宰车间空气中悬浮的微生物会持续附着在屠体上,且此时屠体的温度较高,利于其表面上的微生物的生长和繁殖。其次,如前文所述,在此环节中,屠体是由工人用手先从取红脏处推到修整处,然后再推到称重和去尾处的,且由于吊挂后颈部的位置较低,在对颈部进行修整时,需要一个工人先用手将屠体的前半部分抬起,在这些过程中,微生物会从人手转移到屠体上,对其造成进一步污染。而在Gill等[19]的研究中,屠体是由屠宰线自动从一个环节运送到下一个环节的,减少了人手与屠体接触的机会。
去尾燎毛后,胴体平均APC下降了0.73lg(CFU/cm2),显著低于修整称重后(P<0.05)。Spescha等[27]和 Yu 等[28]在其研究中发现,燎毛后猪胴体的平均APC分别减少了 1.05 lg(CFU/cm2)和 1.55 lg(CFU/cm2),与本研究结果的趋势一致。目前还未见有关燎毛对羊胴体平均APC影响的研究。
冲洗后,胴体平均APC下降了0.27 lg(CFU/cm2),显著低于去尾燎毛后(P<0.05)。 Rao等[20]和Yalçin 等[21]在其研究中发现,冲洗后,胴体平均APC比冲洗前分别低了 0.2 lg(CFU/cm2)和 0.29 lg(CFU/cm2),与本研究结果相近。而Gill等[19]的研究结果显示,冲洗后,胴体的平均APC比修整后低了0.62 lg(CFU/cm2),下降幅度大于本研究。其原因可能在于,目前有关冷水冲洗对羊胴体平均APC的影响的研究中,在使用的水压、用水量、冲洗时间、样本数量和采样部位等方面均有所不同,导致不同研究所得的结果也不尽相同[19-21,29-30]。
冷却后,胴体平均APC上升了0.27 lg(CFU/cm2),显著高于冲洗后(P<0.05)。Gill等[31]在其研究中发现,冷却22 h后,胴体平均APC下降了0.30 lg(CFU/cm2);Omer等[32]发现,冷却24 h后,胴体平均APC下降了0.47 lg(CFU/cm2),均与本研究结果相反。其原因可能在于,文献[31-32]的研究中企业采用的是风冷冷却,这种冷却方式可以在冷却过程的初期快速降低胴体表面的水分活度,不仅能够抑制大部分微生物的生长,还可以降低部分大肠菌群的数量[18,31,33-34]。 而在本研究中,该企业采用的是雾化喷淋冷却,且冷库内胴体的密度较大,存在胴体之间相互倚靠的现象,导致在冷却过程的初期,胴体表面温度下降较慢且水分活度较高,为微生物的生长和繁殖提供了有利的环境条件。Gill等[31,34]在其研究中发现,对猪和牛胴体进行雾化喷淋冷却21 h~36 h后,其胴体的平均APC上升了0.74 lg(CFU/cm2)和1.71 lg(CFU/cm2),与本研究结果的趋势一致。目前还未见有关雾化喷淋冷却对羊胴体平均APC影响的研究。
3 讨论与结论
纵观整个屠宰加工过程,由于修整称重后没有尽快对屠体进行后续加工和冷却,导致屠体平均APC在此期间显著上升。尽管在后续的去尾燎毛和冲洗环节中,屠体平均APC均有显著下降,但与剥皮扯皮后相比,胴体平均APC变化并不显著,此结果阐释了尽管高温灼烧燎毛和高压冷水冲洗可以显著降低胴体表面的微生物污染水平,但是宰后胴体表面的微生物污染水平还受到剥皮扯皮、取白脏红脏和修整称重等环节的影响。只有在每个环节中都对微生物污染进行有效防控,才能降低宰后胴体表面的微生物污染水平。
本研究通过对盐池某滩羊屠宰加工企业日常生产过程中6个环节的羊胴(屠)体的5个部位表面进行微生物采样和检测,以胴体平均APC作为指示指标进行统计和分析后发现,取白脏红脏、修整称重后将屠体存放在车间内以及雾化喷淋冷却均会显著提高胴(屠)体表面的微生物污染水平;高温灼烧燎毛和高压冷水冲洗可以显著降低胴(屠)体表面的微生物污染水平。
该企业可以根据本研究结果,对其现有的屠宰加工工艺和条件进行有针对性地改进,从而降低宰后胴体表面的微生物污染水平。同时也希望本研究结果可以为其他有类似屠宰加工流程、工艺和条件的滩羊屠宰加工企业提供经验,促进盐池滩羊产业进一步的发展。
