刺梨醇提物对食源性肥胖小鼠的降脂作用
2023-02-14隋怡滕明刚饶浠锐杨丽杨武德柴慧芳
隋怡,滕明刚,饶浠锐,杨丽,杨武德,柴慧芳
(贵州中医药大学,贵州 贵阳 550025)
刺梨(Rosa roxburghii Tratt.)为蔷薇科蔷薇属多年生落叶灌木缫丝花的果实,别名茨梨、文先果、送春归[1],味甘、酸涩,性平,归脾、胃经,主要产于贵州西部地区。刺梨含有多种活性成分,包括多糖类、有机酸类、黄酮类、三萜类化合物,因其富含超氧化物歧化酶(superoxide dismutase,SOD)和维生素C等抗氧化成分,素有“维C之王”的美誉[1]。现代研究表明,刺梨具有健胃消食、止泻、调节机体免疫、抗衰老、抗动脉粥样硬化等作用[2-3]。随着人们生活水平的提高和生活方式的改变,越来越多的人被肥胖问题困扰[4]。肥胖的并发症包括糖尿病、动脉粥样硬化等,危害人体健康[5]。体质量决定于能量的摄取和消耗之间的动态平衡,当机体摄入的能量超过机体消耗的能量,过剩的能量便以脂肪形式储存于脂肪组织中,形成肥胖[5]。目前降脂的药物主要有他汀类、贝特类等,但其潜在肝毒性令人担忧[6]。因此,寻找一种天然、不良作用小的减肥降脂化合物已经成为亟待解决的问题。
前期研究发现,刺梨果汁有降低小鼠体质量的作用。在此基础上,探究刺梨醇提物对食源性肥胖小鼠的影响,以期寻找到一种天然的减肥降脂化合物,为进一步研究刺梨减肥降脂活性机制奠定基础,也为开发刺梨应用价值提供参考。
1 实验材料
1.1 实验动物
清洁级昆明种健康成年小鼠(雄性,体质量28 g~32 g):贵州中医药大学动物研究所,动物许可证号:SCXK(黔)2021-0003。动物饲养环境通风良好,温度22℃~25℃、相对湿度50%~60%,各组小鼠自由进食饮水。实验过程遵循贵州中医药大学动物实验伦理,伦理批准号:20210032。
1.2 主要试剂
刺梨(贵州中医药大学生药教研室鉴定为蔷薇科多年生落叶灌木缫丝花的果实刺梨):市售;辛伐他汀片(国药准字H20084420):山东鑫齐药业有限公司;高脂饲料(组成:77.5%基础饲料、2%胆固醇、10%蛋黄粉、10%猪油、0.5%胆酸盐):江苏协同医药生物工程有限公司;总胆固醇检测试剂盒、甘油三酯检测试剂盒、低密度脂蛋白胆固醇检测试剂盒:南京建成生物工程有限公司;瘦素酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测试剂盒:赛默飞世尔科技(中国)有限公司;油红O染色试剂盒:碧云天生物工程有限公司。
1.3 主要实验仪器
高效液相色谱仪(SR-3000 Solvent Rack):赛默飞世尔科技(中国)有限公司;质谱仪(QT 0203 G 003):美国布鲁克(中国)有限公司;倒置相差显微镜(DIAPHOT 300)、显微镜成像系统(DS-Ri2):日本尼康(中国)有限公司;自动酶标读仪(aynorgy2):美国百乐(中国)有限公司;离心机(VELOCITY 18R):生命动力Dynamica(中国)有限公司;石蜡包埋机(EG1150)、切片机(RM2235):德国徕卡(中国)有限公司。
2 实验方法
2.1 药物的配制
取新鲜刺梨果1 kg,将鲜果充分榨汁,弃渣,取刺梨果汁,加70%乙醇低温(4℃)回流提取,蒸发浓缩成125 g浸膏。将此浸膏加少量双蒸水溶解,双蒸水定容配制成含生药分别为0.25、0.125、0.062 5 g/mL的刺梨醇提液,每种各200 mL,4℃冰箱保存备用。
称取100 mg辛伐他汀片,研钵中加少量双蒸水研磨溶解,双蒸水定容至200 mL。配成0.5 mg/mL药液,4℃冰箱保存备用。
2.2 动物的分组、造模与给药
清洁级健康成年昆明种小鼠48只,雄性,28 g~32 g。随机分为正常组(灌胃,生理盐水)、模型组(灌胃,生理盐水)、刺梨醇提物高剂量组(灌胃,5 g/kg,含生药)、刺梨醇提物中剂量组(灌胃,2.5 g/kg,含生药)、刺梨醇提物低剂量组(灌胃,1.25 g/kg,含生药)、辛伐他汀组(灌胃,100 mg/kg),每组8只。除正常组进食普通饲料外,其余各组每日自由进食高脂饲料建立食源性肥胖模型。各给药组以相应剂量按0.2 mL/10 g连续灌胃给药30 d,每日1次。实验期间每日称取小鼠体质量、饮食和饮水量并记录。以模型组小鼠与正常组小鼠相对显著升高为造模成功标志。实验结束后,取各组小鼠眼眶血液,离心(2 500 r/min,15 min)取上清液为血清,-80℃冰箱保存备用。立即处死各组小鼠,取肝脏,-80℃冰箱保存备用。
2.3 生化试剂盒检测食源性肥胖小鼠血清血脂指标测定
取各组血清,按试剂盒说明书实验步骤检测各组小鼠血清总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)的含量。
2.4 油红O染色观察食源性肥胖小鼠肝脏脂肪含量
取各组小鼠肝组织,置于4%多聚甲醛中固定24h。酒精梯度脱水后用石蜡包埋,切片。用油红O染色试剂盒对各组切片进行染色,实验步骤按试剂盒说明书进行。显微镜观察各组切片肝脏脂肪染色情况并分析。
2.5 ELISA法检测食源性肥胖小鼠血清瘦素含量
取各组小鼠血清,将样本稀释后,按瘦素ELISA试剂盒说明书进行ELISA瘦素(leptin,LEP)检测。
2.6 数据处理
实验结果均服从正态分布,数据以平均值±标准差表示,采用SPSS 20.0统计软件进行单因素方差分析,P<0.05认为实验数据差异具有统计学意义。
3 结果与分析
3.1 刺梨醇提物对食源性肥胖小鼠体质量、饮食、饮水量的影响
为了探究刺梨醇提物对食源性肥胖小鼠体质量的影响,对各组小鼠体质量进行了记录,结果见表1。
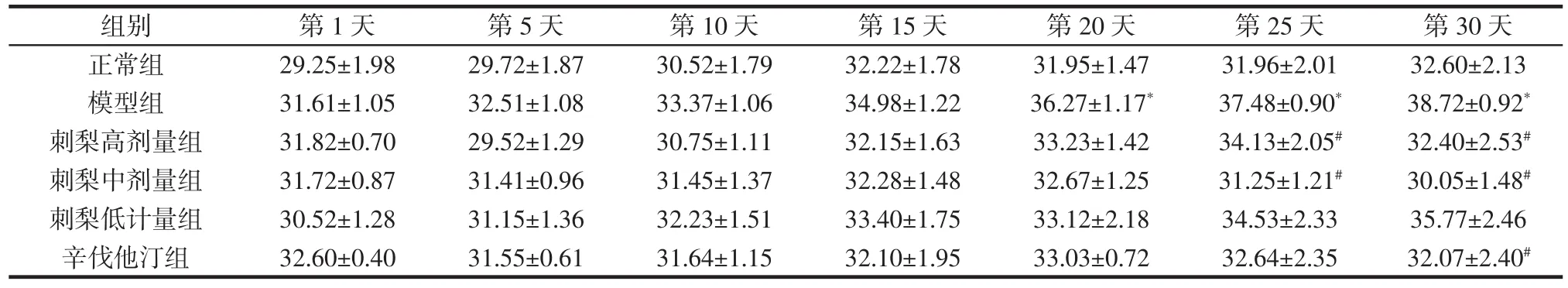
表1 刺梨醇提物对食源性肥胖小鼠体质量的影响(n=8)Table 1 Effect of Rosa roxburghii Tratt.ethanol extracts on the body weight of food-induced obese mice(n=8)g
实验结果显示,自造模第20天起,模型组小鼠与正常组小鼠相比体质量有显著提升(P<0.05),随后与正常组体质量差距逐渐加大;与模型组相比,自给药第25天起,刺梨醇提物高、中剂量组小鼠体质量有显著降低(P<0.05);与模型组相比,辛伐他汀组小鼠体质量给药第30天呈现显著降低(P<0.05);刺梨醇提物低剂量组小鼠体质量与同时间段模型组相比,有降低趋势但尚无显著性差异。
对各组小鼠的每日饮食和饮水量进行检测,实验结果见图1、图2。
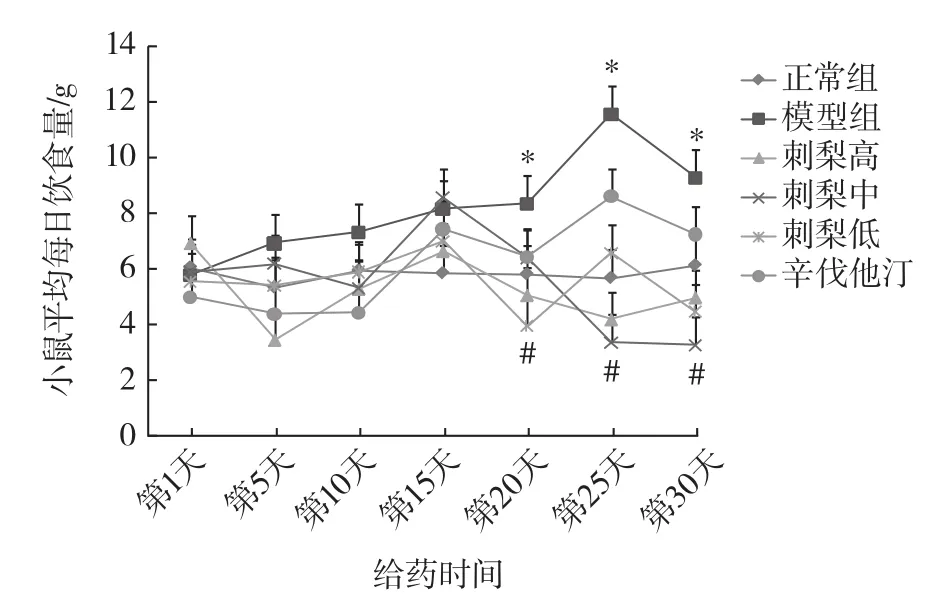
图1 刺梨醇提物对食源性肥胖小鼠每日饮食量的影响(n=8)Fig.1 Effect of Rosa roxburghii Tratt.ethanol extracts on the daily food intake of food-induced obese mice(n=8)

图2 刺梨醇提物对食源性肥胖小鼠每日饮水量的影响(n=8)Fig.2 Effect of Rosa roxburghii Tratt.ethanol extracts on the daily water intake of food-induced obese mice(n=8)
每日各组小鼠饮水量围绕4 mL上下浮动,无显著变化;自给药第20天起,模型组小鼠饮食量与正常组相比显著升高(P<0.05);与模型组相比,刺梨高、中、低剂量组小鼠饮食量显著降低(P<0.05),与正常组小鼠相差不大;辛伐他汀组小鼠饮食量与模型组相比无显著性差异。
3.2 刺梨醇提物对食源性肥胖小鼠血清血脂指标的影响
为探究刺梨醇提物降血脂作用,测定食源性肥胖小鼠血清血脂指标,结果见表2。

表2 刺梨醇提物对食源性肥胖小鼠血清血脂指标水平的影响(n=8)Table 2 Effect of Rosa roxburghii Tratt.ethanol extracts on serum lipid indexes of food-induced obese mice(n=8)mmol/L
结果显示,与正常组相比,模型组小鼠血清TC、TG、LDL-C 含量均显著升高(P<0.05),呈现高血脂状态;与模型组相比,刺梨醇提物高、中剂量组和辛伐他汀组小鼠血清TC、TG、LDL-C含量均显著降低(P<0.05);刺梨醇提物低剂量组仅血清LDL-C与模型组相比显著降低(P<0.05),显示出刺梨醇提物具有显著降血脂作用,且呈现剂量依赖性。
3.3 刺梨醇提物对食源性肥胖小鼠肝脏组织脂肪含量的影响
刺梨醇提物对食源性肥胖小鼠肝脏组织脂肪含量的影响,见图3。
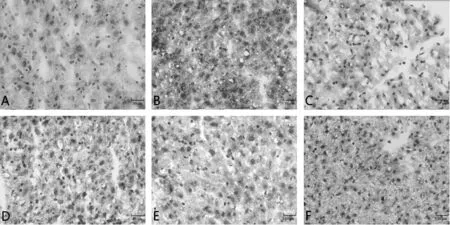
图3 油红O染色观察刺梨醇提物对食源性肥胖小鼠肝组织脂肪含量的影响(n=8,×40)Fig.3 Effect of Rosa roxburghii Tratt.ethanol extracts on the hepatic fat content of food-induced obese mice observed by oil red O staining(n=8,×40)
由图3可以看到,与正常组小鼠相比,模型组小鼠肝脏细胞散在大量脂滴;与模型组相比,刺梨醇提物高、中剂量组和辛伐他汀组肝细胞间散在脂滴显著降低,刺梨醇提物低剂量组脂滴含量也有所降低。
3.4 刺梨醇提物对食源性肥胖小鼠血清瘦素含量的影响
观察到刺梨醇提物能显著降低食源性肥胖小鼠饮食量,进一步检测了各组小鼠血清瘦素,结果见表3。
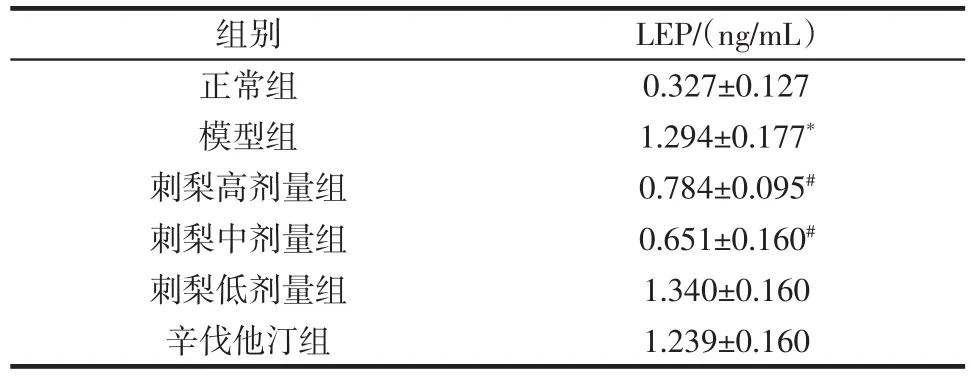
表3 刺梨醇提物对食源性肥胖小鼠血清瘦素的影响(n=8)Table 3 Effect of Rosa roxburghii Tratt.ethanol extracts on the serum leptin of food-induced obese mice(n=8)
实验结果表明,与正常组相比,模型组小鼠血清瘦素含量显著升高(P<0.05);与模型组相比,刺梨醇提物高、中剂量组小鼠血清瘦素含量均显著降低(P<0.05);而刺梨醇提物低剂量组和辛伐他汀组对小鼠血清瘦素影响与模型组相比无显著性差异。
4 讨论与结论
古籍中记载刺梨具有健胃消食、止泻等功效[5]。实验结果显示,用高脂饲料连续喂养小鼠20 d可造成小鼠食源性肥胖模型。而刺梨醇提物高、中剂量组能显著降低食源性肥胖小鼠体质量,作用效果呈现剂量依赖性,且两组自给药25 d起效,起效时间快于辛伐他汀(30 d)。小鼠血清血脂检测和肝组织脂肪检测结果显示,食源性肥胖小鼠血清TC、TG、LDL-C含量、肝组织脂肪含量与正常组相比显著升高(P<0.05);与模型组相比,刺梨醇提物高、中剂量组和辛伐他汀组小鼠血清TC、TG、LDL-C含量和肝组织脂肪含量均显著降低(P<0.05),显示出刺梨醇提物对食源性肥胖小鼠具有显著降血脂、降低肝组织脂肪含量的作用,作用效果呈现剂量依赖性,且与辛伐他汀组相当。
大量研究表明[6-8],瘦素为由脂肪组织分泌的,具有调节能量代谢、抑制中枢神经系统摄食行为的循环激素。正常情况下,机体脂肪含量增加会促进瘦素的释放而发挥厌食作用;而肥胖人群血中瘦素含量远高于正常人群,但依旧没有改善肥胖,瘦素的这种在肥胖人群中效价的降低现象称之为“瘦素抵抗”[9]。一方面,瘦素主要通过与瘦素受体(leptin receptors,LRs)结合而发挥其生理作用[10]。瘦素受体中最重要的为表达于下丘脑的长型瘦素受体,瘦素与LEP结合后,会激活JAK-STAT信号传导通路,进一步激活下丘脑弓状核中的POMC神经元(一种抑制食欲神经元),而抑制下丘脑弓状核中的NPY/AgRP神经元(一种促食欲神经元),从而引发厌食行为[9]。另一方面,脂肪组织分泌的瘦素同样可以促进细胞因子信号抑制因子3(suppressor of cytokine signaling 3,SOCS3)的释放,其可以抑制JAK-STAT信号传导通路,进而抑制瘦素的作用,形成“瘦素抵抗”[11]。 另有研究认为[12],“瘦素抵抗”的原因还可能与瘦素无法正常透过血脑屏障进而发挥中枢神经系统作用有关。减轻“瘦素抵抗”被认为是治疗肥胖及肥胖相关并发症的有效途径。
本研究实验结果显示,自给药第20天起,与模型组小鼠相比,刺梨醇提物高、中、低剂量组小鼠饮食量显著降低(P<0.05),且辛伐他汀组小鼠饮食量与模型组相比变化不大。显示出两者降低体质量和血脂的不同机制。辛伐他汀为胆固醇合成限速酶抑制剂,具有显著降血脂作用;而刺梨醇提物降低肥胖小鼠体质量和血脂的作用似乎与抑制肥胖小鼠摄食量密切相关。因此考察了各组小鼠血清瘦素的含量,实验结果显示,与正常组相比,模型组小鼠血清瘦素含量显著升高(P<0.05),说明模型组小鼠体内存在“瘦素抵抗”;与模型组相比,刺梨醇提物高、中剂量组小鼠血清瘦素含量均显著降低(P<0.05),提示刺梨醇提物能够对抗食源性肥胖造成的小鼠血清瘦素升高的现象,降低血清瘦素,这可能与增加瘦素利用率、改善“瘦素抵抗”作用有关,具体机制有待进一步研究。
研究表明,刺梨醇提物能显著降低食源性小鼠体质量、饮食量、血脂水平、肝脏脂肪含量,且这一作用与降低血清瘦素水平密切相关,为进一步探究刺梨对瘦素通路的影响奠定基础。
