海参内脏酶解物和体壁溶出物的护肤功效评价
2023-02-13米锐周遵春孟楠
米锐,周遵春,孟楠
(辽宁省海洋水产科学研究院,辽宁大连 116023)
海参是一种食药用价值较高的海洋资源,富含多种生物活性物质,包括海参蛋白质及多肽、海参多糖、海参皂苷、脂类等,国内外学者对这些物质的药理作用展开研究,发现其具有抗疲劳、降血脂、调节免疫、抗病毒、延缓衰老和抗血栓等生理活性[1]。同时,在功效性护肤品开发方面,也有研究表明海参多肽具有促进细胞增殖、抗氧化、美白、保湿等功效[2];海参多糖具有抗衰老、促进伤口愈合等功效[3];海参皂苷类物质具有抗真菌、抑制氧化损伤及美白等功效[4]。
海参的深加工主要是针对海参体壁的应用,加工过程中会产生许多副产物,包括海参内脏和海参水煮液。海参内脏就是加工体壁后剩余的消化、呼吸、水管和生殖系统等部分,其中主要组成成分是消化和生殖系统[5];海参加工水煮液就是用沸水灭酶处理新鲜海参防止其自溶而产生的含有大量水溶性海参溶出物的液体[6]。此前在海参内脏的利用方面,除一小部分加工成食品外,大部分作为海参加工的废弃物被丢弃,海参水煮液也同样作为废水排放,这些都造成了资源的极大浪费。研究表明这些副产物含有与体壁相似的功能性活性物质,如果能够有效合理利用,既能提高海参应用的附加值,又能缓解资源浪费及环境污染等问题。而目前已有大量研究致力于海参加工副产物的开发利用,有研究将海参内脏加工成调味料、酶解粉、生物活性肽等产品[7-9],也有将海参水煮液制成脱脂粉、营养饮料,或提取多糖、皂苷等活性成分的相关研究[4,6,10,11]。但是关于海参加工副产物在护肤应用领域的报道还是相对较少。
本研究以海参体壁酶解物为参考,对海参体壁溶出物和海参内脏酶解物的基本成分进行了对照分析,并对保湿、防晒、美白、抗氧化、抗衰老功能指标进行考察,旨在对海参加工副产物的护肤功效进行评价。目前相关国产非特殊用途化妆品的研究多集中在海参体壁胶原多肽,而海参体壁成本相对较高,因此本研究选择体壁酶解物作为对照,旨在对低值的副产物进行开发。副产物的应用可以缓解海参体壁作为原材料的成本投入,为副产物加工提供更多的应用方向,也为合理开发海参副产物资源变废为宝提供参考依据。
1 材料与方法
1.1 原料
试验用海参体壁酶解物、体壁溶出物及内脏酶解物由本实验室制备,其中体壁及内脏酶解物是通过蛋白酶水解后冻干获得,体壁溶出物是将海参体壁水煮浸泡后的液体经冻干获得。
1.2 主要试剂与仪器设备
总抗氧化能力检测试剂盒,上海碧云天生物技术有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),左旋多巴(L-DOPA)、酪氨酸酶、弹性蛋白酶、分析纯,上海麦克林生化科技有限公司;N-甲氧基琥珀酰-丙酰氨-丙酰氨-脯酰氨-缬氨酸对硝基酰苯胺,分析纯,美国Sigma公司;碳酸钾及硫酸铵等试剂,分析纯,天津市科密欧化学试剂有限公司。小鼠胚胎成纤维细胞Balb/c3T3购自中国医学科学院基础医学研究所细胞资源中心。
Infinite M200 PRO NanoQuant酶标仪,瑞士Tecan公司;SP-756型紫外分光光度计,上海光谱仪器有限公司;BSA224S电子天平,赛多利斯科学仪器有限公司;DHG-9076A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司。
1.3 试验方法
1.3.1 基本成分检测
水分含量的测定:直接干燥法GB/T 5009.3-2016;粗脂肪含量的测定:酸水解法GB/T 5009.6-2016;灰分含量的测定:高温灼烧法GB/T 5009.4-2016;蛋白及多肽含量的测定:凯氏定氮法GB/T 5009.5-2016;总糖含量的测定:高效液相色谱法GB/T 5009.8-2016。
1.3.2 MTT法对Balb/c3T3细胞活性测定
将Balb/c3T3细胞以每毫升1×105个接种于96孔培养板上,每孔190 μL,于37 ℃、5% CO2培养箱内培养4 h,加入10 μL不同浓度样品进行处理,设置灭菌双蒸水作为对照组及无细胞调零组,每组3个孔,置37 ℃、5% CO2培养箱内分别培养24 h,加入20 μL MTT,继续孵育4 h后,弃上清,每孔加入150 μL二甲基亚砜溶解,室温震荡10 min,于490 nm处测定OD值,按照公式(1)计算细胞活力(记为E,%)。
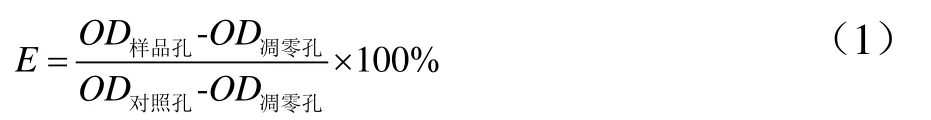
1.3.3 吸湿和保湿性测定
参照文献[12]中的方法,略有改变,对3种海参样品的吸湿性和保湿性进行试验。
吸湿性:分别在两个干燥器底部用饱和碳酸钾溶液(RH为43%)和饱和硫酸铵溶液(RH为81%)来维持内部相对恒定的湿度条件,然后称取l g冻干后的粉末样品于平皿中,将平皿放入干燥器内,设置重复试验组,在12 h内的不同时间点,取出平皿精确称量,由公式(2)计算样品的吸湿率(记为F,%)。

式中:
Wo——吸湿性试验前样品质量,g;
Wn——吸湿性试验后样品质量,g。
保湿性:将完成吸湿性试验的样品放入干燥器中进行保湿性试验,干燥器底部放有200 g经过干燥处理的变色硅胶,在12 h内的不同时间点,取出平皿精确称量,由公式(3)计算样品的保湿率(记为G,%)。

式中:
Ho——保湿性试验前的样品质量,g。
Hn——保湿性试验后的样品质量,g
1.3.4 防晒性测定
采用文献[13]中方法,通过计算紫外吸收率来评价3种海参样品的防晒性能。将样品溶液的质量浓度定为1 g/L,测定样品在紫外波长230~400 nm范围的透过率(I),并按照下式计算紫外吸收率(记为J,%)。

1.3.5 DPPH自由基清除活性测定
参考文献[14]的方法,取各试验浓度的样品溶液分别加入离心管中,再加入用无水乙醇配制的浓度0.2 mmol/L的DPPH工作液,混合均匀,待反应30 min后,于517 nm处测定其吸光度。DPPH自由基清除率(K,%)按下式计算。
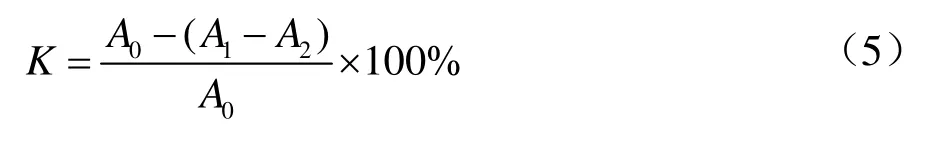
式中:
A1——2 mL样品液+2 mL DPPH工作液的吸光度;
A2——2 mL样品液+2 mL无水乙醇的吸光度;
A0——2 mL蒸馏水+2 mL DPPH工作液的吸光度。
1.3.6 ABTS法总抗氧化活性测定
按照说明书要求配制ABTS工作溶液,氧化剂作用下促使ABTS生成ABTS+,在抗氧化性样品存在下,ABTS+的生成受到抑制,于405 nm波长处测定反应溶液的吸光度,并调整样品到适宜的工作浓度,通过标准曲线计算出样品的总抗氧化能力。
1.3.7 FRAP法总抗氧化活性测定
按照说明书要求配制FRAP工作溶液,在酸性条件下抗氧化性样品能够还原Fe3+,于593 nm波长处测定反应溶液的吸光度,并调整样品到适宜的工作浓度,通过标准曲线计算出样品的总抗氧化能力。
1.3.8 美白性能测定
通过测定反应生成的多巴醌的吸光度[15],计算酪氨酸酶抑制率来评价美白性能。用PBS磷酸盐缓冲溶液(pH值6.8)配制检测试剂和系列浓度梯度的样品溶液,将检测试剂和样品溶液依次加入到酶标板中,在加入200 U/mL的酪氨酸酶溶液后,把酶标板放入37 ℃温育10 min,再加入底物L-DOPA反应10 min,测定其在475 nm处的吸光度。酪氨酸酶抑制率(M,%)按下式计算。
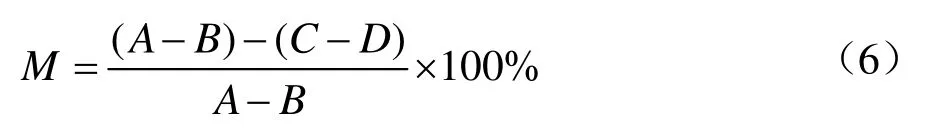
式中:
A——100 μL PBS 溶液+50 μL 酪氨酸酶+50 μL 底物;
B——150 μL PBS 溶液+50 μL 酪氨酸酶;
C——50 μL PBS 溶液+50 μL 样品+50 μL 酪氨酸酶+50 μL底物;
D——100 μL PBS溶液+50 μL 样品+50 μL 酪氨酸酶。
1.3.9 抗衰老性能测定
按照文献[16]方法,通过测定弹性蛋白酶抑制活性来评价抗衰老性能。用0.1 mol/L浓度的Tris-Cl缓冲溶液(pH值8.0)配制浓度为1.015 mmol/L的反应底物 N-甲氧基琥珀酰-丙酰氨-丙酰氨-脯酰氨-缬氨酸对硝基酰苯胺溶液。在酶标板中加入试验样品溶液和反应底物,于25 ℃反应5 min,加入0.5 U/mL的弹性蛋白酶溶液后,再温育30 min,测定其在410 nm处的吸光度。弹性蛋白酶抑制率(记为N,%)按下式计算。

式中:
A3——10 μL 样品+130 μL 反应底物+15 μL 弹性蛋白酶的吸光度;
A4——10 μL 去离子水+130 μL 反应底物+15 μL 弹性蛋白酶的吸光度;
A5——10 μL样品+130 μL反应底物+15 μL去离子水的吸光度。
1.3.10 数据统计分析
2 结果与讨论
2.1 基本成分检测
测定体壁酶解物对照及体壁溶出物、内脏酶解物中蛋白质及多肽、总糖、粗脂肪、灰分和水分的含量,数据如表1所示。对照及样品中,海参体壁及内脏酶解物的主要成分为蛋白质及多肽,所占比重分别为50.62%和 49.12%,而体壁溶出物的蛋白相对含量则较低,与海参体壁及内脏酶解物相比差异显著(p<0.05)。检测到的总糖和粗脂肪含量也相对较高,样品之间在成分占比上略有差异。样品中灰分所占比重很大,其中体壁及内脏酶解物中灰分来自于酶解过程中的无机盐离子的释放;而由于水煮加工过程中大量盐分的溶出,体壁溶出物中灰分所占比重高达45.52%,与其他样品相比差异显著(p<0.05)。另外,样品的水分含量也相对较高,这可能与冷冻干燥程度及营养成分的分配比重相关。
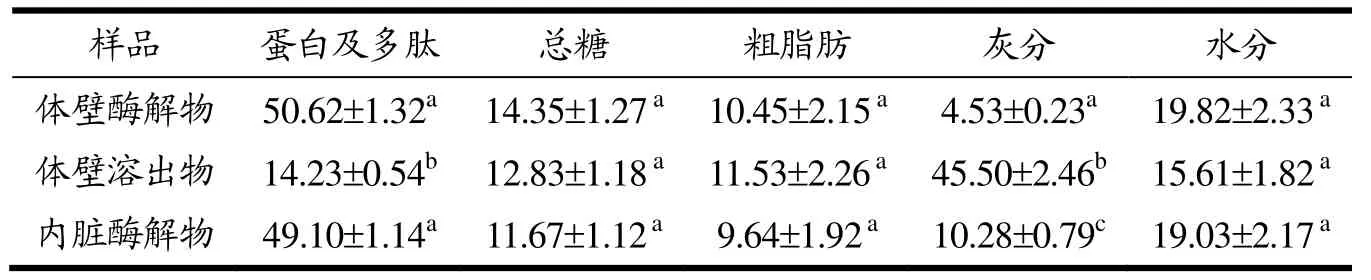
表1 试验样品成分分析(g/100 g)Table 1 Composition analysis of the samples
2.2 细胞毒性评价
从基本成分的检测可以看出,海参样品中富含多肽、多糖、脂类等天然成分,适于作为潜在的化妆品添加剂的应用开发及功效成分的提取研究,因此测定样品对小鼠成纤维细胞Balb/c3T3活性的影响,以评估其安全性。成纤维细胞是在组织损伤、重建修复中起重要作用的一类细胞,能自主地生成和分泌胶原蛋白和其他蛋白质,其细胞活性的变化可以用于评估样品对皮肤细胞的安全性。如图1所示,海参内脏酶解物浓度小于1.0 mg/mL时不影响成纤维细胞的活性,与对照体壁酶解物有相似的细胞活性,且具有剂量依赖性;而体壁溶出物在浓度小于0.5 mg/mL时不影响成纤维细胞的活性,表明在该添加量范围内对成纤维细胞无毒性,也说明了海参副产物样品具有较好的安全性,可以应用于化妆品相关研究中。

图1 样品对成纤维细胞Balb/c3T3活性的影响Fig.1 The effect of samples on the viability of fibroblast cell
2.3 吸湿保湿性能
吸湿保湿性是衡量化妆品的关键因素,皮肤中保湿因子的缺失会导致蒸发失水、干燥粗糙、甚至脆裂等肌肤问题,加速皮肤衰老的程度[17]。因此,化妆品中通常需要添加保湿成分来提高皮肤的含水量,减少干燥引起的皱褶等现象。天然保湿剂具备良好的补水效果和生物亲和性,一直是新型保湿产品研发工作关注的热点。本试验以体壁酶解物作为参考,对比考察了体壁溶出物和内脏酶解物在相对湿度43%和81%条件下,12 h的吸湿保湿性。
如图2所示,样品在43% RH条件下,吸湿性能较弱,体壁酶解物、体壁溶出物和内脏酶解物在 7 h吸湿率分别为1.45%、3.54%和2.45%。长时间置于该湿度条件下,吸湿率反而呈下降趋势。而样品在81%RH条件下显示了较好的吸湿性能,内脏酶解物表现
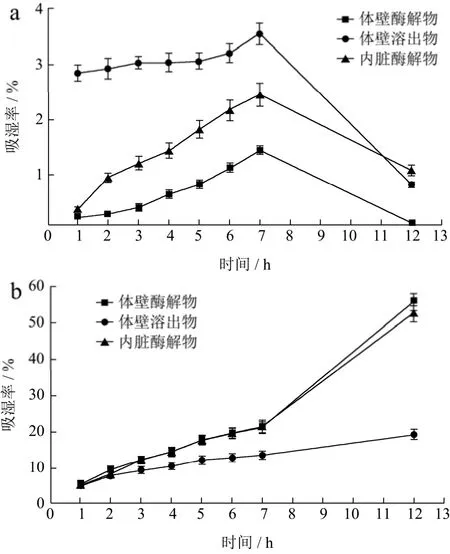
图2 样品分别在湿度43% RH和81% RH条件下的吸湿性Fig.2 Moisture-absorption ability of samples at relative humidity (RH) 43% and 81%
出与体壁酶解物相似的吸湿率曲线,在12 h吸湿率分别为52.51%和55.75%。阳性对照甘油在43% RH条件下吸湿性高于样品,12 h吸湿率为17.23%。甘油在81% RH条件下12 h吸湿率为47.42%。但是就保湿率而言,如图3所示,样品都能够在12 h内保持水分含量的稳定,没有呈现急剧下降的趋势,说明样品均具有良好的保湿性能,内脏酶解物与体壁酶解物在81%RH条件下的保湿率分别为95.04%和94.93%。阳性对照甘油在相对湿度43%和81%条件下12 h的保湿性分别为98.32%和92.83%。综合分析,内脏酶解物在两种湿度条件下,均表现出稳定的吸湿保湿性能。此前有研究表明海参胶原蛋白在12 h内的吸湿性快速升高,6 h以内的保湿性相对稳定,与本研究结果中趋势基本一致[18]。因为海参胶原多肽中含有大量的羧基、氨基及羟基等亲水基团,易于吸收并能够有效锁住水分,具有良好的吸湿保湿性能,可作为天然保湿剂应用于护肤产品的研发[19]。而本研究中验证这两种副产物,尤其是内脏酶解物,也表现出优良的吸湿保湿性能,在应用中可以作为体壁酶解物的补充与替代品使用。
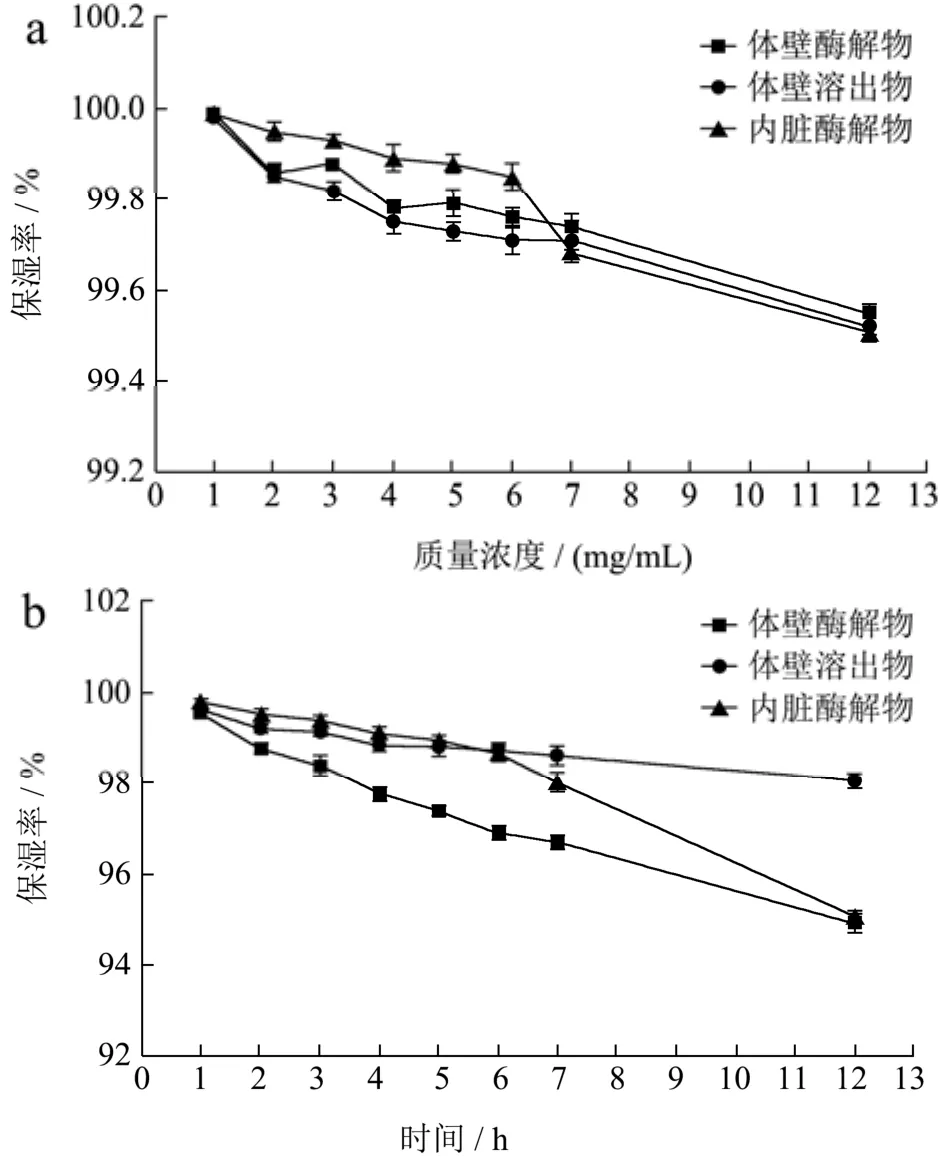
图3 样品分别在湿度43% RH和81% RH条件下的保湿性Fig.3 Moisture-retention ability of samples at relative humidity(RH) 43% and 81%
2.4 防晒性能
长期的紫外线照射,会促使真皮层的胶原蛋白和弹性蛋白酶变性,导致皱纹和皮肤的光老化[20]。同时,三种波长范围的紫外线对皮肤都有不同程度的危害,长波紫外线UVA(320~400 nm)的穿透能力极强,可辐射至真皮层引发氧化反应而导致组织炎症,是皮肤晒黑的主因;而中波紫外线UVB(280~320 nm)具有很强的诱变性,可诱发机体DNA的损伤,进而导致皮肤组织的晒伤[21];短波紫外线UVC(200~280 nm)通常可以被臭氧吸收,但是臭氧层损耗造成了UVC辐射的潜在威胁,导致皮肤癌变的危险。本研究中海参样品的紫外吸收率如图4所示,体壁酶解物对照、体壁溶出物和内脏酶解物在UVC波长范围均发挥较好的吸收作用,平均紫外吸收率分别为90.84%、94.52%、92.73%,UVC波长的高吸收率与文献中海参胶原蛋白检测的紫外吸收峰值在236.5 nm范围的数据比较相符[18];在UVB波长范围,体壁酶解物对照、体壁溶出物和内脏酶解物的紫外吸收效果平均可以达到27.99%、33.89%和30.45%;在UVA波长范围,样品的紫外吸收效果不佳。本试验结果也说明海参样品具有一定的紫外吸收的功能,且对UVC的遮蔽作用优于UVB和UVA,因为蛋白肽类在206~220 nm波长区间有紫外吸收作用,如果含有芳香族基团,紫外吸收最大值在268~280 nm,都介于UVC波长范围内,并且多糖等成分在此波长范围也有吸收作用,紫外吸收作用进而可以缓解皮肤因辐射引起的氧化应激压力,抑制炎症的发生及损伤作用。其中体壁溶出物表现出优于其他样品的紫外吸收性能,在护肤应用中可以起到一定的防晒作用。

图4 样品在紫外波长下的紫外吸收率Fig.4 Average UV absorbance of samples in different wavelength ranges
2.5 DPPH自由基清除活性
DPPH自由基清除活性检测是衡量物质抗氧化能力的常用方法。由图5中曲线可知,样品的DPPH自由基清除率是随着样品浓度的升高而逐渐升高的趋势。海参体壁酶解物、体壁溶出物及内脏酶解物对 DPPH自由基清除率的IC50分别是3.63、3.00和3.19 mg/mL,IC50值越小则DPPH自由基清除活性越好,表明样品的DPPH自由基清除活性为:体壁溶出物>内脏酶解物>体壁酶解物,两种海参副产物的DPPH自由基清除功能优于体壁酶解物,均具有较好的抗氧化能力,在护肤应用中可以作为天然抗氧化成分使用。阳性对照Vc的DPPH自由基清除率的IC50为0.024 mg/mL。此前已有研究对海参酶解多肽的抗氧化活性进行检测,结果表明1 mg/mL浓度海参多肽的DPPH自由基清除率达到56.3%[22]。也有对海参副产物开展抗氧化活性的研究,数据显示刺参肠酶解多肽清除DPPH自由基的IC50为3.31 mg/mL[23],通过海参水煮液水解制备的海参肽,其清除DPPH自由基的IC50为2.015 mg/mL[24],以上研究结果虽然与本试验结果略有差异,也未将不同样品进行对比研究,但都验证了海参样品的抗氧化功能,也说明了海参副产物在提升抗氧化应激作用方面的潜力。氧化应激会影响衰老过程的速率,主要就是不断增加的自由基在氧化过程中破坏了胶原蛋白,导致皮肤出现衰老症状[25]。胶原蛋白是真皮结缔组织的细胞外基质中含量最丰富的蛋白质,能够支撑结缔组织的结构和保持细胞形态,胶原蛋白的变化会引发皮肤松弛和皱纹的产生[26]。因此,有效防止自由基对胶原蛋白造成的损伤,才能延缓皮肤老化。海参体壁和内脏经过酶解后,产物中多肽类占比较高,肽类的抗氧化剂具有很强的生物活性,在应对氧化应激过程中对机体具有显著的保护作用[27]。而体壁酶解物与两种副产物在DPPH自由基清除率上的差异,可能来自于多糖等其他活性成分的影响。

图5 样品的DPPH自由基清除活性Fig.5 DPPH free radical scavenging effect of samples
2.6 ABTS法总抗氧化性能
ABTS测定法是衡量抗氧化剂抗氧化能力的常用方法。体内(细胞内)的自由基可以分为两类:活性氧(ROS)和活性氮(RNS)[28],自由基的产生和过量堆积会抑制内源性抗氧化系统的活性,诱发氧化应激反应而对机体造成损伤,应用ABTS方法则可检测RNS自由基的清除水平。由图6可知,海参体壁酶解物、体壁溶出物及内脏酶解物的 ABTS法总抗氧化能力分别为2.17、4.48、3.02 mmol/g,其强弱为:体壁溶出物>内脏酶解物>体壁酶解物,与DPPH自由基清除活性的排序一致,说明这两种海参副产物在RNS清除水平上也具有很好的抗氧化能力,可以作为多效的天然抗氧化成分应用。阳性对照Vc的总抗氧化能力为30.57 mmol/g。
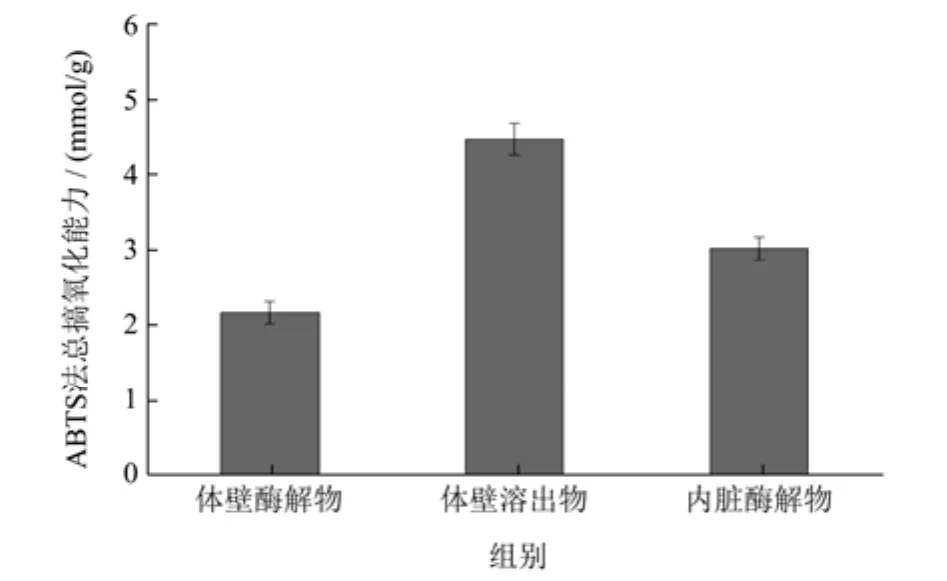
图6 样品的ABTS总抗氧化性能Fig.6 Total anti-oxidation capacity of the samples by ABTS method
2.7 FRAP法总抗氧化性能
FRAP测定法也是评价抗氧化剂抗氧化能力的常用方法。FRAP法的检测原理是基于铁离子还原为亚铁离子的还原反应,反映的是电子的转移能力,而电子转移是自由基清除的一种机制[29]。所以,结合DPPH自由基和ABTS自由基清除活性的测定,考察FRAP法抗氧化能力才有意义。由图7可知,海参体壁酶解物、体壁溶出物及内脏酶解物的FRAP法总抗氧化能力分别为3.34、5.91、4.19 mmol/g,其强弱为:体壁溶出物>内脏酶解物>体壁酶解物,抗氧化趋势与DPPH自由基清除率及ABTS法总抗氧化能力一致,体壁溶出物效果最佳。表明样品具有抗氧化活性,能有效地清除DPPH自由基和ABTS自由基的同时,还可以有效还原铁离子,说明样品的抗氧化活性可能通过电子转移来实现。阳性对照Vc的总抗氧化能力为293.14 mmol/g。
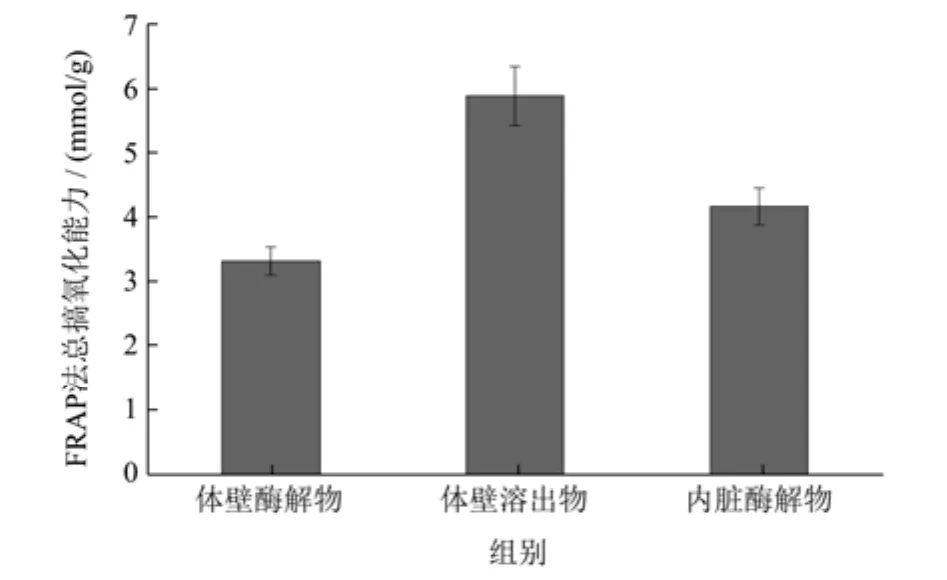
图7 样品的FRAP总抗氧化性能Fig.7 Total anti-oxidation capacity of the samples by FRAP method
2.8 美白性能
在护肤应用领域,美白性能一直是大家关注的热点,美白性能研究也侧重在抑制酪氨酸酶活性上。酪氨酸酶在黑色素生成的第一步中是起到限速调节作用的关键酶,可将酪氨酸氧化成多巴醌,然后生成多巴色素,最终氧化生成黑色素[30],形成黑色素的反应会产生活性氧又加速了皮肤色素的沉着。因此,通过抑制酪氨酸酶活性来抑制黑色素的生成可以作为皮肤美白的一个方法。海洋源提取的天然活性物质在美白剂应用上也具有较高的生物相容性及安全性。图8则反映了海参样品对酪氨酸酶活性的抑制作用,体壁酶解物、体壁溶出物及内脏酶解物对酪氨酸酶活性抑制率的IC50分别为16.82、49.43、40.00 mg/mL,所以酪氨酸酶活性抑制作用为:体壁酶解物>内脏酶解物>体壁溶出物,对照体壁酶解物具有更好的酪氨酸蛋白酶抑制活性。阳性对照熊果苷对酪氨酸酶抑制率的IC50为1.12 mg/mL。已有研究表明海洋活性胶原肽对酪氨酸酶活性抑制率的 IC50为17.06 mg/mL[31],与本研究结果类似。而海参体壁酶解物主要成分也是胶原蛋白肽类,是其具有较好的美白功效的主要原因,胶原蛋白可以通过螯合铜离子来抑制酪氨酸酶活性,也可以通过降低细胞内环磷酸腺苷的含量,来抑制酪氨酸酶的表达[32]。而两种副产物的抑制活性虽然低于体壁酶解物,但也都能够发挥较好的酪氨酸酶抑制剂的作用。副产物中胶原蛋白含量低于体壁,但仍含有多糖等活性物质,其酪氨酸酶抑制活性可能源自蛋白肽类、多糖、皂苷等的协同作用,已有研究表明海参中提取的皂苷等活性物质也能发挥美白功效,从海参水煮液中提取的皂苷组分在质量浓度为50~70 g/L时,对酪氨酸酶抑制率稳定在30.4%[4]。

图8 样品的酪氨酸酶抑制率Fig.8 Tyrosinase inhibition rate of samples
2.9 抗衰老性能
皮肤的衰老包括内源性和外源性的老化,内源性老化可分为自然衰老和由于皮肤弹性的变化引发的衰老,而外源性皮肤衰老是由紫外线辐射导致的光老化[33]。在衰老的过程中弹性蛋白酶发挥了重要的作用,它是存在于细胞外基质中主要负责分解弹性蛋白的一种酶,也能降解胶原蛋白、纤连蛋白等,造成皮肤弹性的变化,皮肤组织结构完整性的丧失,引发衰老[34]。因此,弹性蛋白酶抑制剂可以作为潜在的化妆品成分用于对抗皮肤老化,有效预防皮肤弹性的丧失和下垂等问题。图9是海参体壁酶解物、体壁溶出物及内脏酶解物抑制弹性蛋白酶活性的曲线,可以看到样品在一定程度上具有弹性蛋白酶抑制活性,其中体壁酶解物与体壁溶出物的曲线呈曲折上升趋势,而内脏酶解物的抑制活性波动幅度较大,在80 mg/mL和100 mg/mL的高浓度区间表现出较好的抑制作用,对弹性蛋白酶的抑制率可以达到26.34%。有研究对海参蒸煮液中提取的糖蛋白进行抗皱功能分析,10 mg/mL高分子量糖蛋白的抑制率可达28.78%[35],也验证了海参副产物活性成分具有抗衰老作用。
3 结论
本试验以海参体壁酶解物为参照,验证了体壁溶出物及内脏酶解物的吸湿保湿、防晒、抗氧化、美白及抗衰老功能。结果显示,这两种海参副产物均具备护肤保健的功能,其中体壁溶出物的防晒、抗氧化功能表现最佳,内脏酶解物的吸湿保湿、抗衰老功能最佳。可以有效利用两种副产物在护肤功效上的作用优势,将二者结合应用或者作为体壁酶解物的补充及替代品应用在护肤产品上,以达到更好的护肤效果。这两种海参副产物与体壁酶解物之间在多种护肤功效中存在一定的差异性,这可能是由于它们在功效成分及组成配比上的不同引起的,这也为未来副产物功效成分深度开发及配比应用研究提供思路,以期使海参副产物在护肤应用领域实现功能优化及协同增效。
