基于ttr基因的mini-MPN-qLAMP法快速定量检测食品中沙门氏菌
2023-02-13章小洪郑连宝陈卫平王伟影贺云鹏方芳胡彤
章小洪,郑连宝,陈卫平,王伟影,贺云鹏,方芳,胡彤
(1.丽水市质量检验检测研究院,浙江丽水 323000)(2.浙江工业大学生物工程学院,浙江杭州 310032)(3.德清县食品药品检验检测中心,浙江湖州 313200)(4.衢州市食品药品检验研究院,浙江衢州 324000)
沙门氏菌是一种重要的食源性致病菌,该菌主要污染的食品有肉、蛋、乳等禽肉类制品和速冻食品。一旦发生沙门氏菌污染的情况,食品生产环境中残留的沙门氏菌不易控制,存在交叉污染的安全隐患[1,2]。消费者食用了被沙门氏菌污染的食品容易引起腹泻甚至败血症等食物中毒的现象。全球细菌性食物中毒事件中,沙门氏菌引起的食物中毒长期占据榜首[3]。GB 4789.4[4]中,沙门氏菌的检验程序繁琐,需要4~6 d才能确认结果,当前急需一种高效、低成本的快速沙门氏菌检测方法。因此,开发新的沙门氏菌检测方法一直是一个热点研究方向[5]。近年来核酸检测技术的迅速发展带动了食品检测技术的进步,其中荧光定量PCR(Real-Time Quantitative Polymerase Chain Reaction,qPCR)技术被应用于食品中沙门氏菌的检验[6]。荧光定量环介导等温扩增技术(Quantitative Loop-Mediated Isothermal Amplification,qLAMP)、重组聚合酶扩增等技术在沙门氏菌检测中也取得了重要进展[7,8]。这些等温扩增技术一方面减少了昂贵的PCR仪器使用,另外也将沙门氏菌的检测效率大大提高了。
在食品微生物的定量检测中,MPN(Most Probable Number,MPN)计数法是一种基于概率计算的计数方法,相比平板计数法具有更高的灵活性,且检出限可根据加样量进行调整,因此广泛用于食品中大肠菌群、金黄色葡萄球菌和单增李斯特菌等微生物的定量检测。国家标准GB 4789.4中只对沙门氏菌规定了定性检测方法[5],但沙门氏菌的研究通常需要定量方法的辅助。美国分析化学家协会(AOAC)、美国环保局(EPA)等机构制定的国际标准中均运用了该方法[9,10],可见MPN计数法对于沙门氏菌的定量研究具有重要意义。
invA基因编码位于沙门氏菌致病岛上的入侵蛋白,是侵袭宿主细胞所需的毒力因子。现有商业化检测试剂盒均以invA基因作为靶标基因[11],但近年来发现有12.3%的S.entericaserovar Kentucky分离菌株无法检测出invA基因[12],且S.entericaserovar Litchfield和Senftenberg等菌株在自然界中也存在丢失invA基因的可能[13]。ttrRSBCA转座子是沙门氏菌无氧代谢过程中重要的基因,Malorny B等开发了基于ttrRSBCA转座子检测食品中沙门氏菌属的qPCR方法[14]。近年来,Kreitlow等[15]发现ttr基因在沙门氏菌中的特异性最高,其包容性和排他性均为100%,而invA基因在沙门氏菌的特异性次之,排他性100%,包容性为97.6%,证明了ttr基因在沙门氏菌的检测中优于invA基因。
本研究针对ttrRSBCA基因座建立一种快速检测食品中沙门氏菌的 qLAMP技术,并结合 mini-MPN和短时间增菌技术,即沙门氏菌的mini-MPN-qLAMP法,并与已建立的mini-MPN-qPCR法[16]比较,以确定所建立的mini-MPN-qLAMP方法的可靠性,为食品中沙门氏菌快速定量检测提供参考。
1 材料与方法
1.1 材料
1.1.1 主要仪器设备
U445超低温保存箱,西班牙泰事达科技公司;QuantStudio5荧光定量PCR仪、LEGEND MICRO21离心机,美国赛默飞世尔科技公司;IN260生化培养箱,德国美墨尔特有限公司;HF-Safe-1200JE生物安全柜,上海力申科学仪器有限公司。
1.1.2 主要材料和试剂
鸡胸肉购置于本地超市,庆元乌米饭购自本地市场;缓冲蛋白胨水(BPW)、XLT-4琼脂,购于青岛海博生物技术有限公司;ThermoPol缓冲液、Bst2.0 DNA聚合酶(8 U/μL)、MgSO4(100 mmol/L)、LAMP荧光染料,购于NEB北京公司;TBGreen Premix Ex Taq、ROX 参比荧光染料、dNTP Mixture(10 mmol/L),购于宝生物工程有限公司。
1.1.3 菌种和引物
引物:依据沙门氏菌属稳定表达的ttr RSBCA转座子基因序列(AF282268.1),LAMP引物使用NEB LAMP Primer Design Tool(https://lamp.neb.com/)软件设计,经实验筛选得到引物;qPCR引物使用PrimerQuest(https://sg.idtdna.com/PrimerQuest/Home/Index)软件设计,引物序列详见表1。所有引物均使用BLAST进行比对,由上海生工生物工程有限公司合成。菌种:实验主要测试菌株为鼠伤寒沙门氏菌ATCC14028,具体特异性验证菌株详见表2。
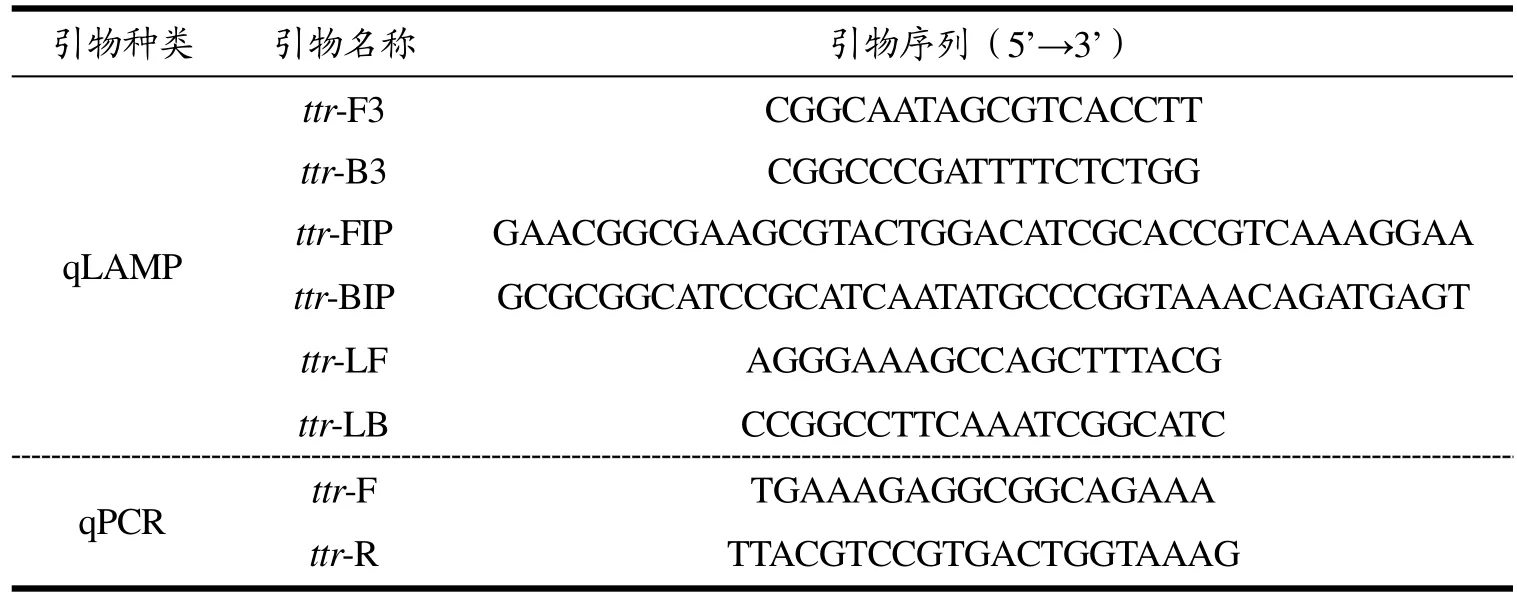
表1 实验用引物Table 1 The primers used in this experiment
1.2 实验方法
1.2.1 菌液制备与核酸提取
菌液制备:将待测菌株接种于BPW中36 ℃培养16 h得到新鲜菌液。
核酸提取:采用煮沸法提取核酸。吸取1 mL样液于12 000 r/min离心5 min,小心移去上清液900 μL,加入1 mL无菌水后混匀再12 000 r/min离心5 min,小心移去上清液 900 μL,置于 100 ℃电热板中煮沸15 min,迅速冷却后12 000 r/min离心1 min,移取上清液直接用于qPCR和qLAMP实验。
1.2.2 qLAMP和qPCR的反应条件
LAMP反应体系:10 X ThermoPol Buffer 2 μL,MgSO41.2 μL,dNTP Mixture 2.8 μL,50 X LAMP 荧光染料 0.2 μL,ROX 参比荧光染料 0.2 μL,10 X Primers Mix 2 μL,Bst2.0 WarmStart DNA 聚合酶0.8 μL,DNA 粗提液 5 μL,加无菌水至 20 μL。反应条件:65 ℃保温反应40 min,以1 min作1个循环检测荧光值,结束后测定溶解曲线(65~95 ℃,0.2 ℃/s)。
qPCR反应体系参照文献[16]。
1.2.3 qLAMP和 qPCR的特异性实验和纯培养检出限测定
特异性检测:参照1.2.1提取表2中各菌株核酸,使用建立的qLAMP法和qPCR法对方法的特异性进行检测。
检出限检测:参照 1.2.1制备鼠伤寒沙门氏菌ATCC14028菌液,使用PBS进行10倍系列稀释,得到 5×107、5×106、5×105、5×104、5×103、5×102、5×101、5×100CFU/mL稀释液,每个浓度取1 mL分别进行核酸提取和qLAMP、qPCR实验,确定方法检出限,并进行溶解曲线分析。同时取适宜浓度100 μL样液进行XLT-4平板涂布计数。
1.2.4 平板计数法定量检测沙门氏菌
使用PBS进行10倍系列稀释,取3个适宜稀释梯度,分别吸取100 μL稀释菌液,涂布于XLT-4平板,36 ℃培养 24 h。然后对典型菌落进行计数,并依据GB 4789.4-2016进行后续鉴定工作。
1.2.5 mini-MPN-qLAMP、mini-MPN-qPCR和mini-MPN法定量检测沙门氏菌
使用BPW对样液进行10倍系列稀释,每个梯度浓度取1.2 mL至48孔板,每个浓度加3孔,置于36 ℃增菌5 h后分别从48孔板中取1 mL增菌液,提取核酸,进行qPCR和qLAMP鉴定实验,剩余增菌液继续置于36 ℃增菌至18 h,然后在XLT-4平板划线,依据GB 4789.4进行鉴定。依据不同浓度阳性孔数进行MPN查表计数[17]。
1.2.6 人工污染鸡胸肉混合液和冷冻乌米饭定量检测
从当地市场购置鸡胸肉和乌米饭,置于无菌均质袋中,送入实验室,适度均质后置于冰箱中冷冻保存。参照GB 4789.4-2016进行检验,确认无沙门氏菌污染后,再制备成样品混合液(即人工添加 102~108CFU/mL不同浓度的沙门氏菌稀释液)待平板计数法、mini-MPN法、mini-MPN-qPCR法和mini-MPN-qLAMP法定量检测。
1.2.7 数据统计与处理
以上实验均设3个平行,使用SigmaPlot 14.0进行数据统计和Bland-Altman相关性分析。
2 结果与分析
2.1 qLAMP和qPCR检测方法确立
实验测定的标准曲线和溶解曲线如图1,qPCR实验获得的相对标准曲线方程为y=-3.02x+36.61,r2=0.997,PCR扩增效率为 100%,检出限为50 CFU/mL,溶解曲线分析表明溶解温度为86.1 ℃;qLAMP实验获得的相对标准曲线方程为y=-2.39x+12.51,r2=0.949,PCR扩增效率为 151%,检出限为500 CFU/mL,溶解曲线分析表明溶解温度为 87.4 ℃。与本项目组之前基于invA基因建立的qPCR法和qLAMP法相比,本研究建立的两种方法检出限具有一致性[16,18]。并且qPCR法建立的标准曲线相对qLAMP法标准曲线稳定性更好。当使用qLAMP法对低浓度的沙门氏菌进行检测时,曲线线性易受到影响,本实验多次测试结果表明,低浓度下LAMP的扩增不稳定,Ct值容易出现较大波动,这与 Youn[19]等研究得到的结果一致。同时,本研究中qLAMP法检出限与Fang等[20]建立的qLAMP法检出限相似。
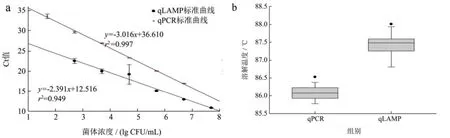
图1 qLAMP和qPCR检出限测定和溶解温度分析Fig.1 The detection limit and melting temperature analysis of qLAMP and qPCR
为了验证所建立的qLAMP和qPCR方法的特异性,本研究使用15株沙门氏菌菌株和21株非沙门氏菌菌株进行qLAMP和qPCR实验。如表2,qLAMP和qPCR均特异性良好,15株沙门氏菌菌株均能扩增出ttr基因片段,而21株非沙门氏菌菌株均未检出ttr基因,故实验结果符合沙门氏菌特异性鉴定的要求。
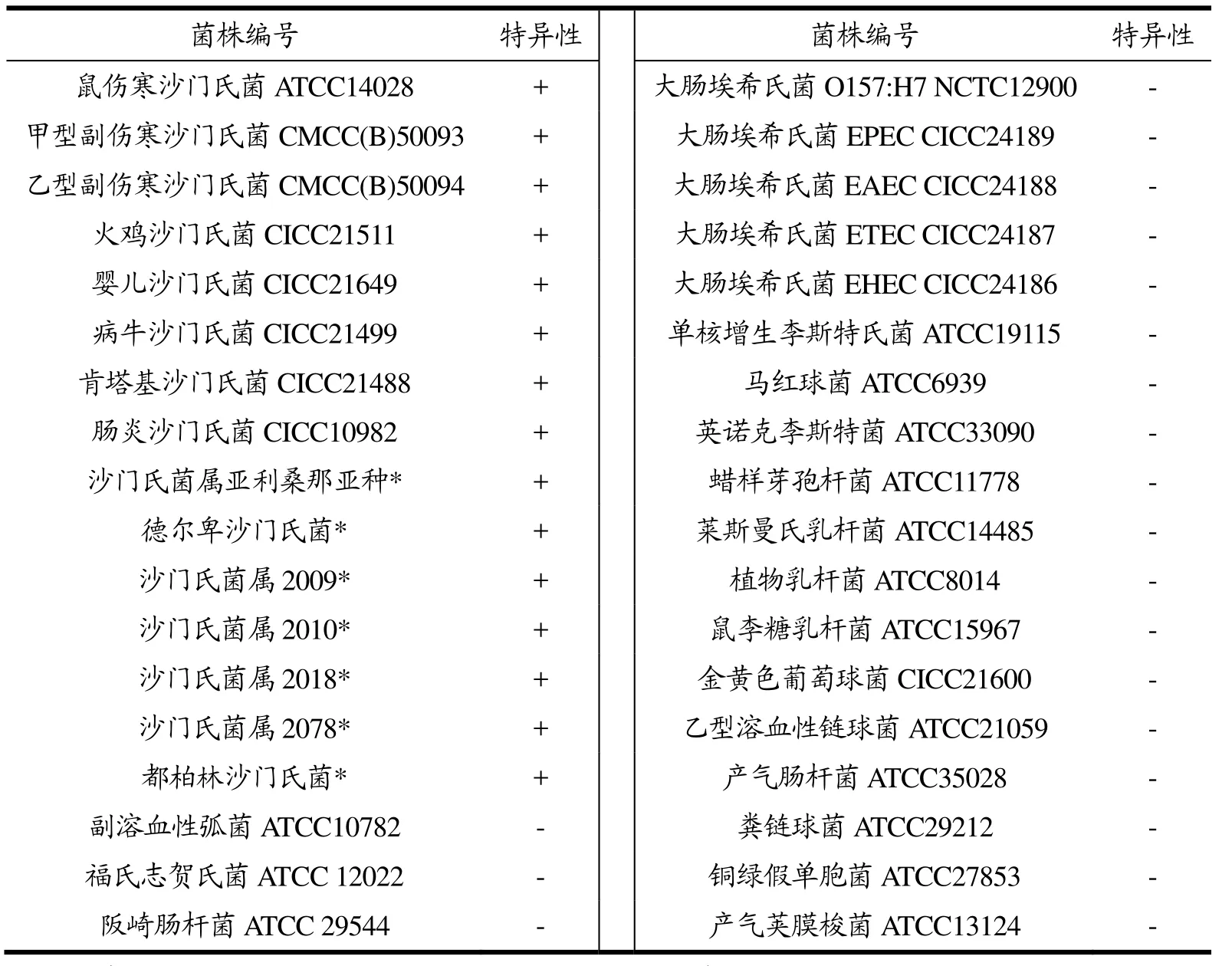
表2 qLAMP和qPCR的特异性实验Table 2 Specificity of qPCR and qLAMP
2.2 人工污染速冻乌米饭混合液的定量检测
实验使用初始浓度为5×108CFU/mL的沙门氏菌菌液进行10倍稀释后,每个浓度分别取1 mL至25 g乌米饭样品中均质,加入225 mL BPW稀释后,得到终浓度为 6.30、5.30、4.30、3.30、2.30、1.30、0.30、-0.70 lg CFU/mL稀释液,分别使用mini-MPN-qLAMP、mini-MPN-qPCR、mini-MPN计数法和平板计数法对速冻乌米饭中沙门氏菌进行定量检测,结果如表3所示。平板计数法最低检出浓度为 1.46 lg CFU/mL,而基于MPN的方法最低可检出-0.44 lg MPN/mL的沙门氏菌,相较平板计数法检出限显著降低。从表中得出,基于MPN 的mini-MPN-qLAMP、mini-MPN-qPCR、mini-MPN法计数结果相近。其中mini-MPN-qLAMP和mini-MPN-qPCR法的结果平均差异为0.02 lg MPN/mL,最大差异为 0.28 lg MPN/mL。所有计数结果均在mini-MPN-qLAMP的95%置信区间内。实验结果显示mini-MPN-qLAMP法的检出限为-0.44 lg MPN/mL。
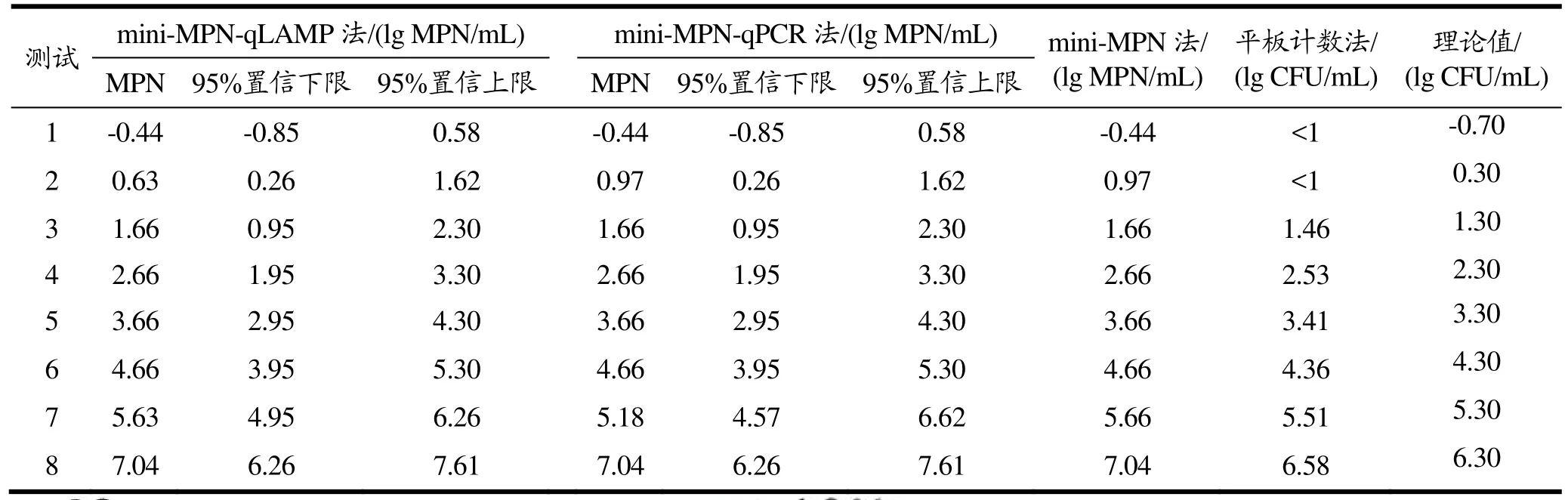
表3 速冻乌米饭的沙门氏菌定量检测结果Table 3 The quantitative detection of Salmonella in frozen black rice
为验证mini-MPN-qLAMP的有效性,实验将mini-MPN-qLAMP法和其它定量检测方法的结果进行Bland-Altman相关性比较分析,结果见图2。mini-MPN-qPCR、mini-MPN和平板计数法的定量结果与 mini-MPN-qLAMP结果一致性程度较高。平板计数法与mini-MPN-qLAMP的相关系数r2=0.997,而mini-MPN与mini-MPN-qLAMP的相关系数r2=0.998,具有更好的线性关系。从图中可以看出,mini-MPN和mini-MPN- qLAMP法的95%置信区间上差异为-0.19和0.28 lg MPN/mL之间,这两种方法在95%置信区间差异不超过0.15 lg MPN/mL,因此,与已被广泛认可的MPN计数法相比,mini-MPN-qLAMP法为沙门氏菌定量检测提供了一种可靠的替代方法。
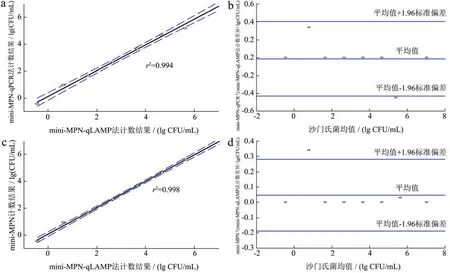
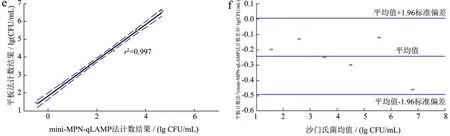
图2 在速冻乌米饭应用中mini-MPN-qLAMP法与其他方法的Bland-Altman比较分析Fig.2 Bland-Altman analysis of mini-MPN-qLAMP and other quantitative methods infrozen black rice
2.3 人工污染速冻鸡胸肉混合液的定量检测
实验使用浓度4×108CFU/mL菌液进行10倍稀释后,稀释液分别取1 mL至25 g鸡胸肉样品中均质,加入225 mL BPW稀释后得到终浓度为6.20、5.20、4.20、3.20、2.20、1.20、0.20、-0.80 lg CFU/mL稀释液,分别使用 mini-MPN-qLAMP、mini-MPN-qPCR、mini-MPN法和平板计数法对速冻鸡胸肉中沙门氏菌进行定量检测,结果见表4所示。基于MPN的方法在检出限方面相比平板计数法同样更具优势。mini-MPN-qLAMP和mini-MPN-qPCR法的结果平均差异为0.51 lg MPN/mL,最大差异为1.03 lg MPN/mL。相较于速冻乌米饭,在速冻鸡胸肉中mini-MPN-qPCR、mini-MPN-LAMP、mini-MPN和平板计数法四种方法的结果一致性程度较低,原因可能是生肉制品中存在大量的腐败假单胞菌[21]对结果造成的干扰。另外,通过平板计数法发现鸡胸肉中存在大量大肠菌群等干扰菌,这些细菌容易对常规的mini-MPN法和平板计数的结果造成干扰。在增菌过程中,大肠菌群等细菌大量繁殖,而mini-MPN法的增菌时间偏长,大肠菌群属于优势菌种,导致mini-MPN法的结果存在较大偏差。这些结果与本课题组对山泉水中沙门氏菌的检测结果相似[18]。实验结果显示 mini-MPN-qLAMP法的检出限为-0.64 lg MPN/mL。
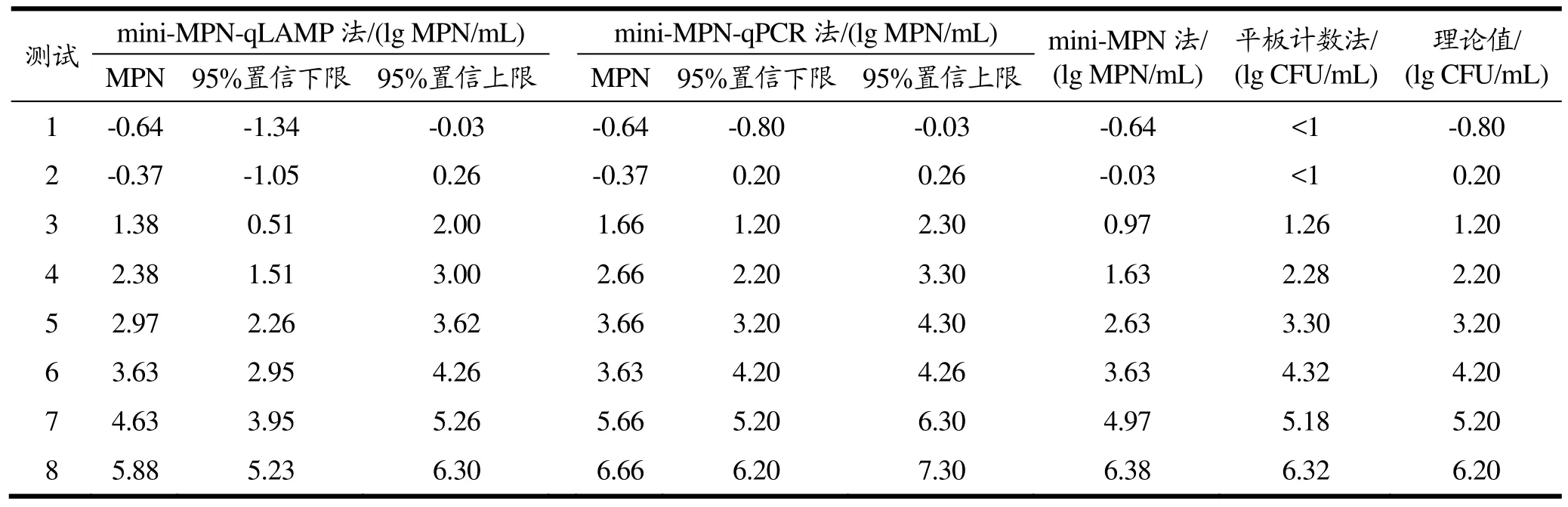
表4 鸡胸肉混合液的沙门氏菌定量检测结果Table 4 The quantitative detection of Salmonella in chicken breast rinsate
实验将 mini-MPN-qLAMP法和其它定量检测方法的结果进行Bland-Altman相关性分析,结果见图3。平板计数法与mini-MPN-qLAMP的相关系数r2=0.963,mini-MPN与mini-MPN-qLAMP的相关系数r2=0.970。mini-MPN-qPCR与mini-MPN-qLAMP相关线性最好,r2=0.990。如图所示,mini-MPN-qLAMP法和其他检测方法的 95%置信区间上差异普遍偏大,mini-MPN-qPCR与mini-MPN-qLAMP的结果在95%置信区间上差异为-0.40和1.18 lg MPN/mL之间。相比而言,在高污染杂菌的条件下,mini-MPN-qLAMP法为沙门氏菌定量检测提供了一种可靠的检测方法,具有较好的定量检测能力。
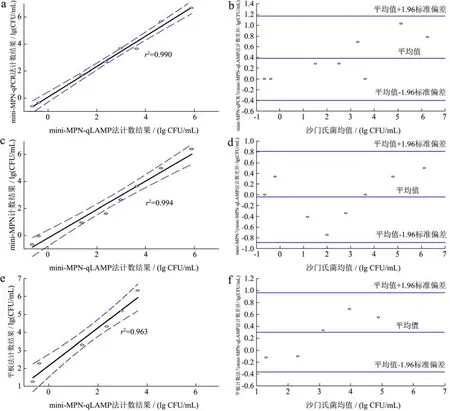
图3 在鸡胸肉检测应用中mini-MPN-qLAMP法与其他方法的Bland-Altman分析Fig.3 Bland-Altman analysis of mini-MPN-qLAMP and other quantitative methods in chicken breast rinsate
3 讨论
由于不同食品对于沙门氏菌的检测影响较大,考虑到沙门氏菌普遍易感的两种食品速冻面米食品和生制肉制品,本实验选取速冻乌米饭和速冻鸡胸肉进行不同污染程度食品沙门氏菌定量检测方法的验证。常用的定量检测方法有平板计数法,MPN计数法。其中平板计数法由于取样量少,存在检出限高的问题,并且对于污染严重的样品可能无法直接计数。
与平板计数法相比,MPN计数法可以显著降低定量方法的检出限。虽然通过概率计算可能带入误差[22],但MPN值与平板计数法结果之间存在正相关[23]。根据MPN计算公式,MPN法的误差与加样量和发酵管数相关。发酵管数越多,MPN计数结果越准确,但这将实验成本升高,操作变得复杂。为了控制实验成本,减少实验工作量,项目组使用体积小,容量大的 48孔板作为多管发酵容器,可实现每孔加样量1.2 mL,使用3管稀释法大大降低了传统MPN计数对人力和物力成本需求,可实现快速简便定量检测,并且通过MPN统计表中的95%置信区间减少误差。
基于 mini-MPN计数法,本实验建立了mini-MPN-qLAMP和 mini-MPN-qPCR法。其中mini-MPN-qPCR法的具有良好的定量检测能力[16,24],但该方法需要昂贵的荧光定量PCR仪。qLAMP技术对设备要求更低,只需等温条件即可进行实时荧光检测。另外,qLAMP是基于荧光的LAMP技术,具有特异性强、灵敏度高、反应快的特点,也可使用显色反应进行检测。LAMP技术对于引物设计的要求较高,需要设计合理引物防止出现假阳性现象。而且LAMP显色技术容易受到核酸提取方法的影响,因此,本研究使用qLAMP法对LAMP过程进行监控,检测结果更加可靠,后续可增加基于显色反应的LAMP技术进行检测,进一步降低仪器要求,实现现场检测。
项目组同时设计了 mini-MPN-qLAMP、mini-MPN-qPCR、mini-MPN和平板计数法定量测定沙门氏菌,通过Bland-Altman分析对两种方法的检测结果的一致性进行评价。两种检测方法的结果差异用结果的差值平均值进行估计,平均值的变异情况则用差值的标准差来描述。当测量结果的差值服从正态分布时,95%的差值位于平均值±1.96标准差之间,则可认为这两种方法测量结果具有较好的一致性[25]。本实验使用两种不同污染程度的食品对所建立的mini-MPN-qLAMP法进行定量检测验证,发现mini-MPN-qLAMP可以通过基因检测消除初始杂菌对实验的影响,项目组后续考虑检验结果区分死菌活菌的能力,配合PMA等检测方法进行进一步研究[26]。
4 结论
本研究旨在建立一种准确度高、操作简便的沙门氏菌定量等温扩增检测方法。研究使用ttr基因替代传统的invA基因作为检测靶点建立了qLAMP和qPCR定性检测方法,并使用15株沙门氏菌菌株和21株非沙门氏菌菌株进行特异性验证,仅沙门氏菌检测呈阳性结果。qLAMP和 qPCR纯培养检出限分别为500 CFU/mL和50 CFU/mL,建立的定性检测方法可行。研究进一步使用基于48孔板的3孔微量多管发酵法和短时间增菌技术建立了 mini-MPN-qLAMP法和mini-MPN-qPCR 法实现了定量检测。通过Bland-Altman分析表明,经过5 h BPW增菌后所建立的 mini-MPN-qLAMP法在速冻乌米饭中检测结果与mini-MPN-qPCR、mini-MPN计数法、平板计数法相比均具有较高的一致性,r2≥0.994,检出限为-0.44 lg MPN/mL;而在速冻鸡胸肉中该法检测结果与mini-MPN-qPCR结果一致性最佳,r2=0.990,检出限为-0.64 lg MPN/mL。肉制品中腐败杂菌会影响mini-MPN计数和平板计数结果,mini-MPN-qLAMP可排除肉制品中腐败杂菌对检测结果的影响。
综上所述,本实验建立的mini-MPN-qLAMP法是一种准确度高、操作简便的沙门氏菌定量检测方法,无需特定PCR仪器即可进行沙门氏菌的快速检测,可大幅度提高检测效率,可在食品的沙门氏菌检测领域予以推广。
