贻贝的可控酶解及其酶解液的抗氧化活性
2017-07-01郭晓华黄海李玉环
郭晓华,黄海,李玉环
(1.山东美佳集团有限公司,山东日照276800;2.钦州学院食品工程学院,广西钦州535011;3.日照职业技术学院海洋工程学院,山东日照276826)
贻贝的可控酶解及其酶解液的抗氧化活性
郭晓华1,黄海2,*,李玉环3
(1.山东美佳集团有限公司,山东日照276800;2.钦州学院食品工程学院,广西钦州535011;3.日照职业技术学院海洋工程学院,山东日照276826)
用Alcalase对贻贝进行酶解能够得到具有抗氧化活性的酶解物。通过控制酶解时间分别得到水解度(hydrolysis degree,DH)为12%、18%、24%和30%的4种酶解物,研究其抗氧化活性。结果表明,酶解物的还原力和羟基自由基清除率均随DH升高而升高,但在DH 24%~30%范围升高极缓;其DPPH自由基、超氧阴离子自由基清除率和脂质过氧化抑制率均随DH升高而呈现先增后降的趋势,最高清除率均出现在DH 24%处。DH为24%的贻贝Alcalase酶解物具有最佳的抗氧化活性。
贻贝;水解度;抗氧化活性;酶解
贻贝是贝类养殖事业中的重要种类,世界许多地区都有养殖。日照近几年贻贝产量迅速上升,2014年日照贻贝产量达到50万t,约占全国总产量的70%,世界总产量的40%。而且由于日照贻贝的收获是在每年的腊月到次年的清明节前后,收获季节气温较低,产品品质高。然而日照贻贝加工还是以生产单冻贻贝肉为主,生产工艺相对简单,劳动力需求大,产品附加值不高。
蛋白质可控酶解技术就是通过控制水解度(hydrolysis degree,DH)来获得需要的具有某种活性的目标肽组分。许多研究表明,通过可控酶解技术可以获得抗氧化活性肽[1-2]、矿物元素结合活性肽[3-4]、降血压活性肽[5-6]等。抗氧化肽具有消除自由基,抑制氧化反应的功能,在食品行业可用于抗氧化剂,延长食品的保质期;在生物体内可具有减轻自由基对机体的损伤、延缓衰老等功能[7]。本论文通过可控酶解技术制备具有抗氧化活性的酶解物,为贻贝抗氧化保健产品的开发提供理论支持,促进贻贝加工行业的快速健康发展。
1 材料与方法
1.1 材料与仪器
新鲜贻贝:日照岚山水产批发市场。
风味蛋白酶(12 kU/g)、胰蛋白酶(190 kU/g)、胃蛋白酶(20 kU/g):南宁庞博生物工程有限公司;Alcalase(103 kU/g)、中性蛋白酶(150 kU/g):丹麦诺维信;福林酚试剂、牛血清白蛋白、甘氨酸:上海生工;还原型谷胱甘肽、DPPH:Sigma公司;抗坏血酸、邻苯二胺、铁氰化钾、三氯化铁、三氯乙酸、Tris、邻苯三酚、甲基紫等试剂均为分析纯及以上。
PHS-3C型精密pH计:上海雷磁仪器厂;FDU-1200型EYELA冷冻干燥机:上海爱朗仪器有限公司;UV-2550型紫外分光光度计:日本岛津公司;DF-101S集热式恒温加热磁力搅拌器:郑州长城科工贸有限公司;GL-21M高速冷冻离心机:湘仪离心机仪器有限公司。
1.2 方法
1.2.1 样品前处理
贻贝取肉后,用清水清洗,去除足丝、杂质等,控干水分,置于组织捣碎机中匀浆,浆液用95%乙醇(4倍体积)在50℃萃取6 h,重复2次,抽滤除去脂肪,滤饼用少量乙醇冲洗后,真空干燥后粉碎过100目筛,即得脱脂贻贝粉。
1.2.2 贻贝酶解物制备
选取合适的蛋白酶在试验确定的条件下对脱脂贻贝粉进行酶解。酶解过程中采用0.1 mol/L NaOH和HCl维持pH值稳定。酶解完成后在100℃加热10 min灭酶,冷却至室温,于6 000 r/min、4℃条件下离心20 min得到上清液,上清液过0.22 μm微孔滤膜后,旋转蒸发浓缩、冷冻干燥即得贻贝酶解物(enzymatic mussel powder,EMP)。
1.2.3 抗氧化活性检测
将EMP配成系列浓度,以同浓度的谷胱甘肽(Glutathione,GSH)为参照,分别测定样液的总还原力[8]、DPPH自由基清除率[9]、超氧阴离子自由基清除率[10]、羟基自由基清除率[11]、亚油酸脂质过氧化抑制率[12]。运用SPSS统计软件得到各抗氧化活性指标的半数清除率(Half scavenging concentration,SC50),即达到 50%清除率时的浓度。
1.2.4 其他指标的测定
DH(DH)测定按照茚三酮比色法进行[13],蛋白质浓度测定采用福林酚比色法[14]。
2 结果与分析
2.1 贻贝酶解工艺优化
2.1.1 酶的选择
以酶解液的蛋白回收率(酶解液蛋白质质量占底物蛋白质质量的百分比)和总还原力为评价指标进行酶的筛选。各种酶均在其推荐的pH值、温度下以相同的料液比、加酶量水解相同时间,得到酶解液。各种酶的水解条件如表1所示,各种酶解物的蛋白质回收率和还原力见图1。
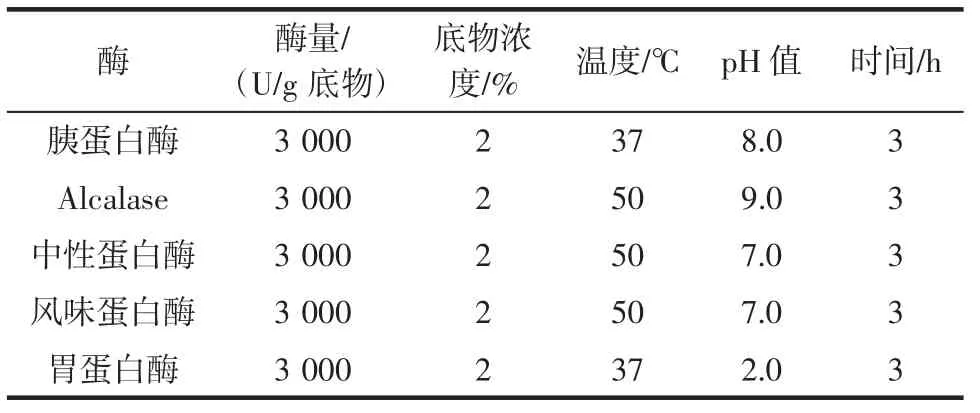
表1 各种酶的酶解条件Table 1 The enzymolysis parameters of enzymes
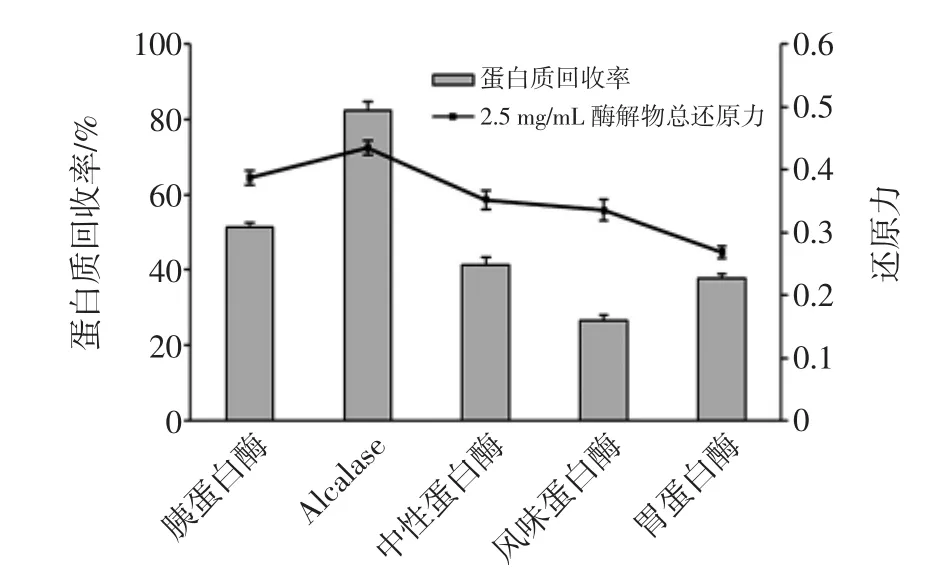
图1 各种酶解物的蛋白质回收率和还原力Fig.1 The protein recovery rate and reducing power of hydrolysates
由图1可知,Alcalase的蛋白质回收率最高,达到82.36%,显著高于其它酶(P<0.05),其余从高到低依次为胰蛋白酶、中性蛋白酶、胃蛋白酶和风味蛋白酶。从酶解液总还原力方面来看,还原力从高到低依次为Alcalase、胰蛋白酶、中性蛋白酶、风味蛋白酶和胃蛋白酶。这说明不同酶的专一性不同,得到的肽链组成、大小均不相同,从而导致还原力的差异。根据试验结果,Alcalase的蛋白质回收率和总还原力均显著高于其它酶,因此选择Alcalase作为水解用酶。
2.1.2 Alcalase酶解条件优化
以DH为评价指标,对Alcalase的温度、pH值、料液比、加酶量4个条件进行优化,水解时间均为2 h,结果如图2所示。Alcalase在60℃时DH最高,达到22.57%,温度超过60℃时,Alcalase开始失活(图2A)。Alcalase在pH10.0时活性最高,此时DH达到26.35%,当pH值超过10.0酶活力开始下降(图2B)。试验表明当料液比为1∶40(g/mL)时,DH最高(图2C)。随着加酶量的增加,DH呈现上升趋势,当加酶量达3 000 U/g时,DH几乎不变,所以最适加酶量为3 000 U/g(图2D)。由此可确定贻贝的最佳Alcalase水解条件为:温度60 ℃、pH 10.0、料液比 1 ∶40(g/mL)、加酶量 3 000 U/g。
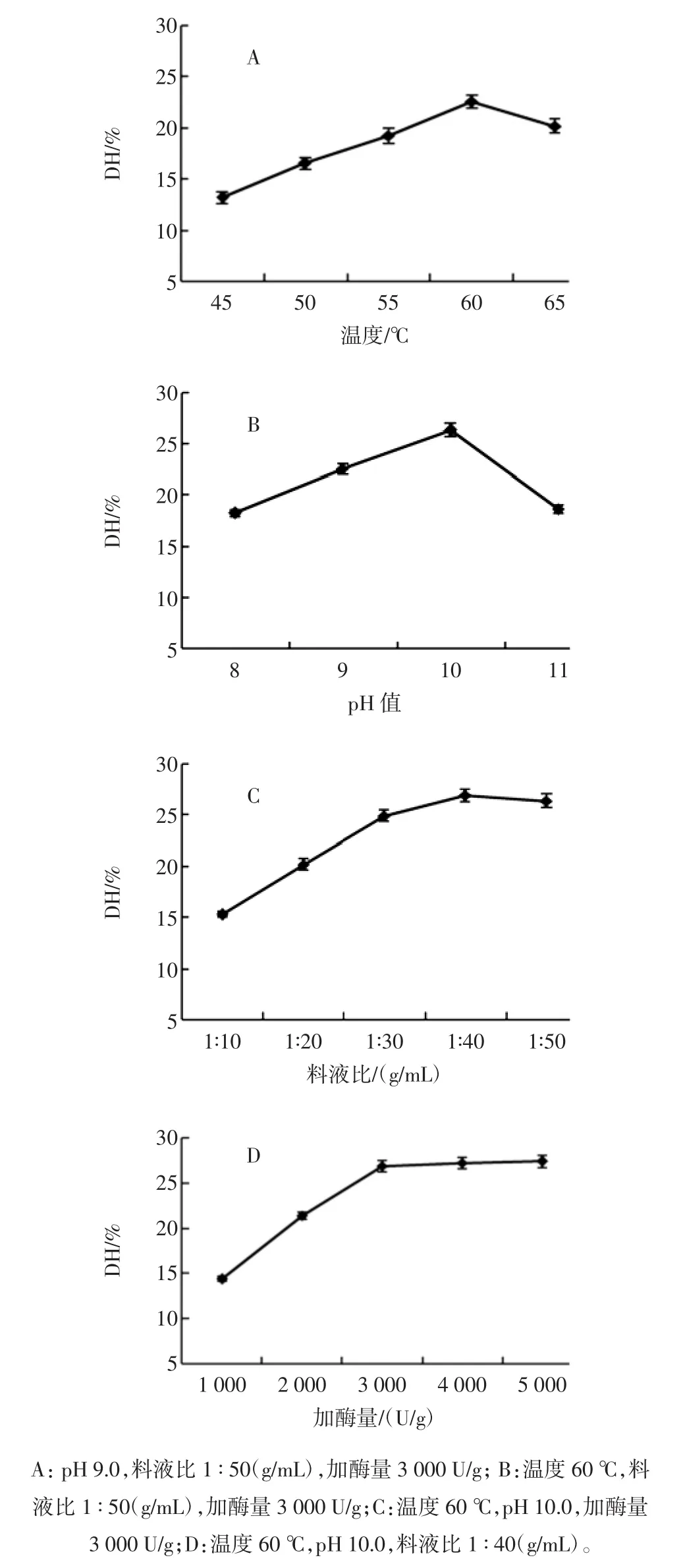
图2 Alcalase水解条件优化Fig.2 The optimization of hydrolysis with Alcalase
2.2 贻贝酶解物化学成分分析
在上述优化条件下控制酶解时间得到不同DH的酶解物。本文制备了DH分别为12%、18%、24%和30%的4种酶解物(酶解时间分别为45、90、160、240 min),对其化学成分进行分析,结果如表2所示。
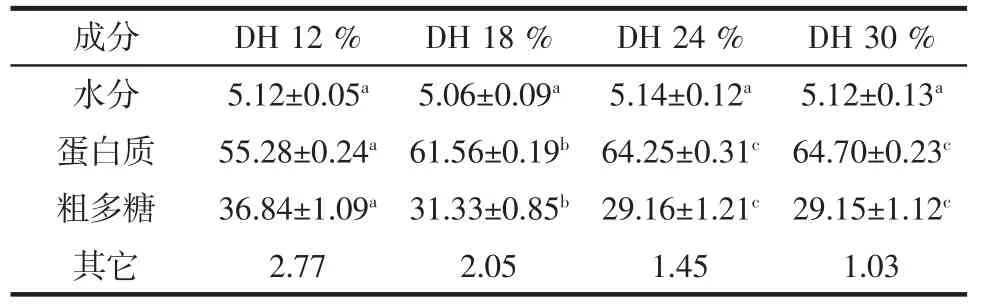
表2 贻贝酶解物化学成分Table 2 The contents of mussel hydrolysates %
随着DH升高,酶解物中蛋白质含量逐渐升高,而多糖含量逐渐降低,这是由于随着水解的进行,越来越多的蛋白质溶解,酶解液中蛋白质所占比例越来越大。
2.3 贻贝酶解物抗氧化活性
2.3.1 贻贝酶解物的还原力
不同DH的贻贝酶解物的还原力大小如图3所示。
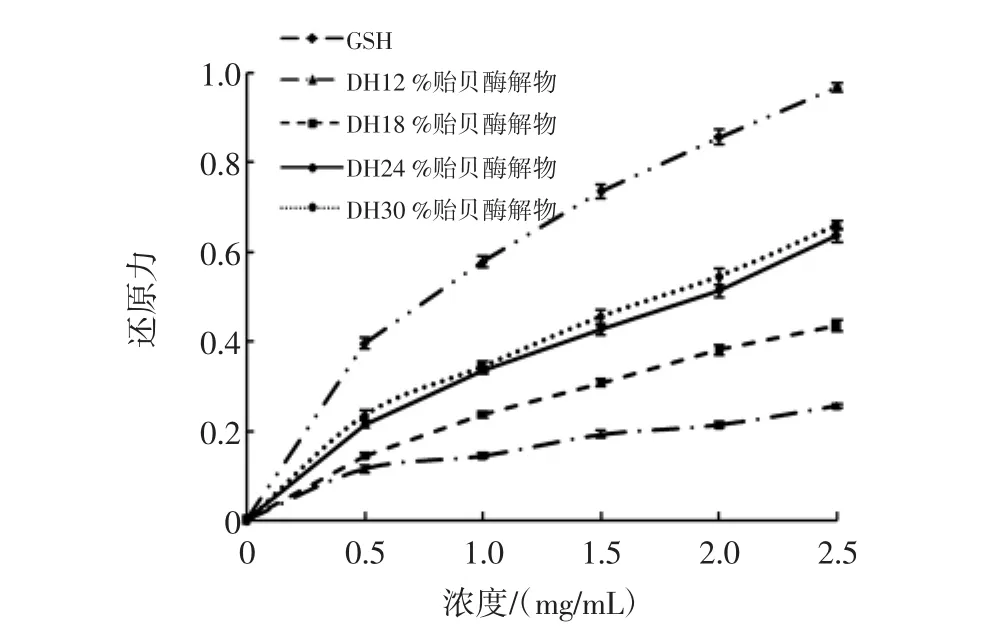
图3 DH对贻贝酶解物还原力的影响Fig.3 The influence of DH on reducing power of hydrolysates
GSH和4个DH的贻贝酶解物的还原力均呈现量效关系,即随着浓度的增加而增加,GSH的还原力显著高于同浓度各种DH的贻贝酶解物。在DH12%至30%范围内,贻贝酶解物还原力随着DH的增加而升高,当DH达到24%后,还原力基本维持稳定,略有上升。综合分析各DH酶解物的化学成分和还原力可知,随着DH上升,酶解物蛋白质含量和还原力均升高,可见还原力主要体现在蛋白质上。由于DH为24%和30%的酶解物蛋白质含量基本相同(P>0.05),所以具有的还原力也相当。
2.3.2 贻贝酶解物的DPPH自由基清除率
DH对贻贝酶解物DPPH自由基清除率的影响见图4。
由图4可知,GSH的DPPH自由基清除率显著高于同浓度各酶解物,且所有组的DPPH自由基清除率也呈现明显的量效关系。在DH 12%~24%范围内,DH对贻贝酶解物DPPH自由基清除能力的影响表现为正相关,这可能是由于酶解物随着DH的升高蛋白质含量也升高。然而当DH从24%升高到30%时,酶解物的DPPH自由基清除率却下降,由于这两个DH的酶解物蛋白质含量几乎相等,由此可知酶解物的DPPH自由基清除能力不仅与蛋白质的含量相关,还与蛋白肽的分子大小有关。

图4 DH对贻贝酶解物DPPH自由基清除率的影响Fig.4 The influence of DH on scavenging rate of DPPH free radical of hydrolysates
2.3.3 贻贝酶解物的超氧阴离子自由基清除率
DH对贻贝酶解物超氧阴离子自由基清除率的影响见图5。
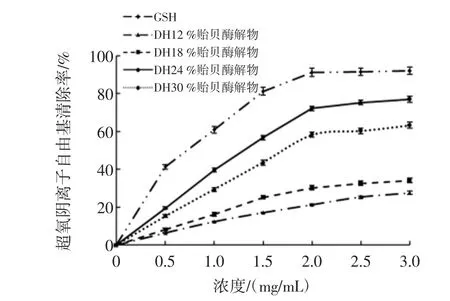
图5 DH对贻贝酶解物超氧阴离子自由基清除率的影响Fig.5 The influence of DH on scavenging rate of superoxide anion radical of hydrolysates
由图5可知,GSH的超氧阴离子自由基清除率也显著高于同浓度各酶解物,且所有组的超氧阴离子自由基清除率也呈现明显的量效关系。在DH12%~24%范围内各酶解物超氧阴离子自由基清除率随着DH的升高而显著升高。当浓度为3 mg/mL时,DH为12%、18%、24%的贻贝酶解物超氧阴离子自由基清除率分别为27.59%、34.01%、76.89%。同样当DH超过24%时,也观察到清除率下降的情况,3 mg/mL DH为30%的酶解物超氧阴离子自由基清除率降为63.32%。这与DPPH自由基清除率的趋势相一致,说明酶解物对超氧阴离子自由基清除能力也与蛋白肽的分子大小有关。
2.3.4 贻贝酶解物的羟基自由基清除率
DH对贻贝酶解物羟基自由基清除率的影响见图6。

图6 DH对贻贝酶解物羟基自由基清除率的影响Fig.6 The influence of DH on scavenging rate of hydroxyl radical of hydrolysates
由图6可知,4种酶解物的羟基自由基清除能力与DH呈现正相关。与酶解物对超氧自由基清除作用不相同的是并未出现清除率随着DH升高呈现先升后降的情况,而是呈现一直上升的趋势,但从DH24%到30%时,清除率上升不显著(P>0.05)。这一变化趋势与You[15]等研究泥鳅蛋白木瓜蛋白酶解液以及张艳萍[16]等用碱性蛋白酶水解贻贝蛋白所得的研究结果基本一致。
2.3.5 贻贝酶解物的脂质过氧化抑制作用
DH对贻贝酶解物脂质过氧化抑制率的影响见图7。
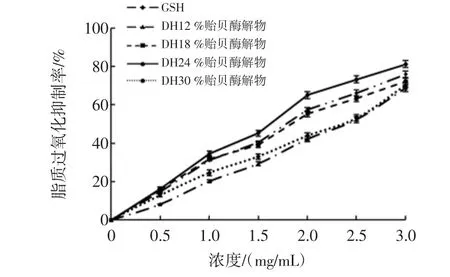
图7 DH对贻贝酶解物脂质过氧化抑制率的影响Fig.7 The influence of DH on inhibition rate of lipid peroxidation of hydrolysates
2.3.6 贻贝酶解物自由基清除作用及脂质过氧化抑制作用的SC50
通过二次曲线拟合,求出DH12%、DH18%、DH24%、DH30%4种酶解物对3种自由基清除作用及脂质过氧化抑制作用的SC50,结果如表3所示。
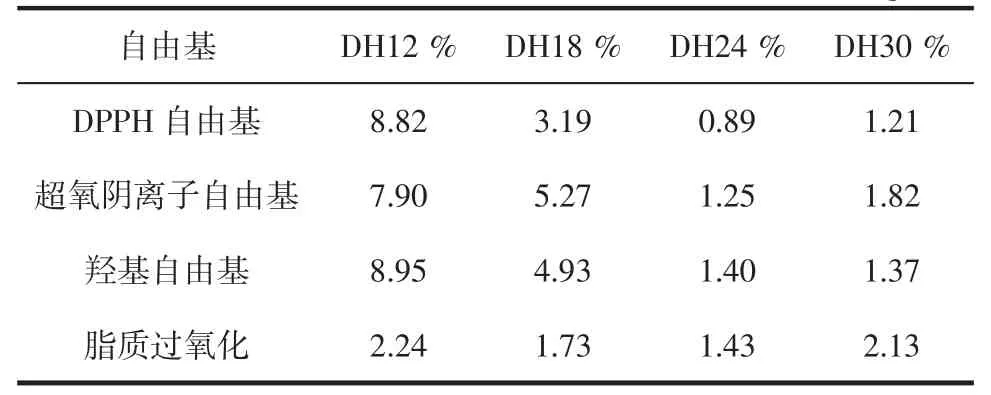
表3 贻贝酶解物自由基清除和脂质过氧化抑制的SC50Table 3 The SC50of radical scavenging and lipid peroxidation inhibition of mussel hydrolysates mg/mL
DH24%酶解物对DPPH自由基、超氧阴离子自由基的清除作用和对脂质过氧化抑制作用最强,其SC50分别为0.89、1.25、1.43 mg/mL。DH24%酶解物对羟基自由基也具有较强的清除作用,其SC50为1.40 mg/mL,仅略高于DH30%酶解物的1.37 mg/mL。因此DH24%酶解物显示出最佳的抗氧化活性。
由于不同的氧化体系氧化机制不同,所以试验中贻贝酶解物在不同的氧化体系中活性不同。通过比较DH24%酶解物对3种自由基清除作用及脂质过氧化抑制作用的SC50可知,其清除DPPH自由基活性最高,其次是羟基自由基,脂质过氧化抑制作用最低。
3 结论
Alcalase酶解贻贝的效果最佳,蛋白回收率及其酶解物还原力均显著高于其它酶。Alcalase最佳酶解工艺条件为:温度 60 ℃、pH 10.0、料液比 1 ∶40(g/mL)、加酶量3 000 U/g。通过控制酶解时间制备得到DH分别为12%、18%、24%和30%的4种酶解物,随着DH升高,酶解物中蛋白质含量逐渐升高,而多糖含量逐渐降低。蛋白质含量和肽分子大小是影响酶解物抗氧化活性的两个因素。酶解物的还原力和羟基自由基清除率均随DH升高而升高,但在DH24%~30%范围升高极缓,说明还原力和羟基自由基清除活性主要与蛋白质含量有关。酶解物的DPPH自由基和超氧阴离子自由基清除率和脂质过氧化抑制率均随DH升高而呈现先增后降的趋势,最高清除率出现在DH24%处,说明DPPH、超氧阴离子自由基清除活性和脂质过氧化抑制活性不但与蛋白质含量有关,还与肽分子大小有关。DH为24%的贻贝酶解物具有最佳的抗氧化活性。
[1] Thiansilakul Y,Benjakul S,Shanidi F.Antioxidative activity of protein hydrolysate from scad muscle using Alcalase and Flavourzyme[J].Journal of Food Biochemistry,2007,31:266-287
[2]Xie Z,Huang J,Xu X.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food Chemistry,2008,111:370-376
[3] Li Y,Huang H.Enzymatic preparation of carp roes’hydrolysate with Ca-binding capacity[J].Advanced Material Research,2012(554/556):1309-1317
[4] 黄海,李八方,曾名湧.鲤鱼卵酶解制备钙离子结合活性肽的条件优化[J].食品研究与开发,2017,38(1):73-77
[5] Miguel M,Contreras M,Recio I,et al.ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J].Food Chemistry,2009,112:211-214
[6] Wu P,Aluko E,Muir D.Purification of angiotensin I converting enzyme inhibitory peptides from the enzymatic hydrolysate of defatted canola meal[J].Food Chemistry,2008,111:942-950
[7] 王章存,徐贤,魏翠平.大豆蛋白的酶解及其抗氧化活性研究[J].中国粮油学报,2009,24(5):21-24
[8] Yen G C,Chen H Y.Antioxidant activity of various tea extracts in relation to their antimutagenicity[J].Journal of Agricultural and Food Chemistry,1995,43(1):27-32
[9] Guerard F,Sumaya-Martinez M T,Laroque D,et al.Optimization of free radical scavenging activity by response surface methodology in the hydrolysis of shrimp processing discards[J].Process Biochemistry,2007,42:1486-1491
[10]沈侃,邵雪玲.平菇多糖清除O2-及对红细胞膜自由基氧化的影响[J].氨基酸和生物资源,2002,24(2):19-21
[11]朱兴松.甲基紫光度法测定Fenton体系中产生的羟自由基[J].哈尔滨商业大学学报,2003,19(5):592-594
[12]Osawa T,Namiki M.A novel type of antioxidant isolated from leaf wax of Eucalyptus leaves[J].Agricultural and Biological Chemistry,1981,45(3):735-739
[13]Moore S,Stein W H.A modified ninhydrin reagent for the photometric determination of amino acids and related compounds[J].Journal of Biological Chemistry,1954,211(2):907-913
[14]Lowry O H,Rosebrough A L,Farr A L,et al.Protein measurement with the Folin-phenol reagent[J].Journal of Biological Chemistry,1951,193:165-275
[15]You L,Zhao M,Cui C.Effect of degree of hydrolysis on the antioxidant activity of loach (Misgurnus anguillicaudatus)protein hydrolysates[J].Innovative Food Science and Emerging Technologies,2009,10:235-240
[16]张艳萍,戴志远,张虹.贻贝蛋白的酶解及其酶解物的抗氧化活性研究[J].中国食品学报,2012,12(1):10-18
Controllable Enzymatic Hydrolysis of Mussel and Antioxidant Activity of Hydrolysates
GUO Xiao-hua1,HUANG Hai2,*,LI Yu-huan3
(1.Shandong Meijia Group Co.,Ltd.,Rizhao 276800,Shandong,China;2.College of Food Engineering,Qinzhou University,Qinzhou 535011,Guangxi,China;3.College of Ocean Engineering,Rizhao Polytechnic,Rizhao 276826,Shandong,China)
The enzymolysis to mussel with Alcalase could obtain enzymatic hydrolysate with antioxidant activity.The hydrolysates with hydrolysis degree(DH)of 12%,18%,24%and 30%respectively were prepared by controlling hydrolysis time.The results showed that the hydrolysate's reducing power and hydroxyl radical scavenging rate increased with the increase of DH,and they increased very slowly in the range of 24%to 30%DH.The scavenging rate of DPPH free radical and superoxide anion radical and the inhibition rate of lipid peroxidation all increased first and then decreased with the increase of DH,and they all reached the maximum at DH 24%.Thus the mussel hydrolysate by Alcalase with DH 24%possessed the best antioxidant activity.
mussel;hydrolysisdegree;antioxidant activity;enzymatic hydrolysis
2017-02-12
山东省科技计划项目(2013GGA11027)
郭晓华(1970—),女(汉),工程师,硕士,研究方向:水产品加工及资源利用。
*通信作者:黄海(1977—),男(汉),副教授,博士,研究方向:水产品加工及资源利用。
10.3969/j.issn.1005-6521.2017.13.005
