多灶性甲状腺乳头状癌超声表现与中央区淋巴结转移相关性研究
2023-02-13马富成贾志莺
张 玲 马富成 贾志莺
新疆医科大学第三临床医学院超声诊断科,新疆乌鲁木齐市 830011
甲状腺乳头癌(Thyroid papillary carcinoma,PTC)预后较好,容易转移与复发,多灶性癌较常见。多灶性甲状腺乳头癌 (Multifocal thyroid papillary carcinoma,MPTC)是指腺体内病灶数目≥2个,其常与微小病灶并存,或全为微小癌灶,恶性程度高,易发生周围组织浸润及中央区淋巴结转移[1-2]。颈部淋巴结清扫术是MPTC淋巴结转移的主要治疗方法,但对颈部淋巴结阴性(cN0期)的PTC患者是否行预防性中央区淋巴结清扫目前仍存在争议,合理、规范的颈部淋巴结清扫可降低术后并发症的风险,减少复发及二次手术率[3]。本文通过回顾性地分析MPTC中央区淋巴结转移声像图及临床病理的特点,以期探索一种有效、可靠的方法,能对术前颈部中央区淋巴结进行全面评估,为临床的诊治提供帮助。
1 对象与方法
1.1 研究对象 收集2021年2—7月首次在我院行甲状腺切除及中央区淋巴结清扫术及术后均经病理检查证实为MPTC的164例患者病例,分析患者的临床及超声影像资料。纳入标准:(1)术前均在我院行超声检查;(2)术后病理证实为PTC;(3)首次行甲状腺切除;(4)行中央区淋巴结清扫;(5)患者资料完整。排除标准:(1)有头颈部放化疗史或对肿瘤进行了其他治疗;(2)合并其他恶性肿瘤;(3)继发性转移灶;(4)临床资料不完全;(5)其他病理类型甲状腺癌或合并其他病理类型甲状腺癌。
1.2 仪器与方法 使用PhilipsiU22、Philips HD7型、ToshibaAplio300型彩色多普勒超声诊断仪,探头频率3~12MHz,患者取仰卧位,枕部垫高,头后仰,充分暴露好颈前区,行纵切、横切及斜切多个切面对患者甲状腺结节及颈部淋巴结行常规超声检查,记录甲状腺内肿瘤位置、最大直径、纵横比、边界、边缘、微钙化、被膜侵犯、数目,按照2017版ACR TI-RADS分类对病灶进行评分[4],如意见不统一时,由两位经验丰富的副主任医师协商后再评判。
1.3 判定标准 超声图像分析:甲状腺被膜侵犯定义为癌结节边界与被膜之间无正常甲状腺组织,与被膜无明显界限,甲状腺被膜中断,甚至突出于被膜外。将局灶性强回声直径≤1mm定义为微钙化,将>1mm粗大钙化归为无微钙化组。多灶的患者选取术前超声评估ACR分类中分值最高的一枚纳入研究,当结节评分相同时时,选取最大径较大的结节,最终共164个结节。肿瘤位于单侧叶是指:病灶位于一侧叶,而大于一侧叶者则为癌灶位于双侧叶。
1.4 统计学方法 使用SPSS26.0软件分析数据,采用χ2行单因素分析,筛选出有统计学意义的指标,以病理诊断中央区淋巴结转移为因变量,从单因素分析中筛选出有统计学意义的指标为自变量,纳入Logistic回归中,以P<0.05为差异有统计学意义。
2 结果
2.1 总体情况 MPTC患者共164例,男37例,女127例,年龄19~69岁,平均年龄(45.2±9.9)岁,中央区淋巴结转移94例,非转移70例,2个癌结节患者共87例,3个癌结节患者66例,≥4个癌结节患者11例,单叶癌结节患者41例,双叶癌结节患者123例。
2.2 中央淋巴结转移与多MPTC超声特征单因素分析 转移与无转移在性别(χ2=8.663,P=0.003)、肿瘤部位(χ2=9.604,P=0.002)、肿瘤数目(χ2=32.314,P<0.001)、肿瘤直径(χ2=52.649,P<0.001)、微钙化(χ2=23.310,P<0.001)、被膜侵犯(χ2=71.281,P<0.01)方面的差异有统计学意义(P均<0.05),而在年龄(χ2=0.203,P=0.652)、肿瘤边界(χ2=0.349,P=0.555)、肿瘤边缘(χ2=2.376,P=-0.123)、纵横比(χ2=0.002,P=0.969)方面比较,差异无统计学意义(P>0.05),见表1。

表1 中央区淋巴结转移与MPTC超声表现单因素分析
2.3 中央淋巴结转移与MPTC超声表现多因素分析 肿瘤数目≥3个、肿瘤最大直径>1cm、微钙化及被膜侵犯与中央淋巴结转移密切相关,是MPTC中央淋巴结转移的独立危险因素(P均<0.05),而性别、肿瘤部位与中央淋巴结转移无密切关系,见表2。
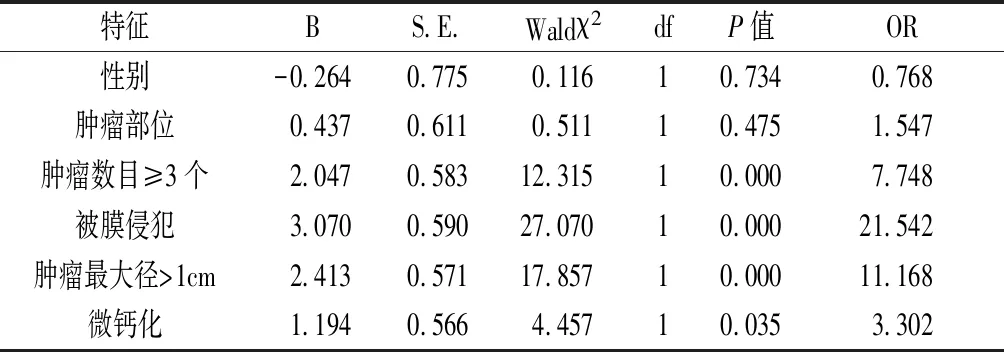
表2 中央区淋巴结转移多灶性PTC超声表现多因素分析
3 讨论
PTC是常见的内分泌恶性肿瘤之一,该病进展缓慢,大多数预后良好,但易出现颈部淋巴结转移,尤其是中央区淋巴结转移,而颈部淋巴结的转移与PTC的复发高度相关。超声虽有方便、价廉及可重复性等有点,但因颈部解剖结构较复杂,超声诊断MPTC颈部中央区淋巴结转移的敏感性低,常常存在隐匿性转移情况。因此,术前准确评估颈部中央区淋巴结是否转移具有重大意义。
多灶性是PTC的临床特点之一,与淋巴结转移、治疗及疾病复发密切相关,虽然2015版ATA指南中未将其视为疾病复发和转移的高危因素,但一些研究表明多灶性是疾病进展的重要危险因素,尤其是双叶出现多灶性病变时,中央区淋巴结转移的风险和侵袭性可能增加[1,5-6]。既往有研究提示,双叶MPTC易出现颈部淋巴结转移,但本研究提示双MPTC不是中央区淋巴结转移的独立预测因子,可能与入组人群不同及病例数较少有关。近年来,多灶病变的起源一直是学者们争论的焦点,大多数学者认为甲状腺内的多发癌灶主要来自单克隆起源,是通过淋巴管道进行腺内播散,但也有不少学者认为多发癌灶是多克隆起源,但至今仍没有确凿的证据证明甲状腺内多发癌灶是单克隆起源还是多克隆起源。
Feng等人[7]认为癌灶数量与MPTC不良生物学行为相关,癌灶数量越多侵袭性越强,淋巴结转移风险越高。本研究对癌灶数目进行了分组,发现中央区淋巴结转移 (癌灶数为2,38.5%;癌灶数≥3,80.8%),与安程程等人[2]报道的结果相近,结果显示,随着癌灶数量的增加,中央区淋巴结转移的风险显著增加。癌灶数量的增加对中央区颈部淋巴结转移影响较大,尤其是癌灶分布在双叶时,恶性程度可能更高,分期可能更晚。因此,对于双叶多灶性PTC患者,应根据患者病情,适当进行中央区淋巴结清扫,对切除的淋巴结进行术中快速病理检查,根据病理检查结果决定是否进行功能性颈淋巴结清扫。
PTC的生长是癌细胞的增殖和对周围组织浸润的过程,癌细胞的增大增加了癌灶接触甲状腺包膜和淋巴管的风险,为肿瘤侵袭和淋巴结转移奠定了基础。文献[8-10]报道甲状腺包膜浸润是癌细胞侵袭性的表现,与患者的死亡和复发有关,肿瘤大小是临床医师制定PTC患者治疗计划的重要影响因素。本文结果显示,肿瘤最大直径>1cm时中央区淋巴结转移增加了11.168倍,甲状腺被膜侵犯时中央区淋巴结转移增加了21.542倍,与何杰等人[11]的研究结果相似,说明肿瘤直径越大、甲状腺被膜越容易浸润,MPTC侵袭性、恶性程度越高,肿瘤最大径和甲状腺被膜侵犯是MPTC患者淋巴结转移的独立危险因素。
微钙化是疑似恶性结节的高度特异性征象和重要超声表现之一,与肿瘤细胞的转移和侵袭性有关,是癌细胞转移的潜在指标之一[3,12-13]。微钙化在超声上表现为砂粒体,它是甲状腺乳头状癌的特征之一,与肿瘤细胞的坏死和钙盐沉积的出现有关。本文发现存在微钙化情况时中央区淋巴结转移发生率为75.3%(64/85), Logistic回归结果显示,存在微钙化时MPTC出现中央区淋巴结转移是不存在微钙化的3.302倍,与Genpeng等[14]的研究相近,这表明微钙化是MPTC中央区淋巴结的转移的重要影响因素,微钙化这一指标对评估MPTC中央区淋巴结是否转移具有重大价值。本研究存在一定不足:属于回顾性研究,且纳入病例较少,可能存在选择偏倚,后续需积累更多病例行进一步分析。总之,MPTC的一些超声表现可能是中央淋巴结转移的独立危险因素,这些超声表现有助于提高超声医生判断MPTC颈部中央淋巴有无结转移的准确性,为临床医师制定最佳治疗方案提供影像学依据。
