质子泵抑制剂联合铝镁加混悬液治疗胃内镜黏膜下剥离术术后溃疡的临床价值
2023-02-13黄志豪林梓瀚李静慧
黄志豪 林梓瀚 李静慧
普宁华侨医院消化内科,广东省揭阳市 515300
内镜技术在临床广泛应用提高了消化道早期肿瘤的检出率。研究证实[1-2]:胃内镜黏膜下剥离术(Endoscopic submucosal dissection, ESD)治疗早期消化道肿瘤的效果可达到与外科手术相同的效果,且具有手术创伤小、住院时间短、术后恢复快的优势,因此广泛用于治疗胃早癌、腺癌等消化道早期肿瘤。然而ESD的切割深度达黏膜下层,因此术后引起的溃疡深度和面积较大,易发生术后穿孔、延迟性出血等并发症[3]。使用质子泵抑制(PPI)抑制胃酸分泌是主要的治疗思路,临床普遍选择艾司奥美拉唑,其通过阻碍氢离子分泌到胃腔中形成盐酸,提高胃内pH,从而形成利于溃疡愈合的条件。但实践中发现PPI治疗的效果存在一定局限,可能是因为在PPI发挥作用的过程中胃中残留的胃酸还会影响凝血过程[4]。铝镁加混悬液是一种胃黏膜保护剂,铝镁加直接覆盖在胃黏膜表面,起到保护胃黏膜的作用。PPI联合铝镁加混悬液用于治疗ESD术后溃疡,或能提高溃疡愈合的效果,减少术后延迟性出血。基于此,本文将探讨PPI联合铝镁加混悬液治疗ESD术后溃疡的临床价值。结果报道如下。
1 资料与方法
1.1 一般资料 纳入我院消化科2019年1月—2020年12月收治的60例ESD术后溃疡患者作为观察对象,按便利抽样法分为C组和O组。纳入标准:(1)符合ESD指征[5],伴有术后溃疡;(2)ESD术后创面<25cm2;(3)近期未使用过PPI或黏膜保护剂、H2受体抑制剂。排除标准:(1)既往有肝胆、胰腺、胃肠道等消化系统手术史;(2)合并十二指肠溃疡、溃疡性结肠炎;(3)凝血功能障碍者。其中C组男18例,女12例;年龄41~60岁,平均年龄(51.69±7.20)岁;创面最大径2~5cm,平均最大径(3.68±1.04)cm;病变类型:高级别上皮内瘤变13例,腺癌6例,腺瘤2例,间质瘤9例;病灶定位:胃上1/3 有6例,中1/3有10例,下1/3有14例;幽门螺旋杆菌感染情况:阳性12例,阴性18例。O组男15例,女15例;年龄42~61岁,平均年龄(51.48±7.86)岁;创面最大径2~5cm,平均最大径(3.53±1.12)cm;病变类型:高级别上皮内瘤变15例,腺癌7例,腺瘤4例,间质瘤4例;病灶定位:胃上1/3有8例,中1/3有10例,下1/3有12例;幽门螺旋杆菌感染情况:阳性9例,阴性21例。两组的基线资料对比差异无统计学意义(P>0.05),具有可比性。患者及家属签署知情同意书。本观察经医院伦理委员会批准。
1.2 方法 C组:给予艾司奥美拉唑(阿斯利康制药,40mg/片,H20046380),40mg,qd,共治疗8周。O组:在C组基础上增加铝镁加混悬液(扬州一洋制药有限公司,15ml∶1.5g,H10980322)治疗,口服本品5ml,tid,共治疗8周。均观察至治疗8周结束后。
1.3 观察指标 (1)临床愈合率[6]:治疗8周结束后复查胃镜,采用S凯塔-Fukutom溃疡分级方法评价溃疡愈合情况。分为活动期(A1、A2期)、愈合期(H1、H2期)、瘢痕期(S1、S2期)。治愈:胃镜下见溃疡瘢痕愈合或无痕迹;有效:胃镜下见溃疡溃疡最大直径缩小≥50%,达H1、H2期或减轻一个级别;无效:胃镜下见溃疡最大直径较治疗前缩小<50%(处于H1、H2期),或创面处于A1、A2期。(2)血清胃蛋白酶原(PG)水平:于术前、术后4周、术后8周,分别采集静脉血液,分离血清后进行检测,采用化学发光法(三菱, PATHFAST化学发光免疫分析仪)检测PGⅠ、PGⅡ、胃蛋白酶原比值(PGR)水平,试剂盒由日本荣研化学株式会社提供。(3)术后不同时间的溃疡面积:用药前、术后4周、术后8周,在内镜下观察溃疡面积。(4)延迟性出血:ESD术后2~30d内,如出现需内窥镜止血的呕血、黑便或便血;胃内镜下明确观察到活动性出血、血栓或暴露血管;血清血红蛋白水平下降>2g/dl;收缩压≤90mmHg(1mmHg=0.133kPa)或脉率≥110次/min[7]。
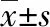
2 结果
2.1 两组临床治愈率与延迟性出血情况对比 O组的治愈率高于C组(P<0.05),两组延迟性出血发生率对比无显著差异(P>0.05),见表1。
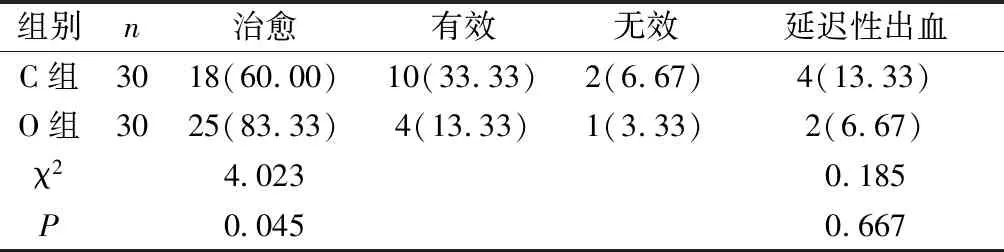
表1 两组临床治愈率与延迟性出血情况对比[n(%)]
2.2 两组血清PG水平对比 术前,两组的PGⅠ、PGⅡ、PGR水平对比无显著差异(P>0.05);术后4周、8周,两组间的PGⅠ、PGⅡ、PGR水平对比无显著差异(P>0.05),见表2。
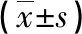
表2 两组血清PG水平对比
2.3 两组术后不同时间的溃疡面积对比 两组在用药前的溃疡面积对比无显著差异(P>0.05);术后4周、8周,O组的溃疡面积均小于C组(P<0.05),见表3。

表3 两组术后不同时间的溃疡面积对比
3 讨论
研究表明[7],ESD术中采用电热止血钳等处理创面血管,使得胃黏膜的血管受到不同程度的破坏,因此ESD术后溃疡属于人造胃溃疡,不同于普通的消化性溃疡,ESD术后溃疡具有其独特性。首先,术后溃疡面积较大,直径超过2cm 的巨大溃疡常见;其次,溃疡可发生于胃内的任意部位;再者,ESD术后溃疡的深度达黏膜下层,创面整齐。胃酸的存在会激活胃蛋白酶,胃蛋白酶可消化已在溃疡创面形成的血栓,不利于溃疡创面的愈合,因此临床首选抑酸剂PPI治疗,艾司奥美拉唑具有起效快、抑酸能力强且持久等特点,可抑制胃酸对溃疡创面局部凝血的影响,然而有研究表明单纯应用PPI的效果欠佳,可能与创面凝血过程中缺乏保护有关[8]。镁铝加混悬液除有快速中和胃酸的作用外,还可保护胃黏膜、降低胃蛋白酶活性,提供创面愈合的有利条件。上述两种药物联合以期能提高ESD术后溃疡愈合的效果。迟发性出血是ESD术后最常见的并发症,术后52d内有呕血或黑便等临床表现,调查显示[9]其发生率在2%~10%。结果显示:治疗8周后,O组的治愈率高于C组(P<0.05),两组延迟性出血发生率对比无显著差异(P>0.05),说明联合用药方案可提高ESD术后溃疡的愈合效果,但降低延迟性出血的效果有限。ESD术导致的急性溃疡形成后,机体启动凝血机制,血小板大量聚集在创面,并出现血凝块,以阻止创面出血,而胃酸可降低血小板的凝血功能。首先艾司奥美拉唑通过抑制 H+/K+-ATP 酶,阻断质子泵驱动的胃壁细胞内H+与小管内K+的交换过程,阻断胃酸分泌的最后通道,升高胃内pH值,有利于血小板发挥止血功能,同时提高创面处血凝块的稳定性。同时使用镁铝加混悬液口服后可中和胃酸,并在溃疡创面表面形成黏膜保护剂,防止胃酸对血小板聚集、形成凝血块等过程的侵袭干扰,形成有利于溃疡创面愈合的条件。上述两种药物联合,从抑制胃酸分泌、保护创面两方面高效促进ESD术后溃疡愈合,减少术后延迟性出血,这一发现与卢桂芳等[10]研究结果相似。而本文结果显示,联合用药方案在降低延迟性出血的效果有限,可能与本研究纳入观察的样本量偏少有关。
本文结果发现:术后4周、8周,O组的溃疡面积均小于C组(P<0.05),说明PPI联合镁铝加混悬液可有效促进ESD术后溃疡患者的溃疡面积缩小,ESD导致胃溃疡的机制是机械性的,为医源性溃疡,黏膜溃疡周围组织具有完整的肌肉群和正常的收缩性,愈合主要依靠局部血小板聚集和微血栓形成。镁铝加混悬液一方面可协同PPI拮抗胃酸的释放,提高胃内pH,另一方面其能在胃黏膜表面形成网状结构的保护层,同时减少食物残渣、胃酸对创面的侵蚀,减少胃黏膜细胞受损;另外该药还可促进表皮生长因子、成纤维生长因子等物质的生成,利于溃疡创面局部肉芽组织、新生血管的生成,促进溃疡愈合。
PG是胃蛋白酶的前体,PGⅡ主要由胃底腺的主细胞和黏液颈细胞分泌,血清PGⅡ水平主要反映不同胃黏膜的形态和功能。血清PGⅠ主要评价胃泌酸腺细胞的功能。ESD术后患者的胃黏膜被破坏,主细胞及壁细胞数量增加,胃酸和胃蛋白酶原大量分泌,导致PGⅠ、PGⅡ进入血循环。而本文结果发现,两组间的PGⅠ、PGⅡ、PGR水平对比无显著差异(P>0.05),表明联合用药方案在调节PG水平的效果不显著。可能是因为血清PG受多种因素影响,如Hp感染、患者的个体胃黏膜状态、术中造成的胃黏膜损伤程度、是否伴有慢性萎缩性胃炎等因素。需在更大量病例中进一步验证镁铝加混悬液对PG水平的影响。
综上所述,PPI联合铝镁加混悬液可提高ESD术后溃疡患者的溃疡愈合效果,缩小溃疡面积,但调节PG水平和降低延迟性出血的效果有限。
