PET水解酶传统与智能分子设计研究进展
2023-02-12苗瑞菊丁尊丹田健张红兵关菲菲
苗瑞菊 , 丁尊丹 , 田健 , 张红兵 , 关菲菲
1.河北经贸大学生物科学与工程学院,石家庄 050061;
2.中国农业科学院生物技术研究所,北京 100081
合成塑料属于长链聚合物,通常是化石燃料的副产品,制成的产品品质优良,日常生活中应用广泛,自1950年问世伊始就得以大规模生产使用[1]。据统计,2018年全球塑料产量为3.59亿t,2019增长到3.68亿t,该数字还在持续增长[2]。由于大多数塑料用品生产成本低,导致重复使用的意愿不高,大部分是一次性使用,塑料垃圾乱扔乱放屡禁不止,如渔具、塑料瓶、购物袋等一次性塑料用品污染环境的现象屡见不鲜,不仅导致化石资源过度消耗,还会造成严重的环境污染。由于塑料的降解性差,在环境中不会完全消失,而是通过机械作用生成直径小于5 mm的微塑料颗粒转移到土壤和海洋中,甚至在空气中也能检测到[3-4],在土壤中直接影响土壤微生物的功能和结构多样性,危害植物健康,还可以通过食物链或呼吸等方式在动物及人体中富集[5]。聚对苯二甲酸乙二醇酯是一种以对苯二甲酸(terephthalic acid,TPA)、乙二醇(ethylene glycol,EG)为单体的聚酯塑料,具有重量轻、绝缘性好、强度和透明度高、热学性能好、耐化学腐蚀等特点,被广泛应用在聚酯织物、普通塑料容器、包装材料以及电子设备中,年消费量约占世界塑料总产量的13%[6]。虽然PET和其他合成聚合物塑料被认为是无毒的,但它们是潜在的有毒着色剂和添加剂的载体,对全球生态系统和人类健康造成严重威胁[1,5]。本文对脂肪酶、角质酶、IsPETase和IsMHETase这4种PET水解酶的发现历史、结构特点与催化机制进行了介绍,重点阐述了PET水解酶传统蛋白质工程与人工智能分子设计的研究进展。以期为进一步设计和构建高效PET水解酶、提高热稳定性以及拓宽其他生物技术应用领域提供有益参考。
1 塑料废弃物的处理现状
截至目前,塑料废弃物的处理方法主要有垃圾填埋、焚烧、机械回收和化学回收四种方法。填埋法是将塑料作为垃圾进行填埋,最终沉积在土壤和海洋中,造成地下水污染[7]。在“太平洋垃圾带”中,塑料垃圾的累积量已达到了7万t,而且仍在以惊人的速度增长[8]。焚烧法是将塑料作为一种能源,通过焚烧获取能量,如日本等土地资源匮乏的国家,更倾向于这种处理方法,但这一过程通常会释放出有毒物质,如呋喃和二噁英等,造成环境的二次污染[9]。回收法是将塑料废物转化为可重复使用的材料,是解决塑料废物污染的一种经济有效的方法,其中机械回收要经过分类、粉碎、融化、造粒等过程,由于不会改变材料的基本结构,回收塑料与非回收塑料可共同作为原料用于工业生产[10-11],但机械回收不适用于温度敏感性差的塑料和多层塑料[12],材料变质现象也较为常见。此外,回收法还存在新PET材料在寿命期内会自发降解[13]、塑料垃圾中潜在的有毒有机化合物仍然会危害环境和公共健康[14]、分类带来的经济和适用性等问题[15]。化学回收法则是通过水解、糖酵解或甲醇水解,将塑料解聚成单体或其他有用的产品,常需要高温、高压、催化剂等苛刻条件,成本较高,还存在产生有毒副产物的风险[10,16]。
因此,为减少塑料垃圾的影响,实行新的具有环保意义的回收策略成为当务之急,生物降解法应运而生,该方法是利用微生物产生的酶(通常是水解酶[17],在水分子的帮助下降解聚合物)将塑料聚合物裂解为单体及其他降解物,进一步作为微生物的碳源和能源[18]。与传统方法相比,生物降解法条件温和,经济环保,具有不可替代的优势和广阔的发展前景。目前在生物降解的塑料中,有关PET的研究最多,已发现多种放线菌、藻类、细菌和真菌具有降解PET的能力[19-20]。自2005年Müller等[21]在Thermobifida fusca中首次分离出了具有降解PET活性的酶以来,研究人员在降解PET的微生物中分离得到了脂肪酶[22]、角质酶[23-24]、IsPETase和IsMHETase[25]等一系列水解酶,它们水解PET的酯键生成对苯二甲酸双羟乙酯[Bis(2-hydroxyethyl)terephthalic acid,BHET]、对苯二甲酸单羟乙酯[Mono(2-hdroxyethyl)terephthalic acid,MHET]、TPA和EG等组分(图1),水解产物可用于合成新的PET材料[26]或生产其他高附加值产品,如柴油级燃料、多环芳烃(polycyclic aromatic,PCA)、没食子酸(gallic acid,GA)、邻苯三酚(pyrogallol,PG)等[27]。Rorrer等[28]利用己二烯二酸、丙烯酸等物质与PET部分结构产物BHET联合制造了新型高性能玻璃纤维增强塑料。总之,PET水解酶的发现和应用降低了PET回收再利用的成本,促进了PET循环可持续经济的发展。
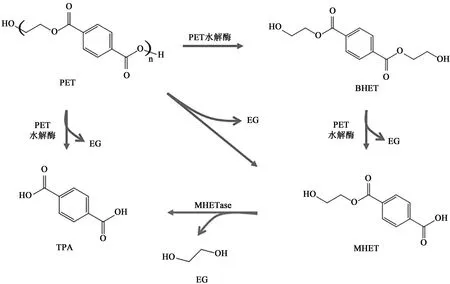
图1 PET酶解示意图[6]Fig. 1 The schematic diagram of PET enzymatic hydrolysis[6]
尽管许多PET水解酶已被表征,但PET分子量高、结晶度高、疏水性强等特性限制了酶解效率[29],加之PET水解酶本身催化效率低、稳定性和生产性能差,难以满足工业需求,因此采用酶工程方法提高PET水解酶的降解性能。定向进化、半理性设计等传统的分子设计方法需要依赖高通量筛选技术,然而在对酶的进化机制、结构等基础信息了解有限的情况下,利用人工智能分子设计方法辅助蛋白质工程,比传统方法更加高效、准确[30]。
2 PET水解酶
2.1 脂肪酶
脂肪酶作为一类多功能酶,不仅能水解长链甘油三酯生成脂肪酸和甘油,还参与氨解和醇解[31]。近年来,研究发现一些脂肪酶对PET纤维或者薄膜有降解作用。这些脂肪酶具有相同的α/β水解酶折叠结构、 Ser-His-Asp催化三联体和氧阴离子空穴结构,活性中心因埋藏在盖子结构域中,不利于与底物结合,因此影响水解活性[32]。据报道,Thermomyces lanuginosusLipase (TlLip)具有PET水解能力,但与角质酶相比水解产物的释放量要低[33]。Candida antarcticaLipase B(CaLipB或CALB)不能直接用于降解PET,但对BHET和MHET有较高活性,Carniel等[22]利用CaLipB与Humicola insolensCutinase(HiCut)协同作用使得从PET到TPA的回收率提高了7.7倍。
2.2 角质酶
角质酶属于丝氨酸水解酶类,结构中含有的α螺旋、β折叠和催化三联体(Ser-His-Asp),其主要作用于中短链酯类(C8-C10)[34-35]。角质酶与脂肪酶同源性很高,但仍有独特之处,一是没有盖子结构域,催化位置直接暴露在溶剂中[36],二是氧阴离子空穴不是配体结合引导形成的,而是预先形成的,有助于阴离子底物复合物的稳定[37]。基于此,角质酶成为被研究最多的PET水解酶,目前发现的主要有以下几种:LC-cutinase(LCC)、Saccharomonospora viridisAHK190 cutinase(SvCut190或Cut190)、Thermobifida fuscaKW3cutinase 2(TfCut2)、Humicola insolenscutinase (HiCut或HiC)、Fusarium solani pisicutinase (FsCut或FsC)和Pseudomonas mendocinacutinase (PmCut或PmC)[2]。其中LCC是Sulaiman等[23]从枝叶堆肥中分离出来一种典型角质酶,它对多种脂肪酸单酯都具有水解活性。在最适反应条件(pH 8.0、50 ℃)下PET降解率为12 mg·h-1·mg-1酶,且主要降解产物为TPA。LCC与Thermobifida fuscaHydrolases 1和2(BTA1 and BTA2)、Fusarium solani pisiCutinase (FsC)、Ideonella sakaiensisPETase (IsPETase)相比,具有更高的PET水解活性和热稳定性[38]。
2.3 IsPETase
2016年Yoshida等[25]从PET碎片污染的环境样本中分离到一种能在PET薄膜上生长的细菌,命名为Ideonella sakaiensis201-F6,这种细菌可以同化PET作为主要的碳源及能源,从中分离并鉴定出发挥PET水解功能的酶为IsPETase和IsMHETase(简称PETase和MHETase)。两者协同作用降解PET,通过高效液相色谱检测发现MHET为主要产物,TPA和BHET为次要产物。在30 ℃和pH 7的条件下,PETase对PET有较高的活性,对脂肪酸酯的活性较低,这表明PETase对PET具有偏好性。其三维结构呈现典型的α/β水解酶折叠,在活性中心发现一个由Ser160、His237和Asp206残基组成的保守催化三联体[39]。与其他PET水解酶相比,PETase具有以下特点[39-41]。①PETase具有两个二硫键——DS1(Cys203-Cys239)和DS2(Cys273-Cys289),其中DS2在已知的PET水解酶中是保守的,而DS1是PETase特有的。DS1位于活性中心附近,对于催化活性和活性中心的完整性具有重要作用。②PETase的β8-α6环与其他酶相比多出3个残基(Asn244、Ser245和Asn246),导致底物结合袋的裂缝被扩大,从而扩大了酶与大分子底物的结合空间。③Trp185的3种构象的转换与Ser214形成的较小空间位阻都导致底物结合口袋变大,以适应PET大分子。
IsPETase被认为是在温和条件下降解PET最活跃的酶[25],尽管一些研究表明这种酶的稳定性和活性都有所改善,但即使在中等温度下稳定性仍然是一个问题。
2.4 IsMHETase
由以上可知,Ideonella sakaiensis201-F6还表达了另一种酶IsMHETase用来催化PETase启动后的PET降解步骤,可以将MHET降解为EG和TPA,后来的研究证实IsMHETase对BHET没有活性[25,42]。对IsMHETase结构的研究表明,采用α/β-水解酶折叠,属于丝氨酸水解酶,盖子结构域包含活性位点和Ca2+结合位点[42-43]。催化三联体由Ser225、His528和Asp492组成,氧阴离子孔由Gly132和Glu226的主链酰胺氮原子组成,并含有5个二硫键(Cys51-Cys92、Cys224-Cys529、Cys303-Cys320、Cys340-Cys348和Cys577-Cys599),这些二硫键在单宁酶家族成员中较为保守[44]。
3 PET水解酶传统分子设计
想要实现PET水解酶的工业化应用,首先要提高PET水解酶的催化活性,还要考虑PET材料本身的表面疏水性、结晶度、玻璃态转化温度(Tg)等特性。聚酯在空气中的Tg约为80 ℃,在酶解反应过程中,溶剂分子在聚合物链内的扩散削弱了氢键,使得碎片的取向随机化,增加了整体的灵活性,聚酯的Tg降低至65 ℃左右[45-46]。当高于玻璃态转化温度时,将产生柔性的、灵活的、更易接受酶攻击的聚酯链。因此,人们相信通过提高酶解反应的温度,可以实现更快的PET降解速度,这要求酶具有较高的热稳定性[47]。
3.1 修饰活性中心与底物结合口袋
3.1.1改变底物结合口袋空间大小 酶与底物的识别和结合是酶发挥作用的关键,活性部位和底物结合口袋需要足够的空间来容纳底物,因此扩大底物结合空间是酶工程的常用方法。增大底物结合口袋的方法之一是将部分氨基酸突变为侧链更小的丙氨酸。Joo等[39]研究发现PETase第280位的精氨酸是一个极性氨基酸,在三维结构中呈凸起形状,可能会阻碍PET底物的稳定结合,用Ala取代了Arg280后,PETaseR280A的PET膜降解活性在18 h和36 h分别比PETase野生型提高了22.4%和32.4%。观察PETaseR280A晶体结构发现,R280A通过提供疏水和非凸起的裂隙扩展了Ⅱc亚基,说明小的疏水残基可能会利于更长底物的稳定结合,从而导致PETase活性的提高。Araújo等[48]创建的突变体L81A、N84A、L182A、V184A和L189A,扩大了角质酶FsC的活性部位。在这些突变体中,L81A和L182A的活性分别增加了4倍和5倍。Silva等[49]利用定点突变的方法,对来自Thermobifida fusca的角质酶Tfu_0883进行改造,构建了单突变体I218A和双突变体Q132A/T101A。该突变扩大了催化空间,增加了疏水性,单突变体和双突变体都表现出相当高的水解效率。Kawabata等[50]设计突变体Q138A修饰Cut190以扩大结合口袋的额外空间,得到的突变体酶活性显著提高。
拥有较大的活性中心裂缝的PET水解酶其催化活性并不一定高,有时适当缩小反而会提高活性。Austin等[40]对比PETase与同源角质酶的晶体结构发现,PETase具有更宽的活性中心裂缝,通过突变两个活性中心残基(S238F和W159H)来缩小裂缝范围。S238F为底物结合提供了新的π-π堆积和疏水相互作用使底物结合作用增强,W159H缩小了侧链,使长链PET聚合物结合到更深的活性中心通道中。实验发现该突变体不仅改善了PET的降解能力,还能降解PET替代品聚2,5-呋喃二甲酸乙二醇酯(polyethylene 2,5-furandicarboxylate,PEF)。以上研究表明,设计并改变底物口袋空间大小可以提高PET水解酶的催化能力和专一性。
3.1.2相似结构的氨基酸残基交换TfCut2与LCC是两种具有较高序列和结构相似性的PET水解酶,它们位于蛋白质表面的结合凹槽中都有暴露的活性位点,将TfCut2中参与底物结合的氨基酸残基与LCC相对应的氨基酸残基进行交换,获得了具有更高PET水解活性的突变体G62A和双点突变体G62A/I213S,水解50 h后,两种突变体都导致PET膜的重量损失超过42%,与野生型TfCut2相比增加了2.7倍。其中G62A相较于野生型水解速率常数提高了4倍,底物结合常数降低了1.5倍[51]。另一项研究发现,PETase的一个底物结合残基W185具有摆动的构象,该氨基酸所在的β6-β7环高度灵活,经过结构分析发现PETase存在特有的两个氨基酸S214和I218,而在其他同源酶中对应的分别是His和Phe。较小的侧链为W185的摆动提供了空间,多种同源酶的Ser/Ile双点突变提高了PET降解活性[52]。
3.1.3其他修饰 Furukawa等[53]在PETase底物结合口袋中的阳离子氨基酸位置引入单一的阴离子氨基酸突变,如R53E、R90E和K95E,这些突变在阴离子表面活性剂的辅助下能够有效地促进和加速PET的水解。表面活性剂有助于PET表面向酶活性部位的排列。虽然降解过程在30 ℃下进行,但降解效果与70 ℃甚至更高温度下使用耐热酶的降解效果相当。Ma等[54]探索了PETase底物结合槽周围的6个关键残基,R61A、L88F和I179F突变体对PET的亲和力比野生型分别增加了1.4、2.1和2.5倍。在PETase活性部位、底物结合口袋或参与稳定活性部位刚性的残基上发生突变,产生了几个突变体(Y58A、W130A、W130H、A180I和S185H),使水解物的产量提高了3倍[55]。
3.2 添加新的化学键
Son等[56]在先前工作产生的PETaseR280A上增加额外的氢键来稳定分子,获得三点突变体S121E/D186H/R280A,研究表明,三点突变体(S121E/D186H/R280A)对PET的降解率是天然蛋白的13.9倍,是先前建立的R280A的2.3倍。
钙离子结合酶的高热稳定性是由于结合酶的结构波动比未结合酶小引起的[57]。二价金属离子结合部位的引入对提高水解酶热稳定性和催化性能起着至关重要的作用。钙离子的存在改善了酶结构的巨大构象变化,使底物结合槽保持在开放的构象中,并促进了酶与底物的结合[58]。在聚酯水解酶TfCut2上引入二硫键取代其钙结合部位。由此产生的变异体的熔点增加到94.7 ℃(野生型TfCut2:69.8 ℃),其半失活温度增加到84.6 ℃(TfCut2:67.3 ℃)[59]。差示扫描荧光实验表明,LCC在钙离子存在下是热稳定的。为了避免补充盐,Tournier等[38]通过酶工程提高LCC的活性和热稳定性。采用二硫键取代二价金属键的替代策略,获得了热稳定高且不依赖于钙离子的LCC突变体D238C/S283C,Tm值上升9.8 ℃,WCCG(F243W/D238C/S283C/Y127G)和ICCG(F243I/D238C/S283C/Y127G)分别在10.5 h和9.3 h内将90%以上的PET解聚成单体。这些研究结果表明,用二硫键取代钙离子结合部位可以得到高效的、不依赖钙离子的耐热聚酯水解酶。
3.3 修饰表面氨基酸
经过建模和结构比较发现,来自Thermobifida cellulosilyticaDSM44535的角质酶Thc_Cut1和Thc_Cut2两种酶活性口袋附近表面的静电和疏水性质不同是导致它们降解效率不同的主要原因。选择Thc_Cut2活性位点外表面区域的氨基酸进行了定点突变,这些突变体对PET的水解效率远低于Thc_Cut1,但与Thc_Cut2相比,携带R29N和A30V的突变体在可溶性底物上表现出较高的比活和Kcat/Km值。酶表面带正电的精氨酸(Arg19和Arg29)突变为不带正电的丝氨酸和天冬酰胺,显著提高了3PET和PET的水解活性。相反,不带电的谷氨酰胺(Glu65)突变为带负电荷的谷氨酸会完全失去PET薄膜水解活性[60]。这些发现清楚地表明,表面性质(即位于蛋白质表面活性位点外的氨基酸)在PET水解中发挥重要作用。
3.4 降低产物抑制
在PET降解过程中,PET水解酶释放中间产物和最终产物,包括BHET、MHET、TPA和EG,这些降解产物会抑制水解过程[61]。为缓解产物抑制,Barth等[62]使用含TfCut2的超滤膜反应器降解PET薄膜,超滤可溶的水解物(TPA、MHET和BHET),以最大限度地减少对酶的产物抑制,将生物催化水解率提高70%。另一个有希望缓解产物抑制的策略是建立双酶体系。以脂肪酶CaLipB和角质酶HiCut为例,CaLipB的加入将BHET全部转化为TPA,解决了HiCut的产物抑制,两种酶的组合显示出协同作用,使PET完全解聚为TPA[22]。此外,通过蛋白质工程来减少酶和水解物之间的相互作用是一种很有前途的策略。Wei等[51]设计并构建了TfCut2单点突变体G62A,结合常数较野生型降低了约5.5倍,主要是因为Ala的空间位阻比Gly低,解除了MHET对TfCut2的产物抑制。
4 人工智能分子设计在PET水解酶研究中的应用
定向进化受到自然进化的启发,通过反复突变与筛选来积累所需功能的有益突变,因此对高通量筛选技术有较强的依赖性,需要花费大量的时间和精力[63-64]。人工智能通过从先前的筛选中学习表征变体的属性并使用所学习的信息来选择可能具有所需功能的新序列,从而减少迭代次数,可用来指导定向进化[65]。人工智能辅助的蛋白质工程已经解决了许多问题,如提高催化活性、预测底物专一性和溶解度等[66]。人工智能技术为研究PET水解酶带来了新方案。
4.1 提高热稳定性
到目前为止,对于提高PET水解酶热稳定性的研究是以一种合理而又随意的方式进行的,即操作者对酶的结构进行观察,根据经验或半经验的方法选择要突变的残基,这种方法不能提出多个氨基酸的突变体。据报道,某些氨基酸突变同时应用会发生拮抗作用,导致性能低于野生型。这种现象被称为上位效应,阻碍了酶在较高温度下保持水解能力或与晶体底物亲和力的充分优化[67-68]。
崔颖璐等[69]开发了蛋白质工程的贪婪累积策略(GReedy accumulated strategy for protein engineering,GRAPE),并将其应用于PETase的设计,提高了酶的稳定性。该方法结合了系统的聚类分析和有益突变的贪婪积累,根据位置、Tm值的变化、与Ser160的距离(催化三联体的水解性残基)、相对于PET结合区的位置以及可能的稳定机制(H键的形成、疏水相互作用)和熵变来表征21个候选分子。得到的十点突变体DuraPETase热稳定性得到大幅度改善,Tm比野生型提高了31 ℃,对于半结晶度PET底物(30%),37 ℃处理72 h的产物得率是野生型的100倍。
三维自我监督卷积神经网络MutCompute使用PDB蛋白质数据库中19 000多条序列进行训练,在平衡蛋白质结构的基础上学习氨基酸的局部化学微环境,因此可以预测出野生型蛋白质中不适合局部环境的氨基酸位置。Lu等[56]使用MutCompute获得了IsPETase野生型和ThermoPETase(晶体结构PDB 5XJH和6IJ6)中20个典型氨基酸在每个位置结构拟合的离散概率分布结构,以确定野生型氨基酸残基与潜在替代相比不太适合的位置。通过催化活性(酯酶活性和塑料降解率)和热稳定性(蛋白质熔化温度Tm)来筛选出有益突变体,进一步组装、分析得到FAST-PETase(MutCompute预测得出的N233K/R224Q/S121E叠加ThermoPETase的D186H/R280A)。与野生型相比,FAST-PETase在30~50 ℃和一系列pH条件下表现出优越的PET水解活性,1周内可水解51种不同热成型的且未经预处理的PET,还可以在50 ℃下解聚未经预处理的商用水瓶的无定形部分和经过热预处理的水瓶[70]。
4.2 提高降解效率
目前尚不清楚IsPETase通过自然选择进化到什么程度,但由于自然界中PET仅有数十年的短暂历史,所以该酶理论上没有充分发挥进化潜力的时间。突变设计工具Premuse是基于自然序列进化规律开发的,使用成对对比来构建理想比对,通过计算得到的位置特异性氨基酸概率来定量选择首选突变。利用Premuse从1 486条IsPETase同源序列中筛选出10个单点突变体,优选出W159H和F229Y这两个较稳定的突变位点后获得双点突变体W159H/F229Y的酶促性能提高更显著。在40 ℃降解24 h,非晶态PET的降解活性比野生型提高了近40倍。Premuse充分利用了同源蛋白序列所包含的进化信息,成功率高,工作量小,是一种高效的蛋白质工程方法[71]。
随着人工智能技术的发展和网络服务器的普及,对于无计算机基础的研究者,可以通过在线服务器进行人工智能分子设计。Pross(Protein Repair One-Stop Shop)就是一个可以在线访问的服务器,输入蛋白质的序列或结构信息就可以预测出提高热稳定性的突变体序列[72]。Rennison等[73]将PETase活性部位、氧阴离子空穴和结合残基固定以防止突变,使用Pross服务器对同源性超过35%和覆盖率超过75%的蛋白质序列进行标准多序列比对,应用Rosetta计算突变扫描,最终预测出51种突变体。通过与3种高效耐热的PET水解酶(TfCut2、Cut190和LCC)进行对比,确定了3个突变体:S125R、S136E和T270Q进行实验表征,其中S136E的活性增加显著,比野生型增加了3.3倍。
5 展望
目前,研究学者利用传统蛋白质工程和人工智能分子设计方法有效提高了PET水解酶的降解效率和热稳定性,推动着PET生物降解的绿色高效发展。然而,PET生物降解研究还处于初步阶段,若想实现PET循环经济,首先要解决高结晶度PET降解难的问题,应继续筛选挖掘PET降解微生物和关键酶基因。随着生物信息学相关技术的发展,创建了越来越多的PET水解酶特异性搜索算法[74-75],这些技术手段可以加快PET降解微生物以及新酶基因的发现。此外,还应关注PET完全降解与单体产物有效回收问题。PET不完全降解产物BHET、MHET等不能直接回收生成新的PET,双酶体系可将低聚产物及时转化,缓解产物抑制的同时生成更多的TPA产物。总之,PET水解酶具有很高的应用前景,开发高结晶度PET降解酶并创新高附加值产品转化途径,有望在不久的将来建立更加高效的PET生物降解系统。
