挤压膨化处理对藜麦营养成分及体外酵解特性的影响
2023-02-12何雨芯赵巨堂胡梦伟聂少平谢明勇胡婕伦
方 芳,何雨芯,赵巨堂,胡梦伟,聂少平,谢明勇,胡婕伦
(南昌大学 食品科学与技术国家重点实验室,中国-加拿大食品科学与技术联合实验室(南昌),江西省生物活性多糖重点实验室,江西 南昌 330047)
藜麦(Chenopodium quinoaWilld.)又称南美藜、印第安麦、奎藜等,是一种原产于南美的苋科藜亚科藜属植物,起源于南美洲安第斯山脉地区,种植历史悠久,被称为“粮食之母”和“安第斯山的黄金‘谷物’”[1]。藜麦的主要产区位于秘鲁、玻利维亚和厄瓜多尔等中高海拔地区[2],我国藜麦主要种植在青藏高原、云贵高原、西北地区等[3]。藜麦作为一种全营养“伪谷物”,含有优质的蛋白质、比例均衡的氨基酸,因此深受消费者喜爱[4],此外,藜麦还含有膳食纤维、皂苷、植物甾醇、酚类物质、维生素和矿物质等营养素[5-10],联合国粮食和农业组织报告[11]指出藜麦是唯一一种满足人体基本营养需求的单体植物。
大量研究表明,肠道微生态失衡将会导致一系列代谢疾病[12],如肥胖、糖尿病、炎症性肠病等,而肠道菌群在调节肠道微生态方面发挥着无可替代的作用[13]。肠道菌群是人体胃部以及肠道部位中微生物的总称[14-15],以厚壁菌门(60%~80%)和拟杆菌门(20%~40%)为主[16]。肠道菌群会随饮食习惯而改变,并随时间推移稳定存活于宿主体内[17]。近年来,众多研究表明藜麦具有抗氧化[18]、预防肥胖[19]、缓解炎症[20]、调节血糖水平[21]以及改善肠道菌群[22]等作用,而这与藜麦所含的营养成分息息相关,以干质量计算,藜麦中淀粉质量分数约为52%~69%[2],膳食纤维质量分数约为10%[23],蛋白质量分数最高可达22.08%[24],脂肪质量分数约为5.5%~7.8%[25],其中藜麦膳食纤维可以到达大肠,并作为肠道菌群可利用的碳源影响其生长,提示通过藜麦饮食干预可以调控肠道微生态,从而达到预防疾病的目的。
藜麦的常见加工处理方式有蒸煮、焙烤、挤压膨化和发酵等[26-27],其中挤压膨化技术效率高、连续性强,在我国得到迅速的发展与推广,并被广泛应用于杂粮加工行业[28]。当前,关于挤压膨化加工藜麦的研究主要集中在生产工艺的优化方面,鲜见不同加工方式藜麦营养成分及其对人体肠道菌群影响的报道。目前体外发酵和动物实验是研究肠道菌群的主要方法,其中体外发酵耗时短、财力物力投入低,并且容易控制实验参数,实验重复性高[29],是初步验证实验的最佳选择。在有效时间内,新鲜人类粪便具有与人体肠道菌群相似的菌群特性,因此,可通过藜麦制品在新鲜人类粪便培养基中的发酵行为来表征其对肠道菌群的影响。此外,在发酵过程中肠道菌群产生的代谢产物,如乙酸、丙酸、丁酸等短链脂肪酸(short-chain fatty acids,SCFAs),会对机体产生积极的影响[30],同时还可以降低结肠内环境pH值,促进部分有益细菌的生长[31]。本研究利用挤压膨化技术加工藜麦,测定藜麦在加工前后淀粉、膳食纤维、脂肪以及蛋白质含量等,通过体外酵解模型分析藜麦挤压膨化样品在人体粪便培养基中的产气量、pH值、SCFAs浓度以及肠道菌群组成,为藜麦加工产品改善人体肠道菌群研究提供参考。
1 材料与方法
1.1 材料与试剂
藜麦 繁峙县绿山庄粮油加工有限公司;总淀粉、直链淀粉、膳食纤维试剂盒 爱尔兰Megazyme公司;无水乙醇、碳酸钠、氢氧化钠、硼酸、亚硝酸钠(均为分析纯) 广州西陇科学股份有限公司;α-耐热淀粉酶、胃蛋白酶、胰脂肪酶、没食子酸、吗啉乙磺酸、三羟甲基氨基甲烷 美国Sigma-Aldrich公司;猪胆粉 上海康朗生物科技有限公司;蛋白胨、酵母膏粉、L-半胱氨酸盐酸盐一水合物、胆盐、VK1、吐温-80、血红素、菊粉以及SCFAs(乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸)标准品 上海阿拉丁试剂有限公司;磷酸盐缓冲液(pH 7.2~7.4、0.01 mol/L)北京索莱宝科技有限公司;粪便DNA提取试剂盒、DNA回收试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
Varioskan Flash全波长多功能酶标仪、NanoDrop超微量分光光度计 美国Thermo公司;DSH-50A-1水分测定仪 上海佑科仪器仪表有限公司;KN680全自动凯氏定氮仪 济南阿尔瓦仪器有限公司;DFM-1000C高速打粉机 温岭市林大机械有限公司;XL-70双螺杆挤压膨化机 济南希朗机械有限公司;YXQ-100SII高压灭菌锅 上海博迅医疗生物仪器股份有限公司;FE-28台式pH计 梅特勒-托利多国际贸易有限公司;VOSHINCOS-100 B数显恒温摇床 无锡沃信仪器有限公司;厌氧手套箱 美国COY公司;7890B气相色谱仪 美国安捷伦科技有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;ND200-24A氮气吹扫仪 上海左乐仪器有限公司。
1.3 方法
1.3.1 藜麦挤压膨化样品的制备
藜麦籽粒→粉碎→过0.150 mm筛→调节水分质量分数约为22%→喂料→挤压膨化(膨化温度140 ℃、螺杆转速200 r/min)→粉碎后过孔径0.150 mm筛。
1.3.2 基本营养成分分析
采用水分测定仪测定水分含量;灰分含量测定参考GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》;蛋白质含量参照全自动凯氏定氮仪说明书进行测定;总淀粉、直链淀粉、膳食纤维含量参照相应试剂盒说明书进行测定;脂肪含量采用GB/T 5009.6-2016《食品安全国家标准 食品中脂肪的测定》中的索氏抽提法测定。
1.3.3 体外模拟消化
体外模拟消化参考课题组前期的研究方法[32],配制口腔模拟消化液(simulated stomatic fluid,SSF)、胃模拟消化液(simulated gastric fluid,SGF)和小肠模拟消化液(simulated intestinal fluid,SIF),用1 mol/L盐酸或1 mol/L NaOH溶液调节pH值(下同)。准确称取0.455 g藜麦挤压膨化样品置于锥形瓶中,加入4.545 mL蒸馏水复溶[33],混匀。向混合样品中加入等体积SSF,调节体系pH 7,将离心管置于摇床(黑暗、180 r/min、37 ℃,下同)中振荡孵育2 min。将模拟口腔消化后的样品取出,迅速加入等体积SGF,调节体系pH 3,继续置于摇床中孵育2 h。取出模拟胃部消化物后,立刻加入等体积SIF,调节体系pH 7,继续置于摇床中孵育2 h,然后将装有样品的锥形瓶置于95 ℃水浴锅中加热5 min,得到藜麦挤压膨化样品体外消化产物,冻干后常温保存于干燥器中。
1.3.4 体外酵解实验
1.3.4.1 培养基配制
根据课题组前期研究方法[34]配制基础培养基。分别将1.3.3节藜麦体外消化后样品、菊粉、去离子水以质量分数0.5%添加到基础培养基中,混匀后调节体系pH 6.0,分别记为QUI组、阳性对照(AC)组和空白对照(CK)组培养基。分别取5 mL各组培养基加入Hungate厌氧管中,使用氮气吹扫仪排尽空气,然后用高压灭菌锅灭菌(121 ℃、15 min),灭菌完成转移至厌氧培养箱中。
1.3.4.2 挤压膨化藜麦体外酵解
招募身体健康、无胃肠道病史、具有良好的饮食习惯且3 个月内未服用抗生素等药物及含有益生菌的食品或药品的志愿者。分别收集6 名志愿者(年龄在22~26 岁,3 名女性和3 名男性)的新鲜粪便:在约定时间内同时采集6 名志愿者粪便,采集后立即将粪便转移至厌氧手套箱,按照25 g/100 mL加入含有0.1%(质量分数)L-半胱氨酸盐酸的磷酸盐缓冲液稀释,涡旋均匀后静置5 min,将上清液经4 层无菌纱布过滤,得粪便滤液,等体积混合6 名志愿者的粪便滤液。
厌氧环境(5%(体积分数,后同)H2、5% CO2、90% N2)下用1 mL注射器将0.1 mL混合粪便滤液加入Hungate厌氧管中(粪便从收集到接种的间隔时间不应超过2 h),置于37 ℃的黑暗厌氧环境下振荡(180 r/min)培养,在0、6、12、24、48 h分别取出厌氧管,将发酵液迅速转移至无菌EP管中,随后立即冻存于-80 ℃冰箱。每组每个时间点设置3 个平行。
1.3.4.3 发酵液中pH值的测定
采用台式pH计测定发酵液的pH值。
1.3.4.4 发酵液中产气量的测定
将一次性注射器活塞推至0刻度处,将注射器针尖刺入厌氧管内,注射器活塞在厌氧管内气压作用下自由移动,活塞指示体积的变化量即为产气量,单位为mL。
1.3.4.5 SCFAs浓度的测定
采用气相色谱法[35]测定发酵液中SCFAs浓度。取发酵液12000hg、4 ℃离心10 min,取0.5 mL上清液分别加入1.2 mL无水乙醇、1 mL正己烷和0.1 mL质量分数98%浓硫酸酯化萃取SCFAs,置于60 ℃摇床(250 r/min)中振荡,充分反应 1 h后静置分层,取有机相(上层溶液)经0.22 μm有机滤膜过滤,采用气相色谱测定SCFAs浓度。
气相色谱条件:7890 B气相色谱仪配备19091J-413 HP-5色谱柱(0.32 mmh 30 m,0.25 µm);载气为N2;分流比为1∶40;火焰离子化检测器;升温程序为30 ℃、3.5 min,5 ℃/min升至40 ℃,15 ℃/min升至180 ℃,保持10 min;进样量为1 μL;进样口温度200 ℃。
1.3.4.6 肠道菌群组成的鉴定
将1.3.4.2节冻存于-80 ℃下发酵48 h所得的样品进行肠道菌群分析。采用粪便DNA提取试剂盒提取DNA,采用NanoDrop 2000对DNA样本进行质量分析。利用引物515F(5’-barcode-GTGCCAGCMGCCGCGGTAA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA的V4区进行PCR扩增,并用2%(质量分数)的琼脂糖凝胶进行电泳,对目标条带进行切胶回收,采用DNA回收试剂盒回收纯化DNA,采用2100生物分析仪系统(高灵敏度DNA芯片)检测文库质量。最后通过Illumina MiSeq平台对获得的DNA片段进行配对末端测序,将得到的数据通过QIIME软件进行物种鉴定分析[36],利用派森诺基因云网站(https://www.genescloud.cn)对肠道菌群进行α-多样性分析、β-多样性分析及主成分分析(principal component analysis,PCA),并绘制肠道菌群门、属相对丰度柱状图。
1.4 数据处理与分析
实验设置以3 次重复,结果以平均值±标准差表示。采用SPSS 24.0软件进行单因素方差分析,采用独立样本t检验和Tukey检验进行显著性分析,P<0.05则认为差异显著。采用GraphPad Prism 8.0.2软件作图。
2 结果与分析
2.1 挤压膨化处理前后藜麦基本营养成分含量
如表1所示,与未处理的藜麦相比,挤压膨化后的藜麦灰分、总淀粉以及蛋白质含量并无显著性差异(P>0.05),与李敏等[37]的研究结果一致。相比未处理的藜麦,挤压膨化后藜麦中直链淀粉含量显著下降(P<0.05),同时脂肪含量也显著降低(P<0.05),这可能是由于脂肪酸在高温加热的过程中发生氧化和氢化作用,与直链淀粉形成复合物,最终导致含量下降[38]。与未加工藜麦相比,加工后藜麦的总膳食纤维含量显著下降(P<0.05),值得注意的是,不可溶性膳食纤维含量显著下降的同时可溶性膳食纤维含量显著上升。相似地,燕麦、大豆、玉米经过挤压膨化后,可溶性膳食纤维含量均显著上升[39-40],该现象出现的原因可能是挤压膨化的加热过程使不可溶性膳食纤维裂解,转化为可溶性成分[41]。

表1 挤压膨化处理前后藜麦的基本营养成分含量Table 1 Nutritional components of quinoa before and after extrusion treatment
2.2 体外酵解过程中pH值、产气量的变化
pH值从一定程度上可以反映发酵培养基中碳水化合物的消耗程度以及SCFAs的产生情况[42]。从图1A可以看出,CK和AC组pH值在发酵0~12 h明显下降,并在12 h时pH值最低(分别为6.78、4.18),而QUI组在发酵6 h时pH值(5.48)最低。之后,各组pH值均呈现上升趋势,在发酵24~48 h时达到稳定并持续至酵解结束。研究表明,pH值上升的情况可能是由于肠道微生物利用二氧化碳产生甲烷,或培养基中的蛋白质分解产生NH3,NH3与酸反应生成NH4+[43]。体外酵解到达48 h时,pH值依次为CK组(7.18)>QUI组(5.99)>AC组(4.78),各组pH值相较于初始值均有所下降。
肠道菌群能利用碳水化合物、蛋白质、多酚等物质酵解产生二氧化碳,氢气、硫化氢和甲烷等气体,产气量一定程度上可以反映菌群的代谢情况。由图1B可知,各组的产气量在0~48 h体外发酵期间一直保持上升,QUI组和AC组在0~12 h产气量大幅增加,产气速率也最快,表明在该阶段肠道微生物代谢旺盛,这可能是由于藜麦挤压膨化样品和菊粉含有大量的不可消化淀粉(抗性淀粉、膳食纤维、低聚糖等)[44-45],在酵解前期淀粉类物质的发酵速率比其他物质更快[46]。随着发酵时间的延长,产气量仍在不断增加但气体产生速率在逐渐下降,可能是菌群发酵后期主要消耗二氧化碳产生甲烷气体,或菌群发酵利用蛋白质所产生的氨气与酸性气体发生反应,从而导致产气速率下降[43]。在发酵48 h时各组产气量最高,依次为AC组(4.57 mL)>QUI组(3.63 mL)>CK组(3.03 mL)。
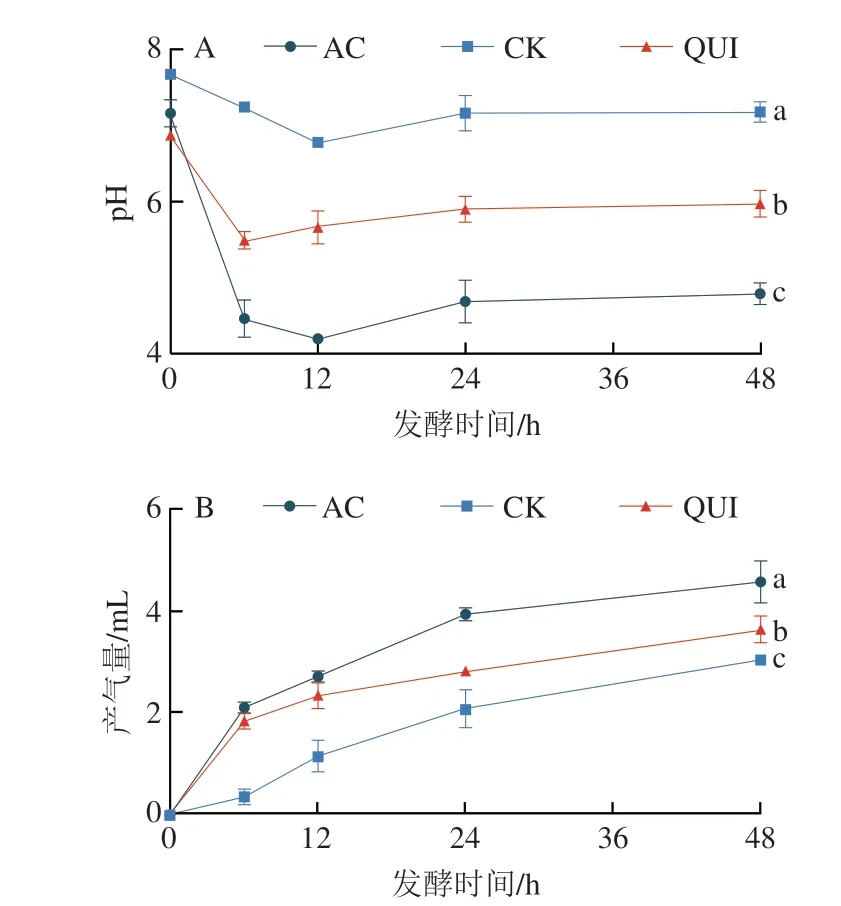
图1 体外发酵过程中pH值(A)、产气量(B)的变化Fig.1 Changes in pH (A) and gas production (B) during in vitro fermentation
2.3 体外酵解过程中SCFAs的产生情况
如图2A所示,各组总SCFAs浓度随时间的延长持续上升,其中QUI组在发酵24 h后基本保持稳定。AC组和QUI组在0~6 h内SCFAs产生速率最快,而CK组直至发酵12 h后SCFAs产生速率才有所降低,这与2.2节产气量以及pH值的变化趋势相印证。发酵48 h时,总SCFAs浓度依次为:AC组(49.70 mmol/L)>QUI组(37.08 mmol/L)>CK组(23.78 mmol/L)。AC组和CK组乙酸浓度呈增加趋势(图2B),QUI组在发酵24~48 h期间基本保持不变。发酵48 h时,AC组、QUI组和CK组乙酸浓度分别为27.06、18.68、12.11 mmol/L。如图2C所示,QUI组产丙酸情况与AC组相近,在48 h时两组丙酸浓度无显著性差异(P>0.05),而CK组显著低于其余两组(P<0.05)。从图2D可以看出,QUI组发酵期间产丁酸浓度明显低于AC组,同时明显高于CK组。各组戊酸浓度随发酵时间延长而持续增加(图2E),AC组增长速率几乎不变并且发酵48 h后显著高于其他两组(P<0.05),QUI组和CK组在发酵24 h后速率降低。如图2F、G所示,发酵前期(0~6 h)各组均产生较少的异丁酸、异戊酸,约在6 h后各组异丁酸、异戊酸浓度出现明显的增长趋势,QUI组产异丁酸、异戊酸能力均最强,其次是CK组,AC组最弱。此外,发酵48 h后QUI组不同SCFAs浓度均高于CK组。

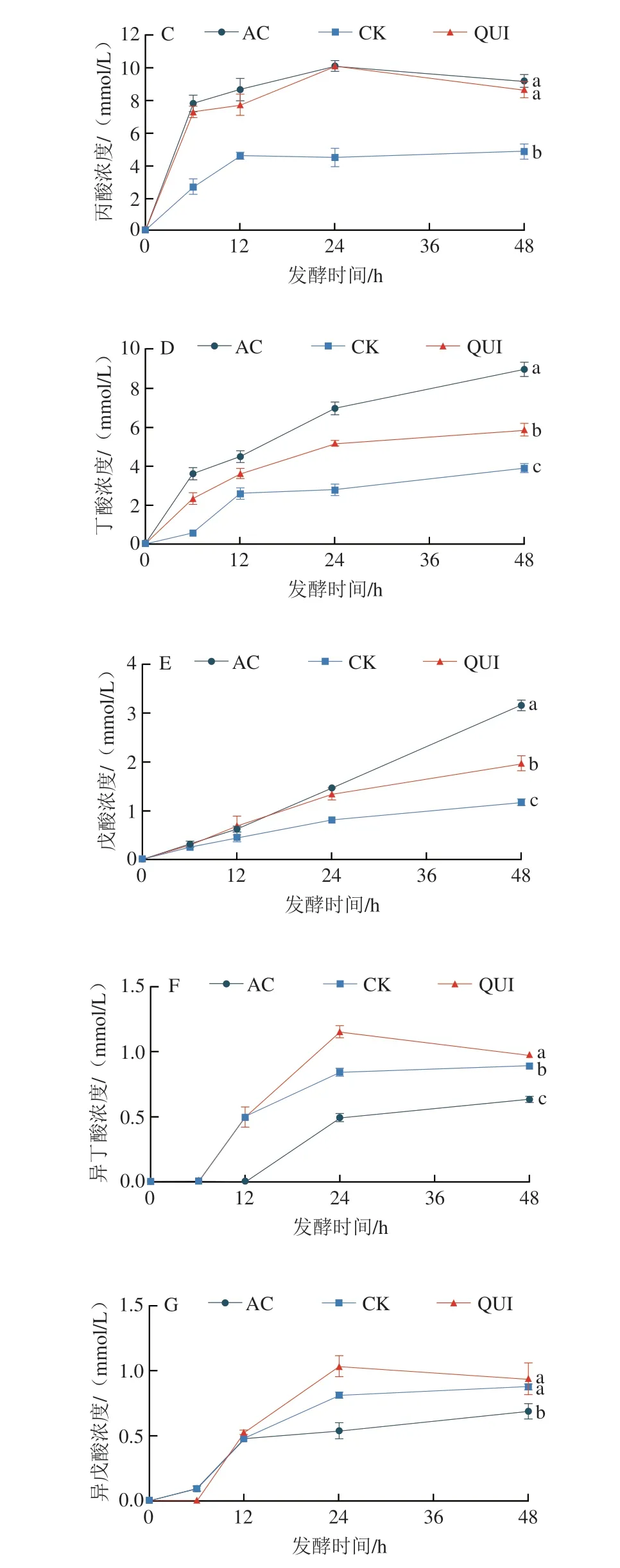
图2 体外发酵过程中SCFAs浓度的变化Fig.2 Changes in the concentrations of SCFAs during in vitro fermentation
作为主要的SCFAs,乙酸、丙酸、丁酸发挥的功能各异。研究表明,乙酸能被大脑、心脏和外周组织氧化利用,是宿主吸收利用能量的主要来源;丁酸作为结肠上皮细胞的重要能量来源,具有抗炎特性并能预防、抑制癌症的发生,同时还可以促进细胞分泌胰岛素;丙酸能抑制内源性胆固醇的合成[47-50]。各组酵解样品产生SCFAs的情况表明,QUI组的产酸能力总体介于CK和AC组之间,且由发酵48 h后SCFAs浓度分析结果可知乙酸产量>丙酸产量>丁酸产量,这与前期研究结果[51]一致,表明藜麦挤压膨化样品能一定程度影响肠道菌群代谢物的产生,在肠道和肝脏代谢中发挥重要作用,调节宿主的健康。
2.4 体外发酵液肠道菌群的多样性分析结果
在α-多样性分析中,常采用Chao 1指数和Shannon指数表征菌群多样性,Chao 1指数越大,菌群丰度越高;Shannon指数越大,则表明菌群多样性越高。从图3A、B可以看出,各组Chao 1指数依次为CK(440.48)>QUI(368.91)>AC(365.50);各组Shannon指数依次为QUI(5.41)>AC(4.92)>CK(4.87);相较于CK组,QUI组肠道微生物丰度显著降低但多样性显著提高。在β-多样性分析中,PCA可以表征不同菌群结构组成的差异性,样本之间距离越远说明菌群结构差异越大。从图3C中可以看出,3 组发酵液中肠道菌群结构差异性较大,其中AC组与CK组差异性最大,而QUI组与AC组之间的菌群差异性小于与CK组的差异性,说明藜麦挤压膨化样品培养发酵会对肠道菌群结构产生一定程度的影响。
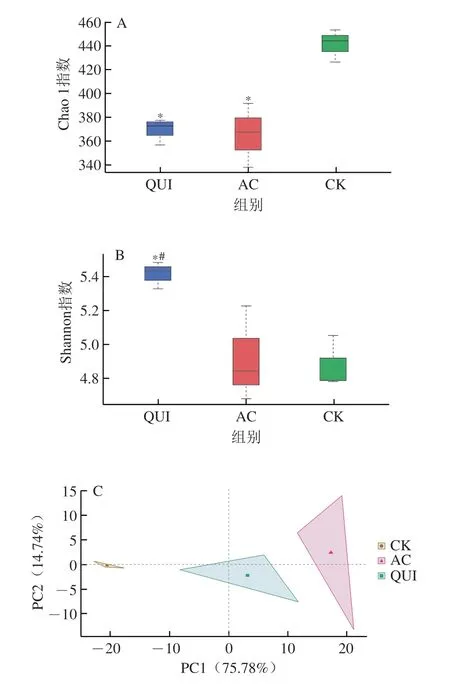
图3 体外发酵48 h肠道菌群的多样性分析结果Fig.3 Diversity analysis of gut microbiota after 48 h of in vitro fermentation
2.5 体外发酵液肠道菌群微生物组成分析结果
体外发酵结束后,QUI组、AC组和CK组肠道菌群在门、属水平的微生物组成如图4A、B所示。3 组样本中相对丰度较高的4 个菌门的分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)及放线菌门(Actinobacteria)。其中,与CK组相比,AC组和QUI组拟杆菌门、厚壁菌门和放线菌门相对丰度明显增加,变形菌门明显减少,这种变化趋势对于宿主健康有一定的积极意义,因为变形菌门中包括大肠杆菌、沙门氏菌、幽门螺杆菌等病原菌,降低该菌门的菌能对肠道健康具有一定的积极意义。拟杆菌门和厚壁菌门丰度的增加可能与藜麦挤压膨化样品中的膳食纤维含量变化有关[52]。研究表明,厚壁菌门能通过非致病性途径刺激机体免疫功能,促进宿主对食物中维生素、矿物质等营养成分的吸收与合成;拟杆菌门主要促进上皮细胞的发育和营养吸收[53];放线菌是抗生素、酶抑制剂、免疫调节剂等多种化合物的次级代谢产物[54]。
如图5所示,在科、属水平上,相较于CK组,QUI组能显著降低菌群中肠杆菌科(Enterobacteriaceae)及瘤胃菌科(Ruminococcaceae)的相对丰度(P<0.05),同时显著增加普雷沃氏菌(Prevotella)、巨单胞菌(Megamonas)、巨球形菌(Megasphaera)、考拉杆菌(Phascolarctobacterium)、双歧杆菌(Bifidobacterium)和拟杆菌(Bacteroides)相对丰度(P<0.05)。据报道,普雷沃氏菌数量的增加与高膳食纤维饮食有关,并且该菌属能有效抑制氨、胺和吲哚等肿瘤诱导因子的产生[55]。巨单胞菌经研究证明与非淀粉多糖的降解有关,在预防肥胖方面发挥重要作用[56],该菌属可能是亚洲人群的特征菌属[57]。巨球形菌相对丰度的增加可能与藜麦挤压膨化样品中所含的非消化性淀粉有关[58],考拉杆菌能增强胃肠道机能、降低炎症水平[59]。双歧杆菌能帮助宿主吸收营养,增强免疫力,如治疗腹泻、便秘、肠易激综合征等肠道疾病[60],拟杆菌作为人体重要的共生菌,在人体消化食物以及获取营养和能量方面起关键作用[61]。而肠杆菌科和瘤胃菌科则被大量实验证明与肿瘤、炎症等疾病正相关[62-63]。

图5 体外发酵48 h后几种主要科、属菌群的相对丰度Fig.5 Relative abundance of several major families and genera after 48 h of in vitro fermentation
3 结论
本实验比较挤压膨化处理前后藜麦的基本营养成分含量的变化,并通过体外酵解实验发掘藜麦挤压膨化后样品的酵解特性。结果表明,挤压膨化加工后,藜麦灰分、总淀粉以及蛋白质含量并无显著变化(P>0.05),其直链淀粉、脂肪以及总膳食纤维含量、不可溶性膳食纤维含量显著下降(P<0.05),且可溶性膳食纤维含量显著增加(P<0.05)。藜麦挤压膨化制品在体外酵解中能一定程度上增加粪便肠道菌群的多样性,显著上调普雷沃氏菌、巨单胞菌、巨球形菌、考拉杆菌、双歧杆菌、拟杆菌的相对丰度(P<0.05),并显著下调瘤胃菌科和肠杆菌科的相对丰度(P<0.05)。此外,挤压膨化处理藜麦酵解48 h后不同SCFAs浓度均高于CK组。本研究结果可为藜麦挤压膨化制品及其调节肠道功能相关产品的开发提供一定的理论依据。
