乙酰化脱氧雪腐镰刀菌烯醇污染、毒性及转化研究进展
2023-02-12王瑞虎李萌萌关二旗刘远晓赵世通
王瑞虎,李萌萌,关二旗,刘远晓,金 瑞,卞 科,赵世通
(河南工业大学粮油食品学院,河南 郑州 450001)
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)俗称呕吐毒素,是禾谷镰刀菌等真菌在一定的温度、湿度条件下产生的次级代谢产物,常存在于小麦、玉米和大麦等谷物及其制品中,并通过食物链在人和动物体内蓄积,具有广泛的生殖毒性、发育毒性、细胞毒性、免疫毒性和神经毒性等[1]。随着对DON研究的深入,DON衍生物也逐渐成为关注的重点。目前已发现的DON衍生物主要包括3-乙酰基-DON(acetyl-DON,3-Ac-DON)、15-乙酰基-DON(15-acetyl-DON,15-Ac-DON)、DON-3-葡萄糖苷(DON-3-glucoside,DON-3-G)、DON-15-葡萄糖苷(DON-15-glucoside,DON-15-G)、DON-3-葡萄糖苷酸(glucoside acid,GlcA)、DON-15-GlcA、去环氧DON(deepoxy-DON,DOM)、3-酮基-DON(3-ketone-DON,3-keto-DON)和3-异构-DON(3-epimerization-DON,3-epi-DON)等[2-4]。
其中,3-Ac-DON和15-Ac-DON均为DON的生物合成前体,由共同前体3,15-二乙酰DON(3,15-diacetyl-DON,3,15-diADON)产生,3-Ac-DON和15-Ac-DON往往伴随DON产生,三者分子结构如图1所示。3-Ac-DON和15-Ac-DON的毒性与DON相似,在一些细胞中的毒性甚至比DON更强,且大部分在人和动物体内会重新转化生成DON,具有较高的生物利用率和转化率,严重威胁人和动物健康[4]。2011年,联合国粮农组织和世界卫生组织下属的食品添加剂联合专家委员会(Joint Food and Agriculture Organization of the United Nations/World Health Organization Expert Committee on Food Additives,JECFA)规定该类化合物(上述3 种毒素)的临时最大每日允许摄入量(acceptable daily intake,ADI)为1 μg/(kgmbg d)[5]。因此,在广泛研究DON毒性及降解规律时,关注3-Ac-DON和15-Ac-DON的毒性及其转化尤为重要。本文主要介绍DON乙酰化衍生物的产生、检测技术、污染现状及风险评估研究进展,重点综述DON乙酰化衍生物的细胞毒性、基因毒性和联合毒性等,同时阐述3 种毒素在各消化阶段及加工过程中的转化情况,以期为DON乙酰化衍生物的降解和防控研究提供参考。

图1 DON、3-Ac-DON和15-Ac-DON的分子结构Fig.1 Molecular structures of DON,3-Ac-DON and 15-Ac-DON
1 乙酰化脱氧雪腐镰刀菌烯醇的生成
3-Ac-DON和15-Ac-DON的生成与禾谷镰刀菌等真菌产毒的途径有关。参与毒素生物合成的基因共有12~16 个,不同菌株参与的基因有所差异[6-7]。这些基因被统一命名为Tri基因,其中Tri3~Tri14共12 个基因组成Tri5基因簇,Tri1与Tri16两个基因组成一个基因簇,Tri15与Tri101基因游离于这两个基因簇之外[8]。3-Ac-DON和15-Ac-DON由Tri8基因催化其前体物质3,15-diADON水解生成,之后脱乙酰基生成DON,是DON生物合成的关键步骤。不同镰刀菌的Tri8基因略有不同,基因表达的不同显著影响了两种毒素的含量与分布[9]。
温度显著影响3-Ac-DON和15-Ac-DON的生物合成,产生DON和3-Ac-DON的最佳温度在25~30 ℃之间,产生15-Ac-DON的最佳温度较低,约10 ℃[10]。同时,地理位置与采样年份的不同会显著影响菌株类型,从而影响两种毒素的分布状况[11]。由于3-Ac-DON和15-Ac-DON是产生DON的前体物质,当镰刀菌产生DON时,3-Ac-DON和15-Ac-DON往往伴随DON的产生而产生,受环境、地区等的影响,保留程度各不相同。亦有研究发现,产生3-Ac-DON的镰刀菌对全球环境变化表现出更强的适应性,正在成为主要的产毒镰刀菌[12-13]。研究掌握两者的产生途径及影响因素,明确产生毒素的化学型,对DON及其乙酰化衍生物的防控具有至关重要的作用。
2 3-Ac-DON和15-Ac-DON的检测、污染现状及风险评估
2.1 3-Ac-DON和15-Ac-DON的检测
3-Ac-DON和15-Ac-DON检测的研究难点在于如何进一步经济、迅速地分离纯化得到相应标准品[14]。常用的检测方法主要是气相色谱串联质谱法(gas chromatography-tandem mass spectrometry,GC-MS/MS)、高效液相色谱法(high-performance liquid chromatography,HPLC)、液相色谱串联质谱法(liquid chromatographyt and emmassspectrometry,L C-M S/M S)。由于3-Ac-DON和15-Ac-DON是同分异构体,采用HPLC检测干扰较多,定性效果较差,GC-MS/MS需要采用衍生的方法,过程较繁琐。因此,3-Ac-DON和15-Ac-DON的检测主要采用具有较高分离能力和抗干扰能力、快速、重现性强的LC-MS/MS,运用特征性碎片离子实现对两种毒素的同时检测。
Cao Meirong等[15]开发了一种自动在线固相提取系统,结合LC-MS/MS对玉米和小麦样品中3 种毒素进行测定。将样品的提取溶剂注入自动在线固相提取系统,以减少基质干扰。检测限为0.1~0.2 μg/kg,回收率在86.5%~99.7%之间。自动化在线固相提取系统能够直接将提取物注入LC-MS/MS中,加快分析速度,提高分析效率。超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)是在LC-MS/MS基础上进一步提高分析速率和分离效率的技术,龚蕾等[16]运用UPLC-MS/MS在10 min内实现了对DON、3-Ac-DON、15-Ac-DON和DON-3-G的快速分离鉴别,样品前处理回收率88.5%~117.0%,相对标准偏差为1.5%~8.6%,极大地提高了检测效率。
2.2 DON、3-Ac-DON和15-Ac-DON的污染现状及风险评估
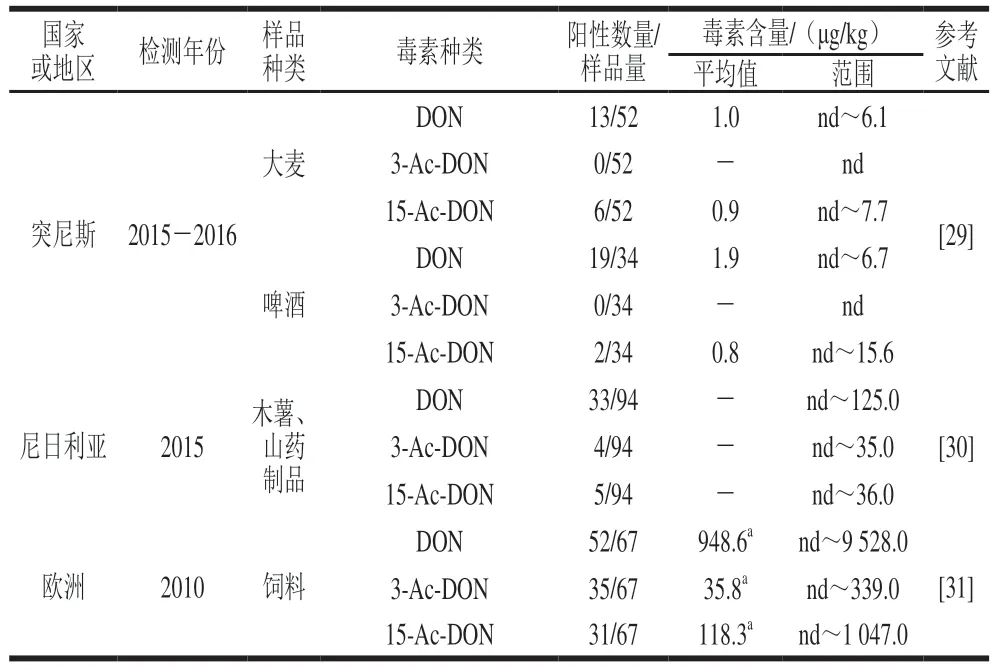
受气候变化、耕作制度改变等因素的影响,DON及其乙酰化衍生物在世界范围内的检出率越来越高,而且DON及其乙酰化衍生物共存的现象普遍存在。产生3-Ac-DON的镰刀菌具有较强的产孢子能力、生长速率和适应性,对谷物危害严重[12-13]。即使原始样品中不含3-Ac-DON和15-Ac-DON,在长期储藏后的样品中,二者仍可能产生[17]。近年来国内外学者对DON及其乙酰化衍生物污染情况的调查结果如表1所示。

表1 食品及原料中DON、3-Ac-DON和15-Ac-DON污染现状Table 1 Contamination status of DON,3-Ac-DON and 15-Ac-DON in foods and raw materials
续表1
研究发现,由于自然界产毒真菌的广泛存在,DON及其乙酰化衍生物的污染不仅存在于谷物及其制品中,木薯、山药等作物中也有检出,对食品安全构成极大威胁。同时,不同年份样品中3 种毒素污染率普遍较高,而小麦等谷物储藏周期往往较长,储藏期间毒素的变化将进一步增加食品安全风险[17]。DON及其乙酰化衍生物主要经过食物链在人体内蓄积,这3 种毒素的暴露具有同时发生、高毒性、高污染等特点,在进行污染情况调查以及评估真菌毒素饮食暴露量时,往往需要将3 种毒素累积风险同时评估。
虽然对多数食品的评估结果显示,DON及其乙酰化衍生物的估计每日摄入量均低于JECFA规定的ADI[32-34],但个别毒素含量较高的食品仍可能带来较大安全隐患。Han Zheng等[35]研究发现,对DON、3-Ac-DON和15-Ac-DON三者综合考虑计算累积健康风险,5%的人群毒素摄入量高于1.087 μg/(kgmbg d),具有潜在的健康威胁。在环境适宜产毒真菌生长的部分地区3 种毒素饮食暴露值甚至高达2.39 μg/(kgmbg d)[36]。因此,有必要对DON及其乙酰化衍生物进行更深入的风险评估,积极建立健全DON及其乙酰化衍生物的农业防控、污染预测、污染监测、执行立法等风险管理措施,以保障粮食安全,减少食品安全问题的出现。
3 3-Ac-DON、15-Ac-DON的毒性及转化
DON会对人和动物产生广泛的毒性效应,如细胞毒性、基因毒性、免疫毒性、生殖毒性等,包括神经内分泌信号通路改变、促炎症基因表达、生长激素轴破坏和肠道完整性改变等毒性反应[37-38],产生呕吐、腹泻、恶心、头昏等症状[1,39]。研究发现,DON的乙酰化引起其结构变化并产生了毒性差异,相较而言,3-Ac-DON和15-Ac-DON的毒性与DON相似,在一些细胞中甚至比DON更强[40-41]。同时,3-Ac-DON和15-Ac-DON的极性较强,更有利于扩散,这极大地增加了两种乙酰化衍生物的毒性作用[3]。DON乙酰化衍生物与DON表现出较强的联合毒性作用[42],大部分3-Ac-DON和15-Ac-DON在加工与消化过程中会被转化为DON[43-45],严重危害食品安全。
3.1 3-Ac-DON、15-Ac-DON的毒性
3.1.1 细胞毒性
DON乙酰化衍生物具有较强的细胞毒性,对多数细胞具有损伤作用,可以改变细胞渗透性、细胞膜完整性,抑制跨上皮转运、细胞内因子分泌,影响细胞内部调节因子表达、细胞增殖和活力,并最终导致细胞膜裂解、细胞死亡[46]。研究评估DON、3-Ac-DON和15-Ac-DON对人体肠细胞渗透性的影响,结果显示,15-Ac-DON的渗透性最高,诱导细胞电阻下降最高,并促使其表现出显著的荧光黄渗透性,影响细胞膜屏障功能[46-47]。在分化细胞中,15-Ac-DON亦显著影响细胞的屏障功能[48]。在分子水平上,3 种毒素显著影响细胞内调节细胞增殖、代谢过程效应因子细胞有丝分裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)、细胞外信号调节激酶(extracellular signal regulated kinase 1/2,ERK1/2)、p38和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)的产生,引起线粒体氧化应激反应、线粒体呼吸中断,引发细胞能量代谢障碍,蛋白质磷酸化,导致细胞凋亡。而15-Ac-DON可以更显著地影响MAPK、ERK1/2的表达,因此15-Ac-DON毒性更大,造成的组织学病变比DON与3-Ac-DON更强[49]。同时,3 种毒素会刺激细胞中肿瘤坏死因子(tumor necrosis factor,TNF)-α和白细胞介素(interleukin,IL)-1β的分泌,导致厌食症的发生[50]。
受3 种毒素影响,细胞的增殖与活力也会显著下降,评估细胞在体外生长与存活能力降低50%时的浓度(半抑制剂量)可以较好地表征各种毒素的细胞毒性。在马的免疫细胞中,DON和3-Ac-DON的半抑制质量浓度分别为3.09、25.90 μg/mL,而在增殖细胞中,DON和3-Ac-DON的半抑制质量浓度分别为0.73 μg/mL和6.89 μg/mL[51],毒素对马增殖细胞的影响比一般细胞更显著。Juan-García等[41]研究认为,3-Ac-DON对人体肝细胞的毒性比15-Ac-DON更大,采用噻唑蓝法测定二者在一定时间内的半抑制质量浓度分别为3.6~6.2、5.2~8.1 μg/mL,在中性红实验中3-Ac-DON也表现出最强的毒性作用[52],显著地影响人体肝脏功能,毒素随作用时间延长对肝细胞的毒性逐渐增强。与多数研究不同,在肝细胞中3-Ac-DON表现出更高的毒性,这可能与实验采用的细胞体系与研究方法有关,毒素对不同生物细胞与同种生物不同细胞的毒性,需要进一步探讨,以明确3 种毒素对各种细胞毒性的不同及其毒性机制。
3.1.2 基因毒性
3-Ac-DON和15-Ac-DON显著影响基因表达,诱导DNA损伤并导致基因表达差异,促使凋亡基因表达,引起细胞周期停止和DNA合成抑制,从而抑制蛋白质合成,导致细胞凋亡。DON乙酰化衍生物即使在低浓度的情况下也会造成DNA损伤[53]。小鼠经口摄入DON、3-Ac-DON和15-Ac-DON后,体内血清TNF-α、IL-1β、IL-6、CXC趋化因子配体2、血浆炎性趋化因子CC配体(chemokine C-C motif ligand,CCL)-2和CCL-7mRNA等出现显著上调[54],引起急性毒性。Pinton等[46]通过DNA芯片筛选毒素对肠细胞基因表达的影响,DON和15-Ac-DON诱导最显著的基因是炎症趋化因子IL-8基因,酶联免疫吸附试验检测结果显示,不同毒素刺激IL-8产生的能力依次为3-Ac-DON<DON<15-Ac-DON。这些炎症因子将导致慢性炎症性疾病,并加重人体对某些食物过敏原的过敏反应[55]。
3-Ac-DON和15-Ac-DON除诱导病原性基因的表达外,亦会抑制细胞内DNA合成,影响细胞生长代谢等过程,甚至导致细胞凋亡[56-57]。采用溴脱氧尿嘧啶核苷掺入法测定DON乙酰化衍生物对细胞DNA合成的影响,发现15-Ac-DON显著抑制细胞内DNA合成[56]。采用酵母细胞进行毒性评价发现,15-Ac-DON对线粒体核糖体基因的具有显著抑制作用,15-Ac-DON处理对葡萄糖转运基因HXT9和HXT11的影响明显高于其他霉菌毒素,细胞出现明显的葡萄糖缺乏现象,引起细胞凋亡,DON和3-Ac-DON暴露影响与15-Ac-DON相似但相对变化较小[57]。研究表明,DON乙酰化衍生物具有较强的基因毒性,影响细胞内基因表达,但DON、3-Ac-DON和15-Ac-DON化学结构的差异导致了与细胞死亡和细胞周期异常相关的基因表达的变化[58],15-Ac-DON的基因毒性显著高于DON。
3.1.3 联合毒性
多数情况下,真菌毒素污染往往不是单独发生的,人和动物常同时暴露于几种霉菌毒素,其毒性存在协同、增效或拮抗等多种效应,真菌毒素混合物的毒性不能仅根据单个化合物的影响来预测[59]。
在低浓度下,单端孢霉烯族毒素间具有协同作用;在较高浓度组合下,具有相加或近乎相加的作用[42]。研究发现,不同浓度处理人体胃上皮细胞24 h,DON在低和中等抑制浓度水平下与15-Ac-DON具有协同细胞毒性,能够显著降低细胞活性[60];DON、3-Ac-DON和15-Ac-DON二元或三元作用于小鼠腹腔巨噬细胞的联合毒性作用均表现为协同作用,毒素联合作用于细胞后显著提高了细胞活性氧浓度和细胞线粒体膜通透性[61];在肝细胞中DON、3-Ac-DON和15-Ac-DON显著影响细胞发育,抑制细胞增殖,亦主要表现为协同作用[62]。DON、3-Ac-DON和15-Ac-DON含量较低时,单独暴露于每种毒素可能不会产生风险,但当暴露于混合毒素时,可能会超过毒性效应的阈值剂量。应对3 种真菌毒素混合物的毒性及其在动物实验中的相互作用进一步研究,加强对3-Ac-DON和15-Ac-DON的监测控制[61-62]。
如表2所示,15-Ac-DON表现出更强的基因毒性,在影响细胞渗透性、完整性以及细胞增殖、生长等方面,3-Ac-DON和15-Ac-DON表现出与DON相似毒性,在针对不同细胞体系的研究中,3 种毒素毒性的表现略有差别,说明两种乙酰化毒素对不同细胞、组织等的毒性仍需进一步研究阐明[47,57]。同时,3 种毒素表现出较强的联合毒性作用[61-62],而谷物食品大都被DON及其乙酰化衍生物共同污染[24],在制定相关限量标准、评估真菌毒素污染状况及风险预警时,应充分考虑3-Ac-DON、15-Ac-DON的毒性[41,47]。

表2 DON及其乙酰化衍生物毒性分析Table 2 Toxicity of DON and its acetylated forms
3.2 3-Ac-DON和15-Ac-DON的生物转化
人和动物摄入真菌毒素后,消化系统、肠道微生物群会代谢这些真菌毒素,将其转化为不同的活性形式[63-64]。去乙酰化是3-Ac-DON和15-Ac-DON在人和动物体内的主要代谢途径[43-44]。
研究表明,猪体内3-Ac-DON在吸收之前迅速发生去乙酰化生成DON,喂食后20 min即在血浆中检测到DON,3 h后血浆中DON达到最大浓度[65]。猪口服DON、3-Ac-DON和15-Ac-DON的吸收率均为100%,3-Ac-DON和15-Ac-DON完全水解。对于肉鸡,DON、3-Ac-DON和15-Ac-DON经口摄入后吸收率分别为10.6%、18.2%和42.2%,在肉鸡体内3-Ac-DON完全水解为DON,而15-Ac-DON水解的比例较低(75.4%)[66-67]。虽然研究中15-Ac-DON水解相对较少,但15-Ac-DON毒性在多数细胞中与DON相似甚至更强,因此就全身毒性而言,两种乙酰化衍生物都可以近似被认为是DON本身的毒性。
采用动物粪便厌氧微生物体外培养3-Ac-DON和15-Ac-DON,在大鼠、猪和人类估计的肠道停留时间内,3-Ac-DON和15-Ac-DON都可以通过肠道粪便微生物群完全转化为DON,3-Ac-DON和15-Ac-DON在肠道内转化为DON的时间占停留时间的比率如表3所示,在人体内,两种乙酰化衍生物有充足时间转化为DON,构成健康威胁[44]。

表3 3-Ac-DON和15-Ac-DON在肠道内转化为DON的时间占停留时间的比率Table 3 Ratio of transformation time of 3-Ac-DON and 15-Ac-DON to DON in intestinal tract to residence time
研究人员通过体外实验研究人体消化酶与消化系统微生物对3-Ac-DON和15-Ac-DON的去乙酰化作用,发现小肠与肝脏具有较强的去乙酰化能力,而结肠和肾脏作用则较弱,胃蛋白酶、胰酶、肠道细菌均具有一定的去乙酰化能力,3-Ac-DON和15-Ac-DON在人体内去乙酰化过程如图2所示[68]。胃肠道是人和动物对抗食物污染物的第一道屏障,3-Ac-DON和15-Ac-DON在消化系统转化为DON后,机体迅速吸收DON,同时DON及其代谢物快速分布于血浆、肌肉、胃、肠、肝、肾、心脏、脑和脾等组织[69]。在肉鸡、猪、大鼠、小鼠、人类、人类组织与细胞中,3-Ac-DON和15-Ac-DON均表现出较强的去乙酰化能力,即使不考虑吸收后3-Ac-DON和15-Ac-DON与DON具有相似甚至更强的毒性,3-Ac-DON和15-Ac-DON在机体消化、代谢、排泄进程及体内微生物作用下也会迅速转化为DON,危害人与动物的健康。
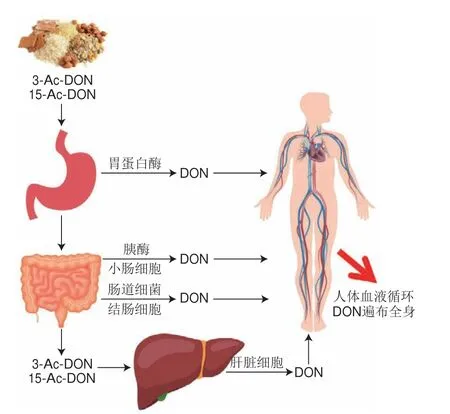
图2 人体3-Ac-DON、15-Ac-DON去乙酰化过程Fig.2 Deacetylation process of 3-Ac-DON and 15-Ac-DON in human body
3.3 加工过程3-Ac-DON、15-Ac-DON的转化
食品在制作过程中大多经过储藏、清理和加工等过程,这些过程都会影响DON、3-Ac-DON和15-Ac-DON在食品中的含量与分布。加工过程DON含量上升可能与其隐蔽型转化有关[70-71]。在啤酒酿造过程中,DON、3-Ac-DON和15-Ac-DON含量均出现显著下降,D3G含量上升,这可能与酵母的生长代谢有关[72]。而研究馒头制作过程中pH值、酵母菌水平和蒸制时间对3-Ac-DON、15-Ac-DON转变为DON的影响时发现,碱性条件和较短的蒸制时间有利于毒素的去乙酰化,馒头加工完成后DON含量显著升高[45]。面包制作时,发酵过程3-Ac-DON和15-Ac-DON含量显著降低,在和面阶段,3-Ac-DON和15-Ac-DON含量进一步下降,DON含量上升,3 种毒素之间可能发生了转化[68]。在另一项研究中,面包制作过程中,3 种毒素含量均出现显著下降[73]。这可能由于温度、发酵过程中使用的酵母菌株、烘烤时间、面包大小等均会影响面包的制作过程,并会影响真菌毒素的稳定性,从而造成了毒素不同的变化趋势。
小麦粉中蛋白质可能导致了3-Ac-DON和15-Ac-DON的去乙酰化[74],如细胞色素P450、乙酰酯酶和组蛋白脱乙酰化酶是面团制备中去乙酰化的潜在作用酶。而碱性条件、和面过程与高温过程可能加速了这些蛋白作用的进程,而因食品中这些蛋白的广泛存在,食品加工过程中DON乙酰化衍生物将不可避免地转化为DON。目前关于3 种毒素在食品加工过程相关转化及作用机制的研究尚不完善,毒素之间的相互转化显著影响了它们带来的健康风险,需要进一步研究这些过程加以阐明。
4 结语
DON的产生往往伴随其乙酰化衍生物的产生,且在世界范围内污染率呈逐渐升高的趋势,产生3-Ac-DON的镰刀菌具有更强的环境适应性,正在成为主要的产毒镰刀菌,需进一步调查评估其影响。而DON乙酰化衍生物的毒性与DON相似,在一些细胞体系中甚至比DON更强,产生广泛的细胞毒性、基因毒性等,影响细胞内蛋白质合成、基因表达、DNA合成,产生较强的氧化应激反应,促使细胞凋亡,并与DON具有较强的协同毒性。同时,在人和动物体内,绝大多数DON乙酰化衍生物会迅速转化为DON。因此,在风险评估中应综合考虑DON及其乙酰化衍生物的毒性,同时应对其相互转化后毒性的变化做进一步评估。
关于DON乙酰化衍生物的毒性及在食品加工、储藏等过程的转化机制仍有待完善,为了保障食品安全,仍需对DON乙酰化衍生物在不同细胞、组织体系中的毒性和不同过程的转化进行深入研究,应进一步优化改进检测技术,并制定相关限量标准,以降低食品安全风险;研究DON降解技术的同时,关注其乙酰化衍生物的降解情况,从而全面评估降解技术的应用效果。
