从学科发展史设计周环反应的课堂教学
2023-02-11马忠华项勇刚曹秀芳马济美
马忠华,项勇刚,曹秀芳,马济美
华中农业大学理学院,武汉 430070
有机化学基于电子分布和空间结构认知化合物,探究反应机理,进而阐述不同类别反应的特征和应用。电子的重新分布导致共价键可能发生异裂或均裂,对应则发生电荷反应或自由基的变化。周环反应的电子变化规律有所不同,它的基本理论认为,反应通过环状过渡态协同进行,一步同时完成多个键的断裂与生成,不能局限于从电子分布对价键变化进行描述,需要考虑轨道空间结构和能级,这无疑会加大教与学的难度。教学中一般注重于阐述周环反应的理论逻辑,内容容易显得“骨感”。初学者难以将理论与实践关联起来,往往产生“能干什么”的困惑,这不利于学习接受新的理论。本文探究在教学中,如何帮助学生理解周环反应在有机反应中的地位,对周环反应发展历史中的典型案例进行重构,结合基本知识点与历史背景,提升学生学习兴趣,让学生辩证地认识理论和实践在化学学科发展中相互促进、不可或缺的作用。
1 周环反应对认知学科发展的意义
有机化学是在研究生命活动现象、变化规律和物质性质的实践中最早形成的学科分支之一,侧重于指向实践性的问题,为研究生命运动的规律提供必备的基础知识与实践条件[1],早期的化学学科极度注重“经验性”知识。
周环反应理论,最具代表性的是在20世纪50–60年代形成的福井谦一(K. Fukui)的前线轨道理论和霍夫曼(R. Hoffmann)的轨道对称守恒原理。量子力学理论被引入化学,解释和指导研究复杂的化学变化,促使化学学科向“非经验性”转变,是现代有机化学发展史上的一个里程碑[2,3]。这两个理论深受早期的有机电子学说(价键理论和分子轨道理论)的影响。尤其价键理论,在我们现在有机化学课程的各章节内容中,仍然被广泛用于对官能团性质和化学反应的探究。前线轨道理论和轨道对称守恒原理,使化学工作者无需经过复杂的理论计算,即能解释主体选择性等奇妙现象,预测复杂多环骨架的生物活性分子的合成机理。
因此,不同于按照官能团划分的其他章节,周环反应的教学内容,呈现的是新的理论体系。这个体系是在有机电子学说基础上的发展和创新,更接近于反应的本质,从这一点来说,周环反应内容传递给学生的信息是学科发展的轨迹和新的高度。
2 周环反应的基本教学内容和难点
2.1 基本教学内容
周环反应的教学内容主要涉及电环化、环加成和σ-迁移三类反应的选择规则,如表1所示。前面章节中介绍过的双烯合成反应属于典型的一类环加成,这对学生本章节认知周环反应有利。本校基础有机化学教学侧重于环加成与电环化反应,对σ-迁移反应进行简要介绍。
2.2 教学难点
前线轨道理论和轨道对称守恒原理(表1)突破了有机电子学说中电子密度的局限,把分子轨道理论推到一个新的高度。如何简要、准确、生动阐述轨道对称守恒要点,是教学最大的难点。
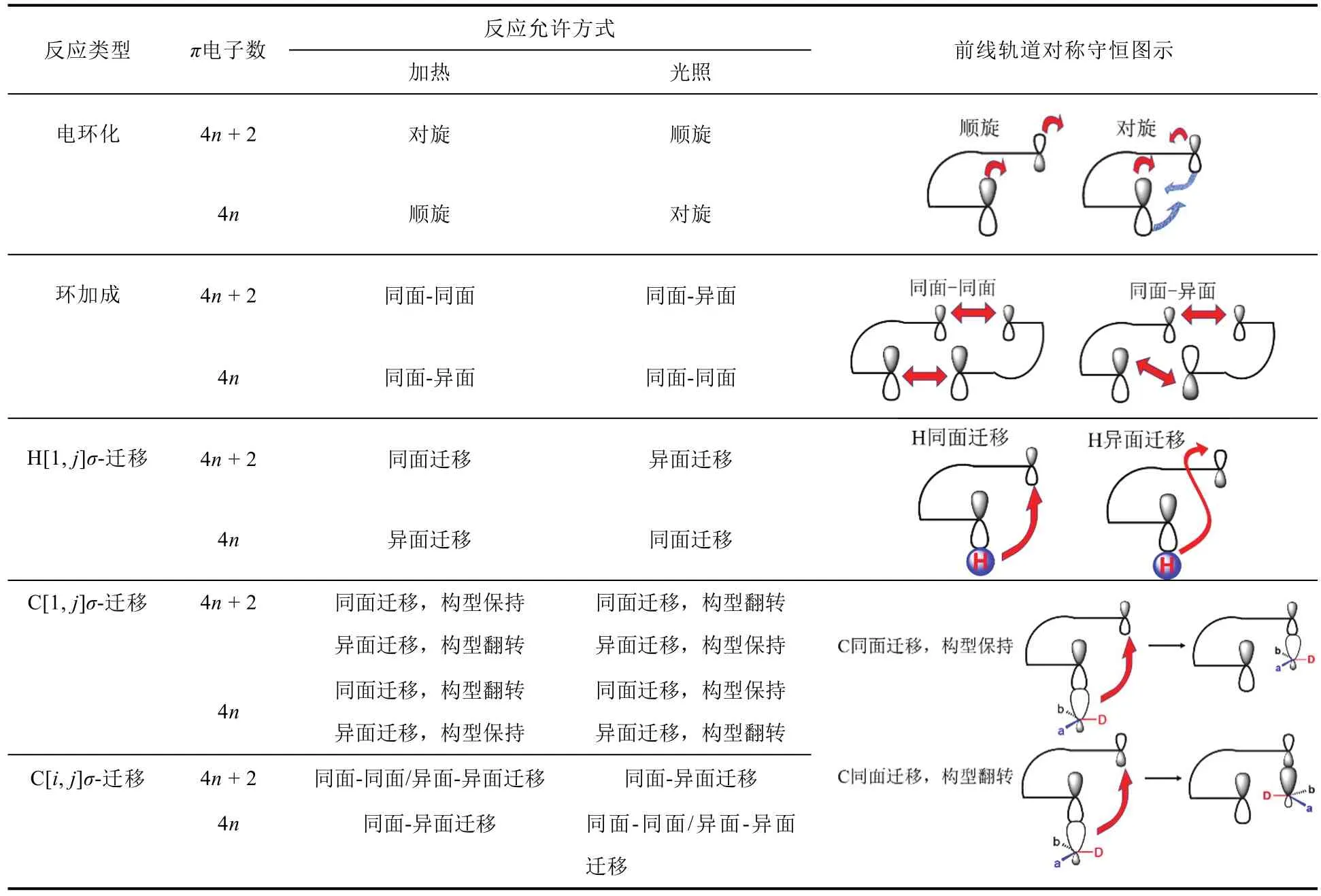
表1 周环反应的选择规则
周环反应理论具有强大的预测能力,前线轨道理论和轨道对称守恒原理使复杂生物分子的“非经验化”化学合成成为可能。如何将复杂实例简化,帮助学生抓住周环反应选择性规律的要点,认知其对于科学研究的现实意义,也是教学中要解决的难题。
3 教学处理与设计
我们主要通过化学史挖掘,将科学家的开创性研究进行改编,使其适用于课堂教学,结合“故事”,使“骨感”的理论与实践紧密结合,丰富课堂形式,同时对学生进行科学意识的熏陶和培养。
3.1 结合发展史引入新理论
我们首先对福井谦一提出前线轨道理论的史实进行教学还原。文献报道[3,4],福井谦一善于在纷繁复杂的化学变化中,对反应内在的奥秘进行逻辑推理,不推崇经验性的性质总结。这种思想,与当时化学发展的趋势相契合。福井谦一敏锐地捕捉到萘的芳香取代反应中的矛盾点:带有相反电荷的两种试剂,分别与萘发生取代反应时,在环上取代的位置相同(图1)。这单纯从电子效应是无法解释的,因为萘的不同位置电子密度明显存在差异。硝基的亲电取代发生在1-和5-位的话,氨基的亲核取代理应发生在2-位。福井谦一以此为突破点,提出模型,发展出前线轨道理论,先后在1952和1954年[5,6],预测了萘的硝化反应和氨基化反应的产物选择性,都主要发生在1,5-位,与实验结果一致[7]。
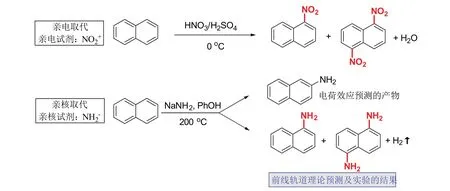
图1 福井谦一对萘的硝化与氨化的理论预测及实验结果对比
我们以此为背景进行教学设计,让学生意识到,本章节的内容将不同于价键理论,新理论将探究电荷效应之外的其他因素。我们结合教材和文献内容[8],给出简练的结果展示(图1)。其中,硝化反应是已学知识点,引导学生向新内容过渡。氨基化反应一般不会出现在教材中,我们通过三个问题引导学生切入:① 萘上各个位置的电子云分布与苯是否一样,完全平均化?② 考虑电荷效应,NH2−负离子与NO2+正离子在萘环上的取代位置会不会一样?③ 实验结果表明氨化和硝化在同样的位置发生,该修改实验结论还是理论要点?问题①在于温故,问题②在于温故后的“经验”推理,问题③促进学生“思新”。教学中点出经验推理与福井谦一理论预测结果的不同,将枯燥的理论以案例的形式初步展现,激发学生进一步学习的兴趣,但并不进一步展开理论要点。
3.2 理论难点的教学处理
3.2.1 电环化
采用原子轨道同相/异相重叠的方法,对电环化反应新形成的σ轨道进行示意,是教材及教学普遍认可的做法。前线轨道的对称守恒示意图如表1所示,表中也给出“4n热顺光对,4n + 2热对光顺”的选择定律。应用理论快速、准确对产物分子的立体选择性进行预测,对“旋转”时成环碳原子上的基团“走位”进行判断,是学生颇为头疼的问题。
我们对选律进行数字简化处理,利用简单的数学符号“+/−”,对体系进行标识。这里以关环的过程为例,基本做法如下:
① 线性共轭体系的双键数为偶数,用“+”表示;反之,双键数为奇数,用“−”表示。周环反应分为4n体系和4n + 2体系两类(n是线性共轭体系的碳原子数),对应的双键数分别为偶数2n和奇数2n + 1。
② 观察线性共轭体系的一头一尾两端两个双键碳上的基团位置,两个基团处于相同位置时,用“+”标识;相反,两个基团处于相对(背)位置时,用“−”标识(图2)。相对(背)指两个基团分别位于各自的双键延长线的左、右两侧(或上、下两侧),相同则指两个基团均位于延长线的左边或者右边(或上、下方)。图2中,以氢为例进行了标识,也可以对―CH3进行标识。
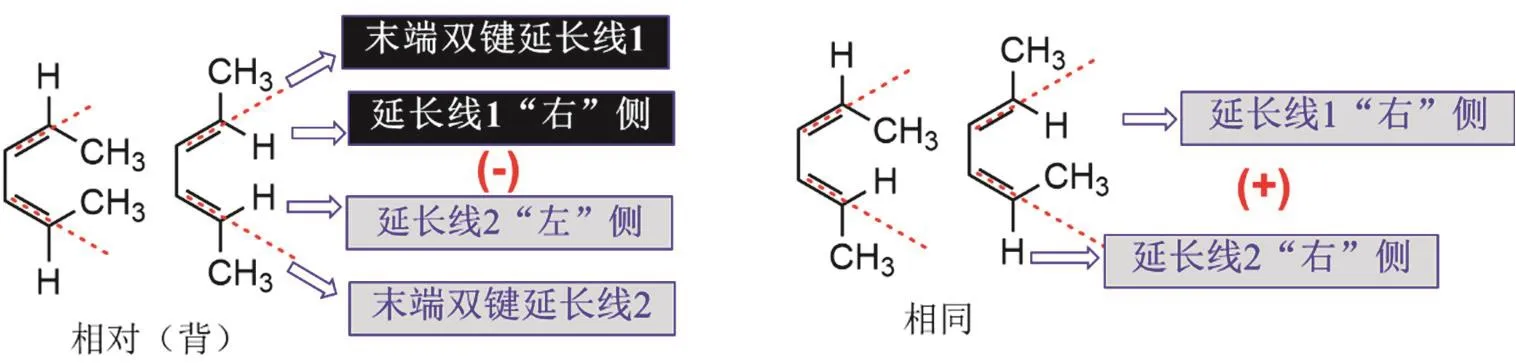
图2 线性共轭体系末端双键上官能团的简化标识示意
③ 加热条件用“+”表示(基态),光照条件用“−”表示(激发态)。
④ 综合考虑上述①–③标识的三个正负号,利用数学中简单的“负负得正”的符号运算的规律,最后为“+”,表示两个考察的基团在产物中处于环同侧(顺式),为“−”则表示它们处于环的异侧(反式)。
上面四条简化的做法,学生可以利用最直观的判断,快速预测产物立体选择性。这对于复杂分子的反应,更能体现出应用优势。图3所示是Havinga等1961年在研究维生素D时,预钙化甾醇的关环产物的立体选择性判断[9]。预钙化甾醇中,环化体系双键数3,两个末端双键的两个基团分别在延长线的左右两侧,条件为加热,所以符号依次为“− − +”,最终的符号运算结果为“+”,表示产物中,―CH3和―H这两个考察对象,处在新形成的环的同侧,同时向内(异焦钙化甾醇)或者向外(焦钙化甾醇)。
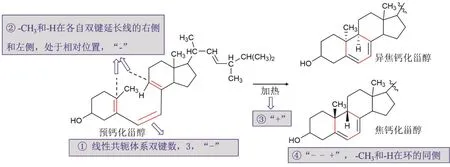
图3 运用简化标识的方法快速判断复杂分子的环化反应立体选择性
3.2.2 环加成与σ-迁移
环加成与σ-迁移的反应选律列于表1,标识的基本原则与电环化相同,具体如下:
环加成计算的双键数包括两个反应分子的双键数的总和,双键总数为奇数用“−”标识,总数为偶数用“+”标识;同样地,“+”和“−”分别对应加热和光照。不同的是,环加成涉及两个反应分子的前线轨道,这与电环化只涉及单分子前线轨道有所不同,这一个不同之处,固定用“−”标识。最后同样进行符号运算,结果“+”表示同面-同面加成允许,结果“−”表示同面-同面加成禁阻,据此快速判定产物立体选择性。例如,经典的双烯合成反应,底物双键数分别为2和1,标识为“−”,加热情况下(标识为“+”),符号运算为“+ − −”,结果为“+”,表示加热时,双烯合成是允许的(同面-同面加成允许)。
σ-迁移也是计算双键总数后,分别用“+”和“−”标识偶数和奇数情况。σ-迁移可以看作近似于自由基轨道变化的协同反应,将自由基看作0.5个π键。例如,[1,3]-迁移为(1 + 3)/2 = 2个双键,用“+”标识;[1,5]-和[3,3]-迁移为3个双键,用“−”标识。与环加成类似,反应涉及两个“分子”的前线轨道,用“−”标识。这样,加热条件下的[1,3]-迁移,用符号标识为“+ + −”,运算结果为“−”,意味着[1,3]-迁移在加热条件下,同面迁移禁阻。光照条件下的[1,3]-迁移则标识为“+ − −”,运算结果“+”,意味着同面迁移允许。同样的方法可以快速判断[1,5]-和[3,3]-迁移的结果。
这种快速的简化处理的方法,对于应用周环反应的规则能提供方便,但教学中仍然需要根据实际情况,要求学生从前线轨道和分子轨道理论来进行理解,从而准确判断产物的立体选择性。
3.3 教学重点深化与拓展
周环反应的高立体选择性是一个非常重要的特征,尤其是在具有多环骨架的生物活性分子的合成中,科学家经常推测通过周环反应途径,实现相应的重要中间体或化合物的合成。
3.3.1 从Dewar苯实例强化轨道对称性对立体选择性的控制认识
在教学过程中,我们先从简单的双环[2.2.0]己-2,5-二烯(Dewar苯)与苯相互转化的过程出发,强化学生对轨道对称性的理解。文献数据重构如图4所示[10–12]。
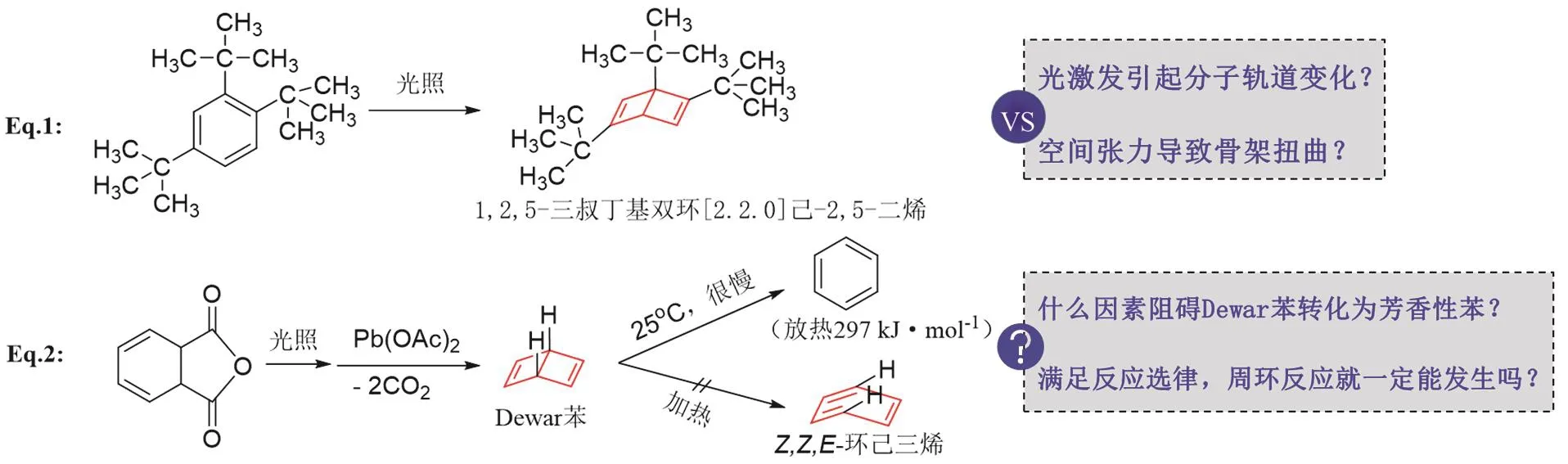
图4 杜瓦苯及衍生物与苯骨架之间的转化
教学中设计四个问题,逐步引导学生进行辩证思考:
(1) 反应式Eq. 1 (图4)被报道于1962年[13],是由光照引发电环化反应,苯环骨架转变为张力更大的双环二烯结构(Dewar苯衍生物)。那么,究竟是叔丁基形成的空间张力导致苯环骨架的变化,还是光激发分子轨道变化导致电环化反应发生?能排除空间张力的影响吗?
这个问题基于反应物中含有三个大体积的叔丁基,两个处在邻位,这很容易联想到三个大基团的空间张力,可能造成苯环骨架扭曲,导致芳香性减弱。这样,让学生意识到,新的反应类型和理论,并不是与基本的化学变化规律不相关,仍然需要综合考虑电荷效应、空间效应等影响到能量变化的因素。这是在知识层面引导学生新故结合,缓解新理论对学生心理的冲击。
(2) 在问题(1)的基础上,继续设置第二个问题,“怎么证明光激发分子轨道变化是主要因素,引起电环化?”这个问题并不要求学生给出答案,旨在引导学生进行科学严谨的思考,培养学生的科研意识和思考习惯。
(3) 反应式Eq. 2 (图4)初始报道于1963年,1971年有进一步的研究结果发表[13],是作者在Eq. 1基础上的进一步工作,制备出简单的Dewar苯,排除了大基团的空间张力效应,也是对问题(2)的解答。这是一个4n体系的光照电环化,产物中两个氢原子处于顺式,而且形成两个含双键的四元环。这个结构的稳定性明显不如苯。结合热力学的量化数据,从Dewar苯转化为苯放热约297 kJ∙mol−1[12],这相当于C―Br键或Cl―H键的离解能,Dewar苯应该很容易转化为苯。但是实际上,这个转化在常温下进行得极慢,两天时间仅有50%转化。那么,阻碍Dewar苯转化为稳定的芳香苯的原因是什么?进而突出电环化选律的关键作用。
(4) 第4个问题是进一步的拓展,在教学中根据实际情况选用。反应式Eq. 2中,Dewar苯转化为Z,Z,E-环己三烯是满足电环化选律的,但是反应并不能发生,表明轨道对称守恒的电环化过程不是影响反应进程的唯一因素。那么,周环反应的发生,除了满足反应选律,还需要具备哪些条件呢?这可以引导学生辩证分析影响化学反应的因素。
3.3.2 从多环骨架的构建深化知识应用
教学中选用二苯乙烯这个代表性的实例[13],将对苯乙烯结构类比于己三烯衍生物,从简单的链式底物过度到复杂的多环结构,深化学生对周环反应构建多环骨架的认识(图5)。
制备马兜铃酸[14]等多环碳氢化合物是一个具体的例子,可以丰富学生对电环化反应构建多环骨架的认识(图5)。图3所示维生素D的研究,是通过己三烯电环化获得多环骨架的另一个实例。
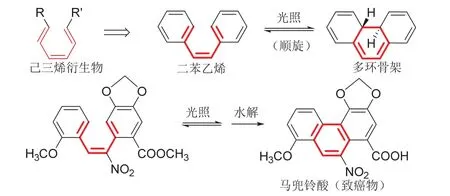
图5 电环化反应从二苯乙烯衍生物构建多环骨架
环加成构建多环骨架的应用更为普遍,其中最有影响力的应该是现代有机合成之父Woodward合成维生素B12 (Vitamin B12,VB12)的工作[15]。其中构建B环前体(B’环)的过程使用SnCl4催化,后来被证明是一个周环反应,是一个典型的4 + 2过程。教学过程中对同面-同面的加成过程进行示意,如图6所示。
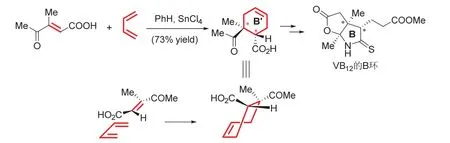
图6 环加成制备VB12的B环前体及立体选择性示意
环加成构成六元环,同时构成张力较大的三、四元或者七元环,在周环反应中也非常普遍。对张力环的有效构建,通过轨道对称守恒进行解释,对于学生理解立体选择性很有帮助。图4所示杜瓦苯骨架转化,也是一个得到张力环的实例。另一个简单的例子如图7所示[16],是通过链状前体分子内的4 + 2环化,得到含有七元环的双环中间体,热后转化为倍半萜烯雪松烯。双环中间体结构简单,但是在制备七元环的同时精准控制环的立体化学结构,环加成表现出独特的优势,使反应能一步完成。
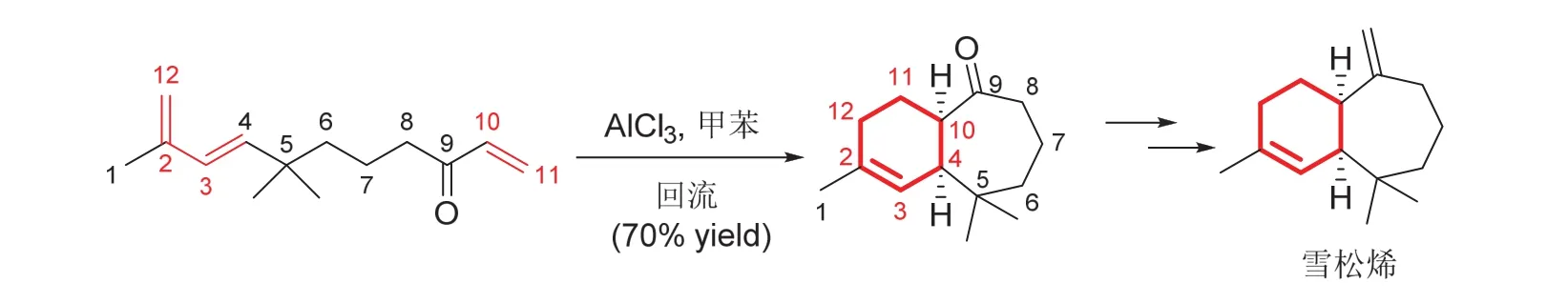
图7 4 + 2环加成构成含张力环中间体(雪松烯的合成)
实际上,环加成构建多环骨架以合成天然产物分子的实例不胜枚举,合成吗啡的C环,甾族化合物D环前体(D’环)等,都是很好的实例,简化的过程如图8所示,可以在教学过程中,根据实际情况选择使用。
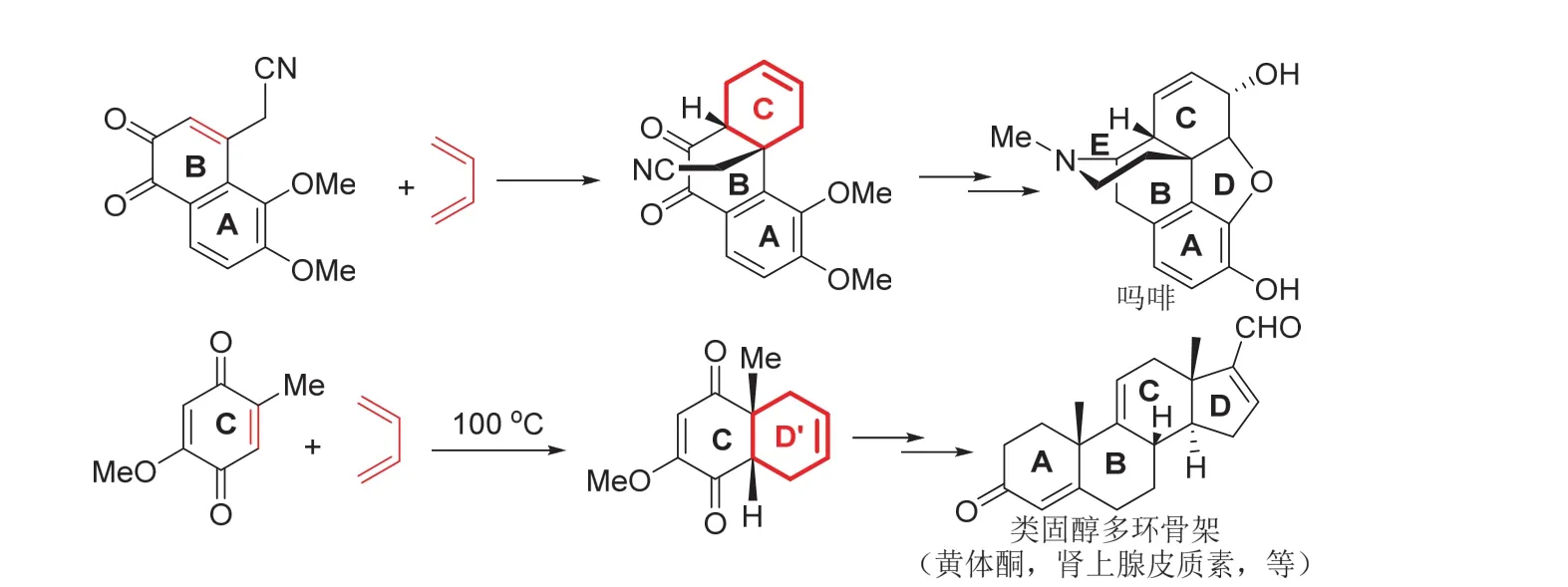
图8 环加成制备多环骨架的实例(吗啡和类固醇)
在对复杂结构的活性生物分子的举例过程中,向学生传递两个基本的信息:在化学方面,周环反应构建多环骨架是天然产物分子的全合成中重要的手段;在生物体内,这些复杂分子的产生是酶催化的生物反应,周环反应常被用于推测生物作用的机制。
4 思政元素的融合
作为一门自然学科,化学对求真、创新、协作的科学精神的培养是不可或缺的。周环反应的章节内容蕴含有丰富的思政元素[17],我们主要从以下几个方面,将思政内容动态融合于全章节。
(1) 科学的质疑与求真精神。福井谦一敏锐捕捉萘的芳香取代反应中的矛盾点,发展前线轨道理论,以及杜瓦苯与Z,Z,E-环己三烯转化的研究与发现,都是科学质疑精神的充分体现。杜瓦苯被鲍林假设为平面结构,并认定为苯的共振极限式。在这个权威理论的背景下,杜瓦苯及衍生物的成功制备,是不迷信权威、从实践出真知的科学质疑精神的充分体现。
(2) 科学理论的重大进展促进学科发展。福井谦一的理论在早期并不受重视,但在Woodward应用他的理论,指导完成VB12的全合成之后,理论极大地推动了有机合成的发展,尤其在复杂结构天然产物分子的全合成方面,这对于探索生命活动的奥秘,具有现实意义。化学理论不仅仅是解释实验结果和事实,更能促进学科长足发展,进而促进社会经济和文明的发展进步。因此,在学习有机化学的过程中,化学机理的学习是很有必要、很有意义的。
(3) 科学的协作与创新精神。Woodward组织了世界范围内一百多个科学家团队,分段进行VB12的重要片段的合成工作,历经11年,最后完成全合成,得到这个含有9个手性中心的复杂分子,创造了“诱导不对称”等合成策略。这个工作,是有机合成的案例宝库,充分体现了科学的协作创新精神。
5 结语
结合化学发展史中的经典实例,梳理周环反应理论与实践的发展脉络,引导学生展开对周环反应实践应用的思考、对学习反应机理必要性的思考、对化学“经验性”和“理论性”的深层思考,有利于学生科学思维与创新意识的培养和发展,以及培养学生用理论指导实践的创新意识。
同时,将复杂的多环化合物的合成案例适当简化,使之适合于教学,促进学生在理解基本案例的基础上,对更多复杂分子合成过程中的原理应用展开讨论,对教学设计来说,也是具有挑战性的。通过章节学习,培养学生实践出真知的科学的实践观,理论指导实践、学科交叉融合的科学的发展观,从知识传授、能力培养、价值引领三方面全面促进学生思维发展[18]。
