一种小麦新兴功能活性成分
——苯并恶唑啉酮的含量解析与降血糖评价
2023-02-10龚凌霄杨若言
龚凌霄,杨若言,王 静✉
(北京工商大学 食品与健康学院,中加食品营养与健康联合实验室(北京),食品添加剂与配料北京高校工程研究中心,北京100048)
苯并噁嗪类化合物(Benzoxazinoids,BXs)是一类具有药理学特性和保健特性的天然化合物,按化学方法分为苯并恶唑啉酮类、内酰胺类和异羟肟酸类[1],多项研究表明苯并恶唑啉酮类的功能活性相对 BXs中其他物质的功能活性更丰富,其中 6-甲氧基-2-苯唑啉酮(6-Methoxybenzoxazolin-2-one,MBOA)和2-苯并恶唑啉酮(Benzoxazolin-2-one,BOA)是两种主要的苯并恶唑啉酮类化合物[2]。MBOA、BOA在食品加工领域受到越来越多的关注,不仅因为MBOA、BOA存在于小麦等谷物食品中,还因为其具有一定的保健功效。
已报道的关于MBOA、BOA的提取与检测方法各有不同,包括样品前处理、提取溶剂及比例、提取方式三个方面,样品前处理主要分为在液氮下研磨[3]和冻干后磨粉[4]两种方式。提取溶剂的选择多为 80%甲醇水溶液,或加入少量甲酸(1%)。提取方式包括加速溶剂萃取仪萃取[5]、震荡[6]、超声[7]等,但大部分选用加速溶剂萃取仪加速萃取。在检测方法上主要包括HPLC-MS[8]、LC-ESI-MS[9]、UPLC-Q-TOF[10]、UPLC-Q-TOFMS[11]等。现在检测和提取方式尚未形成统一的标准[12],因此,建立MBOA、BOA的检测方法,并在食品领域对 MBOA、BOA进行系统的含量测定与分析具有重要的研究意义。
研究发现MBOA具有抑制食欲、减轻体重、刺激生殖系统,抗癌以及抗过敏等功效,BOA、MBOA均具有抗菌作用[13],现阶段我国对于MBOA的研究重点主要在于其对田鼠繁殖的影响及对植物生长的影响等方面,暂未见 MBOA、BOA在食品加工的应用以及保健功效方面的研究,因此,MBOA、BOA作为一种新兴的功能活性成分,具有重要的研究潜力。
本研究在优化MBOA、BOA提取以及检测方法的基础上,测定河南省十余种小麦中MBOA、BOA的含量,进一步选取MBOA、BOA含量较高的小麦进行不同加工处理,进而明确其含量变化与加工方式之间的关系,并以阿魏酸、阿卡波糖作为阳性对照,研究 MBOA、BOA对血糖的调控作用,为其对健康的有益作用提供一定的理论依据。
1 材料与方法
1.1 实验材料
淮麦:江苏;甲醇、乙腈、乙酸、磷酸二氢钠、磷酸氢二钠、酒石酸钾钠、亚硫酸氢钠、苯酚、氢氧化钠:国药集团化学试剂有限公司;乙酸乙酯:西陇化工股份有限公司;郑麦 366、郑麦0942、郑麦136、温庑0528、郑麦1860、郑麦26、百农207、矮抗58、郑麦7698、周麦18、郑麦9023、郑麦 1354、周麦 36:河南省农业科学院;α-葡萄糖苷酶、α-淀粉酶、4-硝基苯-α-D-吡喃葡萄糖苷3,5-二硝基水杨酸、MBOA、BOA:Sigma有限公司;阿魏酸:源叶生物。
1.2 仪器与设备
H2OPRO-UV-T型超纯水系统:德国赛多利斯公司;FreeZone® 6L型冷冻干燥机:美国Labconco公司;FW-100型高速万能粉碎机:北京中兴伟业仪器有限公司;JK-MSH-Pro-6A型六联磁力搅拌器:上海精学科学仪器公司;ME104型电子天平:梅特勒-托利多仪器有限公司;CR22N型高速离心机:日本日立公司;PT 2500 E型水浴锅:杰瑞尔电器有限公司;1260型HPLC、6420型QQQ:安捷伦公司;R-300型旋蒸仪:瑞士步琦BUCHI公司;HMJ-A35A1型和面机:小熊电器股份有限公司;SZ28T1型蒸锅:浙江苏泊尔股份有限公司;BioTekSynergy H1MDG型酶标仪:美国伯腾仪器有限公司;Cary 100型紫外分光光度计:安捷伦科技(中国)有限公司。
1.3 小麦中MBOA、BOA的提取
取小麦样品–80 ℃冻干12 h,直至样品质量不在减轻。将冻干后的样品磨碎至粉状,称取一定量的样品置于80%甲醇水溶液中(w/v=1/5),磁力搅拌3 h。将摇匀后的样品于7 000 rpm,7 ℃离心10 min。取用上清液,旋蒸浓缩,将甲醇全部蒸出后加入等体积乙酸乙酯萃取3次,取乙酸乙酯层。将乙酸乙酯提取物旋蒸至干,1 mL甲醇水溶液复溶。将复溶后样品过0.22 μm的有机滤膜进行过滤用于含量分析。
1.4 不同加工方式提取MBOA、BOA
采用样品的热处理、水热加工处理、水冷加工处理的方式提取处理后不同种小麦中的MBOA、BOA。热处理采用 50 ℃烘箱将小麦烘烤至干,水热加工处理参考 Hans等[14]方法,取一定量的小麦种子置于托盘上,第一天早晨使用种子∶水=1∶15的比例将种子润湿,晚上采用种子∶水=1∶10的比例重复润湿。之后的 4天每天早晚采用种子∶水=1∶10的比例重复润湿,共 8次以上,总水热加工(HTP)为5天。收集小麦种子,在 50 ℃条件下烘干直至重量不减轻。将收集得到的小麦种子磨粉,提取得到最终样品。水冷加工处理方式同样参考Hans等[14]方法,在HTP 处理5天后收集小麦种子,在冻干机中冻干,直至重量不减轻。将收集到的小麦种子磨粉,进行提取。
1.5 液质联用分析不同小麦品种中的MBOA和BOA含量
采用Agilent HPLC 1260 和QQQ检测器进行检测,色谱柱为Phenomenex Synergi Polar RP-80A,250 × 2 mm, 粒径为 4 μm。采用的流动相为A相:7%乙腈和20 mmol/L的乙酸,B相:78%乙腈和20 mmol/L的乙酸。进样量为5 μL,流速为0.2 mL/min。洗脱条件为梯度洗脱:0~5 min:16%的 B,5~22 min:16%~30%的 B,22~30 min:30%~50%的 B,30~33 min:50%~16%的 B,33~40 min:16%的 B。总运行时间为 40 min。ESI设定为负离子模式,并在MRM模式下进行检测,离子源温度:350 ℃;锥孔电压:45 psi;毛细管电压:4 kV;柱温30 ℃。根据绘制得到的标准曲线计算样品中的 MBOA、BOA的含量。BOA和MBOA的标准品质谱图如图1所示。
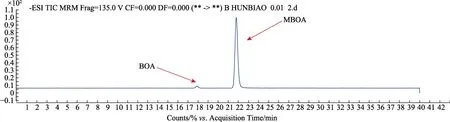
图1 BOA和MBOA的标准品质谱图Fig.1 Chromatogram of BOA and MBOA
1.6 降血糖功能活性测定
1.6.1 α-葡萄糖苷酶抑制活性测定
参考龚凌霄等方法[15],分别将MBOA、BOA用甲醇溶解并配制成浓度为0.1 g/mL的储备液,0.1 mol/L,pH 6.8的磷酸盐缓冲液(PBS)稀释备用;以阿魏酸和阿卡波糖为阳性对照,配制质量浓度为10 mg/mL阿卡波糖溶液,用PBS缓冲液(0.1 mol/L,pH 6.8)稀释备用。
分别取10 μL不同质量浓度的供测样液与45 μL α-葡萄糖苷酶(0.5 U/mL)磷酸盐溶液(0.1 mol/L,pH 6.8)振荡混匀,在37 ℃条件下水浴10 min。之后加入 45 μL 4-硝基苯-α-D-吡喃葡萄糖苷溶液,37 ℃反应20 min,再加入100 μL碳酸钠溶液(0.2 mol/L)终止反应,在405 nm波长下测定吸光度。以PBS缓冲液(0.1 mol/L,pH 6.8)代替α-葡萄糖苷酶溶液作为样品空白(Ab);以PBS缓冲液代替供测样品作为酶液空白(A0)。按照公式计算抑制率,并用 SPSS软件求出各供测样品的半抑制浓度(IC50)。
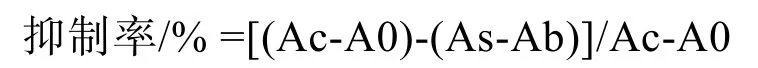
式中:Ac为未添加样品反应液的吸光度;As为添加样品反应液的吸光度。
1.6.2 α-淀粉酶抑制活性测定
分别取MBOA、BOA用甲醇溶解并配制成浓度为0.1 g/mL的储备液,并用0.02 mol/L且pH 6.8的PBS缓冲液稀释备用;以阿卡波糖和阿魏酸为阳性对照。配置3,5二硝基水杨酸(DNS)溶液,用0.02 mol/L PBS,pH值为6.8的PBS溶液配制13 U/m L的α-淀粉酶溶液。
参考Hemalatha等[16]方法并做改动,测定方法:100 μL 抑制剂样品+ 100 μL α-淀粉酶溶液,于37 ℃条件下培养10 min。再加入100 μL 1%的可溶性淀粉溶液(0.02 mol/L PBS),置于37 ℃条件下培养10 min。加入0.2 mL DNS溶液,沸水浴5 min,冷却至室温。加入4 mL蒸馏水稀释,在540 nm下测定吸光度。按照公式计算出α-淀粉酶抑制率,并用SPSS软件求出IC50值。

式中:A0为酶液空白吸光度;Ac为未添加样品反应液的吸光度;As为添加样品反应液的吸光度;Ab为样品空白吸光度。
1.6.3 α-葡萄糖苷酶抑制作用的动力学
参考姜丽丽等[17]的方法并稍作改动,其中,α-葡萄糖苷酶浓度(0.05 U/mL)不变,分别设置6个不同浓度的底物(0.1、0.25、0.5、1、2.5、5 mmol/L),BOA、MBOA两种抑制剂也选取三个不同浓度(0、25、50 mg/mL),并测定吸光度值A,横坐标为底物浓度的倒数(1/ S),纵坐标为反应速度的倒数(1/ V),绘制Lineweaver-Burk双倒数曲线图,得到BOA与MBOA对α-葡萄糖苷酶的抑制类型。
底物浓度为 5 mmol/L,设置 6个不同的 α-葡萄糖苷酶浓度(0.01、0.025、0.05、0.1、0.25、0.5 U/mL),BOA、MBOA两种抑制剂采取三个不同浓度(0、25、50 mg/mL),测定吸光度值A,以酶浓度为横坐标,以反应速度为纵坐标,分析BOA、MBOA 对 α-葡萄糖苷酶的抑制作用是否可逆。
1.6.4 α-淀粉酶抑制作用的动力学
α-淀粉酶浓度(1 U/mL)不变,设置6个不同浓度的底物(0.25、0.5、1、2.5、5、10 mg/mL),BOA、MBOA两种抑制剂采取三个不同浓度(0、25、50 mg/mL),测定吸光度值A,绘制Lineweaver-Burk双倒数曲线,分析BOA、MBOA对α-淀粉酶的抑制类型。
底物浓度为10 mg/mL,设置6个不同的α-淀粉酶浓度(0.25、0.5、1、2.5、5、10 U/mL),BOA、MBOA两种抑制剂采取三个不同浓度(0、25、50 mg/mL),测定吸光度值 A,以酶浓度为横坐标,以反应速度为纵坐标,分析BOA、MBOA对α-淀粉酶的抑制作用是否可逆。
1.7 数据分析
采用均数±标准差(X±SD)形式表示测定结果,并使用Microsoft Excel进行数据分析并做图,使用 SPSS数据分析软件进行单因素方差分析(ANOVA),以P<0.05标准判断差异的显著性情况。
2 结果与讨论
2.1 加工处理对小麦中MBOA、BOA含量的影响
以其中两种小麦(周麦18、郑麦1860)为例,分别进行三种处理方式后测定。经过三种处理方式的全麦粉中MBOA和BOA含量均有所增加,并且水冷加工处理与热处理的方式相对水热加工(HTP)较低;并且由表1中数据可知,相对HTP中的水热处理两个步骤中,水加工处理是提高MBOA与BOA的含量的关键步骤。造成这种差异的原因主要是水加工处理会使得小麦发芽,而相对小麦籽粒,小麦胚芽及幼苗中MBOA和BOA含量较高,进而增加了全麦粉中两种化合物的含量。另有研究表明[18],MBOA与BOA是苯并噁嗪化合物中结构较为稳定的化合物,而热加工可以促进苯并噁嗪类其他化合物向MBOA与BOA的转化,从而增加两种化合物的含量,且苯并恶唑啉酮含量的增加与羟肟酸在烘烤过程中发生的化学降解反应相一致,羟肟酸的生物合成主要发生在HTP处理过程中。
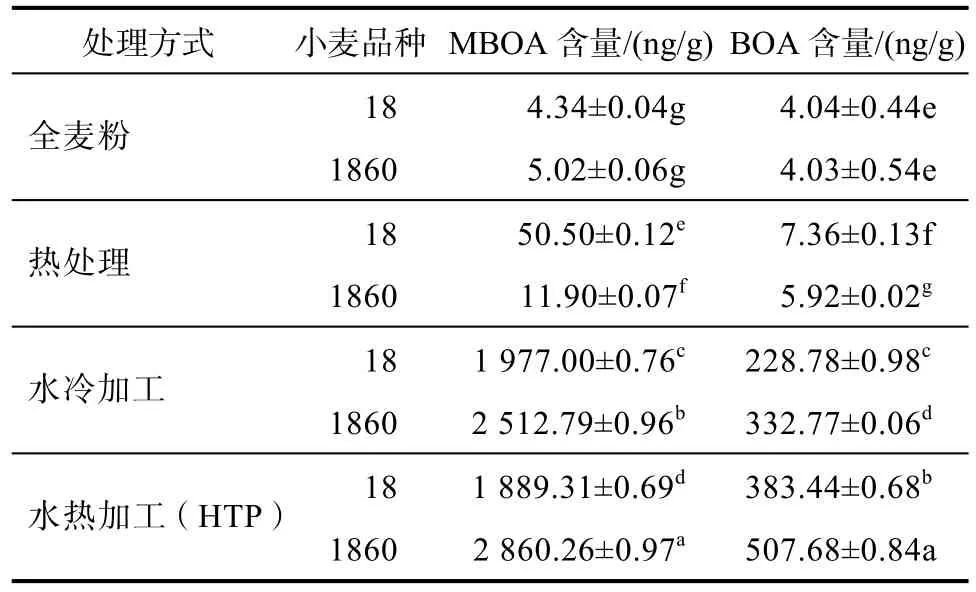
表1 不同处理方式下周麦18和郑麦1860中BOA和MBOA的含量Table 1 The content of BOA and MBOA in wheat 18 and wheat 1860 under different treatments
2.2 加工处理对不同小麦品种中MBOA和BOA含量的影响
将收集到的十三种小麦均进行未处理全麦粉与HTP处理后全麦粉进行MBOA与BOA含量测定,得到结果如表2。结果表明不同品种小麦中MBOA与BOA的含量差异比较明显,不同小麦品种的MBOA含量较接近,在4.30~5.02 ng/g之间,其中郑麦1860的MBOA含量最高;BOA含量范围为1.62~7.98 ng/g,以周麦26的BOA含量最高,是含量最低的温庑0528的5倍。另外,每种小麦的MBOA和BOA的含量比例4∶1到4∶7不等,这些差异性分析原因可能与小麦的生长环境、土壤因素与抗虫害能力有关。经过不同加工处理方式得到的样品中的MBOA与BOA含量也有显著差异,且MBOA与BOA含量变化趋势相近,按MBOA与BOA含量由低到高分别为:未经加工处理的全麦粉<热处理后全麦粉(50 ℃)<水冷加工处理后全麦粉<水热加工处理后全麦粉。其中,经过热处理的全麦粉中MBOA和BOA含量是未处理的全麦粉的1.5~12倍不等,水热加工和水冷加工全麦粉中 MBOA、BOA的含量是未处理全麦的500~1 000倍。
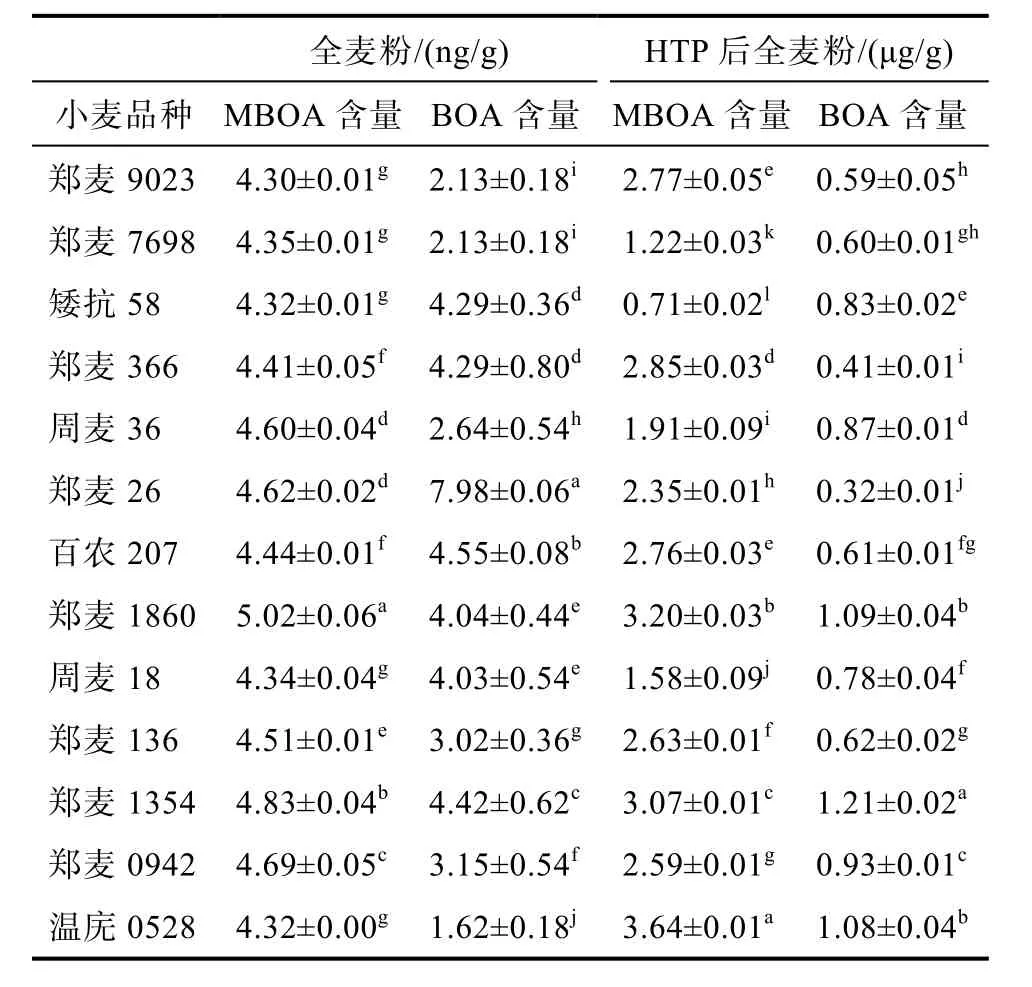
表2 全麦粉与HTP后全麦粉中BOA和MBOA的含量Table 2 The content of BOA and MBOA in whole wheat powder
2.3 MBOA、BOA降血糖功能活性评价
2.3.1 α-葡萄糖苷酶抑制活性
如图2和图3所示,MBOA、BOA对α-葡萄糖苷酶均有抑制活性,且抑制能力呈浓度剂量依赖性。其中,抑制能力由大到小排序为:阿卡波糖>MBOA>阿魏酸>BOA。MBOA的抑制能力强于阿魏酸,但相对降糖药阿卡波糖差距较大。阿卡波糖浓度为1 mg/mL时,抑制率高达93.4%,而MBOA、BOA和阿魏酸的抑制率分别为21.6%、5.5%和13.2%。

图2 MBOA、BOA与阿魏酸在不同浓度下对α-葡萄糖苷酶的抑制率Fig. 2 Inhibition of MBOA, BOA and ferulic acid on α-glucosidase in different concentrations
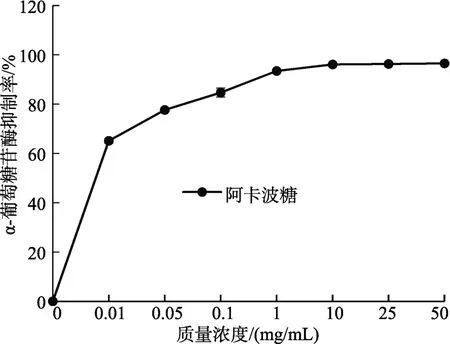
图3 阿卡波糖在不同浓度下对α-葡萄糖苷酶的抑制率Fig. 3 Inhibition of acarbose on α-glucosidase in different concentrations
2.3.2 α-淀粉酶抑制活性
如图4和图5所示,MBOA、BOA对α-淀粉酶均有抑制活性,且抑制能力呈浓度剂量依赖性。其中,抑制力由大到小排序为:阿卡波糖>阿魏酸>BOA>MBOA。当阿卡波糖浓度为 1 mg/mL时,抑制率为58.7%,而MBOA、BOA和阿魏酸的抑制率分别为9.4%、24.7%和29.7%。

图4 MBOA、BOA与阿魏酸在不同浓度下对α-淀粉酶的抑制率Fig. 4 Inhibition of MBOA, BOA and ferulic acid on α-amylase in different concentrations
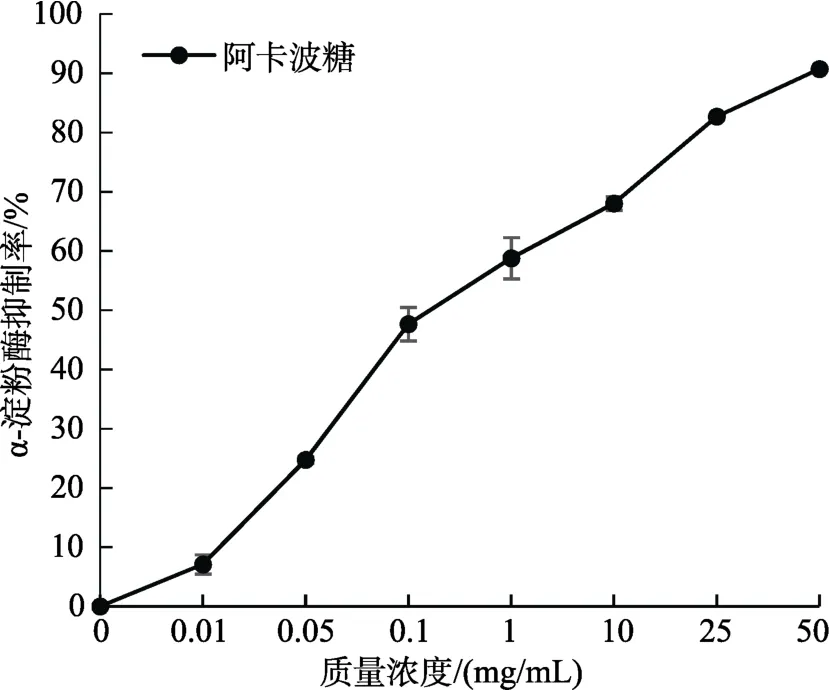
图5 阿卡波糖在不同浓度下对α-淀粉酶的抑制率Fig. 5 Inhibition of acarbose on α-amylase in different concentrations
运用SPSS软件计算MBOA、BOA与对照组阿卡波糖、阿魏酸的α-葡萄糖苷酶和α-淀粉酶的IC50值,选取logit模型,设置浓度、抑制率、总数三个变量,通过软件进行曲线拟合,自动生成曲线方程。表3结果表明BOA对α-葡萄糖苷酶的抑制能力最低,MBOA对α-葡萄糖苷酶的抑制能力虽优于阿魏酸,却远小于阿卡波糖;而MBOA对 α-淀粉酶抑制能力最弱,BOA对 α-淀粉酶的抑制能力与阿魏酸相近,但IC50值约为阿卡波糖的33倍。

表3 MBOA、BOA、阿魏酸与阿卡波糖对α-葡萄糖苷酶和α-淀粉酶的IC50Table 3 IC50 values of MBOA, BOA, ferulic acid and acarbose for α-glucosidase and α-amylase inhibition mg/mL
因此,降糖功能方面,MBOA、BOA对 α-葡萄糖苷酶以及 α-淀粉酶均具有一定的抑制作用,且接近甚至优于阿魏酸的酶抑制能力,可以作为营养因子在控制血糖方面发挥积极作用。
2.3.3 α-葡萄糖苷酶、α-淀粉酶抑制动力学
通过酶抑制动力学分析进一步分析确定MBOA、BOA的抑制机制。由图6可知,在α-葡萄糖苷酶体系分别加入不同浓度的MBOA、BOA,反应速度随抑制剂浓度的增加而减小,米氏常数保持不变。说明 MBOA、BOA对 α-葡萄糖苷酶的抑制作用是非竞争的。
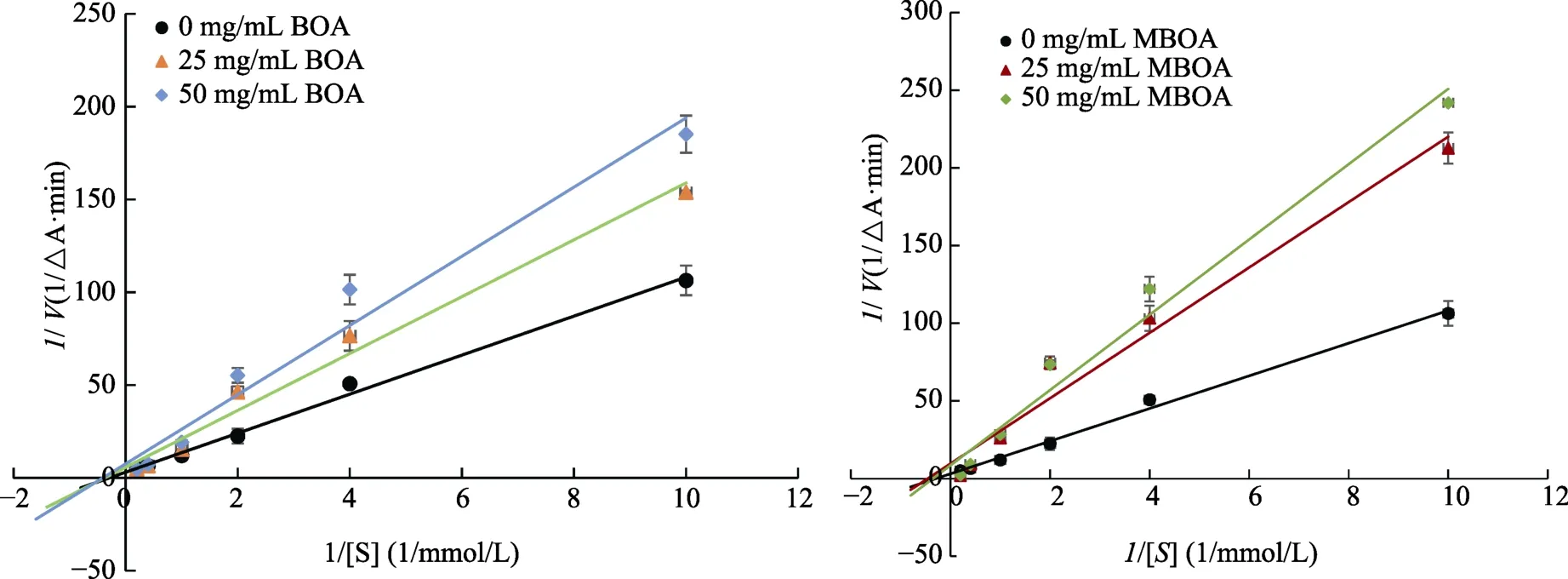
图6 BOA、MBOA对α-葡萄糖苷酶的抑制类型Fig. 6 Inhibition type of MBOA and BOA on α-glucosidase
由图7可知,在α-淀粉酶体系分别加入不同浓度的MBOA、BOA,反应速度随抑制剂浓度的增加而减小,米氏常数保持不变。说明MBOA、BOA对α-淀粉酶的抑制作用是非竞争的。
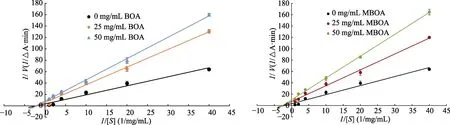
图7 BOA、MBOA对α-淀粉酶的抑制类型Fig. 7 Inhibition type of BOA and MBOA on α-amylase
3 结论
近几年才报道有关包括MBOA、BOA在内的苯并噁嗪类化合物在成熟谷物及谷类制品中的研究,而且此类物质的研究多见于国外。国内苯并噁嗪类化合物的研究重点在于MBOA、DIMBOA这两种化感类物质,且主要关注其在植物保护与昆虫防御方面。与其他谷物相比,玉米、小麦、黑麦中 MBOA、BOA含量相对较高且易检测,而这几类谷物作为人类膳食的重要组成部分与人体健康息息相关。而 MBOA、BOA作为其中的功能活性成分,其提取、检测方法尚未有明确标准,关于我国小麦中 MBOA、BOA的含量与比例关系尚不明确,关于 MBOA、BOA及其它苯并噁嗪类化合物的功能活性研究也不全面。本研究对我国的13个小麦品种中MBOA、BOA含量进行分析比较,结果表明同品种全小麦中的MBOA、BOA含量具有较大差异,而适当加工方法可以大幅提高 MBOA、BOA含量,进一步对MBOA、BOA的降血糖功能活性进行评价,MBOA、BOA 对 α-葡萄糖苷酶以及 α-淀粉酶均具有一定的抑制作用,且接近甚至优于阿魏酸的酶抑制能力,可以作为营养因子在控制血糖方面发挥积极作用。虽然全麦籽粒中MBOA和BOA的含量较低,但经合适的加工方式可显著提高其含量水平。作为潜在的食源性健康因子,后续需进一步完善其他苯并噁嗪类化合物的提取、检测方法,明确不同加工处理方式对其含量的影响,并在体外研究相对完善时通过动物试验甚至临床试验等进一步明确其对人体健康的影响。
