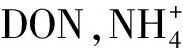祁连山岛状冻土活动层土壤氮库对模拟冻融响应
2023-02-10张振华张中华王英典赵新全王文颖邵新庆杜岩功周华坤
陈 哲, 徐 巍, 门 双, 张振华, 张中华, 王英典,2,6, 赵新全, 王文颖, 孙 建, 邵新庆, 杜岩功, 周华坤*
(1.青海师范大学,青海 西宁 810016;2.高原科学与可持续发展研究院,青海 西宁 810016;3.中国科学院西北高原生物研究所青海省寒区恢复生态学重点实验室,青海 西宁 810008;4.中国科学院青藏高原研究所,北京 100085;5.中国农业大学,北京 100083;6.青海省青藏高原生物多样性形成机制与综合利用重点实验室,青海 西宁 810016;7.青海省青藏高原药用动植物资源重点实验室,青海 西宁 810016)
土壤冻融交替是土壤与大气间因季节或昼夜温差所导致的反复“冻结—融化”过程[1],全球具有冻融现象的土壤面积约占陆地总面积的70%[2]。低温导致冻土区土壤富含有机质,其中北极和亚北极泥炭多年冻土总氮(Nitrogen,N)储量达9.7 Pg,占全球土壤N储量的10%[3],青藏高原冻土区0~3 m土层N储量存约1.8 Pg[4]。而冻融过程中土体的胀缩会导致土壤团聚体结构破碎[5]、植物根系断裂死亡[6],同时冰晶会杀死部分微生物并裂解释放出小分子有机物等[7],这些过程会显著改善土壤有效氮素水平[8-9]。当前,全球气候变暖正深刻改变冻土区土壤冻融格局,例如多年冻土区土壤活动层厚度增加、表土融化期延长[10-11],冬季积雪覆盖减少[12],这将使表土经历更为频繁的冻融交替[13],形成大量“有氧”“无氧”或者介于二者之间的具有独特氧化还原条件的微域,为硝化作用和反硝化作用创造有利条件,加速冻土区土壤有机质矿化[14-15]。在全球中—高纬度不同类型高寒生态系统中,冻融作用导致土壤N2O排放量占全年总排放量的10%~80%[16],且百年尺度上N2O的辐射胁迫强度是等物质量二氧化碳(CO2)温室效应的273倍[17]。因此,冻融过程不但导致土壤氮转化关键过程发生改变,而且该时期N2O大量排放也是全球温室气体排放中不可忽视的“源”,对全球气候变暖将产生正反馈效应[18]。因此,冻融交替是寒冷地区生态系统土壤养分生物地球化学循环的重要驱动力。
冻土区表层土壤作为冻融交替最为频繁、生物化学过程最为活跃、养分最为丰富的土层,其土壤氮转化与冻融效应密切相关。作为全球气候变化的“敏感区”和“先兆区”,青藏高原过去几十年正变得温暖、湿润。其气温增加幅度高于全球平均水平,达到0.16~0.67℃·(10a)-1,冬季增温速率(0.45 ℃·(10a)-1)是夏季增幅(0.25℃·(10a)-1)的近两倍[19]。平均温度,特别是冬季温度的持续上升,导致青藏高原冻土区活动层土壤开始冻结的时间以1.7 d·(10a)-1的速率延后,活动层解冻时间则以4.7 d·(10a)-1的速率提前[20],若非生长季表层土壤(0~20 cm)增温幅度达到2.03~2.3℃时,冻土层厚度将减少14.8%,完全冻结的持续天数减少44~83天,春季表土冻融交替的天数增加37~44天[21]。另外,青藏高原近几十年来大部分地区年均降水量增幅达3.8 mm·(10a)-1,且增加的降水主要发生在植物非生长季(11月—次年4月,3.4 mm·(10a)-1)[22]。由于水相对土壤矿质颗粒具有较大的比热容,土壤水分含量的微小波动会引起土壤热容量大幅改变,进而改变冻融过程中热交换过程。因此降水时空的变化同样影响土壤冻融格局和氮转化。所以,气候变化对青藏高原冻土区带来的是温度、降水、冻融次数的多重改变。全球范围各类生态系统(农田、林地、草地、湿地)冻融期N2O-N通量较大波动范围(0.7~27.2 kg·ha-1·a-1)可能与各系统中水分、温度、冻融格局的差别有关[10,23]。因此,冻融过程中不同水、热条件的耦合及冻融交替频次的加剧使得青藏高原冻土区土壤氮转化关键过程对气候变化响应的不确定性增加。
尽管针对冻融过程中水分、温度、冻融循环次数、土壤类型等因子对土壤氮循环的影响已开展多项野外原位研究或室内模拟研究,但大多以单因子试验为主。也有多个假说试图厘清冻融时期氮素有效性的调控机制[10,23-24],但关于长期频繁冻融过程中氮转化关键过程对不同水热耦合响应的情况探讨还比较欠缺,不利于准确评估气候变化背景下的冻土区土壤养分转化。基于此,本研究拟采用室内模拟试验,监测不同梯度土壤水分和温度组合处理在长期冻融循环过程中土壤有效氮库组分,通过对比分析、结构方程模型等统计方法,探讨青藏高原岛状冻土区高寒草甸活动层土壤氮素有效性对水、热及冻融循环次数的响应方式,以期为近一步探讨和预测气候变化背景下,青藏高原高寒草地暖干化、暖湿化及长期冻融交替等情形可能对土壤氮循环产生的影响提供一定支撑。
1 材料与方法
1.1 研究区概况
受试土壤样品采自祁连山脉东段大通达阪山(101°23′47.21′′ E,37°20′16.93′′ N,海拔3 705 m)。采样点距青海海北高寒草地生态系统国家野外科学观测研究站(简称“海北站”)直线距离30.7 km。该区属典型高原大陆性气候,冷季漫长,暖季短暂。海北站多年气象数据表明,该地年平均气温—1.6℃,最暖月(7月)平均气温10.1℃,最冷月(1月)平均气温—15℃,历史极端最高温26.8℃,最低温—37.1℃。年内日最低气温0℃以下的天数高达280天。多年平均降水量560 mm,其中80%分布于生长季(5—9月)。区域年均蒸发量1 238.0 mm。土壤样品采集地点植被为以高山嵩草(Kobresiapygmaea)为优势种的典型高寒草甸生态系统。植被平均高度小于10 cm,平均地上生物量210 g·m-2。采样区土壤为斑(岛)状永久冻土区的活动层土壤,属草毡寒冻雏形土,表层(0~20 cm)土壤有机质含量45.4 g·kg-1,容重0.90 g·cm-3,pH值7.46,含水量32.7%(6—8月)。表层土壤于10月上旬开始冻结,3月底达到最大冻结深度(187 cm),随后表土开始融化并于6月上旬全部融通[25],全部解冻前表土持续经历约40次昼夜冻融交替[21]。
1.2 试验设计
本研究旨在探究长期冻融交替过程中土壤水分(W)和融化温度(T)两个因素不同水平下的耦合作用对土壤氮库组分的影响。采用两因素三水平完全随机区组试验设计,共9种处理。根据受试土壤持水能力,将水分梯度分别控制为体积含水量15%(W15,干燥)、30%(W30,潮湿)和45%(W45,具1 mm水层)。分别模拟降水减少导致土壤水分亏缺,正常年份生长季自然状态和降水大量增加后土壤水分饱和三种湿度情形。鉴于海北站表层土壤10月下旬—11月中旬和3月上旬—4月中旬两个昼夜冻融时期,近五年来此阶段95%以上天数的昼夜温度处于—13℃与13℃间波动,故我们将所有处理的冻结温度统一设定为—20℃,将融化温度梯度分别控制为5℃(T5,低温)、10℃(T10,中温)和20℃(T20,高温),分别模拟日最高气温降低后低温融化情形,正常年份的自然融化和日最高温增加后的高温融化情形,9个处理分别为W15T5,W15T10,W15T20(区组1),W30T5,W30T10,W30T20(区组2),W45T5,W45T10,W45T20(区组3)。各处理设3次重复,共27个受试土壤单元。以各处理在实施第一次模拟冻融交替前一天的土壤状态为对照。
在预先设定好的三块30 m×30 m的样地中,采取梅花布点的方式,布设5个50 cm×50 cm的样方框,齐地剪取植物地上生物量,带回实验室烘干至恒重测定生物量。用直径10 cm根钻在剪除地上植物后的样方中采集0~20 cm足够的土壤,带回实验室,剔除枯枝、落叶后,轻揉土块,尽量减少土壤团聚体的人为物理破碎,过2 mm土筛,剔除植物根系、石砾等。称取500 g过筛后的土壤,转入体积1 L具塞玻璃广口瓶,摇晃瓶体保证土壤与瓶体均匀接触且上表面平整。瓶中土壤高度8~10 cm,土表距瓶口11~13 cm。采用便携式土壤湿度计测定各受试样平土壤体积含水量,用超纯水将其调至处理所设水平。水分梯度设置好后,记录各样品瓶总质量,做为后期补充水分的依据。
由于土壤采样期,研究区日最高温近20℃,为尽可能使受试土壤与冷季初期冻结前的自然状况相接近,对所有土壤样品做低温驯化处理。做法为将所有样品先后在15℃,10℃和5℃培养箱各培养1周,再使用3台具有制热和制冷双重功能的培养箱进行昼夜冻融交替模拟处理,将冻结温度和融化温度持续时间均设为12小时(8:00—20:00融化,20:00—次日8时冻结),利用机器温控自动循环程序进行昼夜温度调整。在低温驯化和模拟冻融交替过程中每5天测定一次瓶体总质量,根据质量变化补充因蒸发导致的土壤含水量的下降,保证土壤水分稳定。共模拟149天(次)昼夜冻融交替。
1.3 样品测定方法
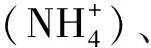
1.3.2微生物量测定 微生物量氮(Microbial biomass nitrogen,MBN)含量,主要通过氯仿熏蒸的方法完成。步骤如下:称取经前处理的12.5 g新鲜土壤样品,置于50 mL烧杯中,将烧杯放入盛有氯仿的真空干燥器中,用真空泵以—0.07 Mpa压力抽真空,氯仿剧烈沸腾3~5 min停止,重复抽真空2次。关闭干燥器阀门,于25℃黑暗条件下熏蒸24 h。同时做未熏蒸对照组。熏蒸结束后用0.5 mol·L-1K2SO4溶液,按土水比1∶4(w∶v)混合液,混合液在25℃条件下,转速200 r·min-1的震荡器上震荡30 min,用中速定量滤纸过滤。取10 mL过滤液,用TOC/TN分析仪(multi N/C 3100,Analytikjena,Germany)测定浸提液总氮(Total nitrogen,TN)含量[26]。
土壤微生物量氮(MBN)含量计算方法如公式:
式中EN为熏蒸土壤浸液提测定的TN与不熏蒸土壤浸提测定的TN的差值;KEN取0.54[27]。
1.4 数据统计
各处理和对照的测量指标在SPSS(IBM SPSS Statistics 20.0,SPSS Inc.,Chicago,USA)中利用单因素方差分析(ANOVA)并结合LSD法进行多重比较,显著性水平选取α=0.05。所有数据在SPSS中经标准化转换后,使用Amos(IBM SPSS Amos 24.0,SPSS Inc.,Chicago,USA)软件构建微生物量与环境因子和氮库组分间的结构方程模型,并计算各路径系数。使用Origin(OriginPro 2020b,OriginLab Corp.,Northampton,USA)制图。
2 结果与分析
2.1 土壤有效氮组分变化
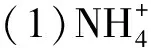
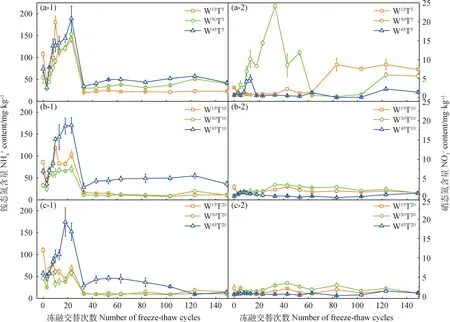
图1 长期冻融交替过程中土壤铵态氮、硝态氮含量动态特征
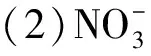

图2 不同处理下冻融前期和后期氮库组分均值差异性
(3)DON含量

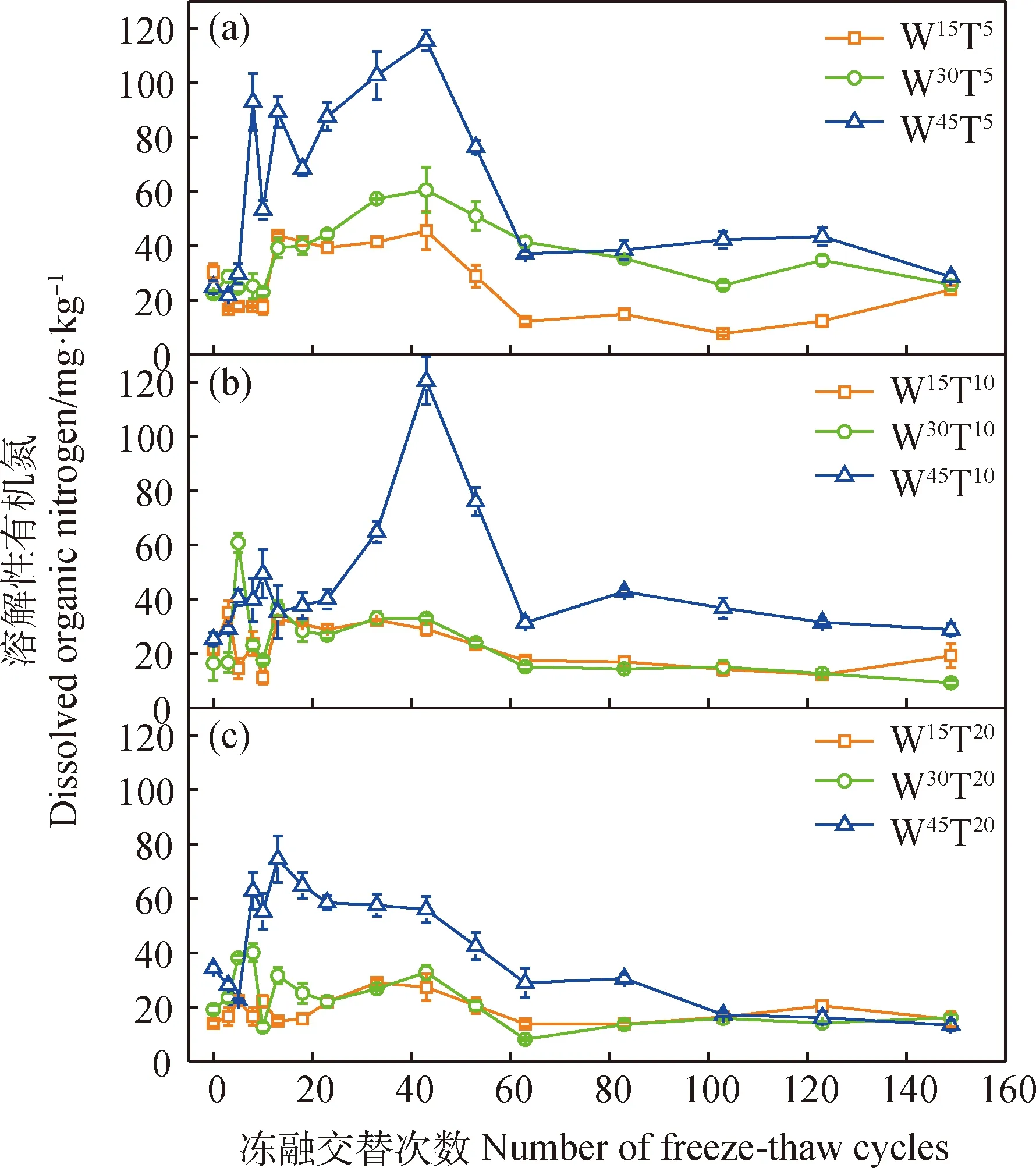
图3 长期冻融交替过程中土壤溶解性有机氮含量变化特征
2.2 土壤微生物量变化
不同水分条件下MBN对长期冻融的响应有所区别,其中W30和W45区组MBN也与土壤速效氮一样呈现前期增加后期降低的趋势,峰值较冻融前对照增加1~2倍(图4),但W15区组在整个试验周期中均无显著波动。W30和W45区组中除W30T20处理外,其它处理MBN前期累积量均值(42.67~52.66 mg·kg-1)显著高于W15区组各处理(28.77~36.22 mg·kg-1)。相同水分条件下,不同融化温度处理并未显著改变MBN动态规律及冻融前期和后期的平均值(图2-d)。另外,在低温(5℃)融化环境下,长期处理反而使得MBN积累有明显的增长趋势,而高温条件下冻融后期MBN含量回归到与冻融前对照相当的水平(图4a)。表明MBN对冻融过程中水分响应相比融化温度更强烈,长期低温有利于微生物氮固持。
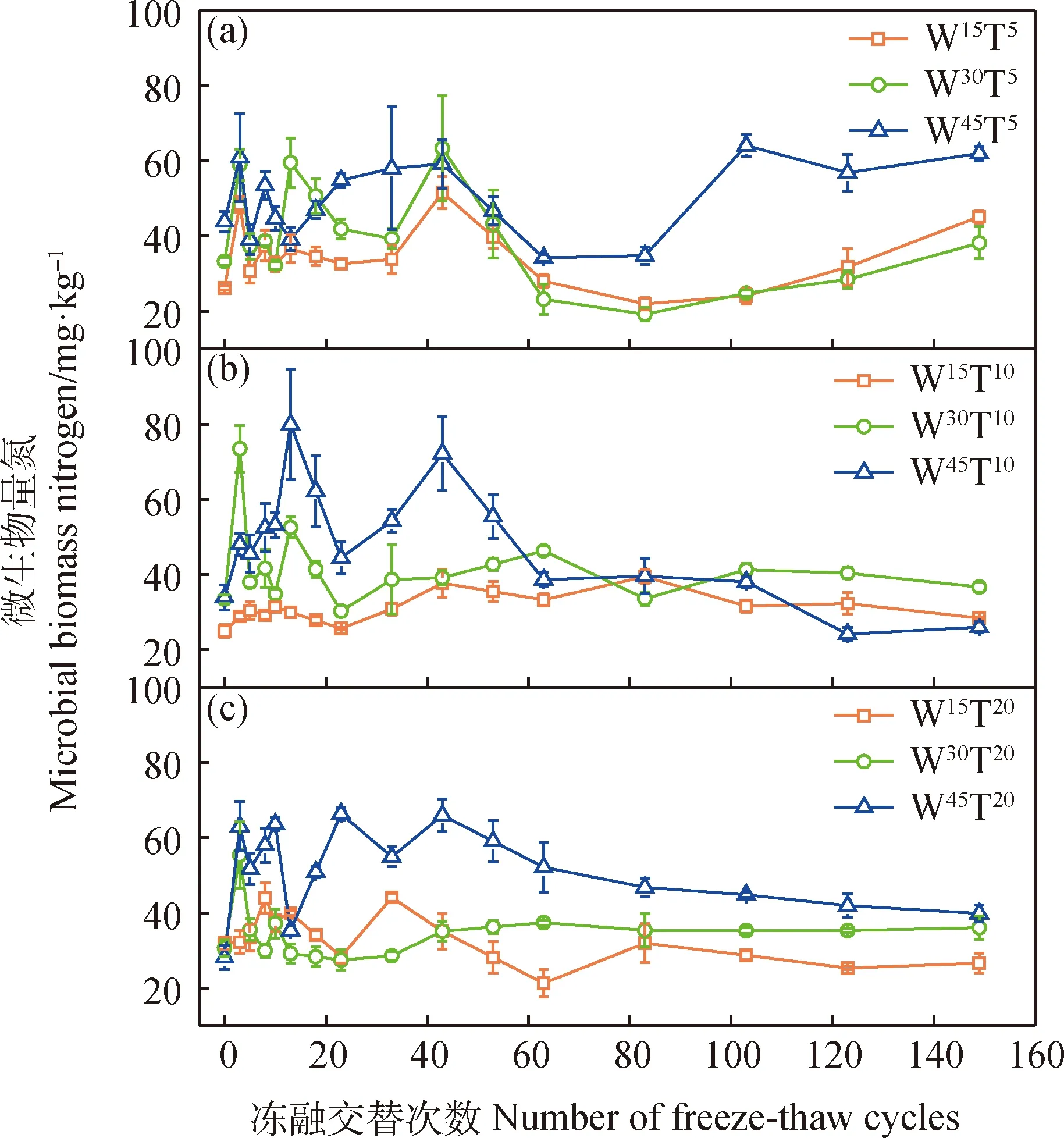
图4 微生物量氮含量动态特征
2.3 调控土壤氮库组分的因子分析
为探明长期冻融过程中土壤水分、冻融温度、冻融频次对土壤氮库氮素有效性的影响,我们采取结构方程模型的方法量化了环境因子和不同形态氮含量对土壤氮素有效性的影响,结果表明随着土壤水分的增加,其通过促进MBN含量(路径系数0.328)和DON含量(路径系数0.376),进而提高氮库有效性,总效应为0.329;冻融的频次和融化温度均对土壤微生物量氮含量无显著关系,其主要通过调节DON含量,影响氮库有效性,但与水分不同的是,冻融频次和融化温度对DON含量均具有显著负效应,路径系数分别为—0.211和—0.229,二者对氮库有效性的总效应分别为—0.128和—0.139(图5)。可见随着冻融频次和融化温度的增加,长期高温条件下的频繁冻融交替会导致土壤氮素有效性衰减。

图5 影响土壤氮库有效性的结构方程模型分析
3 讨论
3.1 冻融频次对土壤氮库的影响

3.2 冻融温度对土壤氮库的影响
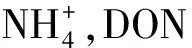

另外,W45区组的土壤氮库对融化温度响应不敏感的主要原因可能与高水分条件下土壤高的比热容有关。因为水分冻融过程中发生相变会吸收或释放大量热量,影响土壤热量分布和热量传递过程[41]。且土壤热传导率和液态含水率呈现正相关关系,即在土壤冻结过程中,液态水相变会降低土壤的热传导率,也就是说高含水量的土壤发生冻结后将减缓大气热量向土体内部的传导[42]。因此冻融过程中复杂的水热关系导致即便在相似的融化温度下,冻融过程中潮湿土壤与干燥土壤的温度波动、冻结持续时间、水分状态、土壤空隙等可能存在显著差异[43]。故水-热-气条件的同步变化造成冻融过程中冻土区土壤物质转化具有较大的不确定性。
3.3 水分对土壤氮库的影响


4 结论