两性霉素B脂质体在血液疾病患者侵袭性真菌病中应用研究进展
2023-02-08高雯慧王丽宁姜杰玲
高雯慧, 王丽宁, 王 苓, 姜杰玲, 胡 炯
我国血液恶性肿瘤患者确诊和临床诊断侵袭性真菌病(invasive fungal disease, IFD)发生率在接受化疗人群中为2.1%[1],在接受造血干细胞移植(hematopoietic stem-cell transplantation, HSCT)人群中达7.7%[2]。曲霉与念珠菌是血液病患者IFD最常见致病菌,毛霉则相对少见[2-3]。近年随着靶向药物应用,血液肿瘤患者合并IFD风险或进一步增高[3];同时,IFD预防治疗的普遍开展使得真菌流行病学发生改变,罕见和/或多重耐药真菌感染比例增高[4],给血液疾病患者IFD的诊断和治疗带来新挑战。
两性霉素B (amphotericin B, AmB)具有强效广谱的抗真菌作用,特别是抗耐药真菌感染,但毒副作用较为明显,限制其临床广泛应用。两性霉素B脂质体(liposomal amphotericin B, LAmB)的安全性较两性霉素B脱氧胆酸盐(amphotericin B deoxycholate, AmBD)有明显改善,为临床提供了更安全有效的治疗选择,也成为目前多种IFD的一线治疗方案[5]。LAmB在我国临床应用相对有限,临床医师对其缺乏系统性认识,本文将对LAmB治疗血液疾病IFD的临床应用进展作一综述。
1 LAmB简介
AmB为含有38元环的多烯大环内酯类抗真菌药物,通过与麦角固醇结合和氧化损伤等多种机制造成真菌细胞死亡[5-6]。AmB水溶性与脂溶性差,制剂中需加入其他两亲分子作为增溶剂来提高溶解度。AmBD以脱氧胆酸盐作为增溶剂,进入血浆后AmB与脱氧胆酸盐迅速分离,因此游离AmB浓度高,相关肾毒性大。此外AmB的急性输液反应(寒战、发热、恶心、呕吐等)常见[6]。LAmB则将AmB包裹在小球形单层脂质体中,释放AmB速度明显低于AmBD。另由于LAmB粒子尺寸较大(直径约80 nm),在正常组织中血管外渗透受限、在肾脏等器官分布减少,因此可降低肾脏损伤[7]。LAmB将AmBD引发中性粒细胞TLR2型应答转变为TLR4型应答,减轻促炎细胞因子分泌上调,从而降低输液相关反应发生风险[8]。临床试验荟萃分析显示,相比AmBD,LAmB引发的肾损伤以及输液反应发生率均显著降低[9];安全性的改善使得LAmB足量应用成为可能。LAmB与AmBD成分、理化性质、药动学特征与比较见表1[5]。
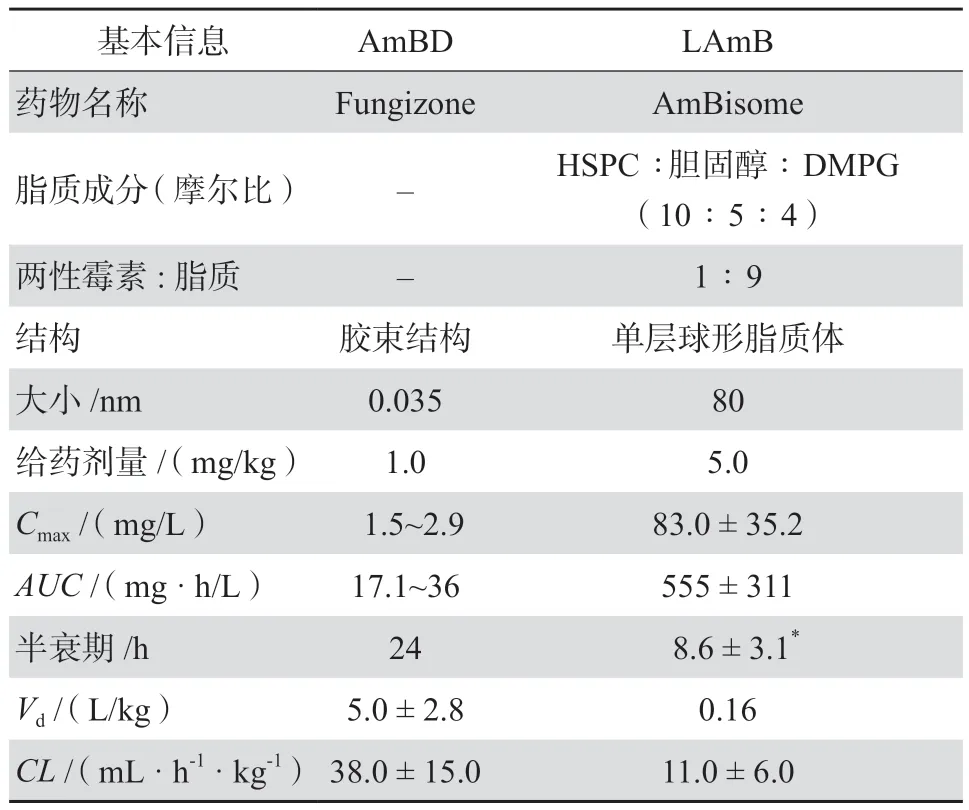
表1 LAmB与AmBD的药物基本信息
2 LAmB的适应证与疗效
目前LAmB在美国、欧洲、中国香港和中国台湾地区均已获批,获批适应证包括严重或系统性真菌感染(如隐球菌病、念珠菌病、曲霉病、组织胞浆菌病和毛霉病等)、脏器利什曼病(皮肤黏膜利什曼病仅获批于美国)、HIV感染者的隐球菌脑膜炎,以及中性粒细胞减少患者的不明原因发热[10-13]。本文就LAmB在血液疾病患者IFD的预防治疗、经验或诊断驱动治疗以及目标治疗的临床研究进展进行详述。
2.1 预防治疗
中国《血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第六次修订版)》(下文简称“血液科IFD指南”)主要推荐使用唑类药物进行预防治疗[3]。当唑类药物因药物不耐受、毒性或与其他药物间的药物-药物相互作用(drug-drug interactions, DDI)等原因无法使用时,LAmB或为预防治疗选择之一[14]。一项澳大利亚单中心回顾性研究中,198例血液病患者接受共计273个疗程预防治疗(每周3次LAmB 1 mg/kg),确诊和临床诊断突破性真菌感染13例(6.6%)[15]。另一项英国单中心回顾性研究纳入92例血液肿瘤患者,接受间歇性高剂量LAmB(每周一次7.5 mg/kg)预防治疗,共计114个疗程治疗,突破性真菌感染发生率(包括临床诊断和拟诊)仅为1.8%(2/114)[14]。提示较高剂量LAmB预防可有效降低IFD突破,LAmB用于预防治疗的循证医学证据有限,其最佳剂量方案还有待进一步探索。
2.2 经验治疗或诊断驱动治疗
2.2.1 未接受IFD预防治疗患者人群 我国血液科IFD指南以及欧洲白血病感染会议(European Conference on Infections in Leukaemia, ECIL)、欧洲临床微生物和感染性疾病学会(European Society of Clinical Microbiology and Infectious Diseases, ESCMID)、 美 国 感 染 性 疾 病 学 会(Infectious Diseases Society of America, IDSA)等国际指南主要推荐棘白菌素类(卡泊芬净和米卡芬净)、LAmB和唑类(伏立康唑和伊曲康唑)药物用于持续粒细胞缺乏且伴发热的高危患者的经验治疗[3,16-19]。早期以血液恶性肿瘤为主体受试者的Ⅲ期临床试验发现,LAmB经验性治疗有效性与AmBD[20]、AmB脂质复合物[21]、伏立康唑[22]、卡泊芬净[23]相似。一项Ⅱ期临床试验则探索了 LAmB 1 mg·kg-1·d-1治疗中性粒细胞减少血液肿瘤患者中难治性发热的有效性,显示66.3%(53/80)患者达到主要治疗终点[24]。近期来自日本Yoshida等[25]的前瞻性观察研究纳入426例中性粒细胞减少伴持续发热患者,95.5%基线伴有血液恶性肿瘤,20.6%接受HSCT,LAmB在>18岁患者中整体治疗反应率45.3%,经验性治疗后确诊突破性IFD感染发生率仅为1%。
2.2.2 接受IFD预防患者人群 随着IFD高危血液病患者预防治疗的广泛开展,预防治疗条件下IFD的诊断和治疗存在难点。IDSA和ECIL指南对于仅接受氟康唑等未覆盖丝状真菌药物预防的人群,可根据患者IFD高危因素,采用经验治疗或诊断驱动治疗。而接受覆盖丝状真菌的广谱抗真菌药物预防人群,则无统一推荐方案,根据患者IFD高危因素、临床特点和微生物学依据选择经验或诊断驱动治疗策略。而药物选择则需根据患者的抗真菌药物暴露史,肝、肾功能等多种因素个体化选择。如北京协和医院回顾性队列研究纳入248例急性髓系白血病和急性淋巴细胞白血病患者,70.6%接受氟康唑、伊曲康唑、伏立康唑或泊沙康唑进行初级预防,突破性感染率(包括确诊、临床诊断和拟诊)分别为6.5%、5.5%、5.4%和5.3%,预防后接受经验或诊断驱动治疗的比例分别为45.7%、23.3%、18.9%和10.5%[26]。
对于已接受广谱抗真菌预防治疗患者,预防治疗可改变IFD流行病学。使用三唑类药物作为预防治疗患者,更可能出现突破性感染病原体包括对唑类耐药曲霉和对唑类内源性耐药的非曲霉等[27]。如伏立康唑缺乏抗毛霉活性,伏立康唑预防治疗后发生突破感染患者中毛霉病比例增高[27]。此时转换为不同种类、对唑类耐药菌有活性的抗真菌药,如LAmB或可提供更好的疗效[27]。
2.3 目标治疗
2.3.1 侵袭性念珠菌病 我国血液科IFD指南及国际指南均推荐棘白菌素类药物和LAmB作为侵袭性念珠菌病治疗的首选药物[3,17-18,28],ESCMID 推荐LAmB剂量为3 mg·kg-1·d-1[18],IDSA推荐LAmB剂量为 3~5 mg·kg-1·d-1[17]。目前尚无血液病患者为主要受试者的LAmB治疗侵袭性念珠菌病有效性与安全性的临床试验。一项意大利小型回顾性研究纳入20例伴慢性播散性念珠菌病恶性血液肿瘤患者,结果显示使用高剂量LAmB(5 mg·kg-1·d-1;6/6)患者均达完全缓解,使用标准剂量LAmB(3 mg·kg-1·d-1;0/3)患者均治疗失败,接受三唑类和棘白菌素类药物治疗后达到完全缓解患者比例分别为33%(2/6)和40%(2/5)[29]。提示高剂量LAmB或可更有效治疗慢性播散性念珠菌病。
2.3.2 侵袭性曲霉病 近年来伏立康唑与艾沙康唑成为侵袭性曲霉病的首选药物,LAmB则为备选之一(强推荐、中等证据)[3,16,19,28]。多部指南明确反对使用 AmBD[16,19,28],IDSA 指南亦反对单独使用棘白菌素类药物作为主要疗法[16]。AmBiLoad双盲临床试验探索了LAmB治疗IFD的最佳剂量[30],纳入201例IFD患者随机接受14 d LAmB 3 mg·kg-1·d-1或 10 mg·kg-1·d-1治疗后转为LAmB 3 mg·kg-1·d-1治疗直至医生决定终止,其中93%为血液肿瘤患者,97%为侵袭性曲霉病[30]。结果显示,3 mg·kg-1·d-1组和 10 mg·kg-1·d-1组整体有效反应率(50% 对 46%,P>0.05)及第12周生存率(72% 对59%,P>0.05)均相似,且后者肾损伤及低钾血症发生率更高,提示高剂量LAmB治疗侵袭性曲霉病患者未获得额外收益[30]。
2.3.3 侵袭性毛霉病 侵袭性毛霉对唑类药物中的氟康唑和伏立康唑、棘白菌素类药物及氟胞嘧啶均耐药,部分菌种对伊曲康唑也耐药,仅对泊沙康唑、艾沙康唑和两性霉素 B 敏感[31]。目前LAmB 5~10 mg·kg-1·d-1为国际指南推荐一线毛霉病治疗方案,其他可使用药物包括AmB脂质复合物、胶质分散体,以及艾沙康唑和泊沙康唑[28,32]。2017年ECIL-6 指南虽有针对AmBD的使用推荐,但2019 年的欧洲医学真菌学联盟(European Confederation of Medical Mycology, ECMM) 指南明确指出存在其他可选方案时,不推荐使用AmBD[28,32]。法国一项多中心、前瞻性临床研究纳入34 例确诊或临床诊断毛霉病的患者接受LAmB 10 mg·kg-1·d-1治疗4周,其中半数患者基线伴有血液系统疾病[33]。研究结果显示,在第 4 周时有效反应(包括部分缓解和完全缓解)率达36%,在 12 周时有效反应率达 45%。相较上文提到的AmBiLoad研究,该研究的治疗时间延长一倍,但总体毒性相似,提示高剂量LAmB或可有效用于侵袭性毛霉病的治疗[33]。
3 LAmB的安全性
3.1 肾脏安全性
早期以血液病患者为主的随机对照临床试验显示,LAmB相较AmBD的肾脏安全性得到显著改善(LAmB组对 AmBD组血清肌酐峰值>0.166 5 mmol/L患者比例:12% 对 26%,P<0.001)[20]。但治疗过程中特定因素或可增加血液病患者应用LAmB时的肾损伤风险。意大利回顾性队列研究显示,血液肿瘤患者若在接受LAmB治疗同时使用环孢素,其肾损伤发生风险是未使用者的 2.62倍(95%CI:1.10~6.27,P=0.03);若在环孢素基础上加用呋塞米[≥40 mg/d,亚危险比(subhazard ratio, SHR) =5.46,95%CI:1.89~15.74,P=0.002]或膦甲酸钠(SHR=9.03,95%CI:3.68~22.14,P<0.000 1),肾损伤风险会进一步增加[34]。日本Takazono等[35]纳入643例首次接受LAmB治疗患者(半数来自血液科)的回顾性研究显示,接受过血管紧张素转换酶抑制剂/血管紧张素受体阻滞剂或碳青霉烯类治疗、同时应用儿茶酚胺或免疫抑制剂,以及≥3.52 mg·kg-1·d-1的 LAmB剂量与治疗期间发生急性肾损伤(acute kidney injury, AKI)显著相关,基线血钾<3.5 mmol/L更是与2级或3级AKI相关。文献综述分析显示,增加钠负荷可帮助预防或减轻AmB相关血清肌酐升高和肾小球滤过率降低,但对AmB相关肾小管毒性无影响[36]。但需注意的是,血液肿瘤及其相关并发症、抗肿瘤治疗均可导致肾损伤,因此血液肿瘤患者中AKI本就较为常见[37]。患者治疗时若出现肾功能变化,还需要考量多方面因素来进行综合管理。
3.2 低钾血症
电解质紊乱是血液病、恶性肿瘤患者常见并发症,严重影响患者预后和生活质量[38],因此治疗过程中患者电解质平衡也需引起临床重视。低钾血症为AmBD常见不良反应之一;相比之下,随机对照试验显示患者接受LAmB治疗时低钾血症发生率显著低于AmBD(11.6% 对6.7%,P≤0.05)[20]。日本Okada等[39]纳入78例首次接受LAmB治疗的血液病患者回顾性研究显示LAmB治疗起始2 d内开始加用钾补充剂可降低LAmB相关低钾血症发生风险(OR=0.094,95%CI:0.019~0.47)。
3.3 输液相关反应
随机对照临床试验显示,LAmB相较于AmBD可显著降低输液相关反应,例如寒战(37.6%对73.5%,P≤0.001)、呕吐(15.2%对23.5%,P≤0.01)、低血压(3.5% 对 8.1%,P≤0.01)等[20]。近期日本Yoshida等[25]前瞻性观察研究发现,成年中性粒细胞减少伴持续发热的患者接受LAmB治疗后输液相关反应发生率为8%,主要包括皮疹、发热、恶心和呕吐。早期美国观察研究显示,大多数急性输液反应发生在输液的前5 min,而所有患者在静脉注射苯海拉明后症状迅速消退[40]。
3.4 肝脏安全性
AmB不经肝脏代谢,主要经肾脏、粪便以原形排泄,因此AmB制剂对肝功能影响有限[41]。临床试验显示,LAmB与伏立康唑和卡泊芬净的肝脏安全性相当[22-23]。Yoshida等[25]前瞻性观察研究显示在接受LAmB治疗的日本成人患者中,肝脏相关不良事件发生率为11.4%,肝脏相关严重不良事件发生率仅为1.6%。
3.5 DDI
LAmB美国说明书指出其可能与以下药物存在DDI:抗肿瘤药物、皮质类固醇和促肾上腺皮质激素、洋地黄糖苷、氟胞嘧啶、唑类、白细胞输注、其他肾毒性药物和骨骼肌松弛剂[10]。与唑类药物相比,LAmB与血液疾病患者常用药物间DDI较少(表2)[42]。
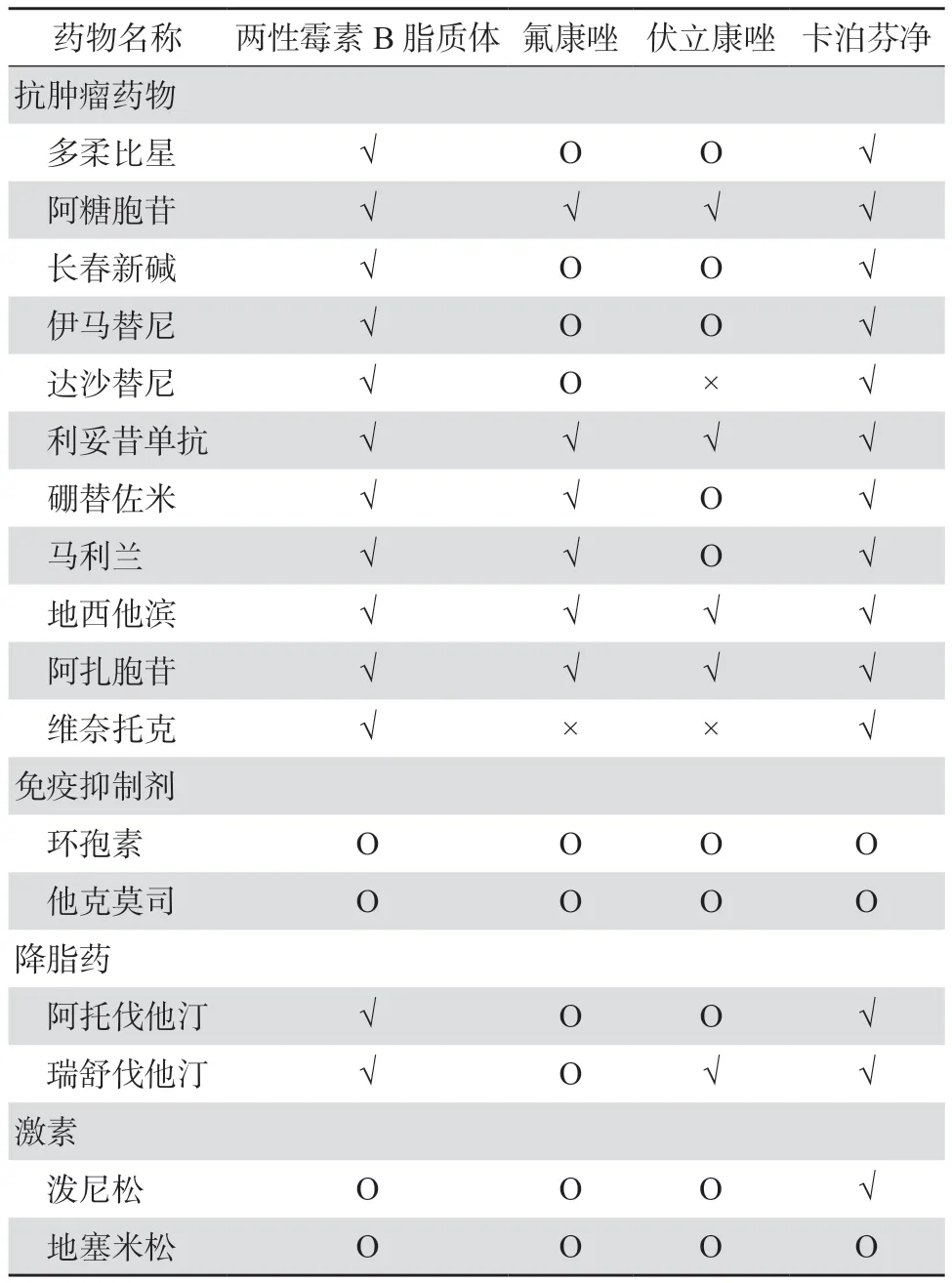
表2 抗真菌药物与血液病患者常用药物间的相互作用
4 结语
IFD是血液病患者的较常见感染性致死因素之一,有效的抗真菌治疗对改善患者预后至关重要。相较于AmBD,LAmB在肾脏毒性、输液相关反应等安全性方面有显著改善,使应用目标剂量治疗IFD成为可能;LAmB在部分患者中,如唑类禁忌证患者、经唑类预防治疗后出现突破性感染患者以及毛霉病患者等,具有独特优势。提升对LAmB临床应用系统性认识有助于血液病患者中IFD治疗的药物优化选择,改善患者预后和降低患者死亡风险。
