饲粮添加乙酸钠对奶山羊泌乳性能和瘤胃微生物区系的影响
2023-02-08王亚玲孔鹏辉袁冬冬田鑫淼蔡含芳许会芬
王亚玲 孔鹏辉 袁冬冬 田鑫淼 李 君 蔡含芳 李 明* 许会芬*
(1.河南农业大学动物科技学院,郑州 450046;2.西北农林科技大学动物科技学院,杨凌 712100;3.河南牧业经济学院动物科技学院,郑州 450046)
我国是畜牧业大国,随着人民生活水平的提高,消费者对奶制品的需求增大。羊奶因具有营养丰富、脂肪球小和易被人体吸收等特点,逐渐成为倍受欢迎的保健乳品[1-3];此外,羊奶中含有特殊的活性成分(表皮生长因子和环磷腺苷等),有助于增强抵抗力,更适于特殊人群饮用[4-5]。乳脂是羊奶的主要成分之一,主要来源于2个途径:一是乳腺上皮细胞从血液中摄取中长链脂肪酸,加工形成脂滴;二是利用瘤胃内挥发性脂肪酸(volatile fatty acid,VFA)在多种酶的作用下进行合成[6]。瘤胃是反刍动物营养物质发酵、消化和代谢的重要场所,对反刍动物营养物质消化和吸收起着至关重要的作用[7]。反刍动物饲粮中的营养物质首先通过瘤胃微生物的降解作用转化为可供机体利用的小分子物质,再进入各个系统发挥功能[8]。乙酸是瘤胃中的VFA之一,占比高达60%~70%,不仅作为乳脂合成前体物直接参与乳腺内脂肪酸的从头合成,还作为信号分子调节乳腺脂肪酸代谢,进而调控乳脂的合成[9]。Urrutia等[10]研究发现,在奶牛饲粮中添加乙酸钠可以提高乳脂产量。Matamoros等[11]进一步研究发现,乙酸钠可通过提高乳腺中从头合成脂肪酸(C≤16)的产量,显著提高奶牛的乳脂产量。然而,作为重要的代谢底物及能量供应物质,乙酸钠的添加是否也对奶山羊乳脂合成具有相似的效果,目前尚未见到报道。因此,本研究通过探索在饲粮中添加乳脂前体物乙酸钠对奶山羊泌乳性能和瘤胃微生物区系的影响,为提高羊奶品质的技术开发提供理论基础。
1 材料与方法
1.1 试验材料
试验用乙酸钠由某生物科技有限公司提供,为粉末状,食品级,纯度为99%。
1.2 试验设计
试验选用15只体重[(53.54±3.07) kg]相近、胎次(2胎次)相同且处于泌乳中期[(60±5) d]的健康西农萨能奶山羊母羊,随机分为3个组,每组5个重复。对照组饲喂基础饲粮;试验组参考乙酸钠在奶牛上的添加剂量[10],分别在基础饲粮的基础上添加30(试验Ⅰ组)和60 g/(d·头)(试验Ⅱ组)的乙酸钠。基础饲粮组成参照NRC(2007)奶山羊营养标准设计,可满足奶山羊营养需要,其组成及营养水平见表1。养殖试验于2021年5—6月在西北农林科技大学萨能羊原种场进行,试验预试期7 d,正试期21 d。每组试验羊分栏饲养,试验期间羊只自由采食和饮水,每日观察记录羊的采食情况。

表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet (DM basis) g/kg
1.3 检测指标及方法
1.3.1 泌乳性能
试验期间每天06:30和15:30进行挤奶,记录日产奶量,试验结束时计算21 d的平均值。每周采集1次奶样,将上午、下午各采集的50 mL奶样混合均匀后,采用乳成分分析仪(FOSS MilkoScanTMFT-120,美国)进行乳成分分析。
1.3.2 瘤胃液采集及瘤胃发酵参数测定
试验结束当天,选取乳脂率差异显著(P<0.05)的2组奶山羊(对照组和试验Ⅱ组),于晨饲前将瘤胃导管经口腔插入瘤胃,并用注射器采集瘤胃液于50 mL无菌离心管内,采集的瘤胃液先测定pH,然后用4层无菌纱布过滤,一部分用于检测瘤胃内VFA含量的变化,另一部分装入冻存管中于-80 ℃保存备用。
瘤胃液pH于采样现场使用便携式pH计测定。瘤胃液VFA含量的测定过程如下:将瘤胃液于4 000 r/min下离心10 min,取1 mL上清液于1.5 mL离心管中,加入0.2 mL的25%偏磷酸去蛋白溶液,混匀后冰浴30 min,在10 000 r/min下离心10 min,用一次性注射器吸取上清液,再用0.22 μm滤膜过滤到2 mL棕色样品瓶后,采用气相色谱仪器(Agilent 7890B GC System,Hewlett Packard公司,美国)检测VFA含量;其中,内标物为巴豆酸,色谱柱为AT-FFAP(30 m×0.32 mm×0.50 μm)毛细管柱,检测器温度为250 ℃,进样口温度为250 ℃,进样量为1.0 μL。
1.3.3 瘤胃微生物DNA样品提取、扩增和MiSeq测序
将冻存的瘤胃液样品送往广州基迪奥生物科技有限公司进行DNA样品提取、扩增和纯化,具体步骤为:1)将提取的DNA样品采用1.0%琼脂糖凝胶电泳观察条带有无断裂或降解,同时使用紫外分光光度计(NanoDrop 2000,Thermo公司,美国)测量A260/A280值,以确定是否存在蛋白质的污染,以此来检验DNA样品的质量。2)将样本中提取的基因组DNA,用带有barcode的特异引物扩增16S rDNA序列的V3~V4区,引物序列参考沈子亮等[12](上游引物为341F:5′-CCTACGGGNGGCWGCAG-3′;下游引物为806R:5′-GGACTACHVGGGTATCTAAT-3′)。3)随后将获得的PCR扩增产物利用AMPure XP Beads进行纯化,纯化步骤如下,加入AMPure XP磁珠试剂,磁珠与核酸结合,结合有核酸的磁珠与杂质分离,用乙醇洗涤后,加入洗脱液,转移洗脱产物,并使用Qubit 3.0荧光定量仪进行产物定量。4)将纯化的扩增产物根据浓度进行混合,连接测序接头,构建测序文库,利用Illumina PE250上机测序。
1.3.4 泌乳性能和瘤胃发酵参数与瘤胃微生物区系的相关性分析
利用GenesCloud平台(https://www.genescloud.cn),使用Spearman等级相关系数算法对瘤胃微生物区系与奶山羊日产奶量、乳脂率、乳蛋白率、乳糖率、非脂固形物含量和瘤胃发酵参数进行相关性分析。
1.4 数据统计分析
试验数据经Excel 2016初步整理后,再用SPSS 26.0进行处理分析,采用one-way ANOVA程序对泌乳性能数据进行方差分析,试验结果数据用“平均值±标准差”表示,以P<0.05作为差异显著判断标准,P<0.01作为差异极显著判断标准。
2 结果与分析
2.1 饲粮添加乙酸钠对奶山羊泌乳性能的影响
由表2可知,与对照组相比,饲粮添加乙酸钠可极显著提高奶山羊日产奶量(P<0.01),试验Ⅰ组和试验Ⅱ组分别提高了0.29和0.22 kg/d(P<0.01),但对乳蛋白率和乳糖率均无显著影响(P>0.05);同时,饲粮添加乙酸钠可极显著提高奶山羊乳脂率(P<0.01),其中试验Ⅰ组乳脂率有升高趋势,但差异不显著(P>0.05),而试验Ⅱ组乳脂率极显著提高了1.30个百分点(P<0.01);试验Ⅱ组乳中非脂固形物含量提高了3.10%(P>0.05)。因此,后续选择对照组和试验Ⅱ组奶山羊进行瘤胃微生物组成和结构的分析。
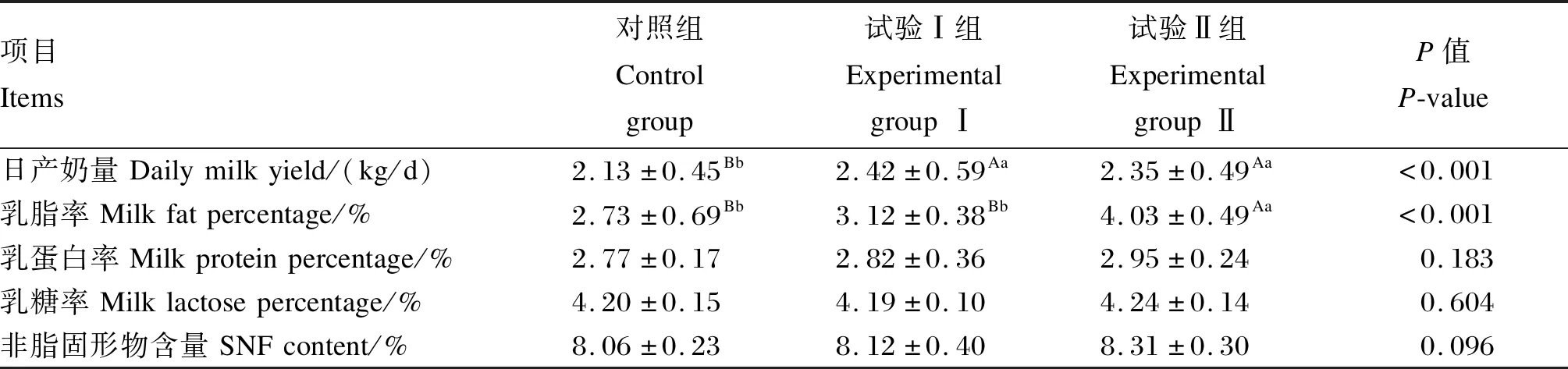
表2 饲粮添加乙酸钠对奶山羊泌乳性能的影响Table 2 Effects of dietary sodium acetate on lactation performance of dairy goats
2.2 饲粮添加乙酸钠对奶山羊瘤胃发酵参数的影响
由表3可知,与对照组相比,试验Ⅱ组奶山羊瘤胃pH和乙酸、丙酸、异丁酸、戊酸、异戊酸、总挥发性脂肪酸(TVFA)含量以及乙酸/丙酸值均无显著差异(P>0.05),而瘤胃丁酸含量极显著降低(P<0.01)。

表3 饲粮添加乙酸钠对奶山羊瘤胃发酵参数的影响Table 3 Effects of dietary sodium acetate on rumen fermentation parameters of dairy goats
2.3 饲粮添加乙酸钠对奶山羊瘤胃微生物区系的影响
2.3.1 饲粮添加乙酸钠对奶山羊瘤胃微生物α多样性的影响
由表4可知,与对照组相比,试验Ⅱ组奶山羊瘤胃微生物的Sobs指数、Chao1指数和Ace指数显著提高(P<0.05),试验Ⅱ组瘤胃微生物的覆盖度极显著降低(P<0.01)。

表4 饲粮添加乙酸钠对奶山羊瘤胃微生物α多样性的影响Table 4 Effects of dietary sodium acetate on α diversity of rumen microbiota of dairy goats
2.3.2 饲粮添加乙酸钠对奶山羊瘤胃微生物β多样性的影响
应用Jaccard相似度算法在操作分类单元(OTU)水平上对所有样品进行非度量多维尺度(NMDS)分析(图1-A),可以看出2组样品明显聚为2类,说明2组奶山羊的瘤胃微生物区系存在明显差异。相似性分析(ANOSIM)结果也表明,奶山羊瘤胃微生物的结构存在显著差异(图1-B,P<0.05)。
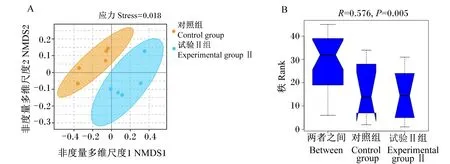
图1 奶山羊瘤胃微生物OTU水平的非度量多维尺度分析(A)和相似性分析(B)Fig.1 NMSD analysis (A) and ANOSIM (B) of rumen microbiota at OTU level of dairy goats
2.3.3 饲粮添加乙酸钠对奶山羊瘤胃微生物组成的影响
如图2所示,在门水平上共检测到21个菌群,其中有20个门水平的菌群是2组奶山羊瘤胃微生物的共有菌群,1个门水平的菌群是试验Ⅱ组奶山羊瘤胃微生物独有的菌群(图2-A);拟杆菌门(Bacteroidetes,对照组相对丰度为43.93%,试验Ⅱ组相对丰度为48.93%)和厚壁菌门(Firmicutes,对照组相对丰度37.77%,试验Ⅱ组相对丰度为36.86%)是2组奶山羊瘤胃微生物的优势菌门(图2-C)。在属水平上共检测到163个菌群,其中有123个属水平的菌群是2组奶山羊瘤胃微生物的共有菌群,24个属水平的菌群是对照组组奶山羊瘤胃微生物独有的菌群,16个属水平的菌群是试验Ⅱ组奶山羊瘤胃微生物独有的菌群(图2-B);2组奶山羊的优势菌属是普雷沃氏菌属1(Prevotella_1,对照组相对丰度为22.42%,试验Ⅱ组相对丰度19.16%)(图2-D)。
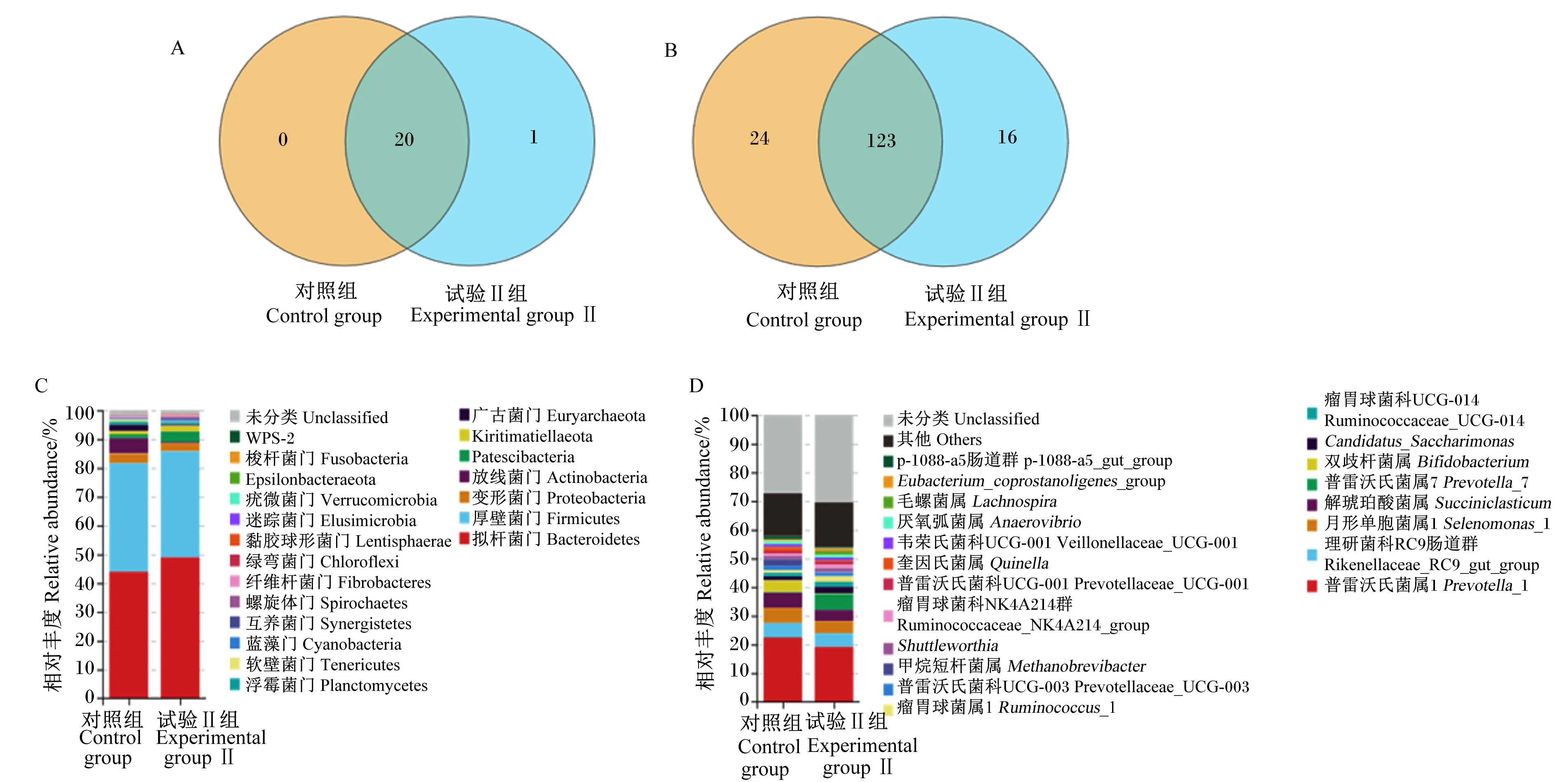
A:门水平Venn图 Venn diagram at phylum level;B:属水平Venn图 Venn diagram at genus level;C:门水平的群落结构 community structure at phylum level;D :属水平的群落结构 community structure at genus level。图2 饲粮添加乙酸钠对奶山羊瘤胃微生物组成的影响Fig.2 Effects of dietary sodium acetate on rumen microbiota composition of dairy goats
2.3.4 饲粮添加乙酸钠对奶山羊瘤胃微生物差异物种的影响
如图3所示,在属水平上,试验Ⅱ组奶山羊瘤胃中的瘤胃球菌属1(Ruminococcus_1)、瘤胃球菌科UCG-005(Ruminococcaceae_UCG-005)、普雷沃氏菌科UCG-004(Prevotellaceae_UCG-004)和Lachnoclostridium_12等4个菌群的相对丰度显著高于对照组(P<0.05),而瘤胃中的解琥珀酸菌属(Succiniclasticum)和甲烷短杆菌属(Methanobrevibacter)的相对丰度显著低于对照组(P<0.05)。

图3 饲粮添加乙酸钠对奶山羊瘤胃微生物差异物种的影响Fig.3 Effects of dietary sodium acetate on different species in rumen microbiota of dairy goats
2.4 奶山羊泌乳性能和瘤胃发酵参数与瘤胃微生物区系的相关性分析
如图4所示,在本试验中,奶山羊日产奶量与瘤胃球菌科UCG-013(Ruminococcaceae_UCG-013)相对丰度呈显著正相关(P<0.05),与Lachnoclostridium_1相对丰度呈极显著负相关(P<0.01);乳脂率与瘤胃球菌属1相对丰度呈显著正相关(P<0.05),与瘤胃球菌科UCG-005和Lachnoclostridium_12相对丰度呈极显著正相关(P<0.01),与解琥珀酸菌属相对丰度呈显著负相关(P<0.05),与甲烷短杆菌属相对丰度呈极显著负相关(P<0.01);乳蛋白率和非脂固形物含量与月形单胞菌属1(Selenomonas_1)相对丰度呈显著负相关(P<0.05);另外,瘤胃中乙酸含量与瘤胃球菌科UCG-005相对丰度呈显著正相关(P<0.05),瘤胃中丁酸含量与瘤胃球菌科UCG-005和Lachnoclostridium_12相对丰度呈极显著负相关(P<0.01)。
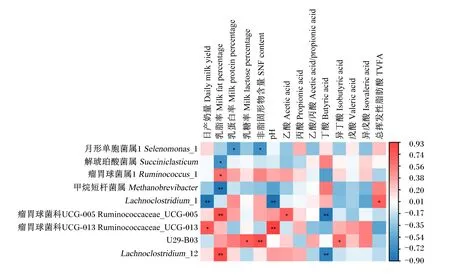
*表示P<0.05,**表示P<0.01。* mean P<0.05,and ** mean P<0.01.图4 奶山羊泌乳性能和瘤胃发酵参数与瘤胃微生物区系的关联热图Fig.4 Heat map of correlations between lactation performance &rumen fermentation parameters and rumen microbiota of dairy goats
3 讨 论
3.1 饲粮添加乙酸钠对奶山羊泌乳性能的影响
乙酸是胃肠道微生物发酵的主要产物之一,其不仅作为乳脂合成的前体物质直接参与乳腺内脂肪酸的从头合成,而且还作为信号分子调节乳腺脂肪酸代谢,进而调控乳脂的合成[13]。研究表明,在泌乳奶牛饲粮中添加2-羟基-4-丁酸和乙酸盐可以提高牛奶中乳蛋白和乳脂的含量[14-15],本试验与此结果一致。Matamoros等[11]研究也发现,在奶牛饲粮中添加3.25%乙酸盐显著提高了牛奶中的乳脂含量。Ali等[16]在牛乳腺上皮细胞中的研究发现,乙酸盐和β-羟基丁酸盐以剂量依赖性的方式促进胞浆甘油三酯的合成及脂滴的形成。进一步的研究结果表明,乙酸盐可通过哺乳动物雷帕霉素靶蛋白(mTOR)/真核细胞起始因子4E(eIF4E)信号通路以剂量依赖性的方式增加奶牛乳腺上皮细胞中的乳脂合成[17]。本研究结果发现,饲粮添加乙酸钠后不仅促进了奶山羊乳脂的合成,也提高了奶山羊的日产奶量,试验Ⅰ组和试验Ⅱ组日产奶量分别提高了0.29和0.22 kg/d。根据某地山羊奶收购价为6元/kg,购买的乙酸钠价格为8元/kg,因此经济效益分别增加了1.50和0.84元/(头·d)。乳脂率和非脂固体物含量的增加,可能是由于饲粮添加乙酸钠增加了乳腺中乳脂前体物的供应,从而促进了乳腺乳脂的从头合成。另外,还有研究表明乙酸盐可以通过组蛋白乙酰化促进脂质合成基因表达,Hsieh等[18]研究发现葡萄糖饥饿能诱导组蛋白乙酰基的开关,从而激活糖异生和脂肪代谢基因的表达。但是,在反刍动物中是否也同样存在这种调控机制,仍有待进一步验证。
3.2 饲粮添加乙酸钠对奶山羊瘤胃发酵参数的影响
瘤胃pH是反映瘤胃发酵参数的重要指标,主要受饲粮组成的影响,并且在发酵模式和微生物区系中发挥着关键作用[19],其正常变化在5.5~7.5。本研究中,对照组和试验Ⅱ组奶山羊瘤胃液pH分别为6.63和6.96,均在正常范围内,这表明饲粮添加乙酸钠对瘤胃微生物发酵状态没有影响。瘤胃VFA是反刍动物的主要能量来源,主要包括乙酸、丙酸和丁酸等,可为机体氧化供能或用于脂质合成[20]。本试验中,饲粮添加乙酸钠后发现奶山羊瘤胃乙酸和丙酸含量有所提高,瘤胃丁酸含量极显著降低。乙酸含量增加的原因可能是因为乙酸钠改善了瘤胃发酵,促进了碳水化合物在瘤胃中的降解[21]。梁胜男等[22]研究发现,产丁酸的细菌主要是厚壁菌门,本研究中,丁酸含量降低可能是由于厚壁菌门细菌数量减少所致。
3.3 饲粮添加乙酸钠对奶山羊瘤胃微生物区系的影响
大量研究结果表明,厚壁菌门和拟杆菌门是反刍动物和部分单胃动物肠道内主要的优势菌门。郭文杰等[23]和李永洙等[24]研究发现,牦牛和山羊肠道内的优势菌门均为厚壁菌门和拟杆菌门,与本研究结果一致。本试验结果表明,饲粮添加乙酸钠提高了奶山羊瘤胃拟杆菌门等的相对丰度,降低了厚壁菌门、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)等的相对丰度,但差异不显著。研究发现,拟杆菌门是促进动物利用碳水化合物的最主要菌群,厚壁菌门是促进动物胃肠道微生物分解纤维素的最主要菌群[25-26],由此说明,饲粮添加乙酸钠可能增加了拟杆菌门内分解碳水化合物的菌群。本研究还发现,普雷沃氏菌属1是奶山羊瘤胃微生物中相对丰度最高的菌属,这与Petri等[27]和逄宾宾等[28]的研究结果一致。普雷沃氏菌属属于拟杆菌门,在瘤胃中分布广泛、数量多,包括半纤维素分解菌和蛋白分解菌,可降解植物性半纤维素、蛋白质和非纤维多糖等,并参与多种微生物代谢[29]。本研究中,试验Ⅱ组奶山羊瘤胃中的瘤胃球菌属1、瘤胃球菌科UCG-005、普雷沃氏菌科UCG-004和Lachnoclostridium_12的相对丰度显著高于对照组,而瘤胃解琥珀酸菌属和甲烷短杆菌属的相对丰度显著低于对照组。Pan等[30]研究发现,瘤胃球菌属1与乙酸产生有关,瘤胃球菌科UCG-005属于瘤胃球菌科(Ruminococcaceae)的一个亚型。Nava等[31]研究发现,瘤胃球菌科具有许多有益的生理功能,包括加强肠道屏障功能和免疫调节。而普雷沃氏菌科UCG-004属于拟杆菌门,胡丹丹等[32]研究发现拟杆菌门含有丰富的水解淀粉蛋白,可以起到高效降解纤维素的作用。解琥珀酸菌属不发酵碳水化合物、氨基酸或单、双及三羧酸,琥珀酸是其唯一能发酵的底物,并且只产生丙酸。微生物在瘤胃发酵过程中会产生大量的气体(如二氧化氮和氢气),甲烷短杆菌属是一种含有氢营养古菌属,能将体内的二氧化碳通过大量氢气还原为甲烷,并参与生产不饱和脂肪酸,但利用率较低[33]。由此说明,饲粮添加乙酸钠可增加奶山羊瘤胃中有益微生物的数量,促进碳水化合物的分解。综上可知,饲粮添加乙酸钠可以提高奶山羊瘤胃中瘤胃球菌属1、瘤胃球菌科UCG-005和普雷沃氏菌科UCG-004等产短链脂肪酸微生物的相对丰度,并降低甲烷短杆菌属的丰度从而降低甲烷排放。
3.4 奶山羊泌乳性能和瘤胃发酵参数与瘤胃微生物区系的相关性分析
在反刍动物的瘤胃中,占比最高的VFA是乙酸,其生成受到瘤胃微生物的调节作用,本研究发现,奶山羊瘤胃乙酸含量与瘤胃球菌科UCG-005相对丰度呈显著正相关。大量研究发现,反刍动物中瘤胃微生物组成和丰度与乳脂率密切相关[34-36]。瘤胃微生物将摄入的碳水化合物发酵形成VFA,其中大部分乙酸被瘤胃上皮细胞吸收进入血液,经三羧酸循环作用合成脂肪酸,为乳腺合成乳脂提供前体物,并最终影响乳脂含量的高低[37]。本研究发现,饲粮添加乙酸钠对奶山羊瘤胃微生物组成和结构有一定的影响,这与Liu等[38]研究发现外源添加支链短链脂肪酸可以促进犊牛瘤胃发酵的结果一致。Song等[39]研究表明,乙酸及其他短链脂肪酸与瘤胃微生物之间的关系是相辅相成的,前者既可以促进有益菌群的生长,同时这些有益菌群的增长也会刺激乙酸等合成的增加。研究表明,瘤胃球菌属1、瘤胃球菌科UCG-005和Lachnoclostridium_12均具有产生短链脂肪酸的能力[40-43]。本研究结果也表明,奶山羊瘤胃中这3种菌相对丰度均与乳脂率呈正相关,且解琥珀酸菌属和甲烷短杆菌属相对丰度与乳脂率呈负相关。以上结果表明,乙酸钠对奶山羊泌乳性能的提高作用可能部分是通过调控瘤胃微生物区系来实现的,然而具体是何种微生物发挥主要作用及其影响泌乳性能的机制还有待进一步研究。
4 结 论
饲粮添加60 g/(d·头)乙酸钠可显著提高奶山羊日产奶量和乳脂率,显著降低瘤胃丁酸含量,并通过改善瘤胃微生物组成和结构提升奶山羊泌乳性能。
