丁酸对母猪繁殖性能的影响及其机制
2023-02-08鲁春灵黄建奎
鲁春灵 冯 斌 黄建奎
(1.四川农业大学动物营养研究所,成都 611130;2.广西商大科技股份有限公司,南宁 530105)
近年来随着母猪品种的改良及管理水平的提高,国内猪场母猪平均窝总产仔数已超过14头,但平均有效活产仔数却不到12头(去除弱仔),这导致我国每头母猪年提供断奶仔猪数不到24头,远低于欧美水平(数据来源《2021年全国猪业数据报告》),这也成为限制我国生猪养殖产业发展的重要技术瓶颈。同时,低繁殖效率客观上导致更多的母猪需求,这对饲料供应和环境保护造成巨大压力。
随着短链脂肪酸(short chain fatty acid,SCFA)的受体——G蛋白偶联受体(G protein-coupled receptor,GPCR)在胎膜和子宫血管中被发现,近年来SCFA对母猪繁殖性能的影响研究受到了关注。研究发现,饲粮中添加SCFA可以提高母猪平均日采食量、仔猪窝增重和断奶重等,缩短产程和发情间隔。但是关于丙酸和乙酸调控母猪繁殖性能的研究较少,且具体机制尚不清楚,而对丁酸盐的研究相对较多。因此,本文重点阐述丁酸对母猪繁殖性能的影响及其可能机制。
1 丁酸概述
丁酸是含4个碳原子的羧酸,主要是由肠道微生物群中的厚壁菌门微生物利用不可溶纤维素、抗性淀粉类等难以消化的碳水化合物发酵形成。丁酸占单胃动物肠道产生SCFA的20%左右,其在盲肠和在近端结肠组织中的含量较高,并且在越往后段肠道中其含量会逐步减少。高含量的丁酸首先被肠道吸收并经过肝门静脉窦进入全身血液循环,然后在肝脏组织以及外周组织器官中进行代谢,从而转化为营养物质和信号分子来调节机体正常的生理活动。丁酸被肠上皮细胞吸收后,一部分可被结肠和肝脏代谢为乙酰辅酶A或丙酰辅酶A,然后通过三羧酸(tricarboxylic acid,TCA)循环为机体供能,其化学计量学遵循一般的方程:57.5C6H12O6+45H2O→65乙酸+20丙酸+15丁酸+140H2+95CO2+288ATP[1]。
丁酸可通过扩散或跨膜转运的方式被肠上皮细胞吸收。其中,最重要的丁酸转运载体是细胞膜囊泡内的单羧酸转运载体(monocarboxylate transporter,MCT),如MCT1和钠离子偶联单羧酸转运蛋白(sodium coupled monocarboxylate transporter,SMCT)[2-3]。SMCT1在小鼠大肠中优先转运丁酸盐[4],转运蛋白MCT1和SMCT1从肠腔吸收丁酸,而基底外侧MCT4和MCT5将丁酸转运出细胞(图1)[5]。

MCT:单羧酸转运载体 monocarboxylate transporter;SMCT:钠离子偶联单羧酸转运蛋白 sodium coupled monocarboxylate transporter。图1 结肠吸收丁酸的示意图Fig.1 Schematic diagram of butyrate absorption in colon
丁酸可以激活短链游离脂肪酸受体(free fatty acid receptor,FFAR)2(GPR43)和FFAR3(GPR41)[6],GPCR在不同组织的免疫细胞以及对代谢调节至关重要的上皮细胞和内分泌细胞中均有表达。在黏膜中,丁酸可以进入毛细血管,并经门静脉到达肝脏。肝脏从门静脉循环中吸收了大部分丁酸用于合成酮体[7]。
2 丁酸对母猪繁殖性能的影响
丁酸受体GPR41和GPR43在胎盘、羊膜、绒毛膜和子宫肌层组织中均被发现。在胎盘合体滋养层和胎儿血管中的免疫细胞中检测到GPR43。在绒毛膜中,GPR43定位于羊膜上皮、绒毛膜滋养细胞和绒毛膜中胚层内的巨噬细胞。研究表明,GPR41和GPR43的mRNA在产妇分娩后的子宫肌层和胎膜上皮中的免疫细胞和血管内皮中高表达[8]。
2.1 丁酸对后备母猪繁殖性能的影响
母猪在受精后返情会给养殖业造成巨大的经济损失。He等[9]在160~175日龄后备母猪配种前1个月开始饲喂0.5 g/kg的丁酸钠(sodium butyrate,SB),结果发现受精后的后备母猪复情率降低,表明SB在一定程度上可以调节母猪的受精过程,但其机制尚不清楚。体外研究表明,用SB处理猪卵母细胞2 h可提高卵母细胞成熟率,并促进囊胚形成[10-11]。此外,丁酸盐还可以促进胚胎血红蛋白的生成,增强脐血携氧能力,提高胚胎着床能力[12]。
孕酮在妊娠的建立和维持以及分娩的开始中起着至关重要的作用,可以提高胚胎植入率、降低流产和早产的风险[13]。排卵前雌二醇浓度的增加可以增加妊娠成功率[14]。丁酸可通过环腺苷酸(cAMP)信号通路调控猪颗粒细胞中孕酮和雌二醇激素的合成[15]。对妊娠期母鼠注射1 g/kg SB,结果表明,SB可通过调节磷脂代谢和卵巢孕酮合成,降低妊娠损失,预防流产[16]。综上可知,SB可能通过提高后备母猪的受精率,促进卵泡发育和雌激素的分泌来提高后备母猪的繁殖性能。
2.2 丁酸对妊娠母猪繁殖性能的影响
妊娠母猪过肥会造成难产,为了确保其健康生产,防止孕酮分泌不足、体况过肥,生产上常常采用限饲管理方式。但是限饲不当又会引起母猪便秘、产仔数少等弊端。研究表明,SB有助于维持肠道完整性和屏障功能,提高营养物质消化率[17]。饲粮添加0.5 g/kg SB可提高母猪妊娠后期的平均日采食量,降低体重损失[18]。另有研究发现,饲喂微囊SB可缩短产程[19],而添加1.5 g/kg丁酸钾(丁酸盐含量为80%)和1.5 g/kg微囊包膜SB(丁酸盐含量为30%)对母猪繁殖性能未产生显著影响[20]。方翠林[21]研究表明,饲粮添加0.5 g/kg包膜SB可显著提高母猪机体抗应激和免疫能力,使得乳汁的质量得到改善,进而提高后代的生长性能。以上研究表明,相同形式的丁酸盐作用于妊娠母猪和泌乳母猪会产生不同效果,这可能与母猪自身的生理变化有关。SB还可以通过影响胎盘来提高妊娠母猪的繁殖性能。有研究发现,SB可显著降低大鼠血压和炎症因子[白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和转化生长因子-β(TGF-β)]表达水平,增加胎儿数和提高胎盘重量及肠屏障标志物[闭锁小带蛋白-1(ZO-1)、封闭蛋白-5(claudin-5)和闭合蛋白(occludin)]的表达水平[22]。
2.3 丁酸对泌乳母猪繁殖性能的影响
母猪初乳中含有蛋白质、脂质、乳糖和生物活性物质等,初乳的质量和产量直接影响后代仔猪生长存活。研究表明,饲粮添加SB可提高母猪的泌乳量和乳脂含量[21],这可能与SB能作用于乳腺细胞,促进乳腺发育有关,但其具体机制尚不清楚。也有研究表明,饲粮添加包膜SB对哺乳期母猪的繁殖性能和仔猪的生产性能无显著影响[23],这可能与SB的添加量有关。从初产母猪妊娠第90天至泌乳,每日添加6 g微囊SB,可显著降低初生弱仔数和木乃伊数,提高初生重和窝重,从而提高母猪繁殖性能[24]。饲粮添加0.5~1.0 g/kg微囊SB能够提高母猪泌乳期采食量和断奶仔猪窝重,减少分娩助产比例及缩短产程和断奶后的发情间隔[25-26]。综上可知,SB通过提高泌乳母猪的采食量改善泌乳母猪的繁殖性能,间接影响产程和发情间隔,并通过提高乳品质来促进后代仔猪的生长性能。饲粮添加丁酸盐对母猪繁殖性能的影响相关研究[9-11,15,18-19,21,24-28]见表1。

表1 饲粮添加丁酸盐对母猪繁殖性能的影响Table 1 Effects of dietary butyrate on reproductive performance of sows
3 丁酸影响母猪繁殖性能的分子机制
3.1 抗氧化途径
氧化应激会导致蛋白硝基化,而酶、受体、转运蛋白和结构蛋白硝化可能会影响生理和病理环境中的胎盘功能[29]。妊娠母猪在胚胎附植前7 d的过程中持续处在低氧环境中,而胚胎附植后,由于胎盘血液循环的建立,使得胎儿从低氧进入高氧环境,胎盘离子稳态失衡导致氧化应激,严重的氧化应激会引起母猪早产、流产、木乃伊、死胎和胎儿宫内生长受限等妊娠疾病[30-31]。
长沙为湖南省省会,位于湖南的东部偏北,坐标为 111°53′—114°5′E,27°51′—28°40′N,属亚热带季风性湿润气候,春、夏季冷暖气流交汇频繁,容易产生强对流天气及雷暴活动。长沙地区年平均气温为17.4 ℃,年平均降水总量为 1 475.7 mm,平均降水日数为 154.7 d,年平均雷暴日为 47.7 d,属多雷区。 据不完全统计,2002—2017年长沙地区共计发生雷电灾害事故1 807起,造成22人死亡,30人受伤,直接经济损失1 584.92万元。
丁酸与转录因子核因子-κB(NF-κB)和核因子E2相关因子2(Nrf2)相互作用,发挥抗氧化和抗炎作用[32]。氧化应激可以破坏细胞内的氧化还原水平,进而抑制/激活几种信号分子和信号通路,例如Kelch样环氧氯丙烷相关蛋白1(Keap1)-Nrf2-抗氧化反应元件(ARE)信号通路、NF-κB信号通路等,进而调控机体的生理功能[33]。NF-κB是一种诱导型转录因子,是氧化的直接靶标,可以保护机体免受氧化应激,其也是丁酸的靶点。研究表明,SB可以上调结肠细胞中编码NF-κB抑制因子(IκB)的基因表达,抑制NF-κB活化,能有效减少过氧化氢(H2O2)和氧化应激对DNA的损伤[34]。
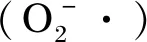
3.2 抗炎途径
在妊娠期间,母猪的生理状况和免疫功能都发生了巨大变化。母猪血液中的促炎因子肿瘤坏死因子-α(TNF-α)和IL-6表达水平显著升高,进而参与许多疾病,包括流产和宫内生长迟缓(IUGR)。此外,妊娠期通过肠道屏障进入体循环的细菌脂多糖(lipopolysaccharide,LPS)增加,体循环中LPS含量的增加可导致代谢性内毒素血症。因此,在妊娠中后期和哺乳期,减少炎症反应并确保母猪正常的代谢和免疫反应,对母猪及其后代的生产性能至关重要。
丁酸通过结合GPCR和催化位点中的锌离子(Zn2+)降低HDAC的活性,进而下调炎症相关因子,如磷脂酰肌醇(3,4,5)-三磷酸、磷脂酶C、丝裂原活化蛋白激酶(MAPK)、磷脂酶A2、Nod样受体蛋白3以及cAMP的水平[38],提高转录因子叉头蛋白3(Foxp3)的表达[39],进而减少炎症和病原体浸润,维持肠道屏障完整性,提高Treg细胞的增殖和活性,增强先天免疫功能[39-41]。丁酸作用于肠上皮细胞的GPCR,能够诱导T细胞和巨噬细胞的增殖分化,增强机体免疫能力。转录因子NF-κB与Toll样受体(TLR)结合,在转录水平上控制多种炎症基因的表达,包括TNF-α和IL-6等。丁酸通过抑制NF-κB活性来减少TNF-α的产生[42]。研究发现,饲粮中添加1 g/kg SB可以提高母猪血清中白细胞介素-10(IL-10) mRNA表达,降低TLR4 mRNA表达和仔猪腹泻率[26]。此外,SB可通过降低初乳中TNF-α的水平和提高初乳中免疫球蛋白A的含量来提高新生仔猪的免疫功能[9]。以上研究结果表明,丁酸盐通过提高抗炎因子水平,降低促炎因子水平,从而发挥抗炎功能。又有研究发现,1 mmol/L SB可以激活TLR4信号通路,缓解LPS诱导的炎症反应[43]。炎性体NOD样受体热蛋白结构域相关蛋白3(NLRP3)能够促进炎性细胞因子分泌[44],而H3K9ac有利于抗炎细胞因子的转录[45]。用SB处理牛巨噬细胞发现,0.25 mmol/L SB显著降低了LPS诱导的NLRP3表达,而1.00 mmol/L SB显著增加H3K9ac蛋白的表达[46]。综上可知,SB主要通过抑制HDAC和NF-κB活性来提高免疫细胞活性,修复LPS等诱导的黏膜损伤,提高母猪的繁殖性能。
3.3 供能途径
丁酸作为结肠上皮细胞主要的能量来源物质,70%~90%被结肠细胞代谢,可为机体提供约6%的维持净能[49]。而这与母猪分娩时产程缩短密切相关,从而提高母猪的繁殖性能。前文提到SB可提高妊娠和泌乳母猪平均日采食量,在目前母猪低能量、高蛋白质的饲粮组成上,增加能量摄入可以增加泌乳期母猪营养储备[50],减少能量不足对母猪体况的不利影响,从而提高母猪的繁殖性能。丁酸作为能量来源作用于炎症性肠病患者,使结肠MCT1显著下调,而使葡萄糖转运蛋白1(GLUT1)上调,表明丁酸可转换为葡萄糖并通过TCA循环为机体供能[38]。SCFA作为分娩前子宫的能量来源[51],可以缩短分娩时间以减少死产[19]、改善初乳成分和产量[26]。丁酸调控母猪繁殖性能的可能分子机制见图2。
3.4 激素调节途径
瘦素由脂肪组织分泌[52],不仅参与能量稳态,还具有调节生殖、造血的作用[53]。在胎盘中,瘦素是炎症和免疫反应的关键调节因子[54-55]。胎盘瘦素表达过高,会增加妊娠期糖尿病和子痫前期的患病几率;瘦素表达过低伴随着胎盘抗炎功能下降[56]。瘦素还能促进骨髓、红细胞和淋巴细胞的生成,并可能促进胎儿免疫系统的成熟[57]。丁酸被证明可以减少炎症,调节细胞增殖和分化,并诱导瘦素释放[58]。丁酸通过激活FFAR2和FFAR3促进脂肪细胞瘦素分泌[59-62]。进一步研究发现,丁酸通过GPR41刺激脂肪细胞中瘦素的产生[63-64],丁酸刺激胰高糖素样肽-1的释放,通过抑制诱食因子刺鼠色蛋白相关蛋白/神经肽Y(AgRP/NPY),促进瘦素受体的表达,调节AMPKα和细胞因子信号转导抑制因子3来抑制食欲[65],而这有利于妊娠期对母猪的限饲。

LPS:脂多糖 lipopolysaccharide;TLR4:Toll样受体4 Toll-like receptor 4;GPCR:G蛋白偶联受体 G protein-coupled receptor;NF-κB:核因子-κB nuclear factor-kappa B;Nrf2:核因子E2相关因子2 nuclear factor E2 related factor 2;ARE:抗氧化反应元件 antioxidant response element;HDAC:组蛋白去乙酰化酶 histone deacetylase。图2 丁酸调控母猪繁殖性能的可能分子机制Fig.2 Possible regulatory molecular mechanisms of butyric acid on reproductive performance of sows
皮质醇属于肾上腺皮质激素,其受体几乎存在于身体的所有细胞中,影响生殖和免疫[66]。下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA轴)调节皮质醇的产生和分泌[67-68]。在氧化应激刺激后,血浆皮质醇浓度会在几分钟内升高,进而削弱免疫系统[69]。丁酸调控中性粒细胞、树突状细胞和巨噬细胞等的多样化、动员和激活[70],修复肠道屏障,阻断细菌和细菌产物的扩散,还可以减少局部和全身炎症[71],影响HPA轴对皮质醇的分泌[72-74]。
妊娠期胰岛素敏感性降低与促肾上腺皮质激素释放激素(CRH)和皮质醇增加有关。胎盘CRH通过激活胎儿HPA轴可触发分娩,胎盘CRH浓度升高、正常或降低分别与早产、足月和晚产有关[75]。在妊娠后期,胎儿HPA轴的活性增强,胎盘源性CRH在母体循环中进行性增加,导致皮质醇循环浓度相对增加进而提高EPI浓度,造成不良妊娠结局[76]。研究发现,早产、IUGR和子痫前期的患者胎盘CRH和皮质醇浓度较高[77]。丁酸可以减弱HPA轴的反应,使CRH水平正常化[78]。
4 小 结
饲粮中添加0.5~3.0 g/kg丁酸可通过Keap1-Nrf2-ARE和NF-κB信号通路提高抗氧化能力,以及缓解炎症反应、调节妊娠母体内激素分泌和能量代谢等方式来提高母猪繁殖性能。但也有研究显示,其并未对母猪繁殖性能有作用,造成这种差异的结果可能与猪的品种和生长阶段、养殖周期以及丁酸盐添加形式有关,后续可以扩大丁酸盐添加水平梯度和时间维度来开展进一步研究。丁酸对母猪繁殖性能的影响的具体机制也有待进一步研究。
