肝细胞癌患者外周血CD100的表达变化及其对T淋巴细胞的功能调控
2023-02-08范慧娟
范慧娟, 宋 淳
空军军医大学第二附属医院 消化内科, 西安 710038
肝细胞癌(HCC)发病率在我国居所有恶性肿瘤第5位,死亡率居第2位[1]。免疫因素参与了HCC的发病过程,HCC发生发展过程中可诱导机体T淋巴细胞功能衰竭,免疫细胞丧失有效抗肿瘤活性,处于失能状态,造成HCC疾病进展[2]。但有关HCC患者T淋巴细胞失能及功能调控的机制尚未完全阐明。CD100是免疫信号素家族成员之一,又称为Sema4D,在机体内具有两种生物学活性形式,即:可溶型CD100(soluble CD100, sCD100)和膜型CD100(membrane-bound CD100, mCD100),在慢性肝炎病毒感染、慢加急性肝衰竭、恶性肿瘤等疾病过程中存在sCD100和mCD100失衡,造成机体免疫紊乱[3-6]。但有关CD100在HCC中的表达变化及其对T淋巴细胞功能的调控作用尚未见相关报道。因此,本研究检测HCC患者外周血sCD100和T淋巴细胞表面mCD100水平,观察重组人CD100体外刺激对HCC患者T淋巴细胞功能的影响,初步探讨CD100在HCC发病中的作用。
1 资料与方法
1.1 研究对象 前瞻性选择2020年4月—2021年7月在本院就诊的57例HCC患者作为研究对象。入组标准:(1)年龄≥18岁且<70岁;(2)符合《原发性肝癌诊疗规范(2019年版)》[7]中提出的诊断标准;(3)采集血液标本前未接受手术、介入、靶向、免疫等治疗。排除标准:(1)合并人获得性免疫缺陷病毒感染;(2)合并自身免疫性疾病;(3)合并心脏、肺脏、肾脏、中枢神经系统等重要脏器功能衰竭;(4)合并其他恶性肿瘤;(5)妊娠期或哺乳期妇女。选择同时期在本院健康查体的22例健康人作为对照。
1.2 主要试剂和仪器 淋巴细胞分离液、佛波酯、伊乌诺霉素(美国Sigma公司);CD100酶联免疫吸附试验(ELISA)试剂盒(武汉华美公司);重组人CD100(北京ACRO公司);小鼠抗人CD3-PE Cy7(克隆SK7)、小鼠抗人CD4-FITC(克隆RPA-T4)、小鼠抗人CD8-APC Cy7(克隆SK1)、小鼠抗人CD100-Alexa Fluor 647(克隆A8)、小鼠抗人干扰素γ(IFNγ)(克隆4S.B3)、小鼠抗人白细胞介素-17A(IL-17A)-PerCP Cy5.5(克隆N49-653)、小鼠抗人IL-22-PE(克隆MH22B2)、BD GolgiStop蛋白转运抑制剂、BD Cytofix固定液、BD Perm/Wash破膜洗涤缓冲液(美国BD Pharmingen公司);细胞增殖检测Cell Counting Kit-8(CCK-8)试剂盒(武汉碧云天公司);人穿孔素酶联斑点吸附试验(enzyme-linked immunospot assay, ELISPOT)试剂盒和人颗粒酶B ELISPOT试剂盒(美国Abcam公司);MagCellect人CD8+T淋巴细胞纯化试剂盒(美国R&D公司);乳酸脱氢酶(LDH)细胞毒性检测试剂盒(武汉碧云天公司);微孔读板仪(美国伯乐公司);FACS AriaⅡ流式细胞仪(美国BD Bioscience公司);ELISPOT读板仪(德国AID公司)。多肽由上海生工公司合成。
1.3 方法
1.3.1 血浆和外周血单个核细胞(peripheral blood mononuclear cells, PBMC)分离 清晨空腹采集10 mL抗凝外周血,于1000 r/min离心10 min后收集上层血浆,冻存于-80 ℃。使用淋巴细胞分离液、采用密度梯度离心法分离PBMC,冻存于液氮。
1.3.2 ELISA法检测sCD100 使用CD100 ELISA检测试剂盒对血浆中sCD100水平进行检测。向检测孔中加入100 μL标准品和血浆样本,于37 ℃孵育2 h,弃液体后直接加入100 μL生物素标记工作抗体,于37 ℃孵育1 h,弃液体洗板3次后加入100 μL辣根过氧化物酶标记亲和素,于37 ℃孵育1 h,弃液体洗板5次后加入90 μL TMB底物,于37 ℃避光孵育30 min,加入50 μL终止液,轻轻混匀后在450 nm波长处读取吸光度,根据标准品吸光度绘制标准曲线,计算血浆sCD100浓度。
1.3.3 PBMC刺激培养 复苏PBMC,使用RPMI1640+10%胎牛血清于37 ℃、5%CO2条件下培养,加入重组人CD100(终浓度:2 μg/mL)[5-6]刺激培养48 h。
1.3.4 流式细胞术 所有HCC患者、对照者未刺激的PBMC直接转入FACS流式检测管中,洗涤后加入小鼠抗人CD3-PE Cy7、小鼠抗人CD4-FITC、小鼠抗人CD8-APC Cy7、小鼠抗人CD100-Alexa Fluor 647各5 μL,于4 ℃避光孵育30 min,洗涤后使用流式细胞仪进行检测。接受重组人CD100刺激的PBMC加入佛波酯(终浓度:50 ng/mL)、伊乌诺霉素(终浓度:1 μg/mL),同时加入4 μL蛋白转运抑制剂,于37 ℃、5%CO2条件下培养5 h,将细胞转入FACS流式检测管中,加入100 μL固定液固定细胞后,使用250 μL破膜洗涤缓冲液对细胞进行破膜,洗涤后加入小鼠抗人CD3-PE Cy7、小鼠抗人CD4-FITC、小鼠抗人CD8-APC Cy7、小鼠抗人IFNγ、小鼠抗人IL-17A-PerCP Cy5.5、小鼠抗人IL-22-PE各5 μL,于4 ℃避光孵育30 min,洗涤后使用流式细胞仪进行检测。
1.3.5 细胞增殖检测 使用CCK-8试剂盒对细胞增殖检测进行检测。在培养的最后4 h,加入10% CCK-8工作液,培养结束后在450 nm波长处读取吸光度,根据已知细胞数量的标准品吸光度绘制标准曲线,计算样本细胞数量。
1.3.6 ELISPOT检测 选择11例HLA-A02限制性HCC患者的PBMC,重组人CD100刺激后加入预包被的PVDF膜ELISPOT平板中,加入甲胎蛋白(AFP)HLA-A02限制性多肽(序列:FMNKFIYEI;终浓度:10 μg/mL)[8],于37 ℃、5%CO2条件下培养48 h,弃液体洗板3次后加入100 μL链霉亲和素碱性磷酸酶耦合物,室温孵育1 h,弃液体洗板3次后加入100 μL BCIP/NBT碱性磷酸酶显色试剂,室温孵育15 min,洗板3次后使用ELISPOT读板仪读板。
1.3.7 CD8+T淋巴细胞纯化、刺激以及与HepG2细胞的共培养 选择7例HLA-A02限制性HCC患者的PBMC,取107个PBMC,离心后使用缓冲液重悬,加入100 μL MagCellect人CD8+T淋巴细胞生物素标记抗体鸡尾酒,混匀后4 ℃孵育15 min,加入200 μL铁磁流体标记的链霉亲和素,混匀后4 ℃孵育15 min,使用缓冲液将细胞悬液总体积调整至2 mL,将试管置于MagCellect磁力架上,室温孵育6 min,小心吸出未沉淀的细胞悬液,其中含有纯化的CD8+T淋巴细胞。取105个纯化的CD8+T淋巴细胞,加入AFP HLA-A02限制性多肽(10 μg/mL)和重组人CD100(2 μg/mL)刺激培养24 h,然后加入5×105个HepG2细胞(亦为HLA-A02限制性)共培养24 h后收集上清。
1.3.8 HepG2细胞死亡检测 收集100 μL培养上清加入96孔板中,加入100 μL LDH细胞毒性检测反应液,室温孵育30 min,在490 nm波长处读取吸光度。低对照为HepG2细胞培养上清的吸光度,高对照为细胞裂解液处理的HepG2细胞培养上清的吸光度,细胞死亡百分比=(检测样本-低对照)/(高对照-低对照)×100%。
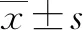
2 结果
2.1 一般资料 HCC组57例,既往有乙型肝炎48例,丙型肝炎2例,酒精性肝病7例,42例患者有肝硬化病史。对照组和HCC组在性别比例和年龄间的差异无统计学意义(P值均>0.05),HCC组AFP水平显著高于对照组(P<0.001)(表1)。

表1 患者的一般临床资料
2.2 HCC患者外周血CD100表达变化 HCC组血浆sCD100水平低于对照组(P<0.001)。对照组和HCC组患者CD3+CD4+T淋巴细胞和CD3+CD8+T淋巴细胞表面mCD100表达典型流式检测分析见图1。HCC组外周血CD4+T淋巴细胞中CD100阳性细胞比例、mCD100平均荧光强度(mean fluorescent intensity, MFI)均高于对照组(P值均<0.05)。HCC组外周血CD8+T淋巴细胞中CD100阳性细胞比例、mCD100 MFI亦均高于对照组(P值均<0.05)(表2)。

表2 对照组和HCC组中血浆sCD100、CD4+和CD8+T淋巴细胞中mCD100表达比较
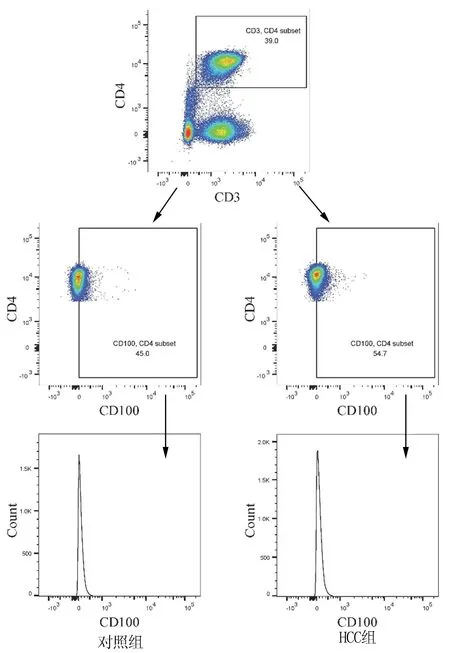
图1 对照组和HCC组CD4+和CD8+T淋巴细胞表面mCD100表达流式细胞检测
2.3 重组人CD100对HCC患者PBMC细胞增殖和T淋巴细胞比例的影响 取27例HCC患者的PBMC(5×105个)使用重组人CD100刺激培养,PBMC增殖数量在经CD100刺激和无CD100刺激之间差异无统计学意义(P=0.399),CD4+和CD8+T淋巴细胞占CD3+T淋巴细胞的比例在经CD100刺激和无CD100刺激之间差异亦无统计学意义(P>0.05)(表3)。

表3 重组人CD100对HCC患者PBMC细胞增殖和T淋巴细胞比例的影响
2.4 重组人CD100对HCC患者辅助性T淋巴细胞(Th)和杀伤性T淋巴细胞(Tc)的影响 HCC患者PBMC无CD100刺激和经CD100刺激后CD4+T淋巴细胞和CD8+T淋巴细胞分泌IFNγ、IL-17A、IL-22的典型流式分析图分别见图2、3。HCC患者PBMC经CD100刺激后,辅助性CD4+T淋巴细胞中,CD4+IFNγ+Th1细胞、CD4+IL-17A+Th17细胞、CD4+IL-22+Th22细胞比例均高于无CD100刺激(P值均<0.05)。经CD100刺激后,杀伤性CD8+T淋巴细胞中,CD8+IFNγ+Tc1细胞比例高于无CD100刺激(P<0.001),但CD8+IL-17A+Tc17细胞和CD8+IL-22+Tc22细胞比例在经CD100刺激和无CD100刺激之间差异均无统计学意义(P值均>0.05)(表4)。

表4 重组人CD100对HCC患者PBMC中Th细胞和Tc细胞亚群的影响
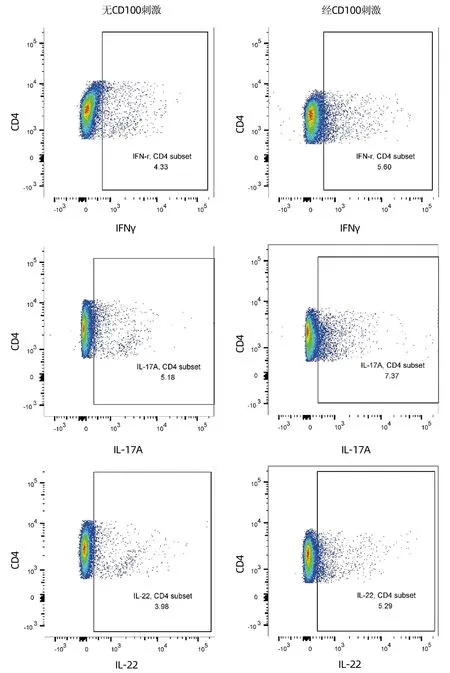
图2 HCC患者PBMC无CD100刺激和经CD100刺激后辅助性CD4+T淋巴细胞亚群的检测
2.5 重组人CD100对HCC患者AFP特异性CD8+T淋巴细胞分泌穿孔素、颗粒酶B以及杀伤功能的影响 11例HLA-A02限制性HCC患者的PBMC经CD100刺激后,AFP特异性CD8+T淋巴细胞分泌穿孔素和颗粒酶B的细胞数量均高于无CD100刺激(P值均<0.05)(表5)。7例HLA-A02限制性HCC患者CD8+T淋巴细胞经CD100刺激后,AFP特异性CD8+T淋巴细胞诱导HepG2细胞死亡的比例亦高于无CD100刺激(16.40%±4.52% vs 11.81%±2.84%,t=2.272,P=0.042)。
图3 HCC患者PBMC无CD100刺激和经CD100刺激后杀伤性CD8+T淋巴细胞亚群的检测

表5 重组人CD100对HCC患者AFP特异性CD8+T淋巴细胞分泌穿孔素和颗粒酶B的影响
3 讨论
宫颈癌和卵巢癌患者肿瘤组织中CD100表达水平升高[9-10],并可诱导肿瘤浸润单核细胞向M2型巨噬细胞分化[10],但肿瘤组织中CD100为总体CD100,包括免疫细胞和肿瘤实质细胞中的CD100,肿瘤组织中的CD100可通过促进肿瘤细胞增殖和迁移、诱导骨转移、肿瘤血管生成拟态,导致肿瘤疾病进展,因此,肿瘤组织CD100升高与疾病预后不良密切相关[11-12]。而本报道中所关注的是HCC患者中两种活性形式的CD100水平,细胞表面的mCD100活化后,细胞外基序脱落后形成的sCD100仍有生物学活性,可诱导传统抗原提呈细胞成熟,并直接调控免疫细胞功能[3-6]。急性病毒感染性疾病(如:急性乙型肝炎、肾综合征出血热)和自身免疫性疾病(如:类风湿性关节炎)患者外周血sCD100水平升高,但免疫细胞表面mCD100水平降低[3,13-14],这提示在机体免疫活化状态下,mCD100从免疫细胞表面脱落形成的sCD100具有较强的免疫调节作用。本研究发现,HCC患者中亦存在CD100表达失衡,表现为外周血sCD100水平降低,T淋巴细胞表面mCD100水平升高,这与既往在机体免疫抑制状态下(如:慢性病毒感染[3-4]、非小细胞肺癌[6]、脓毒性心肌病[15])的表达谱基本一致。但在非小细胞肺癌患者中,mCD100仅在CD8+T淋巴细胞中升高,但在CD4+T淋巴细胞中的表达与对照组无明显差异[6],而本研究发现,HCC患者CD4+和CD8+T淋巴细胞中mCD100水平均显著升高,提示HCC患者T淋巴细胞中mCD100脱落明显受到抑制,造成HCC患者sCD100水平降低。因此,HCC患者中sCD100水平降低可能是由于mCD100从细胞表面脱落不足引起的,进一步导致免疫细胞功能障碍,诱导机体免疫耐受,促进HCC疾病进展。
恶性肿瘤和慢性病毒感染中存在T淋巴细胞功能衰竭[16],以免疫检查点抑制剂为代表的免疫疗法可打破机体免疫耐受,恢复T淋巴细胞活性,为恶性肿瘤患者的治疗提供了有效方法,因此,重塑肿瘤患者T淋巴细胞功能活性是目前肿瘤治疗研究的热点之一[17]。CD100对T淋巴细胞具有免疫调控作用[15]。本研究对外源性CD100调控HCC患者T淋巴细胞的功能活性进行了研究。第一、外源性CD100并未影响HCC患者PBMC增殖和不同T淋巴细胞亚群的比例。这提示CD100可能不通过改变T淋巴细胞数量调控其功能。第二、外源性CD100增加Th1、Th17、Th22细胞比例。这与在脓毒性心肌病、肾小球肾炎中所发现的CD100增强CD4+T淋巴细胞功能的结果一致[15,18]。因此,sCD100表达降低可能抑制了HCC患者CD4+T淋巴细胞免疫应答。第三、CD8+T淋巴细胞是发挥肿瘤杀伤作用的主要免疫细胞之一[19-20],主要通过两种不同的途径发挥抗肿瘤活性,一方面,CD8+T淋巴细胞可分泌细胞因子,通过非特异性杀伤作用诱导肿瘤细胞死亡;另一方面,特异性CD8+T淋巴细胞可通过抗原识别介导肿瘤细胞杀伤,这一过程主要通过分泌穿孔素、颗粒酶B等毒性分子并依赖细胞间直接接触发挥作用[19-20]。外源性CD100可增加非特异性Tc1细胞比例,但对非特异性Tc17和Tc22细胞并未显著影响,提示CD100可促进非特异性CD8+T淋巴细胞分泌IFNγ,但对其他细胞因子分泌可能无明显影响。外源性CD100还可增加AFP特异性CD8+T淋巴细胞分泌穿孔素和颗粒酶B的能力,外源性CD100刺激后AFP特异性CD8+T淋巴细胞对HepG2细胞的体外杀伤功能增强,提示CD100可促进特异性CD8+T淋巴细胞杀伤功能。这与在非小细胞肺癌、急性心肌梗死中CD100可增强CD8+T淋巴细胞杀伤功能的结果基本一致[6,21],这说明sCD100表达降低可能不足以维持HCC患者非特异性和特异性CD8+T淋巴细胞功能,造成细胞失能。但CD100对HCC特异性T淋巴细胞功能调控的机制还有待体内实验进一步研究。
总之,HCC患者中存在sCD100和T淋巴细胞中mCD100表达失衡,sCD100水平降低可能无法维持T淋巴细胞功能活性,造成HCC免疫耐受。CD100可能成为HCC治疗新的靶点。
伦理学声明:本研究方案于2020年4月16日经空军军医大学第二附属医院伦理委员会批准,批号:TDLL-202002-038,所有患者或家属行告知并签署知情同意书。
利益冲突声明:本研究不存在研究者、伦理委员会成员以及与公开研究成果有关的利益冲突。
作者贡献声明:范慧娟负责实验操作,数据分析和论文撰写;宋淳负责课题设计、指导论文撰写并最后定稿。
