尽早启动抗病毒治疗降低慢性HBV感染者肝细胞癌发生风险
2023-02-08阿卜杜热西提阿卜来提顾智强鲁凤民
周 召, 阿卜杜热西提·阿卜来提, 顾智强, 常 靖, 刘 新, 鲁凤民,2
1 北京大学基础医学院 病原生物学系暨感染病研究中心, 北京 100191; 2 北京大学人民医院 肝病研究所,北京 100044
慢性HBV感染是病毒性肝炎、肝硬化和肝细胞癌(HCC)的主要病因。现阶段,全球共有2.96亿慢性HBV感染者[1]。我国现有慢性HBV感染者多达7000~8000万人,其中慢性乙型肝炎(CHB)患者为2000~3000万人[2]。原发性肝癌是全球最常见的恶性肿瘤之一,也是全球第三大癌症致死病因[3]。 HCC为其最常见的组织学类型[4]。2020年,全球共有新确诊HCC患者905 677例,死亡830 180例,其中,近45.3%的新增病例和47.1%的死亡病例发生在我国,而慢性HBV感染仍然是HCC的第一大病因,HBV相关HCC约占全球HCC的45%[3]。现有的抗病毒治疗药物包括核苷(酸)类似物(NUC)和聚乙二醇干扰素α(PEG-IFNα)两类。前者口服方便,副作用小,可通过抑制HBV复制,减少CHB患者终末期肝病发生,已成为临床最常用的抗病毒药物。但由于大部分CHB患者抗病毒治疗启动较晚,治疗率较低,在抗病毒实施近三十年后全球仍未见到HCC年诊断人数的下降。
大多数慢性HBV感染者从感染HBV到HCC通常会经历较为漫长的慢性肝炎和肝硬化阶段。如何通过优化现行抗病毒治疗策略,如更早地启动抗病毒治疗、更强地病毒抑制以及合理地联合用药,以减少包括HCC在内的终末期肝病的发生,是目前临床高度关注的问题之一。本文就尽早启动抗病毒治疗,以阻止并减少HBV DNA整合和与之相关的肝细胞克隆性扩增,进而降低HCC的发生风险展开讨论。
1 慢性HBV感染的自然病程分期
慢性HBV感染的疾病进程是病毒、被感染的肝细胞及宿主免疫相互作用的博弈过程。患者最为常见的血清学改变是HBeAg的阴转及血清学转换(抗-HBe抗体出现)。该转换可伴随病毒复制的抑制、肝脏免疫病理损伤的相对缓解,以及肝损伤生化学指标的复常等。因此,早在20世纪80年代,临床医生就已将CHB分为HBeAg阳性和HBeAg阴性两大类。我国台湾学者通过对慢性HBV感染者的队列研究发现,存在一类以年龄相对较轻、HBV DNA水平较高、肝生化学指标正常、肝组织学无或仅有轻微肝脏炎症损伤为特征的HBeAg阳性感染者,并提出免疫耐受的概念[5]。随后经逐步完善,国际上于2006年正式提出了慢性HBV感染自然进程的4个时相:免疫耐受期、免疫清除期、免疫控制期及疾病再活动期,并被广泛采用[6-7]。近期,笔者团队结合欧美肝病学会有关自然进程与患者疾病状态的更新描述[8-9],按照感染者不同疾病阶段的病毒学特征、肝脏免疫病理损伤及临床表现,进一步将该自然病程分为4个免疫时相、5种疾病状态:免疫耐受(HBeAg阳性慢性感染)、免疫清除状态下的HBeAg阳性CHB和HBeAg阴性CHB、免疫控制(HBeAg阴性慢性感染)、乙型肝炎再活动[10]。目前各大指南均推荐对HBeAg阳性或阴性的CHB患者开展抗病毒治疗。
2 扩大抗病毒治疗渐成共识
一般认为HBV感染通常不会对肝细胞造成直接损伤。CHB患者的肝损伤多为宿主免疫所致,特别是抗HBV特异性CD8+T淋巴细胞通过杀伤作用清除感染肝细胞而导致的免疫病理损伤[11]。而宿主免疫介导的持续的肝脏炎症不仅与肝纤维化、肝硬化密切相关,也是HBV相关HCC发生发展的主要驱动因素。此外,宿主肝细胞基因组中HBV DNA的整合是CHB致癌的另一重要机制。一系列研究[12-14]结果显示,整合事件可发生于上述各个时期。对CHB患者广泛开展抗病毒治疗,以控制炎症和减少HBV DNA整合,可显著降低HCC的发生风险。因此,我国学者[15]提出了“扩大慢性乙型肝炎抗病毒治疗的专家意见”,推荐对所有30 岁以上的慢性HBV感染者进行抗病毒治疗。同时,笔者团队[16]也提出了“扩大慢性乙型肝炎抗病毒治疗应重视ALT正常、年龄≤30岁的HBeAg阴性慢性HBV感染者”的建议。
3 扩大抗病毒治疗重点或在于尽早
最近,韩国Choi等[17]的一项多中心队列研究结果促使我们重新思考对慢性HBV感染者启动抗病毒治疗的最佳时机问题。该研究共纳入了2073例接受一线NUC治疗的CHB患者。所有患者的基线HBV DNA均不低于 5.00 log10IU/mL,随访中共有47例患者发生HCC (0.39 每百人/年) 。对HCC发生风险的Kaplan-Meier分析发现:基线病毒载量是患者发生HCC的独立危险因素。而在著名的中位随访时间为11.4年、观察人数为3653例的REVEAL-HBV前瞻性研究[18]中,作者探究了慢性HBV感染者中病毒载量与HCC发生风险的生物剂量关系,发现高水平血清HBV DNA是独立于患者HBeAg状态、ALT异常升高及是否有肝硬化的危险因素,血清HBV DNA水平越高其发生HCC的风险越大。然而Choi等[17]的研究却显示,患者的HCC发生风险随患者治疗前的基线病毒载量降低而升高。高基线病毒载量组(≥ 8.00 log10IU/mL)患者为最低,以5.00~5.99 log10IU/mL组为高 (P<0.001) 。
在慢性HBV感染的疾病进程中,随着免疫“耐受”的打破,进入免疫清除期患者的血清HBV DNA水平随宿主抗HBV特异性细胞免疫对感染肝细胞的清除而下降,而这一过程往往伴随着肝组织的免疫病理损伤。据此,上述矛盾现象或可解释为:与同龄的病毒载量仍高(≥8.00 log10IU/mL)的患者相比,其DNA水平的下降提示这些患者因更早、更强的宿主免疫造成更严重的肝细胞损伤,以及残余肝细胞的选择性克隆性增殖和病毒及宿主基因突变的积累,从而导致其HCC风险的增加。著名的REVEAL-HBV研究及其他众多的研究均观察到抗病毒治疗抑制病毒复制可降低HCC发生风险,为此Choi等[17]提议对这些高病毒载量(≥8.00 log10IU/mL)的患者应尽早开展抗病毒治疗。这与现有主流指南[8-9]及我国“扩大慢性乙型肝炎抗病毒治疗的专家建议”[15]中有关HCC风险增加的患者应启动抗病毒治疗的精神相契合。但需要注意的是,高病毒载量的慢性HBV感染者更多处于“免疫耐受”状态,该类患者对抗病毒治疗应答往往相对欠佳。未来亟需研发有更强病毒抑制作用的抗HBV药物。
4 致癌的HBV DNA整合事件在慢性HBV感染早期阶段即已存在
20世纪80年代,Nature杂志连续发表了3篇有关HBV整合与HCC相关性的研究报道,后续一系列的研究基本阐明了HBV整合的致癌机制,即HBV DNA片段通过整合到宿主相关癌基因,影响染色体稳定性,形成融合病毒蛋白来发挥促癌作用。Fox Chase癌症研究所已故的Mason教授等[19]研究发现,HBV DNA整合在免疫耐受(HBeAg阳性慢性感染)阶段即已发生。与笔者团队[20]早期依据肝癌组织整合HBV DNA所携带病毒突变的频率所做的推断一致,Larsson等[21]也发现HBeAg阳性感染者的肝组织中均可检测到HBV DNA的整合。
Tu等[22]的研究报道了带有整合的肝细胞往往具有选择性增殖优势,且克隆性扩增现象存在于慢性感染疾病进程的各个时相。在Mason等[19]的前述研究中,作者也特别强调了携带整合HBV DNA片段的肝细胞存在克隆性扩增现象,且HBeAg阴性患者的最大肝细胞克隆大小远大于HBeAg阳性患者。这一现象提示,部分携带了HBV DNA整合片段的肝细胞在反复的炎性坏死与代偿性增殖过程中获得了选择性增殖优势。前文提到,活跃的肝细胞增殖有利于突变随时间积累并最终导致肝细胞的恶性转化。在肝硬化增生结节内出现结节性增生,即noduel in nodule,视为癌前病变或不典型增生结节[23]。与公认的突变随时间积累并最终导致肝癌发生的认知相符合,笔者团队早期研究[19]的确发现癌组织的整合片段携带的突变相对于配对的癌旁组织更低。这提示癌组织的整合事件发生更早,有着更长时间的克隆性扩增历程。综上,应强调及早开展干预治疗,以减少或阻止整合事件的发生,这对于降低慢性HBV感染者HCC发生风险至关重要。
5 抗病毒治疗或可减少整合并降低HBV相关HCC发病风险
HBV整合,即HBV DNA片段通过非同源末端连接或微同源末端连接重组的方式,连接到宿主基因组染色体DNA内,形成病毒-宿主DNA连接[24],被认为是慢性HBV感染的主要致癌机制之一[20]。在感染肝细胞内,HBV基因组共有3种存在形式:以微小染色体形式存在的共价闭合环状DNA(cccDNA)、正链不完整的松弛环状DNA(relaxed circular DNA, rcDNA)及HBV复制过程中出现的副产物双链线性DNA(double strand linear DNA, dslDNA)[25]。显而易见,双末端均游离的dslDNA更易于通过微同源末端重组或非同源末端连接的方式插入宿主基因组断裂处[26]。
现行最常用的NUC通过与内源性dNTP竞争,抑制rcDNA、dslDNA的生成,并间接减少cccDNA池的补充。以PEG-IFNα为基础的免疫调节药物通过直接抑制病毒复制和增强宿主的抗病毒免疫,清除感染肝细胞并直接减少cccDNA的水平[27]。理论上讲,NUC治疗下dslDNA也会显著减少。此外,笔者团队前期研究[28]发现, NUC治疗下新合成的HBV“病毒颗粒”大多数存在复制性缺陷,无法建立新的感染。因此推测由于不可逆的NUC掺入终止,其入核后也难以被修补成完整的双链线性病毒DNA插入宿主基因组。如图1所示,以NUC为主的抗病毒治疗能够从源头上抑制HBV复制、减少dslDNA的产生和整合事件的发生;而PEG-IFN α不仅可以抑制病毒复制,其对患者的免疫调节作用还能够抑制甚至清除既存的携带整合DNA片段的克隆性扩增肝细胞。与笔者团队的预期一致,近期有研究[29-30]显示,在经过长期NUC治疗的人群中,含有整合DNA片段的最大肝细胞克隆大小的确有所减小。这可能与长期NUC抑制病毒复制使dslDNA产生减少,从而从源头上阻止整合事件的发生有关。
那么,携带了具有转录活性和完整S基因的HBV DNA整合片段的肝细胞克隆如何逃避宿主抗HBsAg特异性免疫清除呢?近期的一些对CHB患者抗病毒治疗不同阶段的肝活检组织的RNA测序结果显示,由来自整合的SP1、SP2启动子所启动的转录本往往在其458 nt的位置与宿主基因组发生剪接融合[31]。该剪接理论上可导致大、中、小表面抗原羧基端125个氨基酸缺失,并导致部分跨膜结构域和羧基端抗原表位缺失。据此推测,尽管携带了HBV DNA的整合,但由于转录后的剪接带来的病毒蛋白表达缺失,将有利于这些克隆性扩增肝细胞免疫逃逸。考虑到整合主要是通过影响宿主整合到相关HCC基因的功能与活性[20],上述现象将有利于HCC的最终发生。
6 问题与展望
对处于免疫耐受期的慢性HBV感染者进行NUC治疗,患者HBV DNA仍可普遍检出。尽管按照扩大抗病毒治疗共识对这些感染者启动抗病毒治疗或许并不能够完全阻止核衣壳内HBV DNA负链的合成,但笔者团队的研究[28]结果显示,NUC的掺入不可逆地终止逆转录过程中负链DNA的合成,可以在一定程度上阻止新发整合事件的发生,长远看将降低患者的HCC发生风险(图1)。此外,Kim等[32]通过建立Markov模型阐明,对于CHB患者,在免疫耐受期开始接受抗病毒治疗更具有成本效益,且在药品成本降低等因素的影响下,免疫耐受期抗病毒治疗的成本效益将进一步提高。因此,建议对免疫耐受期的慢性HBV感染者尽早开展抗病毒治疗,以减少整合和克隆性扩增的发生,并降低HCC发生风险。
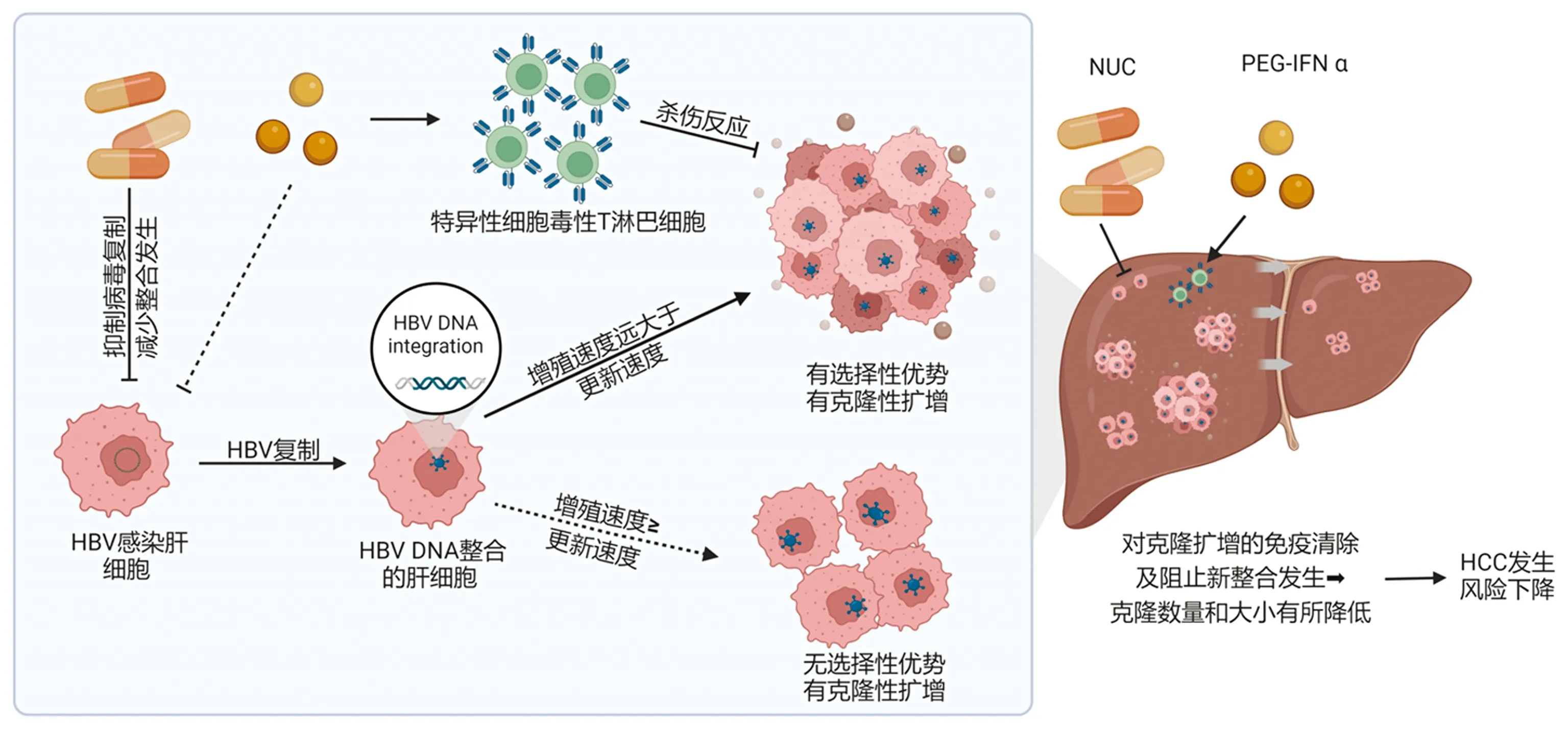
注:HBV感染细胞后,HBV DNA可整合到宿主DNA上,若携带整合HBV DNA的肝细胞增殖速度远超正常肝细胞的自我更新速度,克隆性扩增细胞出现选择性优势。若增殖速度并不明显大于正常肝细胞的自我更新速度,则不会出现选择优势,难以形成大的克隆增生。NUC抑制HBV复制,新合成的rcDNA及dslDNA显著减少,间接减少了整合发生;PEG-IFNα则主要通过激活HBV特异性CD8+ T淋巴细胞的杀伤反应抑制有选择性优势的整合细胞,促进对克隆扩增的免疫清除。NUC及PEG-IFNα联用时,在阻止新整合事件的发生的同时,使已有克隆在数量和大小有所减少,HCC发生风险进一步下降。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:鲁凤民、周召、阿卜杜热西提·阿卜来提、顾智强、常靖负责撰写论文;鲁凤民、顾智强、刘新负责修改论文;鲁凤民负责拟定写作思路,指导撰写文章。
