关于《扩大慢性乙型肝炎抗病毒治疗的专家意见》的几点思考
2023-02-08刘智泓梁携儿侯金林
刘智泓, 梁携儿, 侯金林
1 南方医科大学南方医院 感染内科暨肝病中心, 广州 510515; 2 广东省肝脏疾病研究所, 广州 510515
今年2月,《中华肝脏病杂志》刊登了《扩大慢性乙型肝炎抗病毒治疗的专家意见》[1]。这是基于我国口服抗HBV药物价格大幅降低的背景下,对现今HBV诊疗领域最重要的推荐意见。基于笔者团队既往在慢性乙型肝炎(CHB)临床研究领域的一些经验,本文就《扩大慢性乙型肝炎抗病毒治疗的专家意见》提出几点思考,以供讨论。
1 关于临床干预措施必要性和有效性的思考
如何建立有效的临床诊疗干预措施是现代医学的核心问题。临床医生是患者诊疗过程中的真正决策者,因此,在对患者开展某项干预以前,应充分掌握其必要性和有效性的相关证据。1996年,被誉为“循证医学之父”的Sackett教授提出了广为接受的循证医学定义:“慎重、准确、明智地应用所能获得的最好研究证据来确定个体患者的治疗措施”。而随着现代概率统计学的应用,循证医学的科学性得到了大幅度提高。在研究中所选取的样本是否能代表总体的特点和状况,是建立合理的统计学推论的关键,这与研究结论能否外推密切相关。此外,终点事件的选择也非常重要。临床研究既往有一个广受认可的原则,即“以终为始”(图1)。该原则强调需要以有效改变终点事件作为最终评价标准。就CHB而言,肝癌、肝硬化失代偿使患者生存预期大幅缩减,是可靠的终点事件。但CHB自然病程较长,直接观察这些终点事件意味着巨大的成本,而选择病毒学应答、生化学应答或组织学应答等替代指标,是一种必然技术路线。需要注意的是,替代指标和终点事件相关性也是基于特定样本建立的,因此,在不同的人群中,改善替代指标是否仍等同于改善临床终点,也值得考量。另一方面,需要从不同的角度拓展干预的目标人群并在真实世界中优化组织实施。这要求临床医师关注到特殊人群的治疗需求,并在随机对照研究外开展真实世界的研究。本文尝试总结了开展临床研究、评价临床证据的一种思维框架,并对于扩大CHB抗病毒治疗中的两个关键问题,开展一些相关的讨论。
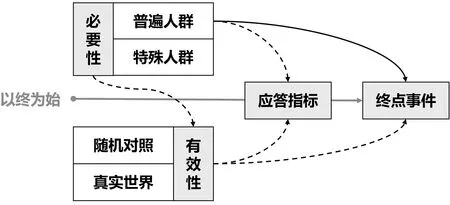
图1 一种开展临床研究、评价临床证据的思维框架
2 关于降低CHB治疗适应证的ALT阈值
“推荐意见3:对于血清HBVDNA阳性,ALT持续高于治疗阈值(男性30U/L、女性19U/L),1年内连续随访3次以上,每次至少间隔3个月,且排除其他原因所致者,建议抗病毒治疗。”[1]
2.1 干预的必要性 慢性HBV感染自然病程可划分为:HBeAg阳性慢性HBV感染、HBeAg阳性CHB、HBeAg阴性慢性HBV感染和HBeAg阴性CHB。其中,CHB期以患者肝内持续存在炎症活动为特征,并因肝组织纤维化而导致病情进展。但此期部分患者可在短期出现血清学转换并获得病情的缓解[2]。因此,并非所有肝功能异常的患者,均需立即启动抗病毒治疗。另一方面,由于ALT异常并非CHB所特有,排除其他原因导致的ALT异常仍有重要意义[3]。中国CHB防治指南自2015年更新以来,就已强调在启动抗病毒治疗前,需要持续检测肝功能,并排除其他原因导致的ALT升高。值得注意的是,本次扩大治疗适应证的专家共识,对于ALT持续异常的判定,以及排除其他病因导致ALT升高的要求,并无改变。
自2017年以来,国际指南对ALT的正常值范围上限(ULN)和启动抗病毒治疗的ALT阈值存在不同意见。如表1所总结,欧洲肝病学会仍建议维持40 U/L的ULN标准[5],但对于HBeAg阳性且ALT为1~2倍ULN的患者,需要存在显著组织学改变才推荐抗病毒治疗;美国肝病学会指南曾将ULN降至男性30 U/L,女性19 U/L[8],后又修订为男性35 U/L,女性25 U/L[6],但一直维持ALT≥2倍ULN才启动抗病毒治疗。对于这些分歧,我国庄辉教授在《慢性乙型肝炎启动治疗的ALT阈值应否修订?》[9]一文中做了详尽的解释,在此归纳为:(1)关于ALT本身的正常值范围,由于过去的流行病学调查未排除多种与ALT水平独立相关的疾病(如血脂异常、脂肪肝或糖尿病等),因此ALT的正常值范围应采纳排除上述疾病后的研究结果;(2)降低ALT作为启动CHB治疗的阈值也是必要的,多项研究表明,更低水平的ALT(例如<0.5倍ULN)的CHB人群具有更低的远期风险。因此,对于ALT>30 U/L(女性为19 U/L)但低于各地实验室2倍ULN的CHB患者,干预的必要性是充分的。
虽然ALT与CHB患者的预后密切相关,但CHB患者本身的肝脏疾病严重程度(以组织学变化为主),仍是决定是否启动抗病毒治疗的首要因素,这在各国际指南中均得到公认。而对无创纤维化诊断技术的重视,则在2017年更新的欧洲肝病学会指南中得到了强调(表1)[5]。在我国临床实践中,慢性HBV感染者既往未规律随访的情况非常普遍。同时,当CHB患者ALT轻度异常时,往往出现间断升高的情况。这两点均使单独根据ALT水平判断患者是否具有治疗适应证存在困难。而依据无创肝纤维化诊断结果启动抗病毒治疗,则可能是一种在临床实践中更为可行、高效的策略。
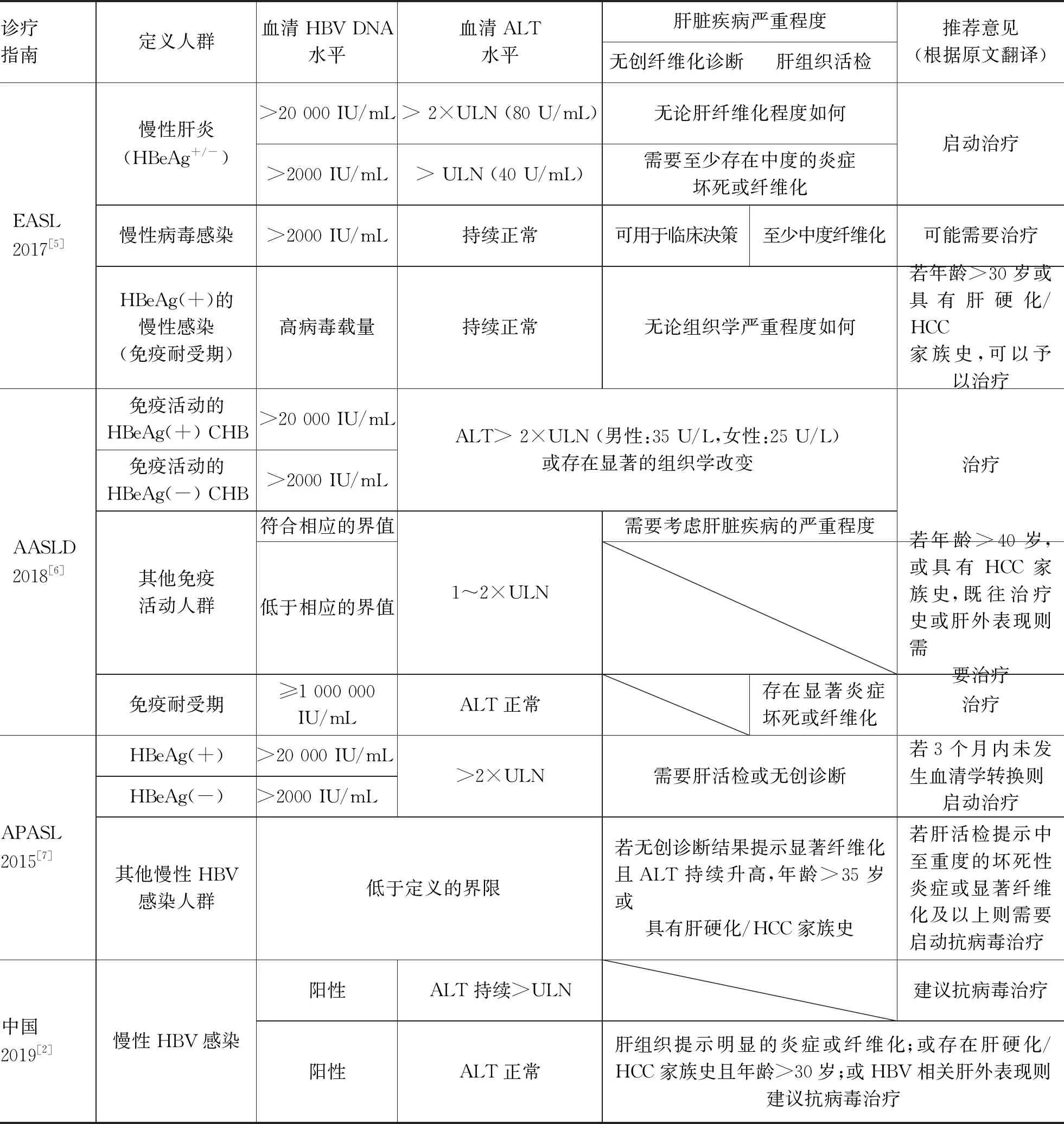
表1 不同地区CHB诊疗指南中对于非肝硬化患者启动抗病毒治疗的推荐意见(经原文作者同意后转载,有修订[4]):
2.2 干预的有效性 基于现有核苷(酸)类似物(NUC)治疗男性ALT 30 U/L(女性为19 U/L)至2倍常规ULN的CHB患者,其有效性也值得探讨。2004年Liaw等[10]报告拉米夫定治疗可显著减少CHB患者的肝硬化失代偿和肝癌的发生率,证实了NUC治疗能减少终点事件发生。但需要注意,在该研究中,并未限定入组患者的ALT水平,而是以肝穿刺结果提示至少存在进展期纤维化(Ishak评分≥4分)作为纳入治疗的标准。在阿德福韦酯的两项注册研究[11-12]中,仅纳入ALT>1.2倍ULN的CHB患者。而恩替卡韦(ETV),则在其HBeAg阳性人群的3期注册研究中,仅纳入ALT 1.3~10倍ULN的患者[13]。替诺福韦二吡呋酯(TDF)以及替诺福韦艾拉酚胺(TAF)在其3期注册研究中,均纳入ALT> 2倍ULN的患者(虽然TAF的3期注册研究采用了更低的ULN)[14-17]。因此,对于扩大本条适应证纳入的人群,既往研究人群均未完整覆盖。
对于ALT正常或者轻度异常的HBeAg阳性患者,既往观点并不推荐启动抗病毒治疗。其依据是既往研究结果提示该类人群疾病进展缓慢且疗效不佳。陈力元教授等[18]曾开展一项使用TDF治疗ALT正常(男性<43 U/L,女性<34 U/L)CHB患者的研究,该研究中,在接受了192周TDF单药治疗的患者中,仅有55%获得病毒学应答,且HBeAg血清学转换率仅为5%。既往并无安慰剂对照研究证实,对于ALT水平较低的CHB患者予以抗病毒治疗能显著减少终点事件的发生。最近,一项TORCH-B研究[19]提供了相关证据,在该项双盲、安慰剂模拟、两次肝活检的随机对照研究中,对于非肝硬化,ALT在近半年均为轻度异常(1~2倍ULN;ULN:40 U/L)的CHB患者,TDF治疗3年被证实能较安慰剂显著减少肝纤维化的进展。杂志同时刊发评论:认为该研究已为是否治疗ALT轻度异常CHB患者的讨论划上句号[20]。另外,我国于2018年开展的艾米替诺福韦(TMF)3期注册研究[21],也曾降低了相关的入组标准:允许ALT水平为1~2倍ULN的患者入选研究。在该项研究中,有42例患者可能符合过去对于免疫耐受的定义(HBV DNA> 7 log10IU/mL, 肝脏硬度值< 7.3 kPa,且ALT低于2倍ULN)。在经过48周治疗后,该亚组患者的病毒定量下降幅度为5.87 log10IU/mL,与整体治疗人群的下降幅度类似。需要注意的是,上述两项研究虽然纳入了ALT轻度异常的人群,但所采用ULN也并非目前专家意见推荐的标准,因此未来仍需要开展更多的相关研究。另一方面,未来治疗CHB的新药临床试验中,也应考虑按照ALT>1倍ULN(男性30 U/L,女性19 U/L)纳入受试者并单独报告其应答情况。
干预该类患者的有效性,除了评价病毒学应答,也应考虑以ALT复常为代表的生化学应答。近年来比较替诺福韦一代前体药物和二代前体药物的疗效及安全性的多项研究[22-24]中均报告,当以更低的ULN标准评价ALT复常率时,二代替诺福韦药物(TAF及TMF)均较一代药物(TDF)具有更高的ALT复常率,提示二代替诺福韦药物能将ALT降至更低的水平。此外,若使用ALT<30 U/L(女性为19 U/L)的标准评价ALT复常,将可能发现更多的患者未能在病毒学应答后获得ALT复常。上述问题,均值得在今后作进一步深入的探讨。
2.3 小结 基于现有研究证据,笔者认为降低ALT的ULN是必要的。同时,采用男性≥30 U/L,女性≥19 U/L作为CHB启动抗病毒治疗阈值的必要性证据也较为充分。需注意,持续监测、排除其他病因仍是判断是否启动CHB抗病毒治疗的核心原则。另外,肝纤维化无创诊断技术的应用,对于处理ALT轻度、间断异常的患者,可能更具现实意义。
在干预该人群的有效性方面, 既往验证NUC疗效的随机对照研究均未纳入ALT轻度异常的患者,部分研究提示这类患者对NUC治疗应答不佳。近期已有研究证实NUC干预能显著减少这类患者的纤维化进展,但治疗更低ALT水平患者的有效性证据以及如何提高其有效性,仍需进一步研究。
3 关于进一步干预低病毒血症(low-level viremia,LLV)
“推荐意见6:对于抗病毒治疗1年以上但仍存在LLV的CHB患者,建议换用或加用强效低耐药NUC(恩替卡韦、替诺福韦酯或丙酚替诺福韦)治疗,或者联合聚乙二醇化干扰素(PEG-IFN)治疗。”[1]既往的多个区域性肝病指南,均未明确提出对于接受抗病毒治疗的人群应在什么时限内获得病毒学应答。
3.1 干预的必要性 2017年,韩国的研究团队[25]报告了初治CHB患者在接受ETV治疗8年后,LLV人群的肝癌累积发生率显著高于完全维持应答(maintained virological response,MVR)人群,该项研究共纳入936例受试者,经过中位时长4.5年的随访后,LLV人群(366例)3年和5年肝细胞癌(HCC)累积发生率分别为6.2%和14.3%,显著高于MVR人群的3.2%和7.5%,同时多因素回归分析结果提示LLV是HCC发生的独立危险因素,初步揭示了干预LLV人群的必要性。但值得注意的是:在该研究的非肝硬化亚组中,LLV和MVR人群的HCC累积发生率并无显著差异,LLV也并非该亚组人群发生HCC的独立危险因素。因此,对于非肝硬化的LLV人群,是否具有干预的必要性,仍需进一步探索。
对于LLV人群的具体定义,目前仍未统一。其中,对于接受多长时间抗病毒治疗后仍未应答才符合LLV人群,是一个备受关注的问题。我国专家既往曾总结LLV的研究现状,表示将所有治疗48周未应答的患者全部判定为LLV人群可能会与部分应答者存在重合[26]。笔者团队[27]既往曾参与全球样本量最大的ETV随机对照研究(080研究),其研究结果提示ETV治疗后的应答率(HBV DNA<50 IU/mL)在前5年均逐步提高:在第1年、第3年、第5年分别为64%、80%及82%。而在TAF对比TDF治疗CHB人群的注册研究中,e抗原阳性人群在第1年实现HBV DNA<69 IU/mL的比例约为72%,在完成3年治疗后,应答率将提高至96%[28]。由此可见,部分应答的患者,可能在后续治疗中取得应答,因此是否应将48周未获得完全应答的人群全部予以进一步干预,仍有待商榷。
对LLV人群,另一个讨论点在于如何排除耐药患者。LLV作为新的定义,应与过去的概念区分,国内专家普遍认同不应将耐药患者纳入LLV人群[26]。但现有的相关研究证据,似乎并未严格排除耐药患者的存在。笔者曾以“乙型病毒性肝炎”及“低病毒血症 ”的关键词进行了文献回顾,在所获取的51篇中英文文献中,一线抗病毒药物治疗的相关研究共7项(5项为ETV,2项未报告)[25,29-34]。其中6项只排除出现病毒学突破(通常定义为HBV DNA较最低水平反弹超过1 log10IU/mL)的患者,而并未采用深度测序的方法,严格排除耐药株的存在。既往研究[35]曾证实,存在耐药株的患者可表现为持续LLV,而并非必然呈现病毒学突破,因此上述研究可能仍存在耐药患者混杂的情况。另外,替诺福韦类药物治疗CHB临床无耐药,但其相关的LLV研究罕见。因此,对于严格排除耐药后的LLV人群,其终点事件的风险是否依然升高,值得进一步的探索。
3.2 干预的有效性 虽然对于LLV人群的定义和进一步干预的必要性仍存在一定争议,但已有多项关于进一步干预ETV经治LLV人群的研究报道。纪冬教授团队[31]比较了初治接受ETV治疗1年后存在LLV的CHB患者,分别转换为TAF或继续ETV治疗后的病毒学应答情况。研究结果提示, TAF转换治疗12周和24周后,病毒学应答率为54.7%和62.7%,而维持ETV治疗组则仅为6.7%和9.3%。虽然该研究仅有25%的患者接受了深度测序以排除耐药,但两组间疗效差异非常显著。在临床实践中,准确无误地收集患者既往治疗经历往往存在困难,而通过深度测序排除耐药似乎并无必要,因此,对于ETV治疗后存在LLV的患者,直接转换为替诺福韦类药物应是一种可行的策略。
虽然现有证据主要为ETV治疗后LLV的患者,但替诺福韦类药物治疗后应答不佳的情况也有报道。如在上文提及的陈力元教授等[18]对ALT正常的CHB人群开展的研究。在该项研究中,接受TDF单药治疗的患者,其病毒学应答率(HBV DNA<69 IU/mL)在治疗192周后仅为55%,且应答率自72~192周均未显著提高。另外,同样上述所提到的TORCH-B研究中[19],基线ALT水平轻度异常(40~80 U/L)的患者,在接受TDF治疗3年后,病毒学应答率仅为85%,仍有15%的患者未能获得病毒学应答。由此可见,基线ALT水平低下,很可能是导致患者应答不佳的原因。这一现象可能与NUC的作用机制相关:主要阻断病毒的逆转录过程,而与直接杀灭细菌的抗生素不同,血循环中已合成的子代病毒则依赖免疫系统进行清除。过去曾有一些临床前或1期临床试验对NUC的剂量作了探索,结果提示NUC普遍存在疗效的饱和,并非剂量越大疗效越高。又例如,TAF和TMF均是25 mg的治疗剂量,实际靶细胞内药物效应成分的浓度都是TDF 300 mg治疗剂量的数倍[36],但临床上并不能观测到TAF或TMF对TDF的疗效优势。我国专家曾对LLV机制进行了回顾和讨论,认为宿主免疫弱及体内脱氧核苷酸丰富导致NUC竞争性抑制是主要的原因[26]。因此,联合或转换其他NUC药物干预LLV可能从机制上存在不足,并非最终解决方案。近期,陈新月教授等[37]报告,LLV人群联用长效干扰素(PEG-IFN)治疗48周,将较联用NUC获得更高的病毒学应答率(97.50% vs 85.90%,P=0.001)。考虑到PEG-IFN对免疫系统的激活作用,这应该是有效干预LLV的合理方案。此外,一种新型的核衣壳抑制剂——Vebicorvir(VBR)在其二期研究中,证明了VBR联用NUC治疗24周均能使更多患者的HBV DNA水平降至5 IU/mL以下(通过一种新的高敏检测方法)[38-39],也提示新靶点的药物在干预LLV方面的潜力。不过,考虑该研究的时长仅有24周,联用VBR能否长时间维持病毒学抑制方面的优势,并减少终点事件的发生,还有待进一步研究。值得注意的是,该项研究所纳入的经治患者在基线前已至少维持HBV DNA<10 IU/mL(罗氏COBAS TaqMan 2.0)超过6个月,但通过新的检测方法,发现83%的HBeAg阳性患者和31%的HBeAg阴性患者仍存在HBV DNA>5 IU/mL,可见随着HBV DNA检测方法的发展,将会进一步改变LLV的相关研究现状。
3.3 小结 已有证据提示NUC治疗后LLV将会增加患者的HCC风险,因此对该部分患者的进一步干预值得关注。但目前该领域仍存在定义不统一,具体机制未被阐明的情况,因此相关证据有待进一步充实。从临床实践的角度考虑,对LLV人群的进一步干预仍很可能改变许多CHB患者的预后。
对于ETV经治患者,替诺福韦类药物的转换治疗是有效的,但这类药物的机制局限性使其并非有效干预LLV人群的最终答案。目前,联合PEG-IFN或新靶点药物的治疗方案均初步证实有效,值得进一步探索。此外,更灵敏的HBV DNA检测方法可能极大的改变LLV相关的研究现状。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:刘智泓负责查找文献,撰写文稿;梁携儿负责审阅文稿;侯金林负责审阅文稿及最后定稿。
志谢:感谢2022年“辩以明思”辩论赛南区辩论队许敏教授及吴彪教授在“扩大治疗低病毒血症患者”部分提供的宝贵意见。
