基于Nrf2/HO-1通路的柴胡皂苷A对A549细胞顺铂敏感性的影响
2023-02-07高薇王佳勇
高薇,王佳勇
海军军医大学长海医院,上海200433
肺癌是全球癌症死亡的主要原因,5年生存率低于15%,其中80%~85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。尽管NSCLC早期检测和系统治疗取得一些进展,但患者预后仍较差[2]。NSCLC化疗药物存在耐药性、疗效不理想、价格昂贵等局限性。因此,亟需新的安全有效治疗策略[3]。越来越多证据表明,中药可降低化疗和放疗毒性,减轻癌症症状,提高患者生存率[4]。顺铂是常用的化疗药物,但由于耐药性问题,常使细胞对顺铂的敏感性降低,从而降低化疗效果。
柴胡皂苷A是从柴胡中提取的一种三萜皂苷[5],具有抗炎[6]、抗氧化[7]、抗肿瘤[8]等多种药理活性。柴胡皂苷A可通过上调细胞自噬水平抑制Huh-7细胞增殖,发挥抗肝癌作用[9];通过抑制ERK蛋白磷酸化促进鼻咽癌细胞凋亡,发挥抗鼻咽癌作用[10];通过抑制Wnt/β-catenin 信号通路提高人肺腺癌顺铂耐药性细胞(A549/DDP)对顺铂的敏感性,逆转A549/DDP细胞顺铂耐药性[11]。基于此,本研究探究柴胡皂苷A与顺铂联用对人肺腺癌A549细胞的影响及可能的作用机制,为NSCLC的临床治疗提供实验依据。
1 材料与方法
1.1 药物与细胞
柴胡皂苷A(批号149158,纯度≥98%)、铁死亡抑制剂Ferrostatin-1(Fer-1,批号119396,纯度≥98%)上海陶术生物科技有限公司。A549细胞株,购于中国科学院典型培养物保藏委员会细胞库。
1.2 主要试剂与仪器
DMEM 培养基(货号8118031),美国Gibco 公司;胎牛血清(FBS,货号SV30087.02),美国HyClone 公司;ECL 发光液(货号WP20005)、BCA蛋白定量试剂盒(货号23225)、C11-BODIPY荧光探针(货号D3861),美国Thermo公司;FeRhonox-1亚铁离子荧光探针(货号GC901),日本Goryo Chemical公司;PVDF 膜(货号IPVH00010),美国Millipore;CCK8(货号C0038)、DCFH-DA 荧光探针(货号MB4682),大连美仑生物;溶质载体家族7 成员11(SLC7A11)抗体(货号ab175186)、谷胱甘肽过氧化物酶4(GPX4)抗体(货号ab125066)、转铁蛋白(Transferrin)抗体(货号ab214039)、溶质载体家族40成员1(SLC40A1)抗体(货号ab239538)、核因子E2相关因子2(Nrf2)抗体(货号ab62352)、血红素加氧酶(HO-1)抗体(货号ab52947)、β-actin 抗体(货号ab8226)、HRP标记二抗(货号ab150077),英国Abcam公司。SpectraMax iD3多模式酶标仪(澳大利亚SpectraMax),FACS Calibur 流式细胞仪(美国Becton Dickinson),1300 SERIES A2 CO2细胞培养箱(美国Thermo Scientific),Mini-PROTEAN Tetra System电泳系统、ChemiDoc MP Imaging System凝胶成像分析系统(美国Bio-Rad)。
1.3 细胞培养
A549 细胞用DMEM 完全培养基(含10% FBS、1%双抗),置于37 ℃、5%CO2培养箱中培养,1~2 d传代一次,取对数生长期细胞进行实验。
1.4 柴胡皂苷A和顺铂浓度筛选
将A549细胞以6×103个/孔接种于96孔板,放入培养箱中培养过夜,将细胞分为对照组和药物组,每组3个复孔,对照组加入空白培养基,药物组分别以终浓度为3.25、7.5、15、30、60、120、240、480 μmol/L柴胡皂苷A 或0.625、1.25、2.5、5、10、20、40、80 μmol/L顺铂处理细胞24 h,同时设置只加培养基的空白孔调零。每孔加入10 μL CCK8溶液,培养箱继续培养2 h,酶标仪波长450 nm处测定各孔吸光度(A),计算细胞存活率[(A药物-A空白)/(A对照-A空白)×100%],并用GraphPad软件计算药物IC50。
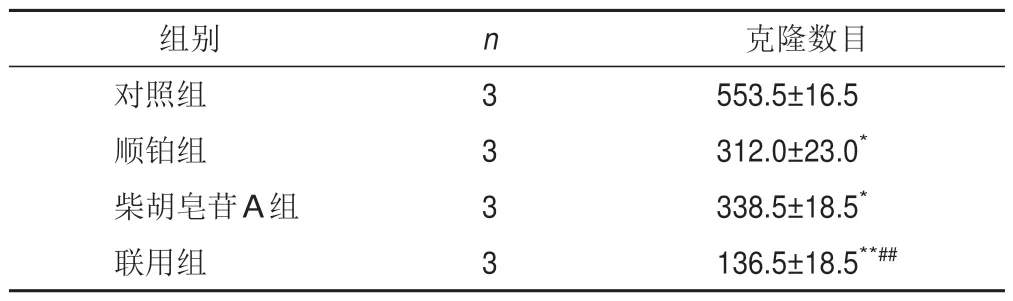
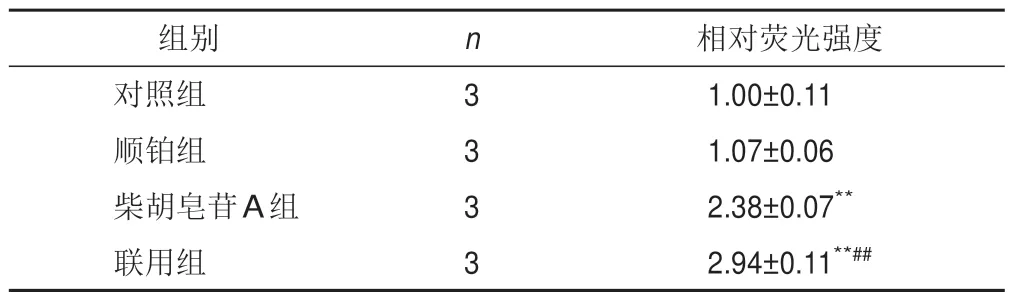
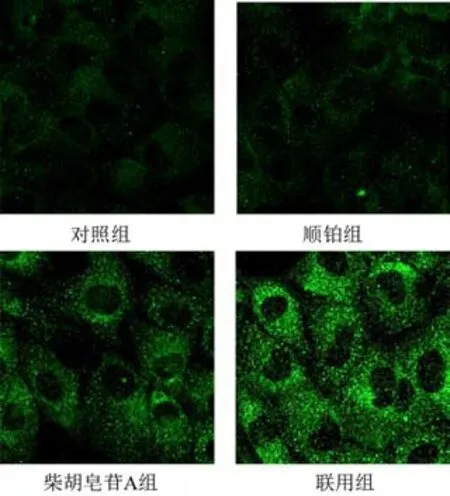
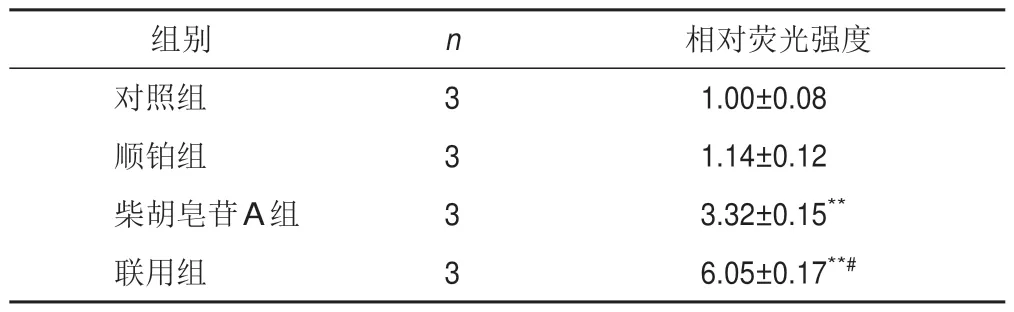
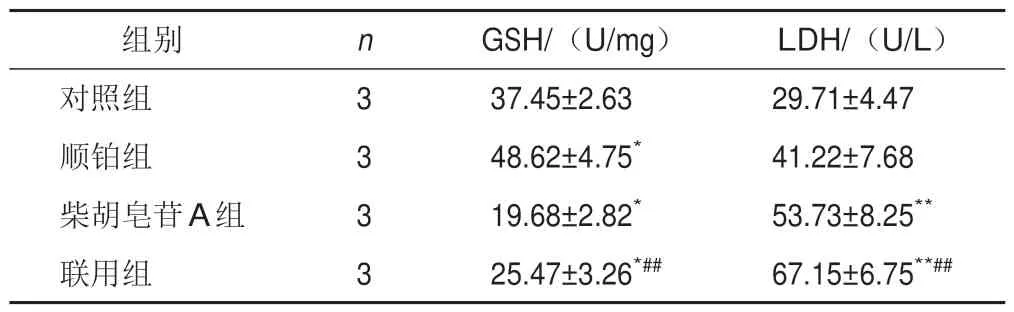
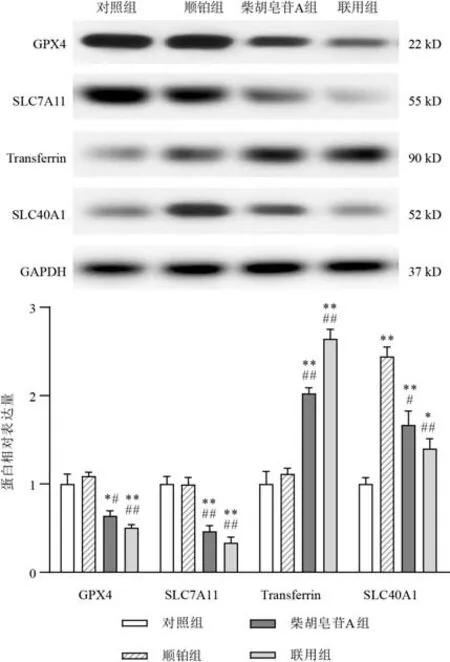
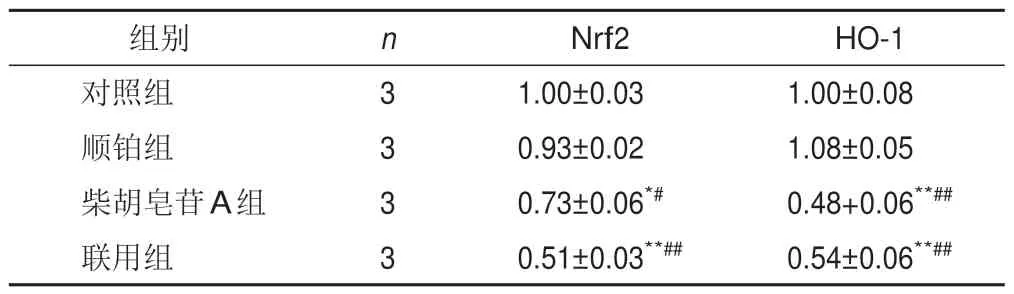
将细胞分为对照组、顺铂组、柴胡皂苷A组及联用组,按以上方法培养,根据筛选出的IC50分别处理细胞,测定各孔吸光度,计算细胞存活率及抑制率(100%-存活率)。采用协同指数q评价2种药物联用的效果[12]。q=EAB/(EA+EB-EA×EB),式中EAB表示A、B两药联合使用的抑制率,EA、EB表示A、B单用的抑制率,q≤0.85表示两药拮抗,0.85 将A549细胞消化成单细胞悬液,以1 000个/孔接种于12孔板,置于培养箱中培养2 d。将细胞分为对照组、顺铂组(5 μmol/L)、柴胡皂苷A组(40 μmol/L)及联用组(40 μmol/L柴胡皂苷A+5 μmol/L顺铂),分别加入相应药物,对照组加入空白培养基,置于培养箱中继续培养11 d。PBS洗2次,4%多聚甲醛室温固定20 min,PBS 洗1 次,1%结晶紫溶液染色10 min,PBS洗3次,室温晾干,显微镜下观察3个视野中的细胞克隆数量。 将A549细胞以1×105个/孔接种于12孔板,待细胞过夜贴壁后,将细胞分为对照组、顺铂组(5 μmol/L)、柴胡皂苷A组(40 μmol/L)及联用组(40 μmol/L柴胡皂苷A+5 μmol/L顺铂),分别加入相应培养基处理24 h。加入2 μmol/L C11-BODIPY荧光探针,37 ℃避光孵育30 min,共聚焦显微镜观察并拍照,Image J 1.6软件计算相对荧光强度(实验组荧光强度/对照组荧光强度)。 将A549细胞以1×105个/孔接种于12孔板,待细胞过夜贴壁后,将细胞分为对照组、顺铂组(5 μmol/L)、柴胡皂苷A组(40 μmol/L)及联用组(40 μmol/L柴胡皂苷A+5 μmol/L顺铂),分别加入相应培养基处理24 h。加入5 μmol/L FeRhonox-1荧光探针,避光孵育1 h,共聚焦显微镜观察并拍照,Image J1.6软件计算相对荧光强度。 将A549细胞以2.5×105个/孔接种于6孔板,待细胞贴壁后,将细胞分为对照组、顺铂组(5 μmol/L)、柴胡皂苷A组(40 μmol/L)及联用组(40 μmol/L柴胡皂苷A+5 μmol/L顺铂),分别加入相应培养基处理24 h。收集细胞上清液,按试剂盒说明书检测乳酸脱氢酶(LDH)含量。加入RIPA裂解液裂解细胞,收集细胞裂解液,按试剂盒说明书检测细胞内谷胱甘肽(GSH)含量。 将A549细胞以2.5×105个/孔接种于6孔板,待细胞贴壁后,将细胞分为对照组、顺铂组(5 μmol/L)、柴胡皂苷A组(40 μmol/L)及联用组(40 μmol/L柴胡皂苷A+5 μmol/L顺铂),分别加入相应培养基处理24 h。收集细胞,根据试剂盒说明书提取总RNA,使用Prime ScriptTMRT Master 和TB Green®Premix Ex TaqTM进行反转录和RT-PCR。以GAPDH 为内参,2-ΔΔCt法计算mRNA相对表达量。引物由上海生工合成,引物序列见表1。 表1 各基因PCR引物序列 将A549细胞以2.5×105个/孔接种于6孔板,待细胞贴壁后,将细胞分为对照组、顺铂组(5 μmol/L)、柴胡皂苷A组(40 μmol/L)及联用组(40 μmol/L柴胡皂苷A+5 μmol/L顺铂),分别加入相应培养基处理24 h。加入RIPA裂解液(含蛋白酶抑制剂),冰上裂解15~30 min,4 ℃、10 000 r/min离心10 min,分离上清液,BCA法测定蛋白浓度,加入5×loading buffer,100 ℃金属浴10 min使蛋白变性,20 μg蛋白样品经凝胶电泳(80 V、30 min,120 V、1.5 h)后转至PVDF膜(冰浴,200 mA,2 h),加入5%脱脂牛奶封闭1 h,TBST洗涤3次,每次8 min,滴加SLC7A11、GPX4、Transferrin、SLC40A1、Nrf2、HO-1 一抗(均为1∶1 000)及GAPDH 一抗(1∶2 000),4 ℃孵育过夜,TBST洗膜3次,每次8 min,加入HRP标记二抗,室温孵育2 h,TBST洗膜3次,每次8 min。采用ECL显影液显色,凝胶成像系统拍照,Image J 1.6软件分析蛋白灰度值。 采用GraphPad Prism 6.0 统计软件进行分析。实验数据以表示,组间比较用t检验。P<0.05表示差异有统计学意义。 随着柴胡皂苷A和顺铂浓度增加,A549细胞存活率呈逐渐降低趋势,其IC50分别为43.5、5.4 μmol/L,见图1。故选择柴胡皂苷A 40 μmol/L、顺铂5 μmol/L进行后续实验。 图1 不同浓度柴胡皂苷A和顺铂处理的A549细胞存活率(xˉ±s,n=3) 与对照组比较,顺铂组、柴胡皂苷A组及联用组A549细胞存活率显著降低(P<0.05,P<0.01);与顺铂组比较,联用组A549 细胞存活率显著降低(P<0.01)。结果见表2。q值计算结果显示,柴胡皂苷A(40 μmol/L)与顺铂(5 μmol/L)联用具有协同作用(q=1.21)。 表2 各组A549细胞存活率比较(,%) 表2 各组A549细胞存活率比较(,%) 注:与对照组比较,*P<0.05,**P<0.01;与顺铂组比较,##P<0.01 与对照组比较,顺铂组、柴胡皂苷A组和联用组A549细胞克隆数目显著减少(P<0.05,P<0.01);与顺铂组比较,联用组A549 细胞克隆数目显著减少(P<0.01)。见表3、图2。 表3 各组A549细胞克隆数目比较(,个) 表3 各组A549细胞克隆数目比较(,个) 注:与对照组比较,*P<0.05,**P<0.01;与顺铂组比较,##P<0.01 图2 各组A549细胞克隆形成 与对照组比较,柴胡皂苷A组和联用组A549细胞脂质过氧化水平显著升高(P<0.01);与顺铂组比较,联用组A549细胞脂质过氧化水平显著升高(P<0.01)。见表4、图3。 表4 各组A549细胞脂质过氧化水平比较() 表4 各组A549细胞脂质过氧化水平比较() 注:与对照组比较,**P<0.01;与顺铂组比较,##P<0.01 图3 各组A549细胞脂质过氧化阳性表达(C11-BODIPY探针,×63) 与对照组比较,柴胡皂苷A组和联用组A549细胞Fe2+含量显著升高(P<0.01);与顺铂组比较,联用组A549细胞Fe2+含量显著升高(P<0.05)。见表5、图4。 表5 各组A549细胞Fe2+含量比较() 表5 各组A549细胞Fe2+含量比较() 注:与对照组比较,**P<0.01;与顺铂组比较,#P<0.05 图4 各组A549细胞Fe2+阳性表达(FeRhonox-1探针,×63) 与对照组比较,柴胡皂苷A组和联用组A549细胞GSH含量显著减少(P<0.05),细胞上清液LDH含量显著增加(P<0.05);与顺铂组比较,联用组A549细胞GSH含量显著减少(P<0.01),细胞上清液LDH含量显著增加(P<0.01)。结果见表6。 表6 各组A549细胞GSH和上清液LDH含量比较() 表6 各组A549细胞GSH和上清液LDH含量比较() 注:与对照组比较,*P<0.05,**P<0.01;与顺铂组比较,##P<0.01 PCR 结果显示,与对照组比较,柴胡皂苷A 组A549 细胞SLC7A11 和GPX4 mRNA 表达显著降低(P<0.05),SLC40A1表达显著升高(P<0.01),联用组A549细胞SLC7A11和GPX4 mRNA表达显著降低(P<0.05)、SLC40A1 和Transferrin mRNA 表达显著升高(P<0.05,P<0.01);与顺铂组比较,联用组A549细胞SLC7A11、GPX4、SLC40A1 mRNA 表达显著降低(P<0.05,P<0.01),Transferrin mRNA 表达显著升高(P<0.01)。结果见表7。 表7 各组A549细胞SLC7A11、GPX4、Transferrin、SLC40A1 mRNA表达比较() 表7 各组A549细胞SLC7A11、GPX4、Transferrin、SLC40A1 mRNA表达比较() 注:与对照组比较,*P<0.05,**P<0.01;与顺铂组比较,#P<0.05,##P<0.01 Western blot结果显示,与对照组比较,柴胡皂苷A组和联用组A549细胞SLC7A11和GPX4蛋白表达显著降低(P<0.05,P<0.01),Transferrin和SLC40A1蛋白表达显著升高(P<0.05,P<0.01),顺铂组A549细胞SLC40A1蛋白表达显著升高(P<0.01);与顺铂组比较,柴胡皂苷A组和联用组A549细胞SLC7A11和GPX4 蛋白表达显著降低(P<0.05,P<0.01),Transferrin蛋白表达显著升高(P<0.01),SLC40A1蛋白表达显著降低(P<0.05,P<0.01)。见图5。 图5 各组A549细胞SLC7A11、GPX4、Transferrin、SLC40A1蛋白表达比较(,n=3) 为考察铁死亡对A549细胞顺铂敏感性的影响,在原有分组基础上使用铁死亡抑制剂Fer-1(10 μmol/L)处理细胞2 h,再加入相应药物培养24 h,分别检测细胞存活率、脂质过氧化水平、Fe2+含量及SLC7A11和GPX4蛋白表达。结果显示,Fer-1处理后细胞存活率显著升高(P<0.05),细胞内脂质过氧化水平和Fe2+含量降低(P<0.05),铁死亡相关蛋白SLC7A11和GPX4表达升高。见图6。 图6 各组A549细胞存活率、脂质过氧化水平、Fe2+含量及铁死亡相关蛋白表达比较(,n=3) 与对照组比较,柴胡皂苷A组和联用组A549细胞Nrf2 和HO-1 mRNA 及蛋白表达显著降低(P<0.05,P<0.01);与顺铂组比较,联用组A549 细胞Nrf2 和HO-1 mRNA及蛋白表达显著降低(P<0.05,P<0.01)。结果见表8、图7。这些结果表明,柴胡皂苷A与顺铂联用能够抑制Nrf2/HO-1通路,破坏细胞抗氧化系统,加强细胞铁死亡。 表8 各组A549细胞Nrf2、HO-1 mRNA表达比较() 表8 各组A549细胞Nrf2、HO-1 mRNA表达比较() 注:与对照组比较,*P<0.05,**P<0.01;与顺铂组比较,#P<0.05,##P<0.01 图7 各组A549细胞Nrf2、HO-1蛋白表达比较(,n=3) 本研究使用柴胡皂苷A和与低浓度顺铂同时处理A549细胞,发现柴胡皂苷A能够增强A549细胞对顺铂的敏感性,抑制细胞增殖,联合用药具有协同作用。提示二者联合应用能增强顺铂NSCLC抗肿瘤作用,是一种有潜力的治疗策略。 铁死亡是细胞程序性死亡的方式,其特征是铁代谢产生的脂质过氧化产物和活性氧(ROS)积累,细胞破裂引起LDH释放增多[13]。研究表明,铁死亡是肿瘤生长的重要调控因子,主要由SLC7A11和GPX4被抑制引起。GPX4是一种依赖GSH的硒酶,抑制GPX4导致GSH介导的抗氧化活性下降及脂质过氧化水平升高,从而引起铁死亡[14]。SLC7A11是一种胱氨酸-谷氨酸逆向转运体,能将细胞外胱氨酸转运到细胞中,然后将其加工成半胱氨酸,半胱氨酸能参与体内多种氧化还原反应,对细胞具有一定保护作用。SLC7A11失活导致细胞内半胱氨酸含量降低,进一步导致GSH含量降低,促进细胞铁死亡。Transferrin主要作用是将Fe2+导入细胞内,而SLC40A1负责将Fe2+从细胞内运输到细胞外,二者对维持细胞内Fe2+平衡至关重要。Transferrin表达升高及SLC40A1表达降低导致细胞内Fe2+积累,从而促进细胞铁死亡[15]。诱导铁死亡可以抑制肿瘤生长,为抗肿瘤治疗提供新思路。本研究结果显示,与顺铂组比较,柴胡皂苷A与顺铂联用能促进A549细胞LDH释放,进一步表明柴胡皂苷A能增强A549细胞对顺铂的敏感性,此外,还能降低铁死亡相关SLC7A11、GPX4蛋白和mRNA表达,提高细胞内脂质过氧化水平,减少细胞内GSH 含量,下调SLC40A1蛋白表达,上调Transferrin蛋白表达,维持细胞内Fe2+含量,促进细胞铁死亡。 Nrf2/HO-1抗氧化通路在铁死亡中起重要作用,为避免处于持续的氧化应激微环境中,肿瘤细胞可通过中和氧化应激减轻细胞中过氧化脂质生成,从而抵抗铁死亡。Nrf2是抗氧化和解毒的主要调控因子,被认为是一种细胞保护因子,通过与下游抗氧化反应元件结合减轻脂质过氧化水平,抑制铁死亡。HO-1受Nrf2转录调控,转录因子Nrf2启动内源性抗氧化反应元件,并激活若干下游抗氧化酶(如HO-1)表达,且铁死亡关键因子SLC7A11、GPX4、SLC40A1都受Nrf2转录调控[16-17]。本研究发现,顺铂能促进A549细胞HO-1表达,激活Nrf2/HO-1抗氧化通路,而柴胡皂苷A单用及与顺铂联用均能降低Nrf2、HO-1蛋白和mRNA表达,提示柴胡皂苷A 能抑制Nrf2 核易位,抑制Nrf2/HO-1通路。这些结果表明,柴胡皂苷A抑制了顺铂诱导的Nrf2/HO-1通路激活,进而促进过氧化脂质生成,进一步促进铁死亡。 综上所述,柴胡皂苷A与顺铂联用能诱导A549细胞铁死亡,其机制可能与破坏细胞氧化还原稳态,提高细胞内脂质过氧化水平及Fe2+含量,降低GSH含量及 SLC7A11、GPX4、SLC40A1 表达,上调Transferrin表达,抑制Nrf2/HO-1通路有关。本研究可为NSCLC的辅助治疗提供实验依据。1.5 细胞克隆形成分析
1.6 脂质过氧化检测
1.7 Fe2+含量检测
1.8 谷胱甘肽和乳酸脱氢酶含量检测
1.9 RT-PCR检测

1.10 Western blot检测
1.11 统计学方法
2 结果
2.1 柴胡皂苷A与顺铂联用对A549细胞存活率的影响
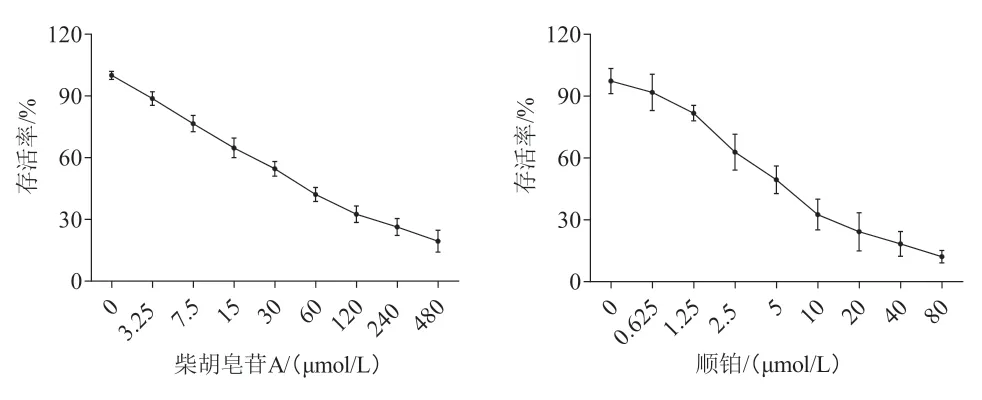
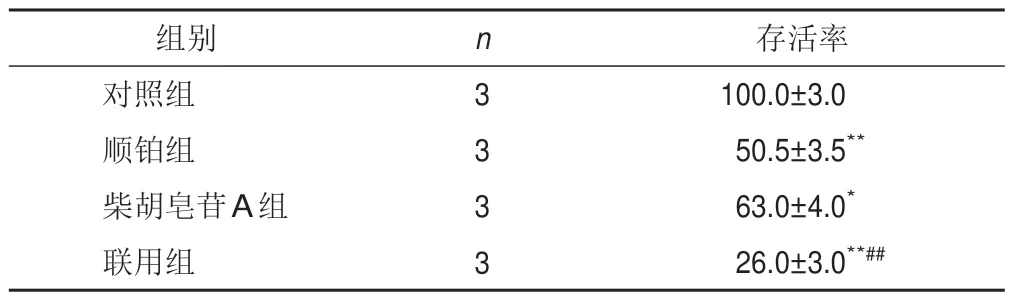
2.2 柴胡皂苷A与顺铂联用对A549细胞克隆数目的影响

2.3 柴胡皂苷A与顺铂联用对A549细胞脂质过氧化水平的影响
2.4 柴胡皂苷A与顺铂联用对A549细胞Fe2+含量的影响

2.5 柴胡皂苷A与顺铂联用对A549细胞谷胱甘肽和乳酸脱氢酶含量的影响
2.6 柴胡皂苷A与顺铂联用对A549细胞铁死亡相关指标表达的影响

2.7 抑制铁死亡对A549细胞顺铂敏感性的影响

2.8 柴胡皂苷A 与顺铂联用对A549 细胞Nrf2/HO-1通路的影响

3 讨论
