新烟碱类杀虫剂污染特征及其毒性效应
2023-02-04刘志琨
崔 嵩,李 斐,刘志琨
新烟碱类杀虫剂污染特征及其毒性效应
崔 嵩*,李 斐,刘志琨
(东北农业大学水利与土木工程学院,国际持久性有毒物质联合研究中心,东北农业大学松花江流域生态环境保护研究中心,黑龙江 哈尔滨 150030)
综述了新烟碱类杀虫剂在土壤、水体和大气中的赋存现状及其对无脊椎动物、脊椎动物和人类的毒性效应.新烟碱类杀虫剂普遍存在于多介质环境中,特别在农业种植区具有较高的残留浓度.新烟碱类杀虫剂对非靶标动物的影响主要表现在氧化应激、抑制活动能力、损伤DNA和生育功能;亦会对人类的生育、生殖、神经以及脏器功能带来风险.因此,今后亟需系统研究新烟碱类杀虫剂在多环境介质中的赋存及污染状况,深入探讨新烟碱类杀虫剂对非靶标生物的健康危害,以便全面了解此类杀虫剂对生态环境及非靶标生物造成的潜在风险.
新烟碱类杀虫剂;污染特征;非靶标生物;毒性效应
新烟碱类杀虫剂自20世纪80年代上市以来,便因其具有高效、广谱和低毒等特点而逐渐取代传统有机磷和氨基甲酸酯等农药[1].该类杀虫剂能选择性作用于昆虫中枢神经系统的烟碱乙酰胆碱受体(nAChR)及其周围神经,并有效阻断昆虫中枢神经的传导,使昆虫持续兴奋、麻痹而后导致死亡,现主要应用于农业、城市绿化、家庭和宠物等害虫控制[2-3].目前,主要使用的新烟碱类杀虫剂有7种,包括吡虫啉(Imidacloprid)、噻虫嗪(Thiamethoxam)、噻虫胺(Clothianidin)、呋虫胺(Dinotefuran)、啶虫脒(Acetamiprid)、噻虫啉(Thiacloprid)、烯啶虫胺(Nitenpyram)等[2].
据统计,新烟碱类杀虫剂已被允许在120多个国家注册使用,2014年全球销售额高达33.45亿美元,占全球杀虫剂销售总额的18%,全球农药销售总额的5.3%[4].由于新烟碱类杀虫剂的大量使用及其具有低挥发性、高水溶性和土壤中半衰期较长等特点,导致该类杀虫剂在全球范围内不同环境介质中被频繁检出,如土壤、灰尘、地表水、沉积物、地下水等环境介质均受到不同程度污染,而由此带来的生态环境问题也已引起全球范围内的广泛关注[5].现有研究已证实,环境中残留的新烟碱类杀虫剂可对非靶标生物(直接或间接受到新烟碱类杀虫剂影响却非原本要作用物种)的行为、遗传、繁殖和生理水平产生影响,扰乱神经元的正常发育并引起神经毒性[6-8],特别在野外暴露情况下对昆虫可产生严重的亚致死/致死效应[9].为应对此问题,欧盟、加拿大、巴西、美国、印度等国家和地区相继出台禁限令,以缓解该类杀虫剂给生态环境安全所带来的危害[10].鉴于新烟碱类杀虫剂在全球市场的高占有率以及给生态环境安全带来的挑战,本文根据目前国内外现有研究文献,系统综述了新烟碱类杀虫剂在环境中的污染现状及其对非靶标生物的潜在危害,明晰当前研究中的不足,进而为我国新烟碱类杀虫剂未来研究和合理使用提供借鉴和参考依据.
1 环境中的污染现状
1.1 土壤
新烟碱类杀虫剂在使用后,大部分母体药物会通过喷雾漂移、拌种等方式进入土壤环境中,进而发生淋溶、地表径流和植物吸收等运移过程(图1),由于其在土壤中半衰期最高可达几百天(表1),因此即使在施用发生数年后的土壤中仍可检测到新烟碱类杀虫剂的残留[11].Yu等[12]对珠江三角洲农业区三种不同作物种植土壤进行了研究,共检出6种新烟碱类杀虫剂,其中蔬菜种植区土壤残留浓度最高(浓度范围:0.26~390ng/g,中值:23ng/g),其次是水稻(浓度范围0.26~280ng/g,中值:6.1ng/g)和水果(浓度范围:0.26~150ng/g,中值:5ng/g)种植土壤.Schaafsma等[13]研究发现加拿大安大略省西南部地区土壤中新烟碱类杀虫剂的平均残留浓度为4.0ng/g,总浓度范围为0.07~20.3ng/g.Stewart等[14]通过对美国中南部农业生产区土壤进行采样检测,结果表明吡虫啉、噻虫胺和噻虫嗪三种杀虫剂在土壤中的平均残留浓度分别为4.0,3.4和2.3ng/g. Botías等[15]于2015年对英国油菜和小麦种植土壤进行分析,发现吡虫啉、噻虫胺、噻虫嗪、噻虫啉是土壤中主要存在的新烟碱类杀虫剂,浓度范围分别为£0.07~7.90,0.41~ 28.6,£0.04~9.75和£0.01~0.22ng/g.Heimbach等[16]对德国北部油菜田的研究发现,土壤中噻虫胺的残留浓度范围为0.8~3.4ng/g.Wu等[17]对山东寿光种植番茄和黄瓜的温室土壤进行检测,在种植番茄和黄瓜的温室土壤中分别检测到了7种和6种新烟碱类杀虫剂,总浓度范围分别为0.731~11.383和0.363~19.224ng/g.此外,在非农业土壤中同样检测到较高浓度的新烟碱类杀虫剂残留.例如,Zhou等[18]利用LC-MS/MS检测技术,测定了天津市公园和居民区土壤中7种新烟碱类杀虫剂的残留状况,总浓度范围分别为0.27~230.76和0.23~132.66ng/g.无论源区(主要指农业种植区域)还是非源区,新烟碱类杀虫剂均普遍存在于土壤环境中.相比之下,我国土壤中新烟碱类杀虫剂残留种类和浓度均高于欧美国家,产生这一现象的主要原因可以归纳为:一是欧美国家对部分新烟碱类杀虫剂的使用实施了严格禁令;二是我国是一个农业大国,农作物种植面积较广,导致新烟碱类杀虫剂使用量也相应增加.据统计,我国新烟碱类杀虫剂的年使用量(折百)在2010~ 2020年之间,从不足每年2000t增加到每年7000t[19];三是受到种植结构、虫害种类和土壤类型等有关因素的影响;四是缺乏科学合理的施用模式,导致存在过量使用和利用率低的现象.因此,针对我国当前土壤中高新烟碱类杀虫剂的污染现状,有必要制定更加有效的管控制度和使用规范,以缓解新烟碱类杀虫剂污染的不断加剧.
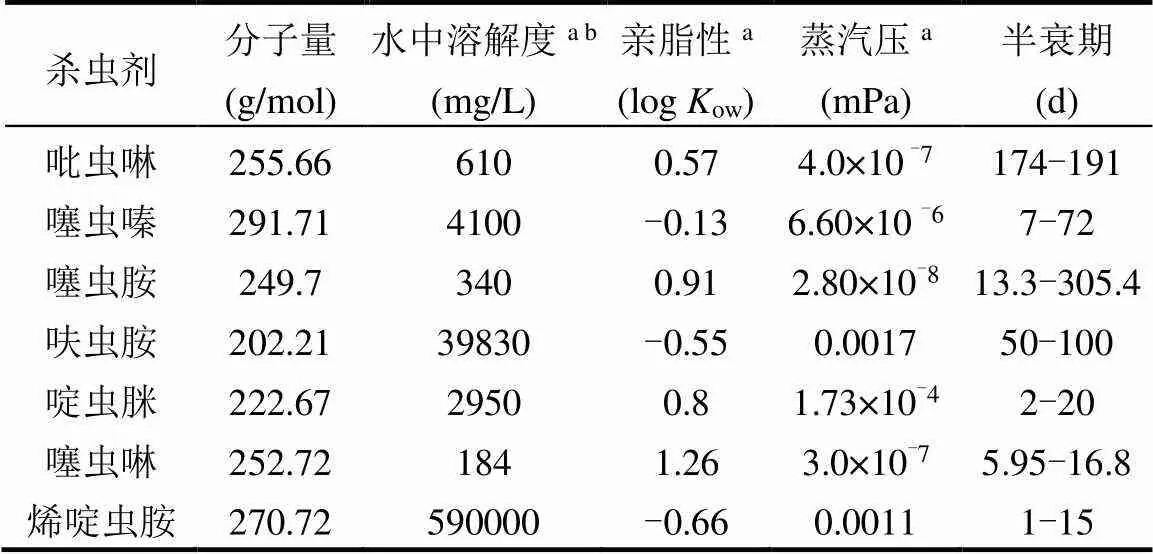
表1 主要新烟碱类杀虫剂的理化性质
注:数据来源于农药性质数据库(Pesticide Properties DataBase, http://sitem.herts.ac.uk/aeru/ppdb/index.htm);a为20℃;b为pH=7.
1.2 水体
新烟碱类杀虫剂拥有较高的溶解度(表1),使其极易通过地表径流、淋溶等方式进入地表水和地下水并造成污染(图1).现有研究表明,全球水体均不同程度受到新烟碱类杀虫剂的污染[20-21].例如,Casillas等[22]采集了西班牙Tagus流域的19个水体样品,测定了5种新烟碱类杀虫剂(吡虫啉、噻虫嗪、噻虫胺、啶虫脒、噻虫啉)的残留状况,整体浓度范围为<8.3~16.8ng/L,其中89%样品中至少含有一种新烟碱类杀虫剂.研究发现,水体中新烟碱类杀虫剂的残留浓度与功能区域有密切关联,位于农业种植区水体中的新烟碱类杀虫剂残留浓度更高.该结果得到了一项针对美国各地河流的全国性调查结果的证实,即水体中噻虫胺和噻虫嗪污染水平与周围作物的种植比例呈显著正相关[23].而我国由于新烟碱类杀虫剂造成的水体污染现象也普遍存在.Naumann等[24]对中国渤海周边河流中新烟碱类杀虫剂赋存特征的研究表明,淡水中5种常见新烟碱类杀虫剂(吡虫啉、噻虫嗪、噻虫胺、啶虫脒、噻虫啉)的检出浓度为<0.02~128ng/L,检出频率为42%~100%. Liu等[25]在松花江哈尔滨段地表水中检测到了7种新烟碱类杀虫剂(啶虫脒、噻虫胺、呋虫胺、吡虫啉、噻虫啉、噻虫嗪、烯啶虫胺),总浓度范围为30.8~135ng/L;在沉积物中则检测到了4种目标研究物(啶虫脒、噻虫胺、噻虫嗪、吡虫啉),总浓度范围为0.61~14.7ng/g.Huang等[26]采集了我国南方农业和城市地区58份沉积物样本,共检测到6种新烟碱类杀虫剂,其总体浓度范围为<0.5~23.8ng/g.Zhang等[27]则对广州市农村水-沉积物系统中新烟碱类杀虫剂的残留与分布进行了调查,农村地区水和沉积物中污染程度均高于城市地区,其中新烟碱类杀虫剂主在地表水中的总浓度为(7.94~636ng/L),在沉积物中的总浓度(0.017~31.3ng/g).
相关研究已经证实,新烟碱类杀虫剂在酸性或中性环境下降解缓慢,能够在水中稳定存在,一旦水体受到新烟碱类杀虫剂的污染尚无十分有效的方法去除[28].Qi等[29]报道了北京5家污水处理厂进、出水中的吡虫啉浓度范围分别为45~100和45~ 106ng/L,造成出水中吡虫啉浓度高于进水的原因可能是污水处理设备中有吡虫啉的残留,该结果表明进入水体中的新烟碱类杀虫剂难以被去除,并可随再生水排放重新进入受纳水体导致地表水和地下水,尤其是饮用水源的二次污染.当前新烟碱类杀虫剂在水体中的残留面临着污染分布广泛和难以去除的特点.因此,如何高效降解和去除水体中的新烟碱类杀虫剂的残留仍是未来研究的重点.
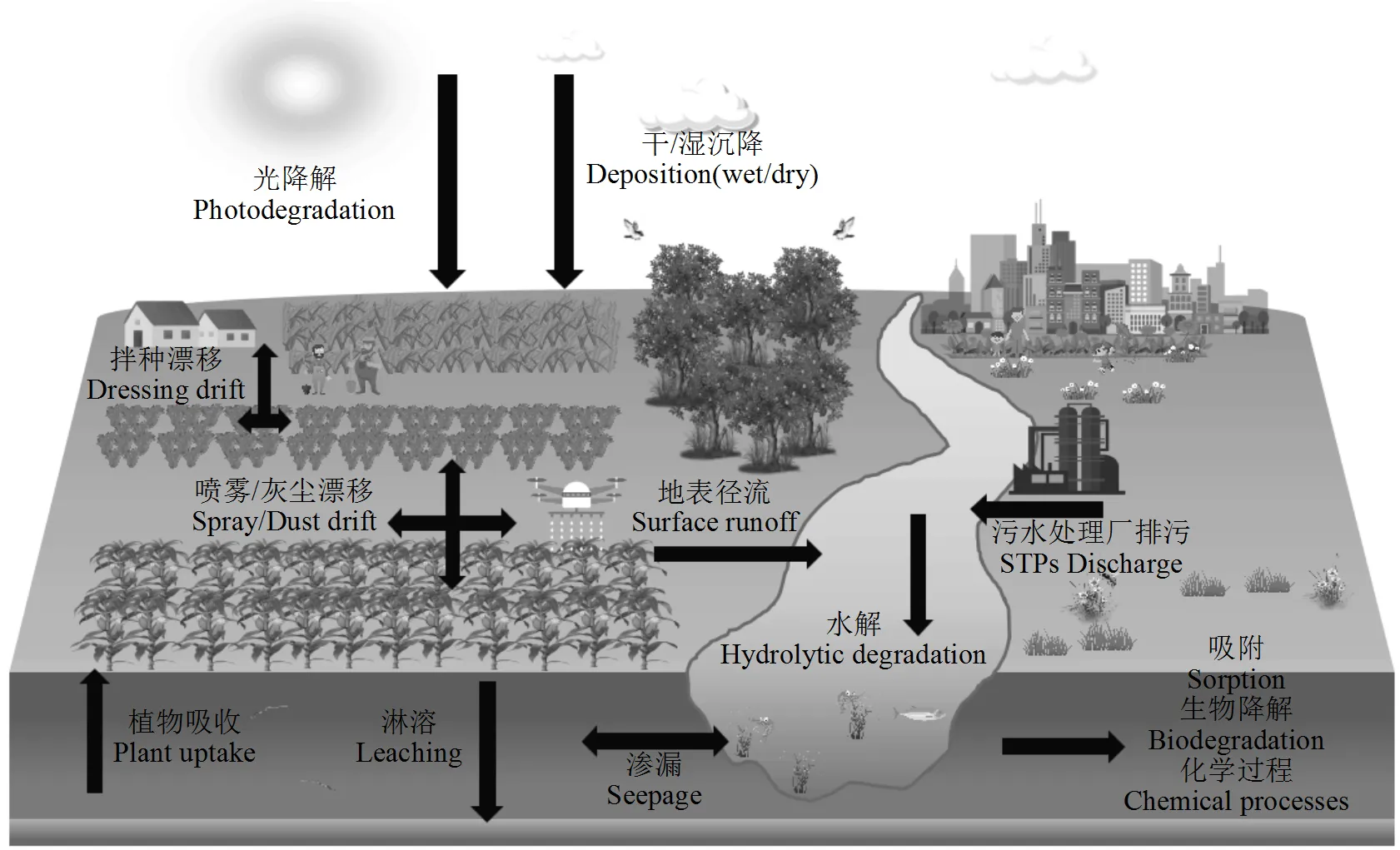
图1 新烟碱类杀虫剂的环境归趋
1.3 大气
大气环境中的新烟碱类杀虫剂主要来源于农药的喷洒和包衣种子播种过程.由于其挥发性较低,主要以大气颗粒物的形式存在,可随大气颗粒物进行传输和迁移,并通过干湿沉降对土壤和水体造成污染[30].Luis等[31]使用大气采样器对加拿大安大略省西南部空气中的新烟碱类杀虫剂进行检测,结果表明使用主动大气采样器采集的样品中噻虫胺和噻虫嗪检出率分别为100%和88.6%,在种植和耕作两个阶段悬浮颗粒物中新烟碱类杀虫剂的浓度分别为16.22和1.91ng/m3.Zhou等[32]研究了郑州市区及农村地区春季和秋季大气细颗粒物(PM2.5)中新烟碱类杀虫剂的浓度,包括吡虫啉、啶虫脒、噻虫嗪和噻虫胺在内的4种新烟碱类杀虫剂检出率均为100%,其中吡虫啉含量最高,城市和农村地区平均浓度分别为31.9 和48.0pg/m3.呼吸摄入是非靶标动物和人体直接暴露于新烟碱类杀虫剂的主要途径之一,研究证实该类杀虫剂会对人体肺功能产生一定的影响[33].然而,监测数据的缺乏限制了对新烟碱类杀虫剂环境行为与风险评估的深入研究,这也为进一步开展相关研究及弥补科学认知提供了机会.
残留在环境中的新烟碱类杀虫剂会对非靶标动物的行为、生殖、遗传、神经和脏器等产生毒性,其行为毒性表现在影响非靶标动物的生长发育和活动能力;生殖毒性主要是降低精子质量、影响睾丸发育、损伤生殖功能甚至造成胎儿畸形等;遗传毒性表现在对DNA造成损伤;神经毒性通过影响大脑发育,进而削弱非靶标动物的嗅觉以及反应灵敏度;脏器毒性主要是造成肝脏、肾脏、心脏的氧化损伤.
2 新烟碱类杀虫剂对无脊椎动物的影响
2.1 陆生无脊椎动物
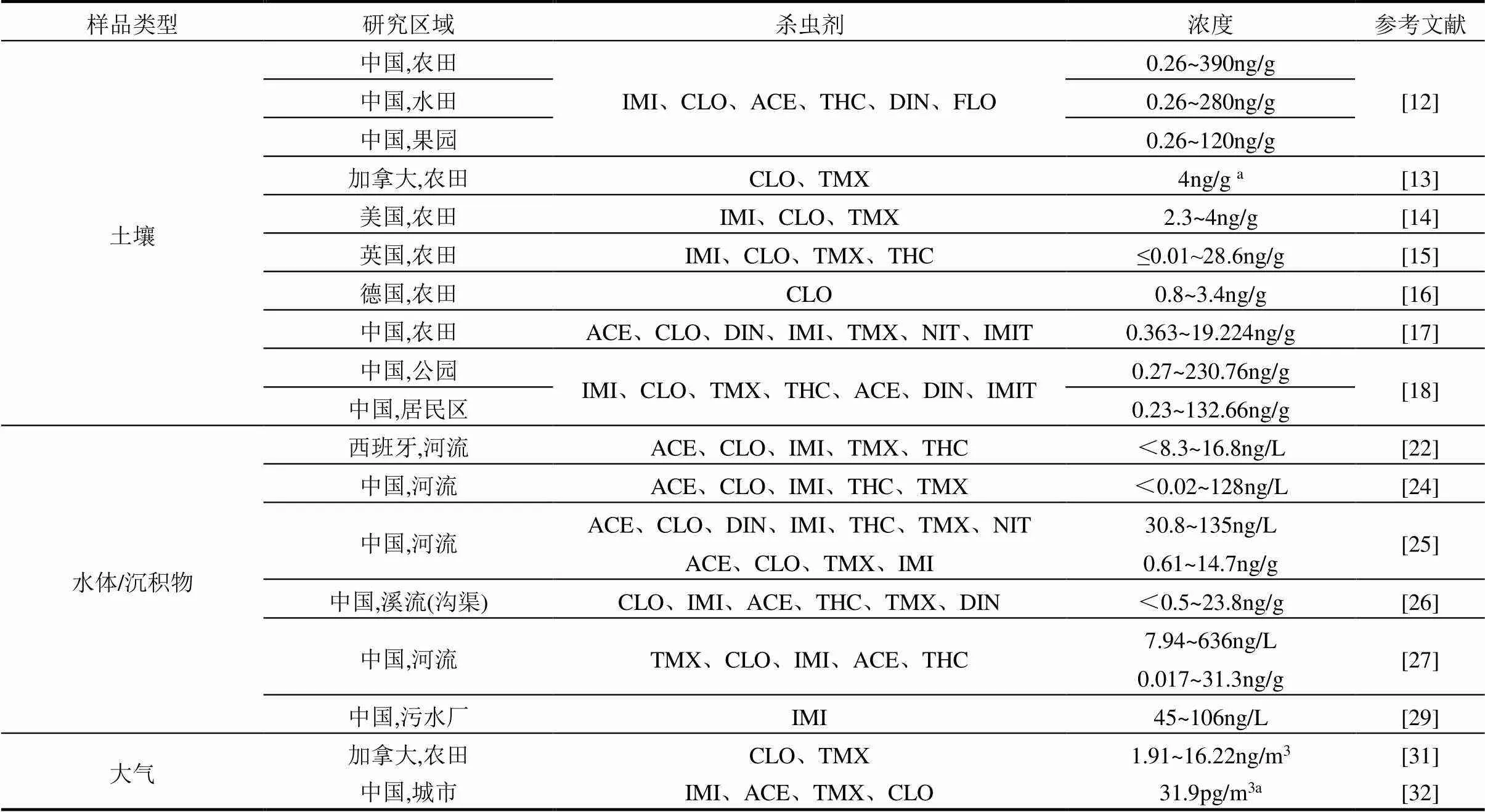
表2 不同环境介质中新烟碱类杀虫剂浓度
注:a为平均浓度;IMI为吡虫啉,TMX为噻虫嗪,CLO为噻虫胺,DIN为呋虫胺,ACE为啶虫脒,THC为噻虫啉,NIT为烯啶虫胺,FLO为氟啶虫酰胺,IMIT为氯噻啉.
蜜蜂是生态系统中重要的传粉者,在维持生物多样性和粮食生产方面发挥着至关重要的作用,因此在新烟碱类杀虫剂对无脊椎动物的研究中,大多以蜜蜂为研究对象[34-35].新烟碱类杀虫剂对蜜蜂的影响可伴随其一生,幼虫期暴露于新烟碱类杀虫剂会干扰大脑皮质、触角神经等功能区的发育,致使蜜蜂成年后嗅觉受损,同时对大脑中蘑菇体的生长产生抑制,进而对活动行为产生影响[36-37];成虫期暴露于吡虫啉会降低工蜂的哺育率、减少巢内活动、改变巢内空间占用率(向巢穴外围移动),同时能够削弱群体的体温调节能力,干扰保温蜡罩的建造[38];以及影响蜜蜂的学习、记忆和定位[39]、减少精子活性、损害免疫系统.Henry等[40]发现噻虫嗪能够减弱觅食蜜蜂的归巢能力,导致蜂群中觅食蜜蜂的数量大量减少,从而增加蜜蜂死亡率.Fischer等[41]将成年蜜蜂暴露于亚致死剂量的新烟碱类杀虫剂后,用雷达对蜜蜂的飞行路径进行追踪,发现蜜蜂在归巢飞行中的返回率显著降低,主要是由于新烟碱类杀虫剂干扰了蜜蜂的记忆能力.Verena等[42]将角壁蜂()暴露于不同浓度(1.5,4.5,10ng/g)的噻虫嗪中,发现精子数量和活力分别下降了57%和42%,这主要是因新烟碱类杀虫剂引起的氧化应激造成精子中线粒体功能受损或精液蛋白丰度降低.值得注意的是,在最低实验浓度(1.5ng/g)下对精子影响最为严重,使活精子总数下降了90%,目前这种非线性剂量反应中的低剂量比高剂量影响更为严重已得到部分研究的证实,但其根本原因尚不清楚.Tsvetkov等[43]进行一项为期2a的研究,量化了加拿大玉米种植区新烟碱类杀虫剂暴露的持续时间和程度,利用该数据进行了相关实验设计,并评估了田间新烟碱类杀虫剂暴露对蜜蜂健康的影响;对照组与实验组之间的对比结果发现,新烟碱类杀虫剂会导致工蜂寿命缩短,并通过降低蜜蜂的卫生行为(一种可遗传行为)来损害蜜蜂的群体免疫系统.综上来看,新烟碱类杀虫剂对蜜蜂产生的亚致死影响是系统的、连贯的并可伴随蜜蜂生长发育的各个阶段.
除蜜蜂外,土壤中新烟碱类杀虫剂的浓度即使在低于安全剂量的情况下,仍可对土壤中无脊椎动物产生较高的毒性,从而损害其在土壤生态系统中的功能[44].新烟碱类杀虫剂对蚯蚓的亚致死效应主要表现在氧化应激以及DNA损伤[45-46].Yan等[47]研究表明将蚯蚓暴露在新烟碱类杀虫剂中28d后,体内丙二醛含量增加,这是由于当生物体处于环境压力下时,内稳态和细胞功能会受到损害,造成活性氧物质(ROS)急剧增加,对生物体产生氧化应激,造成细胞信息传递障碍,细胞膜受到破坏,最终导致脂质过氧化.Zhang等[48]研究发现烯啶虫胺对蚯蚓体腔细胞的DNA具有明显的损伤作用,主要是由于蚯蚓体内的ROS的含量在早期受抗氧化酶作用开始发生变化,导致蚯蚓体内丙二醛含量增加,DNA链断裂.
2.2 水生无脊椎动物
水生无脊椎动物是水生生态系统中的重要组成部分,由于新烟碱类杀虫剂的高水溶性而导致部分水生生物无法避免地受到该类杀虫剂带来的危害.一项数据分析发现,无脊椎动物的种群丰度与附近的吡虫啉浓度呈显著负相关[49].另一项对美国内布拉斯加州农业区湿地水样的调查中发现,水生无脊椎动物的生物量随吡虫啉和噻虫胺浓度的增加而减少[50].现有研究表明,新烟碱类杀虫剂对水生无脊椎动物的亚致死毒性表现在影响生长、酶活性和活动能力.姚媛媛等[51]以红裸须摇蚊()为研究对象,发现暴露在亚致死浓度的新烟碱类杀虫剂下,幼虫的体长和湿重均会受到不同程度的影响,其中啶虫脒对体长影响最大,吡虫啉对湿重影响最为显著.Butcherine等[52-53]针对四种新烟碱类杀虫剂对斑节对虾()影响的研究结果表明,新烟碱类杀虫剂会在斑节对虾腹部组织积累,降低乙酰胆碱酯酶、过氧化氢酶和谷胱甘肽S转移酶(GST)的活性.同时,长期暴露于吡虫啉亚致死浓度下的成年斑节对虾则会导致总脂质含量和体重显著降低,以及脂肪酸组成发生改变,最终导致营养不足,从而影响斑节对虾的生产能力和食用品质.Stara等[54]研究发现,暴露在噻虫啉中会使贻贝()消化腺和鳃中过氧化氢酶活性显著失衡,当噻虫啉浓度达到5mg/L时,则会导致贻贝足丝纤维的产量降低,诱导贻贝从底部脱离,并且不再相互附着.Macaulay等[55]研究发现暴露于12.5 µg/L的吡虫啉则会对蜉蝣目昆虫产生亚致死效应,导致存活率和活动能力下降,并造成蜉蝣目昆虫损伤和蜕皮,随着温度的升高,亚致死作用变强;当浓度为31.5 µg/L时,则会对蜉蝣目昆虫产生致死效应.Siregar等[56]将中华锯齿米虾暴露于不同浓度的吡虫啉24,48,72h后,发现在低浓度(0.03125mg/L)下导致中华锯齿米虾()的活动减缓,高浓度(>0.5mg/L)下则会造成心率降低、鳃呼吸减弱等影响,并最终导致死亡.整体来看,新烟碱类杀虫剂会对非靶标无脊椎动物的生理和生存产生负面影响.其对于陆生无脊椎动物的影响主要表现在干扰大脑中神经系统的发育以及对生物体产生氧化应激造成DNA损伤;对于水生无脊椎动物的影响则主要表现在抑制活动能力,造成心率下降以及呼吸减弱等问题.但现有针对无脊椎动物的研究还相对有限,未来仍需要扩展无脊椎动物的研究种类.
3 新烟碱类杀虫剂对脊椎动物的影响
3.1 陆生脊椎动物
相比之下,新烟碱类杀虫剂对脊椎动物的毒性低于无脊椎动物,但仍会对脊椎动物产生不利影响.由于某些nAChR亚基存在于哺乳动物的睾丸和精子中,因此新烟碱类杀虫剂除对哺乳动物中枢神经系统的损伤之外可能还存在其他影响.目前的研究已经证实,新烟碱类杀虫剂会对大鼠的睾丸发育和生殖产生影响,例如,暴露于啶虫脒中会使大鼠血清中一氧化氮水平增加以及超氧化物歧化酶和过氧化氢酶的抗氧化活性降低,从而引起睾丸的毒性[57].Lovakovi´c[58]等将实验组大鼠连续28d口服不同剂量的吡虫啉,结果发现高剂量(2.25mg/kg)下实验组大鼠的睾丸绝对重量显著低于阴性对照组和低剂量组(0.06和0.8mg/kg),考虑到这些器官生长和功能的正常运行需要雄性激素的持续维持,因此睾丸和附睾重量降低是吡虫啉造成血清睾酮和总蛋白含量下降的直接结果.Ramazan等[59]对大鼠进行不同剂量(2,8,32mg/kg)的噻虫胺灌胃处理,研究发现新烟碱类杀虫剂会对大鼠的生殖系统产生损害,主要表现在大鼠的睾丸功能障碍和精子指标混乱,增加凋亡率.除对生殖系统的影响外,对个体生长发育也会产生影响,Lalita等[60]为了研究新烟碱类杀虫剂对大鼠不同生长阶段的影响,设计3种不同剂量(10,30,90mg/kg)吡虫啉对大鼠不同发育时期(胎儿器官发育期、哺乳期和断奶期)的毒性实验,暴露于新烟碱类杀虫剂的妊娠20d的母鼠子宫胎儿出现骨骼发育畸形;产后第21d天断奶的幼鼠体内血红蛋白呈下降趋势,血小板和淋巴细胞百分比显著增加;暴露于吡虫啉至断奶后42d的小鼠体重减轻,体内总白细胞数显著下降,淋巴细胞和血小板计数百分比呈下降趋势.
鸟类可以通过呼吸、梳理羽毛上的喷雾液滴、饮用残留农药水体以及摄食受污染食物(昆虫、种子、植物果实)等暴露于新烟碱类杀虫剂.亚致死剂量的新烟碱类杀虫剂主要通过两方面影响和减少鸟类种群数量,一是对鸟类生存活动影响,主要表现在抑制其活动能力、减少摄食、增加被捕食风险等;二是对生殖功能的影响,造成精子损伤或抑制胚胎发育,降低后代的质量和数量.鸟类食量减少和体重下降被认为是一种亚致死效应现象,Eng等[61]利用捕获野生鸟类的控制剂量与自动无线电遥测相结合的方法,跟踪了暴露于吡虫啉的白冠带鹀()迁徙活动,发现摄入浓度为1.2~3.6mg/kg的吡虫啉会导致其食量、体重和脂肪迅速减少,造成迁徙过程的停留时间增加和应对恶劣气候的能力变弱,导致被捕食的风险上升.此外,较晚到达迁徙地的鸟类后代的数量会更少.Simon等[62]发现蜂鸟暴露在亚致死水平的吡虫啉环境中(1,2,2.5 µg/g)的活动能力、能量消耗会随着剂量的增加而减少.Poliserpi等[63]对暴露于吡虫啉4,12,24和48h后栗翅牛鹂()肝脏、肾脏和血浆中吡虫啉的浓度进行测定,发现美洲灰海湾鸟摄入35mg/kg剂量药品后5min出现中毒迹象和活动能力下降,表现出肌肉和血浆中胆碱酯酶活性的改变,以及血浆、大脑、肝脏和肌肉中谷胱甘肽S转移酶(GST)活性的改变.Tokumoto等[64]研究了每日口服噻虫胺对成年雄性鹌鹑的生殖功能的影响,分别口服不同剂量的噻虫胺(0.02,1, 50mg/kg),让雄性鹌鹑与未经处理的雌性交配后,测定卵重、受精率和正常发育情况,结果发现噻虫胺可能通过氧化应激使精子DNA断裂而抑制或延缓胚胎发育,新烟碱类杀虫剂对鹌鹑的生殖功能具有严重影响.新烟碱类杀虫剂对陆生脊椎动物的影响主要为生理毒性和生殖毒性,并且毒性的产生可能与氧化应激有关,通过降低体内酶的抗氧化活性对陆生脊椎动物的生长活动以及生殖功能产生影响,通常表现在抑制其活动能力和对睾丸发育、精子质量产生负面影响.
3.2 水生脊椎动物
目前,关于新烟碱类杀虫剂对两栖动物的影响研究较少,通常两栖动物具有复杂的生命周期,在幼虫阶段以水体为栖息地,在成年阶段则以陆地为栖息地.因此,两栖动物在生长发育过程中可暴露于不同种类的农药,其高渗透性皮肤和摄入被污染的食物(水)是两栖动物暴露于新烟碱类杀虫剂的主要方式.Jordan等[65]将南方豹蛙()蝌蚪分别置于不同浓度下(0,0.375,0.75,1.5,3.0, 6.0µg/L)的噻虫胺暴露环境中来观察其总位移、移动速度和移动时间,结果发现虽然暴露于不同浓度下的噻虫胺并未显著降低存活率,但改变了蝌蚪的行为,在暴露96h后,蝌蚪的移动距离变短、速度变慢.这些行为的改变不仅会导致蝌蚪错过最佳的觅食栖息地,同时增加被捕食的风险.新烟碱类杀虫剂同样会对鱼类产生氧化应激,并对DNA造成损伤.Tian等[66]将我国稀有鮈鲫()暴露在3种不同浓度(0.1,0.5, 2.0mg/L)的新烟碱类杀虫剂中60d,发现幼鱼抗氧化酶活性降低,mRNA表达水平发生改变,造成肝脏DNA损伤.Yan等[67]为了研究噻虫嗪对斑马鱼()肝脏氧化应激和抗氧化能力的影响,将斑马鱼暴露于不同浓度(0.30,1.25和5.00mg/ L)噻虫嗪中,发现活性氧(ROS)水平在暴露期间升高;同时噻虫嗪对斑马鱼肝脏DNA也会造成损伤,其损伤程度与噻虫嗪的浓度和时间成正比关系. Vieira等[68]研究发现暴露在吡虫啉下会引起不同组织中生物转化和抗氧化酶活性的变化,暴露于不同浓度的吡虫啉后,组织的氧化还原平衡受到影响,对肝脏、鳃、肾脏和大脑造成脂质过氧化以及蛋白质羰基化等氧化损伤,此过程中肝脏和肾脏往往受影响最为明显.此外,新烟碱类杀虫剂对鱼类的亚致死效应还表现在对其生长发育、活动能力以及神经系统等方面.例如,一项在对斑马鱼()和青鳉()相同发育阶段时体内吡虫啉浓度和生理组织改变程度的研究发现,吡虫啉对二者均有亚致死效应,但对青鳉的亚致死作用更强,会诱导发育畸形、皮肤损伤和生长减缓等[69];Victoria等[70]探究不同浓度(0.02~ 200µg/L)的噻虫嗪对呆鲦鱼()胚胎期和孵化后幼鱼神经毒性的研究结果表明,相较于孵化后,胚胎期暴露噻虫嗪更容易引起明显的神经行为变化.表3系统归纳了新烟碱类杀虫剂对非靶标动物的亚致死效应.
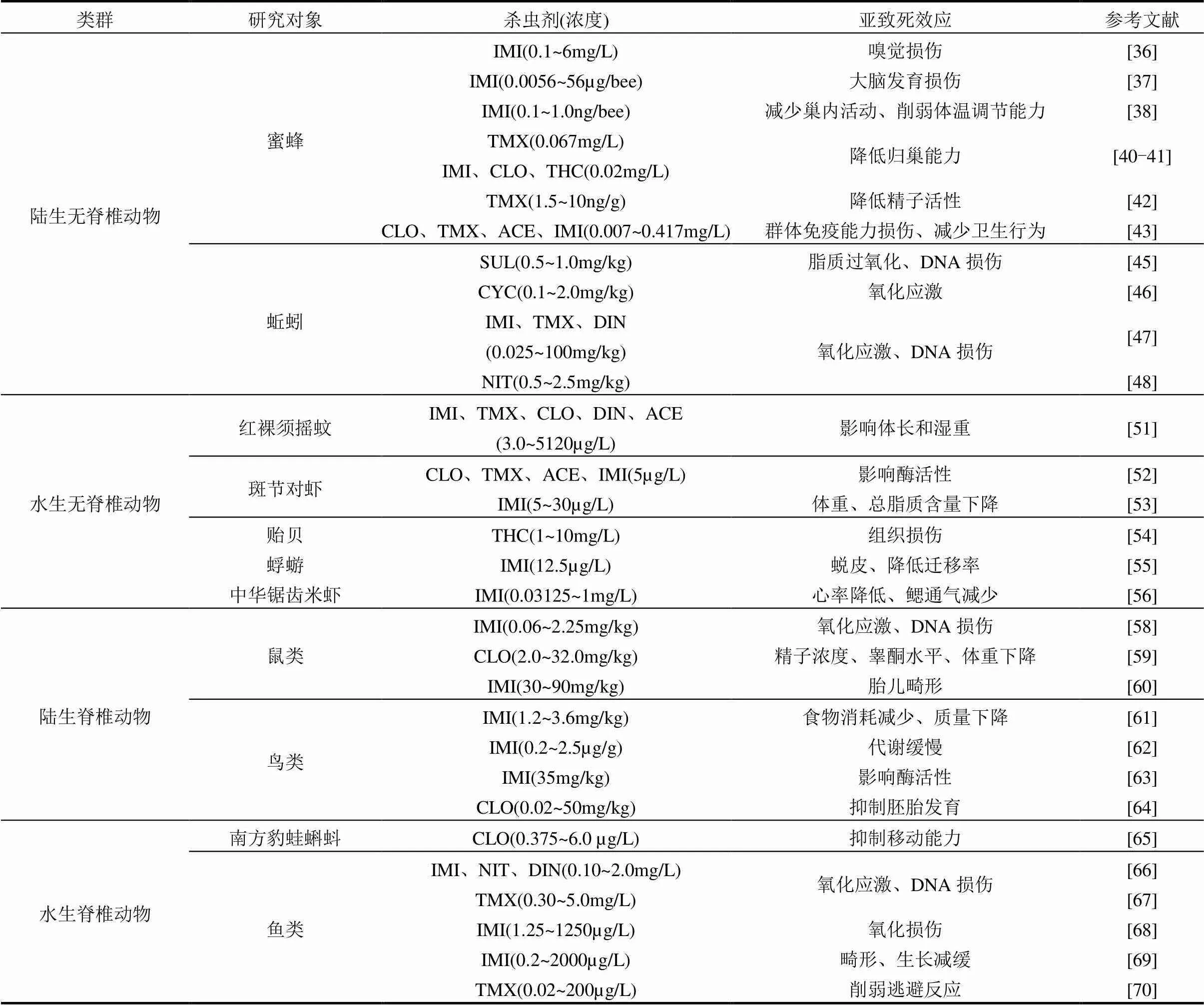
表3 新烟碱类杀虫剂对非靶标动物的亚致死效应
注:IMI为吡虫啉,TMX为噻虫嗪,CLO为噻虫胺,DIN为呋虫胺,ACE为啶虫脒,THC为噻虫啉,NIT为烯啶虫胺,SUL为氟啶虫胺腈,CYC为环氧虫啶.
新烟碱类杀虫剂对不同物种之间产生毒性的剂量差异较大,最大剂量的为陆生脊椎动物(0.06~ 90mg/kg),最小剂量为陆生无脊椎动物(0.001~6mg/L, 0.025~ 2mg/kg).同时从产生毒性的剂量上可以得出,吡虫啉相较于其他种类的新烟碱类杀虫剂对非靶标动物产生的毒性均较大.例如,以新烟碱类杀虫剂对红裸须摇蚊)的体长和湿重影响为例,吡虫啉和噻虫嗪设置的浓度范围为分别为3~48和320~5120µg/L,剂量相差100倍左右.这种毒性的差异在不同种类的杀虫剂及物种之间普遍存在,今后需进行相关研究来论证新烟碱类杀虫剂在不同环境因素条件下对不同种类非靶标动物的毒性效应及其发生机制.
4 人体暴露和健康风险
4.1 外暴露
饮食被认为是人体暴露于新烟碱类杀虫剂的主要途径.由于新烟碱类杀虫剂被植物吸收后可到达植物体内的不同部位[71],即在作物生长期经过新烟碱类杀虫剂处理后会存在于各组织器官(根、茎、叶、花、果实和种子)中.Wang等[72]对黑龙江、内蒙古和云南3个粮食主产区的4种粮食作物进行研究表明,在黑龙江、内蒙古和云南的糙米和燕麦中分别检测到了吡虫啉和噻虫嗪的残留,其中噻虫嗪在内蒙古糙米中的残留量达0.102µg/g,高于欧盟的最大残留限量(大米0.05µg/g).Chen等[73]测定了我国24个省份528份复合膳食样品中10种新烟碱类杀虫剂的残留水平,发现大部分食物样品中存在目标污染物,而吡虫啉和啶虫脒是最常见的新烟碱类杀虫剂.此外,通过该调查发现新烟碱类杀虫剂的平均日摄入量达到710.38ng/kg,低于目前美国环境保护署(EPA)提供的慢性参考剂量57µg/(kg×d)[30].Chauzat等[74]在2002年10月~2005年9月期间对法国24个地点检测了239个蜂蜜样本,其中吡虫啉的检出率最高为21.8%,平均浓度为0.7ng/g.
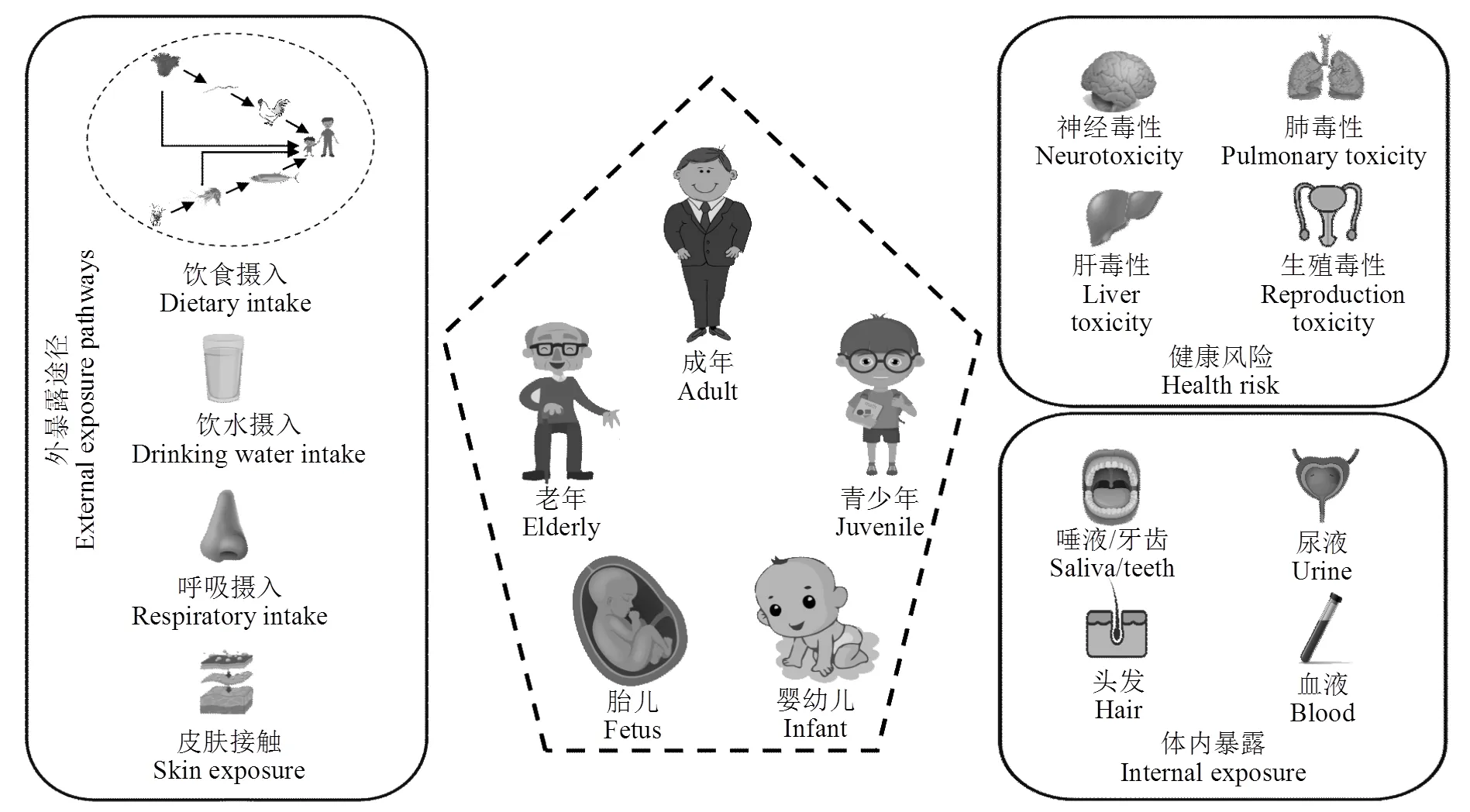
图2 人体暴露及健康风险
饮水摄入也是人体暴露于新烟碱类杀虫剂的重要途径之一[75].Klarich等[76]在爱荷华大学采集了饮用水样本,其中噻虫胺、吡虫啉和噻虫嗪的检出率为100%,浓度分别为3.89~57.3, 1.22~39.5和0.24~4.15ng/L.Zhang等[77]对来自中国6个地区的自来水、井水、直饮水和瓶装水中存在的5种典型新烟碱类杀虫剂的污染水平进行了分析,发现所有水样中检测到的新烟碱类杀虫剂的几何平均浓度(ng/L)由高到低为:吡虫啉(1.76)>噻虫嗪(1.20)>噻虫胺(0.73)>啶虫脒(0.47)>噻虫啉(0.01).其中,自来水中5种典型新烟碱类杀虫剂的浓度中位数均高于其他3种饮用水,不同类型水中该类杀虫剂的浓度(ng/L)大小依次为:自来水(11.3)>井水(4.56)>直饮水(2.57)>瓶装水(0.28).自来水作为人们日常生活的主要水源,每天会被人们大量摄入,虽然在饮用前会对其进行加热煮沸,但从目前有限的研究来看,似乎对水中新烟碱类杀虫剂的消除无明显作用.因此,如何能够有效去除饮用水中的新烟碱类杀虫剂是未来值得研究的重点.此外,Liu等[78]在浙江省某农业区采集的25个茶叶样品中检测出吡虫啉和啶虫脒两种新烟碱类杀虫剂.其中11个样品中啶虫脒的含量为0.2~10ng/g,3个样品中吡虫啉的含量为2.8~6.3ng/g.除此之外,人体暴露于此类杀虫剂的途径可能还包括呼吸和皮肤接触等.尽管当前研究中饮食和饮水摄入的新烟碱类杀虫剂的暴露水平低于当前美国环境保护署(EPA)提出的吡虫啉慢性参考剂量57μg/(kg·d)[30],但每日通过不同途径摄入新烟碱类杀虫剂的总剂量给人们带来的风险仍然不容忽视.新烟碱类杀虫剂的人体暴露途径及可能引起的健康风险,如图2所示.
4.2 内暴露
近年来,关于新烟碱类杀虫剂在人体内暴露的研究主要集中于尿液、唾液和血液等,也有部分关于人体头发和牙齿的研究.例如,Tao等[79]在中国河南省随机抽取43名不同年龄段的新烟碱类杀虫剂施药者,在施药前后进行现场尿样采集,尿液样本中吡虫啉的检出率为100%,施药前后尿液中吡虫啉的浓度范围分别为0.57~8.91和0.38~24.58ng/mL,并进一步估算出在农药喷洒前后,施药者的吡虫啉每日吸收剂量为0.52~61.66、7.65~248.05μg/(kg·d),均低于世界卫生组织/粮农组织规定的急性暴露指标400 μg/(kg·d),但喷洒农药后有32.6%的施药者每日吡虫啉吸收剂量超过了规定的慢性暴露指标60μg/(kg·d).在日本,Osaka等[80]和Ueyama等[81]分别对儿童和成年人群尿液样本进行了检测,啶虫脒、吡虫啉、噻虫啉、噻虫嗪、噻虫胺、呋虫胺和烯啶虫胺7种新烟碱类杀虫剂均被检测到,其中呋虫胺浓度最大,在儿童及成年人尿液样本中最大浓度分别为62.25和27.4µg/L.相比于亚洲人群,欧美国家人体内新烟碱类杀虫剂的暴露水平相对较低,美国尿液样本中新烟碱类杀虫剂的检出率<40%,整体范围在 表4 各国人群新烟碱类杀虫剂的体内暴露情况 注:a为几何平均浓度,LOD为最小检出限;IMI为吡虫啉,TMX为噻虫嗪,CLO为噻虫胺,DIN为呋虫胺,ACE为啶虫脒,THC为噻虫啉,NIT为烯啶虫胺. 一般认为暴露于低浓度新烟碱类杀虫剂环境中对人体健康影响较小,但现有研究表明,长期接触新烟碱类杀虫剂会对人类造成生育缺陷、神经系统及肝肺功能受损等多方面影响(图2).Ichikawa等[89]于2019年采集了胎龄23~34周、出生体重500~ 1500g新生儿的116份尿液样本,发现低体重婴儿出生后的48h内,尿液中新烟碱类杀虫剂代谢物的检出率(24.6%)高于出生后14d的检出率(11.9%);早产儿尿液的检出率和平均浓度(42.9%,0.04ng/mL)均高于适龄胎儿(14.7%,0.02ng/mL);在对出生48h内的婴儿尿液研究发现,新烟碱类杀虫剂代谢物水平与出生体重、体长和头围存在微弱的负相关. Wang等[90]在中国石家庄采集了191份精浆样本,检测到去甲基啶虫脒、吡虫啉-烯烃和去甲基噻虫胺,其检出率分别为98.4%,86.5%,70.8%;中值浓度分别为0.052,0.003和0.007ng/mL,此研究表明精子活力的大小与吡虫啉-烯烃浓度呈显著负相关. Loser等[91]通过进行人类神经元Ca2+成像实验,发现去硝基吡虫啉有类似神经毒物尼古丁的作用,能够通过触发α7和非α7nAChRs影响人类神经元.Hernández等[92]研究了新烟碱类杀虫剂人体呼吸道健康的影响,发现喷雾者和非喷雾者的肺活量及弥散功能在统计学上存在显著差异,通过分析认为,暴露于新烟碱类杀虫剂会导致肺容量减少,造成肺功能障碍.Zhang等[93]收集了中国华南地区374份血液样本(普通人群100份,肝癌患者274份),发现肝癌人群血液中新烟碱类杀虫剂及其代谢物的浓度中位值(0.20~ 2.03ng/mL)高于健康人群(0.19~1.28ng/mL),表明新烟碱类杀虫剂的暴露与肝癌的发生存在相关性.新烟碱类杀虫剂的暴露能够对人类的生育、生殖、神经以及脏器功能带来风险.该类杀虫剂可以通过母亲传递给胎儿,导致胎儿发育不良,出现早产现象;其在人体内产生的代谢物会降低精子质量、损伤肺功能以及增加患癌风险.目前该领域的相关研究仍存在一定的局限性,难以提供全面的评估,还需要进一步研究对人体健康的影响. 新烟碱类杀虫剂在多介质环境中的普遍存在给生态环境安全和人体健康带来了威胁和风险.环境中的非靶标生物能够通过摄食、饮水、呼吸和皮肤接触暴露于该类杀虫剂,并产生致死或亚致死效应.新烟碱类杀虫剂能够影响蜜蜂的飞行、学习和记忆等功能;对蚯蚓的生殖和DNA造成损伤;对脊椎动物的生殖功能和生长发育产生严重影响;对人体则可以造成新生儿出生缺陷、生殖系统和呼吸系统受损等多方面影响.虽然欧美等国家已经相继出台禁令,限制新烟碱类杀虫剂的使用以缓解其给生态环境带来的压力,但该类杀虫剂目前仍占有较大的市场份额.因此,未来需要加强研究该类杀虫剂的环境污染特征及其对非靶标生物毒性效应与发生机制,尤其是水生生物以及易暴露人群和脆弱人群(老年人、儿童和孕妇等). 目前,有关大气中新烟碱类杀虫剂污染的研究仍处于监测数据较少的状况,无法准确评估呼吸摄入该类杀虫剂对非靶标生物的呼吸系统以及肺功能造成的影响;其次,当前有关暴露水平的研究一般只针对某种新烟碱类杀虫剂及其代谢产物,对于多种化合物联合暴露研究较少,因此无法对该类杀虫剂的暴露情况以及其毒理性进行系统地全面评估,同时应加强新烟碱类杀虫剂与其他农药、化肥和抗生素等联合暴露对不同非靶标生物的毒性效应研究;新烟碱类杀虫剂极易溶于水,如何高效去除水体中的此类杀虫剂,防止污水使用或再生水排放等给环境带来的二次污染仍是未来应研究的重点;此外,仍需要开发新型、微毒、高效率的替代杀虫剂,以减少对环境的污染及对非靶标生物造成的影响. [1] Costas-Ferreira C, Faro L R F. Neurotoxic Effects of Neonicotinoids on Mammals: What Is There beyond the Activation of Nicotinic Acetylcholine Receptors?—A Systematic Review [J]. International Journal of Molecular Sciences, 2021,22(16):8413. [2] 张 琪,赵 成,卢晓霞,等.新烟碱类杀虫剂对非靶标生物毒性效应的研究进展[J]. 生态毒理学报, 2020,15(1):56-71. Zhang Q, Zhao C, Lu X X, et al. Advances in research on toxic effects of neonicotinoid insecticides on non-target organisms [J]. Asian Journal of Eco-toxicology, 2020,15(1):56-71. [3] 刘子琪,呼 啸,李 莉,等.新烟碱类农药呋虫胺对映体选择性研究进展[J]. 中国环境科学, 2021,41(10):4811-4819. Liu Z Q, Hu X, Li L, et al. Research progress on the enantioselectivity of a neonicotinoid pesticide dinotefuran [J]. China Environmental Science, 2021,41(10):4811-4819. [4] Bass C, Denholm I, Williamson M S, et al. The global status of insect resistance to neonicotinoid insecticides [J]. Pesticide Biochemistry and Physiology, 2015,121:78-87. [5] Cimino A M, Boyles A L, Thayer K A, et al. Effects of Neonicotinoid Pesticide Exposure on Human Health: A Systematic Review [J]. Environmental Health Perspectives, 2017,125(2):155-162. [6] Malhotra N, Chen K H C, Huang J C, et al. Physiological Effects of Neonicotinoid Insecticides on Non-Target Aquatic Animals—An Updated Review [J]. International Journal of Molecular Sciences, 2021,22(17):9591. [7] Han W C, Tian Y, Shen X M. Human exposure to neonicotinoid insecticides and the evaluation of their potential toxicity: an overview [J]. Chemosphere, 2017,192:59-65. [8] Humann-Guilleminot S, Tassin de Montaigu C, Sire J, et al. A sublethal dose of the neonicotinoid insecticide acetamiprid reduces sperm density in a songbird [J]. Environmental Research, 2019,177: 108589. [9] Gibbons D, Morrissey C, Mineau P. A review of the direct and indirect effects of neonicotinoids and fipronil on vertebrate wildlife [J]. Environmental Science and Pollution Research, 2015,22(1):103-118. [10] 李田田,郑珊珊,王 晶,等.新烟碱类农药的污染现状及转化行为研究进展[J]. 生态毒理学报, 2018,13(4):9-21. Li T T, Zheng S S, Wang J, et al. A review on occurence and transformation behaviors of neonicotinoid pesticides [J]. Asian Journal of Ecotoxicology, 2018,13(4):9-21. [11] 程浩淼,成 凌,朱腾义,等.新烟碱类农药在土壤中环境行为的研究进展[J]. 中国环境科学, 2020,40(2):736-747. Cheng H M, Cheng L, Zhu T Y, et al. Research progress on environmental behaviors of neonicotinoids in the soil [J]. China Environmental Science, 2020,40(2):736-747. [12] Yu Z, Li X F, Wang, S, et al. The human and ecological risks of neonicotinoid insecticides in soils of an agricultural zone within the Pearl River Delta, South China [J]. Environmental Pollution, 2021, 284:117358. [13] Schaafsma A, Victor L R, Xue Y. et al. Field-scale examination of neonicotinoid insecticide persistence in soil as a result of seed treatment use in commercial maize (corn) fields in southwestern Ontario [J]. Environmental Toxicology and Chemistry, 2016,35(2): 295-302. [14] Stewart S D, Lorenz G M, Catchot A L. et al. Potential exposure of pollinators to neonicotinoid insecticides from the use of insecticide seed treatments in the Mid-Southern United States [J]. Environmental Science & Technology, 2014,48(16):9762-9769. [15] Botías C, David A, Horwood J, et al. Neonicotinoid residues in wildflowers, a potential route of chronic exposure for bees [J]. Environmental Science & Technology, 2015,49:12731-12740. [16] Heimbach F, Russ A, Schimmer M. et al. Large-scale monitoring of effects of clothianidin dressed oilseed rape seeds on pollinating insects in Northern Germany: implementation of the monitoring project and its representativeness [J]. Ecotoxicology, 2016,25(9):1630-1647. [17] Wu R L, He W, Li Y L, et al. Residual concentrations and ecological risks of neonicotinoid insecticides in the soils of tomato and cucumber greenhouses in Shouguang, Shandong Province, East China [J]. Science of The Total Environment, 2020,738:140248. [18] Zhou Y, Lu X X,Fu, X F, et al. Development of a fast and sensitive method for measuring multiple neonicotinoid insecticide residues in soil and the application in parks and residential areas [J]. Analytica Chimica Acta, 2018,1016:19-28. [19] 秦萌,任宗杰,张帅,等.从“农药零增长行动”看“农药减量化”发展[J]. 中国植保导刊, 2021,41(11):89-94. Qin M, Ren Z J, Zhang S, et al. Development of “Pesticide Reduction” from the Perspective of “Pesticide Zero Growth Action” [J]. China Plant Protection, 2021,41(11):89-94. [20] Liu Z K, Zhang L M, Zhang Z L, et al. A review of spatiotemporal patterns of neonicotinoid insecticides in water, sediment, and soil across China [J]. Environmental Science and Pollution Research, 2022,29(37):55336-55347. [21] Morrissey C A, Mineau P, Devries J H, et al. Neonicotinoid contamination of global surface waters and associated risk to aquatic invertebrates: A review [J]. Environment International, 2015(74):291- 303. [22] Casillas A, Torre A D,Navarro I, et al. Environmental risk assessment of neonicotinoids in surface water [J]. Science of the Total Environment, 2022,809:151161. [23] Hladik M L, Kolpin D W. First national-scale reconnaissance of neonicotinoid insecticides in streams across the USA [J]. Environmental Chemistry, 2016,13(1):12-20. [24] Naumanna T, Bento C M, Andreas W, et al. Occurrence and ecological risk assessment of neonicotinoids and related insecticides in the Bohai Sea and its surrounding rivers, China [J]. Water Research, 2022,209: 117912. [25] Liu Z, Cui S, Zhang L M, et al. Occurrence, variations, and risk assessment of neonicotinoid insecticides in Harbin section of the Songhua River, northeast China [J]. Environmental Science and Ecotechnology, 2021,8:100128. [26] Huang Z B, Li H Z, Wei Y L, et al. Distribution and ecological risk of neonicotinoid insecticides in sediment in South China: Impact of regional characteristics and chemical properties [J]. Science of The Total Environment, 2020,714:136878. [27] Zhang C, Yi X H, Chen C, et al. Contamination of neonicotinoid insecticides in soil-water-sediment systems of the urban and rural areas in a rapidly developing region: Guangzhou, South China [J]. Environment International, 2020,139:105719. [28] Pietrzak D, Kania J, Kmiecik E, et al. Fate of selected neonicotinoid insecticides in soil-water systems: current state of the art and knowledge gaps [J]. Chemosphere, 2020,255:126981. [29] Qi W X, Singer H, Berg M, et al. Elimination of polar micropollutants and anthropogenic markers by wastewater treatment in Beijing, China [J]. Chemosphere, 2015,119:1054-1061. [30] 韩明慧,方虹霁,王园平,等.新烟碱类农药污染和人体暴露及有害效应研究[J]. 上海预防医学, 2021,33(6):534-543. Han M H, Fang H J, Wang Y P, et al. Pollution, human exposure and harmful effects of neonicotinoid pesticides [J]. Shanghai Journal of Preventive Medicine, 2021,33(6):534-543. [31] Forero L G, Limay-Rios V, Xue Y E, et al. Concentration and movement of neonicotinoids as particulate matter downwind during agricultural practices using air samplers in southwestern Ontario, Canada [J]. Chemosphere, 2017,188:130-138. [32] Zhou Y, Guo J Y, Wang, Z K, et al. Levels and inhalation health risk of neonicotinoid insecticides in fine particulate matter (PM2.5) in urban and rural areas of China [J]. Environment International, 2020,142: 105822. [33] Hernández A F, Casado I, Pena G, et al. Low level of exposure to pesticides leads to lung dysfunction in occupationally exposed subjects [J], Inhalation Toxicology, 2008,20(9):839-849. [34] Breeze T D, Bailey A P, Balcombe K G, et al. Pollination services in the UK: How important are honeybees? [J]. Agriculture Ecosystems Environment, 2011,142:137-143. [35] Choudhary A, Mohindru B, Karedla A K, et al. Sub-lethal effects of thiamethoxam onLinnaeus [J]. Toxin Reviews, 2022, 41(3):1044-1057. [36] Yang E C, Chang H C, Wu W Y, et al. Impaired olfactory associative behavior of honeybee workers due to contamination of imidacloprid in the larval stage [J]. Plos One, 2012,7(11):e49472. [37] Tomé H V V, Martins G F, Lima M A P, et al. Imidacloprid induced impairment of mushroom bodies and behavior of the native stingless bee[J]. Plos One, 2012,7(6): e38406. [38] Crall J D, Switzer C M, Oppenheimer R L, et al. Neonicotinoid exposure disrupts bumblebee nest behavior, social networks, and thermoregulation [J]. Science, 2018,362(6415):683-686. [39] Pisa L. W, Amaral-Rogers V, Belzunces L P, et al. Effects of neonicotinoids and fipronil on non-target invertebrates [J]. Environmental Science and Pollution Research, 2015,22(1):68-102. [40] Henry M, Beguin M, Requier F, et al. A common pesticide decreases foraging success and survival in honey bees [J]. Science, 2012,336 (6079):348-350. [41] Fischer J, Müller T, Spatz A K, et al. Neonicotinoids Interfere with Specific Components of Navigation in Honeybees [J]. Plos One, 2014,9(3):e91364. [42] Verena S, Matthias A, Laura V B. et al. The neonicotinoid thiamethoxam impairs male fertility in solitary bees,[J]. Environmental Pollution, 2021,284:117106. [43] Tsvetkov N, O Samson-Robert, Sood K, et al. Chronic exposure to neonicotinoids reduces honey bee health near corn crops [J]. Science, 2017,356:1395-1397. [44] Bernardino M M, Alves P R, Santo F B, et al. Ecotoxicity of imidacloprid to soil invertebrates in two tropical soils with contrasting texture [J]. Environmental Science and Pollution Research, 2021,28 (22):27655-27665. [45] Zhang X L, Wang X G, Liu Y L, et al. The Toxic Effects of Sulfoxaflor Induced in Earthworms () under Effective Concentrations [J]. International Journal of Environmental Research and Public Health, 2020,17(5):1740. [46] Qi S, Wang D H, Zhu L Z, et al. Effects of a novel neonicotinoid insecticide cycloxaprid on earthworm,[J]. Environmental Science and Pollution Research, 2018,25(14):14138- 14147. [47] Yan X J, Wang J, Zhu L S, et al. Oxidative stress, growth inhibition, and DNA damage in earthworms induced by the combined pollution of typical neonicotinoid insecticides and heavy metals [J]. Science of the Total Environment, 2021,754:141873. [48] Zhang W, Xia X M, Wang J H. et al. Oxidative stress and genotoxicity of nitenpyram to earthworms () [J]. Chemosphere, 2021,264(2):128493. [49] Van Dijk T C, Van Staalduinen M A, Van der Sluijs J P, et al. Macro-Invertebrate Decline in Surface Water Polluted with Imidacloprid [J]. Plos One, 2013,8(5):e62374. [50] Schepker T J, Webb E B, Tillitt D, et al. Neonicotinoid insecticide concentrations in agricultural wetlands and associations with aquatic invertebrate communities [J]. Agriculture, Ecosystems & Environment, 2020,287:106678. [51] 姚媛媛,龙辰,王斌等.5种新烟碱类杀虫剂对休眠期和发育期红裸须摇蚊幼虫的急性毒性研究[J].安徽农业科学, 2021,49(20):1-5. Yao Y Y, Long C, Wang B, et al. Study on acute toxicity of five neonicotinoid insecticides to the larvae ofin dormant and developmental phase [J]. Anhui Agriculture Science, 2021,49(20):1-5. [52] Butcherine P, Kelaher B P, Taylor M D, et al. Acute toxicity, accumulation and sublethal effects of four neonicotinoids on juvenile black tiger shrimp () [J]. Chemosphere, 2021,275:129918. [53] Butcherine P, Kelaher B P, Taylor M D, et al. Impact of imidacloprid on the nutritional quality of adult black tiger shrimp () [J]. Ecotoxicology and Environmental Safety, 2020,198: 110682. [54] Stara A, Pagano M, Capill G, et al. Acute effects of neonicotinoid insecticides on: A case study with the active compound thiacloprid and the commercial formulation calypso 480SC [J]. Ecotoxicology and Environmental Safety, 2020,203:110980. [55] Macaulay S J, Buchwalter D B, Matthaei C D, et al. Water temperature interacts with the insecticide imidacloprid to alter acute lethal and sublethal toxicity to mayfly larvae [J]. New Zealand Journal of Marine. Freshwater Research, 2019,54(1):115-130. [56] Siregar P, Suryanto M E, Chen K H, et al. Exploiting the freshwater shrimpas aquatic invertebrate model to evaluate nontargeted pesticide induced toxicity by investigating physiologic and biochemical parameters [J]. Antioxidants, 2021,10(3): 391. [57] Heba N, Rasha A, Lamia R, et al. Mechanisms and histopathological impacts of acetamiprid and azoxystrobin in male rats [J]. Environmental Science and Pollution Research, 2022,29:43114- 43125. [58] Lovakovi´c T B, Kašuba V, Sekovani´c A, et al. Effects of Sub-Chronic Exposure to Imidacloprid and Reproductive Organs of Adult Male Rats: Antioxidant State, DNA Damage, and Levels of Essential Elements [J]. Antioxidants, 2021,10(12):1965. [59] Ramazan B, Gaffari T, Ökkeş Y, et al. Effects of clothianidin exposure on sperm quality, testicular apoptosis and fatty acid composition in developing male rats [J]. Cell Biology and Toxicology, 2012,28(3): 187-200. [60] Lalita G, Shruta S, Raghib H, et al. A detailed study of developmental immunotoxicity of imidacloprid in Wistar rats [J]. Food and Chemical Toxicology, 2013,51:61-70. [61] Eng M L, Stutchbury B J M, Morrissey C A. A neonicotinoid insecticide reduces fueling and delays migration in songbirds [J]. Science, 2019,365(6458):1177-1180. [62] English S G, Sandoval-Herrera N I, Bishop C A, et al. Neonicotinoid pesticides exert metabolic effects on avian pollinators [J]. Scientific Reports, 2021,11(1):2914. [63] Poliserpi M B, Cristos D, Perez I J M, et al. Tissue distribution and sublethal effects of imidacloprid in the South American grayish baywing () [J]. Chemosphere, 2021,284:131327. [64] Tokumoto J, Danjo M, Kobayashi Y, et al. Effects of Exposure to Clothianidin on the Reproductive System of Male Quails [J]. Journal of Veterinary Medical science, 2013,75(6):755-760. [65] Jordan N H, Freya E R, Puglis H J, et al. Effects of the Neonicotinoid Insecticide Clothianidin on Southern Leopard Frog () Tadpole Behavior [J]. Bulletin of Environmental Contamination and Toxicology, 2019,103(5):717-722. [66] Tian X, Hong X, Yan S, et al. Neonicotinoids caused oxidative stress and DNA damage in juvenile Chinese rare minnows () [J]. Ecotoxicology and Environmental Safety, 2020,197: 110566. [67] Yan S H, Wang J H,Zhu L S, et al. Thiamethoxam induces oxidative stress and antioxidant response in zebrafish () livers [J]. Environmental Toxicology, 2016,31(12):2006-2015. [68] Vieira C E D, Pérez M R, Acayaba R D, et al. DNA damage and oxidative stress induced by imidacloprid exposure in different tissues of the Neotropical fish[J]. Chemosphere, 2018, 195:125-134. [69] Vignet C, Cappello T,Fu Q G, et al. Imidacloprid induces adverse effects on fish early life stages that are more severe in Japanese medaka () than in zebrafish () [J], Chemosphere, 2019,225:470-478. [70] Victoria S, Duffy S, Harrahy E, et al. Embryonic Exposure to Thiamethoxam Reduces Survival and Alters Neurobehavior of Fathead Minnows [J]. Environmental Toxicology and Chemistry, 2022,41(5): 1276-1285. [71] Bonmatin J M, Giorio C, Girolami V, et al. Environmental fate and exposure; neonicotinoids and fipronil [J]. Environmental Science and Pollution Research, 2015,22(1):35-67. [72] Wang P, Yang X, Wang J, et al. Multi-residue method for determination of seven neonicotinoid insecticides in grains using dispersive solid-phase extraction and dispersive liquid-liquid micro- extraction by high performance liquid chromatography [J]. Food Chemistry, 2012,134(3):1691-1698. [73] Chen D W, Zhang Y P, Lv B, et al. Dietary exposure to neonicotinoid insecticides and health risks in the Chinese general population through two consecutive total diet studies [J]. Environment International, 2020,135:105399. [74] Chauzat M P, Martel A C, Nicolas C, et al. An assessment of honeybee colony matrices,() to monitor pesticide presence in continental France [J]. Environmental Toxicology Chemistry, 2011,30(1):103-111. [75] Englert D, Zubrod J P, Link M, et al. Does waterborne exposure explain effects caused by neonicotinoid-contaminated plant material in aquatic systems? [J] Environmental Science Technology, 2017,51: 5793-5802. [76] Klarich K L, Pflug N C, DeWald E M, et al. Occurrence of neonicotinoid insecticides in finished drinking water and fate during drinking water treatment [J]. Environmental Science Technology Letters, 2017,4(5):168-173. [77] Zhang C, Yi X H, Xie L, et al. Contamination of drinking water by neonicotinoid insecticides in China: Human exposure potential through drinking water consumption and percutaneous penetration [J]. Environment International, 2021,156:106650. [78] Liu S T, Zhen Z T, Wei F L, et al. Simultaneous Determination of Seven Neonicotinoid Pesticide Residues in Food by Ultraperformance Liquid Chromatography Tandem Mass Spectrometry [J]. Journal of Agricultural and Food Chemistry, 2010,58(6):3271-3278. [79] Tao Y, Phung D, Dong F S, et al. Urinary monitoring of neonicotinoid imidacloprid exposure to pesticide applicators [J], Science of the Total Environment, 2019,669:721-728. [80] Osaka A, Ueyama J, Kondo T, et al. Exposure characterization of three major insecticide lines in urine of young children in Japan— neonicotinoids, organophosphates, and pyrethroids [J]. Environmental Research, 2016,147:89-96. [81] Ueyama J, Nomura H, Kondo T, et al. Biological Monitoring Method for Urinary Neonicotinoid Insecticides Using LC‐MS/MS and Its Application to Japanese Adults [J]. Occupational Health, 2014,56(6): 461-468. [82] Baker S E, Serafim A B, Morales-Agudelo P, et al. Quantification of DEET and neonicotinoid pesticide biomarkers in human urine by online solid-phase extraction high-performance liquid chromatography-tandem mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2019,411(3):669-678. [83] Kavvalakis M P, Tzatzarakis M N, Theodoropoulou E P, et al. Development and application of LC-APCI-MS method for biomonitoring of animal and human exposure to imidacloprid [J]. Chemosphere, 2013,93(10):2612-2620. [84] Wang L, Liu T Z, Liu F, et al. Occurrence and profile characteristics of the pesticide imidacloprid, preservative parabens, and their metabolites in human urine from rural and urban China [J]. Environmental Science & Technology, 2015,49(24):14633-14640. [85] Wang H X, Yang D J, Fang H J, et al. Predictors, sources, and health risk of exposure to neonicotinoids in Chinese school children: a biomonitoring-based study [J]. Environment International, 2020,143: 105918. [86] Zhang N, Wang B T, Zhang Z P, et al. Occurrence of neonicotinoid insecticides and their metabolites in tooth samples collected from south China: Associations with periodontitis [J]. Chemosphere, 2021,264:128498. [87] Xua M M, Zhang Z P, Li Z Y, et al. Profiles of neonicotinoid insecticides and characteristic metabolites in paired urine and blood samples: Partitioning between urine and blood and implications for human exposure [J]. Science of the Total Environment, 2021,733: 145582. [88] Zhang H, Zhang N, Zhou W, et al. Profiles of neonicotinoid insecticides and their metabolites in paired saliva and periodontal blood samples in human from South China: Association with oxidative stress markers [J]. Ecotoxicology and Environmental Safety, 2021,212: 112001. [89] Ichikawa G, Kuribayashi R, Yoshinori I, et al. LC-ESI/MS/MS analysis of neonicotinoids in urine of very low birth weight infants at birth [J], Plos One, 2019,14(7):e0219208. [90] Wang A Z, Wan Y J, Zhou L X, et al. Neonicotinoid insecticide metabolites in seminal plasma: Associations with semen quality [J]. Science of the Total Environment, 2022, 811:151407. [91] Loser D, Grillberger K, Hinojosa M G, et al. Acute effects of the imidacloprid metabolite desnitro‑imidacloprid on human nACh receptors relevant for neuronal signaling [J]. Archives of Toxicology, 2021,95(12):3695-3716. [92] Hernández A F, Casado I, Pena G, et al. Low Level of Exposure to Pesticides Leads to Lung Dysfunction in Occupationally Exposed Subjects [J]. Inhalation Toxicology, 2008,20(9):839-849. [93] Zhang H, Zhang R W,Zeng X J, et al. Exposure to neonicotinoid insecticides and their characteristic metabolites: Association with human liver cancer [J]. Environmental Research, 2022,208:112703. Pollution characteristics and toxic effects of neonicotinoid insecticides. CUI Song*, LI Fei, LIU Zhi-kun (International Joint Research Center for Persistent Toxic Substances (IJRC-PTS), School of Water Conservancy and Civil Engineering, Research Center for Eco-Environment Protection of Songhua River Basin, Northeast Agricultural University, Harbin 150030, China)., 2023,43(1):361~373 This paper reviewed the occurrence status of neonicotinoid insecticides in soil, water and atmosphere and their toxic effects on invertebrates, vertebrates, and humans. Neonicotinoids commonly exist in multi-media environments, especially in the agricultural planting areas with high residual concentrations. The effects of neonicotinoids on non-target organisms were mainly manifested in oxidative stress, inhibition of activity, damage to DNA and reproductive function, while they also posed risks to human fertility, reproduction, nerves, and organ functions. Therefore, it is urgent to systematically study the occurrence and pollution of neonicotinoid insecticides in multi-environmental media and explore their health effects on non-target organisms, which could help to fully understand the potential risks of these insecticides on the ecological environment and non-target organisms in the future. neonicotinoid insecticides;pollution characteristics;non-target organisms;toxicity effect X171.5 A 1000-6923(2023)01-0361-13 崔 嵩(1981-),男,黑龙江宝清人,教授,博士,主要从事农业水土资源环境效应研究.发表论文110余篇 2022-06-07 国家自然科学基金资助项目(51779047) * 责任作者, 教授, cuisong-bq@neau.edu.cn
4.3 健康风险
5 结语
