噻虫胺研究开发进展综述
2017-05-24主艳飞左文静庄占兴崔蕊蕊郭雯婷范金勇
主艳飞,左文静,庄占兴,崔蕊蕊,郭雯婷,范金勇
噻虫胺研究开发进展综述
主艳飞,左文静,庄占兴,崔蕊蕊,郭雯婷,范金勇
(山东省农药科学研究院 山东省化学农药重点实验室,济南250033)
噻虫胺是一种高效安全、高选择性的新烟碱类杀虫剂,作用于昆虫神经系统烟碱型乙酰胆碱酶受体,阻断昆虫中枢神经系统信号的正常传导,从而导致害虫麻痹并死亡。噻虫胺毒性低,用量少,持效期长,对作物无药害,与常规农药无交互抗性,主要用于甘蔗、水稻及其他作物。综述了噻虫胺的发现、理化性质、合成路线、分析方法、杀虫机理、害虫抗药性、登记情况、应用现状和环境相容性等方面的研究开发现状,并对噻虫胺的开发前景进行了展望。
噻虫胺;研究开发;进展;综述
1 噻虫胺的发现
噻虫胺(clothianidin)是拜耳公司和日本Takeda武田公司共同开发的具有噻唑环的新烟碱类杀虫剂[1],具有广谱杀虫活性,活性与吡虫啉相似。该剂使用方法灵活,既可用于茎叶处理,也可用于土壤种子处理,主要用于水稻、蔬菜、棉花、果树及其他作物田防治蚜虫、蓟马、飞虱等半翅目、鞘翅目、双翅目和某些鳞翅目类害虫。此产品具有卓越的内吸和渗透作用,是替代高毒有机磷农药的又一品种。其结构新颖,性能比传统烟碱类杀虫剂更为优异[2]。
2 噻虫胺的理化性质
噻虫胺的化学名称为()-1-(2-氯-1,3-噻唑-5-基甲基)-3-甲基-2-2-硝基胍;英文通用名称为clothianidin;结构式如下[3]:

纯品外观为白色晶体,无嗅味,溶点176.8 ℃,蒸气压:3.8×10-11Pa(20 ℃),相对密度1.63,溶解度:水0.327 g/L,甲醇6.26 g/L,丙酮15.2 g/L,二氯甲烷1.32 g/L,乙酸乙酯2.03 g/L,二甲苯0.012 8 g/L,正庚烷<0.001 04 g/L,正辛醇0.938 g/L(测定温度:水25 ℃,有机溶剂20 ℃)[3]。
3 噻虫胺的合成
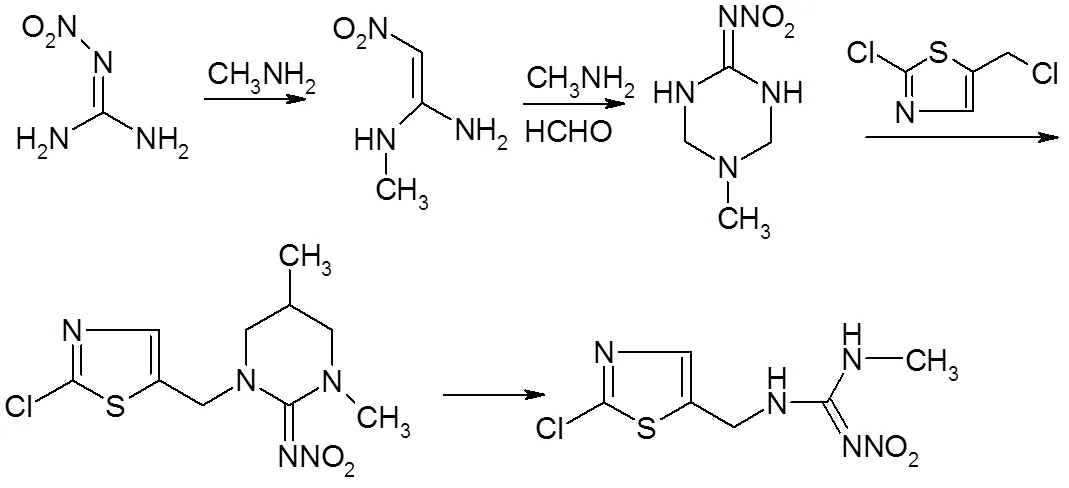
3.1目前文献报道的合成方法主要有以下4条路线[2]
方法1:5-氯甲基2-氯噻唑与1,2-甲基-3-硝基异硫脲反应制备噻虫胺。

方法2:2-氯-5-氯甲基噻唑与-甲基硝基脲反应制备。
方法3:2-氯-5-氯甲基-1,3-噻唑与-硝基--甲基异硫脲反应。
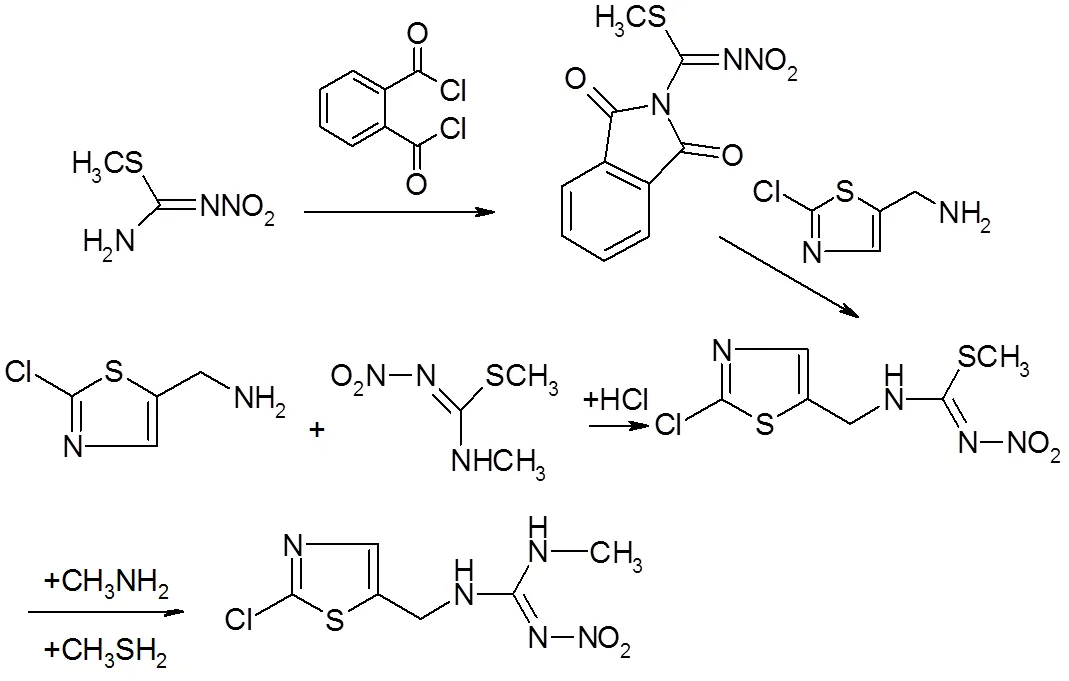
方法4:通过分解1-(2-氯噻唑-5-甲基)-2-硝基亚胺基-3,5-二甲基-六氢-1,3,5-三嗪制备产物。
3.2 在噻虫胺的合成路线中最有产业前景的路线
3.2.1 中间体的制备
-甲基--硝基胍的制备(中间体A):
1,5-二甲基-2-硝基亚氨基-六氯-1,3,5-三嗪的合成(中间体B):
2-氯-5-氯甲基噻唑的合成(中间体C):

1-(2-氯噻唑-5-甲基)-2-硝基亚胺基-3,5-二甲基-六氯-1,3,4-三嗪的合成(中间体D):
3.2.2 噻虫胺的合成

噻虫胺具有杀虫谱广以及优良的生物活性,成为第2代新烟碱类杀虫剂的代表性品种,具有广阔的市场前景。噻虫胺的合成方法前3种是20世纪90年代初开发,第4种方法是最近几年开发。第4种方法通过分解1-(2-氯噻唑-5-甲基) -2-硝基亚胺基-3,5-二甲基-六氢-1,3,5-三嗪而制备,产物产品含量≥96%,合成总收率58.6%(以硝基胍计),原料成本≤12万元。该工艺路线具有选择性较高,反应条件温和,反应时间短,产品纯度高,易于工业化的特点[2]。
4 噻虫胺的分析方法进展
4.1 产品分析
胡礼[4]等采用高效液相色谱法对噻虫胺进行分析,以甲醇和水为流动相,流动相甲醇+水=40+60(体积比),流速1.0 mL/min,使用岛津C18(ODS)柱和二极管阵列检测器,在265 nm波长下对噻虫胺原药进行分离和定量分析。结果表明噻虫胺的线性相关系数为0.999 8;标准偏差为0.23;变异系数为0.24%;平均回收率为99.86%~100.70%。
吴进龙[5]等采用高效液相色谱法对50%噻虫胺水分散粒剂进行分析,以甲醇和0.05%H3PO4为流动相,甲醇+0.05%H3PO4(pH 2.5)=60+40(体积比),流速为1.0 mL/min,使用以ZORBAX80Å Extend-C185 μm为填料的不锈钢柱和二极管阵列检测器,在265 nm波长下对试样进行分离和定量分析。结果表明:噻虫胺的线性相关系数为0.999 7;标准偏差为0.38,变异系数为0.77%;平均回收率为99.6%。
王季鸽[6]等采用高效液相色谱法,以甲醇和水为流动相,流动相甲醇+水=30+50(体积比),流速为1.0 mL/min,使用C18柱和二极管阵列检测器,在265 mm波长下对噻虫胺原药中有效成分进行外标法定量。结果表明:方法的线性相关系数为0.999 6,标准偏差为0.20%。
4.2残留分析
检测样品中的农药残留目前最常用的仪器有GC、HPLC、液质联用(LC-MS)、气质联用 (GC-MS)等。噻虫胺既可用液相色谱-质谱法(UPLC-MS/MS)检测,也可用液相色谱(HPLC) 检测。
4.2.1 液相色谱-质谱法(UPLC-MS/MS)
张春荣[7]等研究噻虫胺在水稻中的残留动态和环境安全性,分别在浙江、山东和湖南进行了残留动态试验,建立了噻虫胺残留的高效液相色谱――串联质谱(UPLC-MS/MS)分析方法。该方法对噻虫胺的检出限为0.01 mg/kg。添加浓度为0.01~1.0 mg/kg时,平均回收率为85%~106%,相对标准偏差(RSD)为1.8%~10.10%。田间试验结果表明,噻虫胺在水稻植株和稻田中的消解动态符合一级动力学方程,消解半衰期分别为(2.5~4.4) d,(2.7~8.9) d,表明噻虫胺属于易降解农药。
张鹏[8]等采用分散固相萃取-液相色谱-串联质谱法研究了50%噻虫胺水分散粒剂在番茄和土壤中的残留及消解动态。结果表明:噻虫胺在番茄中的消解动态符合一级动态方程,半衰期为(3.5~17.3) d。当50%噻虫胺水分散粒剂以推荐剂量(有效成分)60 g/hm2在番茄生长到成熟个体一半大时施药3次,施药间隔7 d时,噻虫胺在番茄中的最终残留量<LOQ~0.32 mg/kg,远低于日本规定的最大残留允许量(MRL)3 mg/kg,推荐采收间隔期为1 d。
罗梅梅[9]等建立同时测定韭菜中噻虫嗪及其代谢物噻虫胺的多残留分析方法,样品用乙腈提取,石墨化炭黑固相萃取小柱净化,超高液相色谱分离,三重四级杆质朴检测,基质匹配标准溶液的外标法定量。结果表明,对韭菜中噻虫嗪、噻虫胺进行0.01~0.2 mg/kg的添加回收率试验,噻虫嗪在韭菜中的平均回收率为73.7%~98.6%,相对标准偏差2.9%~4.5%;噻虫胺在韭菜中的回收率72.4%~ 80.6%,相对标准偏差为2.1%~7.1%。噻虫嗪和噻虫胺在韭菜中的最小检出质量分数均为0.01 mg/kg。
4.2.2 液相色谱法(HPLC)
管欢[10]等建立了采用高效液相色谱测定甘蔗及土壤中噻虫胺的残留分析方法,测定了噻虫胺在甘蔗植株茎秆及土壤中的消解动态和残留。一系列检测结果表明:噻虫胺最小检出量(LOD)为6.80×10-13g,甘蔗茎秆和土壤中最低检测浓度(LOQ)均为0.05 mg/kg。甘蔗茎秆和植株中均未检测到噻虫胺,噻虫胺在土壤中的消解行为符合一级降解动力学方程,半衰期为(24.3~26.4) d。建议噻虫胺在甘蔗上的有效成分用量不超过472.5 g/hm2,属于易降解农药。
黄莹莹[11]等于2011~2012年研究了20%噻虫胺悬乳剂在水稻及稻田环境中的残留动态情况,建立了稻田环境中噻虫胺残留量的液相色谱分析方法和提取、萃取、净化方法。结果表明:噻虫胺的最小检出量是2.0×10-10g,最低检测浓度为0.01 mg/kg,当添加浓度为0.01 mg/kg~1.0 ng/kg时,噻虫胺在不同水稻样品中平均回收率为85.1%~104.1%,相对标准偏差为1.1%~12.1%;噻虫胺在稻田水、稻田土壤和稻田植株中的消解遵循一级化学反应动态方程,平均消解半衰期为6.24、9.96、10.98 d。
陈雁君[12]等建立了一种灵敏度高,操作简单的定量分析小白菜中残留的微量噻虫胺的高效液相色谱方法。样品经丙酮提取,极性硅胶柱净化后进行高效液相色谱分析。方法选用ODS-C18色谱柱(250 mm ×4.6 mm,填料:Kromasil,粒度:5 μm),以甲醇-水(45︰55,体积比)为流动相,流速为1 mL/min,检测波长为265 mm。结果噻虫胺的平均加标回收率为93.02%~94.4%,相对标准偏差为3.3%~5.4%(n=6)。该方法的检出限为0.02 ng,在小白菜中的最低检出浓度为0.004 mg/kg,满足农药残留检测的要求。
5 噻虫胺的作用机理及抗药性现状研究
5.1噻虫胺的作用机理
噻虫胺是一种新烟碱类杀虫剂,具杀虫谱广,触杀,胃毒和内吸等特点,主要作用于烟碱乙酰胆碱受体(nAChR),是nAChR的激动剂,可以选择性抑制昆虫神经系统的nAChR,使ACh无法与AChR结合,进而阻断昆虫中枢神经系统信号的正常传导,造成昆虫麻痹而死亡。与有机磷、氨基甲酸酯类和拟除虫菊酯类等杀虫剂无交互抗性,与其他商品化的品种相比具有较高的活性和安全性,尤其在防治某些鞘翅目害虫中具有突出的活性[13]。
5.2噻虫胺的抗药性现状
陈小坤[14]等通过对乙酰胆碱受体1亚基突变后的抗吡虫啉棉蚜[()]种群的继续筛选,明确该种群的抗性发展规律及对其他新烟碱类杀虫剂啶虫脒和噻虫胺的交互抗性及相关酶学机理。采用浸渍法连续对抗吡虫啉棉蚜进行室内筛选,测定噻虫胺和啶虫脒对抗吡虫啉棉蚜种群的毒力。结果表明:噻虫胺对该突变棉蚜种群的抑制作用主要表现在两方面,一是噻虫胺对抗性棉蚜体内解毒酶的活力有较为明显的抑制作用,干扰了棉蚜体内正常代谢反应,致使其代谢紊乱;另一方面噻虫胺对蚜虫生物学特性比如体重和蜜露分泌等有明显的抑制作用。噻虫胺在抗吡虫啉棉蚜靶标突变种群的治理中具有较大应用价值。
樊龙飞等[15]研究了褐飞虱对噻虫胺、异丙威、啶虫脒3种常用药剂的抗药性水平,筛选田间抗药性治理桶混配方。采用点滴法测定了贵州3个地区(桐梓、黄平、开阳)褐飞虱种群对噻虫胺、异丙威、啶虫脒的抗药性水平,并研究了3种药剂相互混配对褐飞虱的增效作用。研究筛选出2个田间抗药性治理桶混优选配方:噻虫胺与异丙威1︰6和噻虫胺与啶虫脒4︰1(有效成分质量比),它们对3地褐飞虱种群均具有明显增效作用。
6 噻虫胺的登记情况
2002年,噻虫胺在日本取得登记,2003年-2004年,在美国、英国、墨西哥相继取得登记,2006年,该产品进入德国、意大利市场,同年列入欧盟农药登记指令(91/414)附录1,2009年,加拿大获得限制登记,2012年,在我国登记[16]。根据中国农药信息网登记公告,截至2017年2月,噻虫胺原药登记2个,噻虫胺制剂共登记25个,其中单剂12个,复配制剂13个;在单剂中,悬浮剂5个,颗粒剂4个,水分散粒剂2个,种子处理悬浮剂1个;在复配制剂中,悬浮种衣剂5个,颗粒剂6个[17]。
噻虫胺剂型以颗粒剂和悬浮剂为主,主要登记用于甘蔗、水稻、小麦等作物,防治蔗螟,稻飞虱、麦蚜等。近年来,随着加工技术的发展,噻虫胺其他剂型呈现日渐增多的态势。
7 噻虫胺的活性、防治谱
任学祥[18]等采用点滴法、叶片浸渍法和叶柄内吸法分别测定了噻虫胺对烟蚜的毒力,结果表明噻虫胺对烟蚜点滴、浸渍和内吸LC50分别为1.891、2.341、1.303 mg/L,说明噻虫胺对烟蚜具有高毒力。
李贤贤[19]等采用管测药膜法和药液定量滴加法测定了噻虫胺等6种药剂对韭菜迟眼蕈蚊不同虫态的毒力,并研究了噻虫胺、甲氨基阿维菌素苯甲酸盐和辛硫磷亚致死浓度对其4龄幼虫生长发育和繁殖的影响。对2龄和4龄幼虫的毒力,均以噻虫胺最高,LC50分别为0.339 mg/L和1.020 mg/L,用噻虫胺亚致死剂量处理韭菜迟眼蕈蚊4龄幼虫,其发育历期和蛹期延长,蛹重、化蛹率、成虫羽化率、单雌产卵量和孵化率均降低。
郑岩明[20]等采用浸液法测定了噻虫胺、高效氯氟氰菊酯等7种药剂及其混用对黄曲条跳甲的毒力及混剂的增效作用,结果显示:7种药剂中噻虫胺对黄曲条跳甲的毒力最高,LC50为315.1 mg/L。噻虫胺与丁烯氟虫胺1︰9的比例混用,噻虫胺与杀虫单按3︰7的比例混用均有明显的增效作用。庄占兴等[21]采用浸液法测定了噻虫胺与高效氯氟氰菊酯不同配比对韭菜迟眼蕈蚊3龄幼虫的毒力,其中两者以3∶7、5∶5、7∶3比例复配时对韭菜迟眼蕈蚊3龄幼虫的共毒系数大于130,增效作用较显著,其中按照1︰1复配增效作用最佳,按照此比例加工的2%噻虫胺·高氯氟氰GR,有效成分用量450~600 g/hm2,药后60 d防效仍保持在85%,且可促进韭菜生长。
李保同[22]等研究发现50%噻虫胺WG以240、480、960 g(有效成分)/hm2剂量应用时,对柑橘吹绵蚧和潜叶蛾具有良好的防治效果,药后7~56 d对吹绵蚧的防效显著优于或相当于对照药剂25%噻虫嗪WG 240 g(有效成分)/hm2处理和18%杀虫双AS 900 g(有效成分)/hm2处理。根据虫害发生的严重程度和经济利益考虑,建议在生产上的使用剂量为240~480 g(有效成分)/hm2。
唐静[23]等研究开发了0.06%噻虫胺药肥混剂,其将替代毒死蜱、呋喃丹等常规颗粒剂防治甘蔗螟虫,防治效果良好。
李耀发[24]等采用浸虫法,测定噻虫胺对麦长管蚜室内毒力以及田间采用拌种法,进一步探明噻虫胺对小麦苗期安全性及控制麦蚜效果,结果表明噻虫胺对麦蚜室内毒力水平高于吡虫啉,20%噻虫胺SC拌种处理对小麦植株安全,对麦蚜种群控制作用与吡虫啉拌种对麦蚜防效基本相当,可见噻虫胺有望成为吡虫啉替代药剂用于拌种防治麦蚜。
8 噻虫胺的环境毒理及环境行为安全评价
8.1 噻虫胺的环境毒理
崔新倩[25]等为明确新烟碱类杀虫剂对非靶标生物家蚕的毒性以及对生态环境的安全性影响,采用浸叶法测定6种新烟碱类杀虫剂及其他3类对照杀虫剂对家蚕的急性毒性,并观察不同种类杀虫剂引起家蚕的急性中毒症状差异。结果表明:新烟碱类杀虫剂噻虫胺对家蚕存在极大的安全风险,引起家蚕中毒的症状主要表现为拒食,身体扭曲呈"C"或"S"形,头部肿大等。因噻虫胺对家蚕的毒性强,建议远离桑园使用,以避免对养蚕生产造成危害。
季守民[26]等测定噻虫胺等7种生产中常用的新烟碱类杀虫剂对蜜蜂的急性接触毒性和经口毒性,并利用EPPO采取的计算危害商(HQ)值的方法对7种新烟碱类杀虫剂进行风险性评价。结果表明:噻虫胺对蜜蜂的急性毒性为高毒甚至剧毒,风险性为中等风险到高风险。
吴迟[27]等采用饲喂管法和点滴法,分别测定了吡虫啉、噻虫嗪、噻虫胺、啶虫脒4种原药及其制剂对意大利蜜蜂成年工蜂的急性毒性,并采用危害商值(HQ)法进行了初级风险评价。按《化学农药环境安全评价试验准则》的毒性等级划分标准,噻虫胺对蜜蜂的急性毒性为高毒;根据危害商值(HQ),噻虫胺对蜜蜂也存在高风险。
丁悦[28]等采用摄入法、接触法和药膜法分别测定3种制剂对意大利蜜蜂工蜂和玉米螟赤眼蜂成蜂的急性毒性。安全性评价结果表明:噻虫胺对玉米螟赤眼蜂成蜂存在极高风险,安全系数为5.95×10-4。噻虫胺及其混剂对意大利蜜蜂和玉米螟赤眼蜂均存在较高的毒性风险,在害虫综合治理中应谨慎使用。
8.2 噻虫胺的环境行为安全评价
刘保东[29]考察了不同温度和pH值条件对噻虫胺水解的影响。结果表明:噻虫胺在水中的光解符合一级动力学方程;噻虫胺在pH≤5的条件下光解最快,而在中性以及碱性条件下光解较慢;在添加浓度范围内,Fe3+、NO2-均对噻虫胺的光解起到促进作用。其中Fe3+对噻虫胺光解有显著的光敏化作用,随着其浓度的增大噻虫胺的光解明显加快;HA、Cu2+对噻虫胺的光解有抑制作用,并且随着添加浓度的升高抑制作用显著增强;在添加浓度范围内,随着NO3-浓度的升高,其对噻虫胺的光解由促进转为抑制。
吴文铸[30]等采用室内模拟试验,研究了噻虫胺在3种不同类型土壤中的吸附、移动特性及影响因素。结果表明,噻虫胺在江西红壤、太湖水稻土与东北黑土中的吸附较好地符合Freundlich方程,Kd分别为0.49、1.99和4.42。影响噻虫胺土壤吸附性的主要因素为土壤有机质,薄层层析试验显示,当溶剂展开至12.0 cm处,噻虫胺在江西红壤、太湖水稻土与东北黑土中最远移至10~12 cm,8~10 cm,4~6 cm处,土柱试验表明噻虫胺在红壤出液中质量分数为56.04%,太湖水稻土和东北土中的噻虫胺最远已移至20.0~25.0 cm和15.0~20.0 cm处。影响噻虫胺在土壤中吸附性和移动性的主要因素为土壤有机质含量。噻虫胺存在对地下水污染的风险性,特别是在红壤环境下使用噻虫胺应该引起足够重视。
胡倩[31]等利用光催化技术探讨了噻虫胺在水体环境中降解的可行性,不同催化剂浓度、反应温度、底物浓度、溶液初始pH和不同阴阳离子等因素对其光催化降解动力学的影响及初步的光催化降解机制。结果表明噻虫胺的光催化降解符合L-H动力模型,其降解假一级动力学速率常数为0.050 6 min-1。当催化剂用量(TiO2)为3.0 g/L时,噻虫胺的光催化降解速率最大,高温和较低的底物浓度有利于噻虫胺的光催化降解。
9 总 结
近几年来,含氮杂环类杀虫剂已成为杀虫剂领域研究开发的新热点,其中以烟碱类杀虫剂最为突出。继吡虫啉成功进入市场之后,啶虫脒、噻虫嗪、噻虫啉、噻虫胺等新品种又相继开发成功,成为继拟除虫菊酯以来杀虫剂发展史上的又一个新的里程碑[32]。
噻虫胺是高效广谱低毒的新烟碱类杀虫剂,具有低毒,靶标独特,应用方法多样等特点,对危害水稻[33]、甘蔗[23]、小麦[24]、果树[22]、蔬菜[21,34]等作物的半翅目、鞘翅目、双翅目和某些鳞翅目类害虫作用剂量低、高效,引起农药研究者的广泛关注[2],
目前噻虫胺登记数量较少,剂型较单一,随着噻虫胺防治谱研究的深入和应用领域的延伸,与使用技术相配套的一些新的剂型[18]也陆续被开发出来,噻虫胺的潜力将逐步得到发挥。
[1] 程志明. 杀虫剂噻虫胺的开发[J]. 世界农药, 2004, 26(6): 1-3.
[2] 张明媚, 孙克, 吴鸿飞, 等. 噻虫胺的合成[J]. 农药, 2010, 49(2): 94-96.
[3] 王党生, 隋卫平, 谭晓军. 噻虫胺的合成方法[J]. 农药, 2003, 42(9): 15-16.
[4] 胡礼, 项军, 黄路. 噻虫胺原药的高效液相色谱分析[J]. 精细化工中间体, 2011, 41(2): 66-67.
[5] 吴进龙, 张志一, 李国平, 等. 50%噻虫胺水分散粒剂分析方法研究[J]. 农药科学与管理, 2008, 29(1): 8-11.
[6] 王季鸽, 刘育红.高效液相色谱分析噻虫胺原药[J]. 河北化工, 2013, 36(4): 77-78.
[7] 张春荣, 何红梅, 徐玲英, 等. 噻虫胺在水稻中的残留分析方法及其消解动态[J]. 浙江农业学报, 2014, 26(5): 1263-1267.
[8] 张鹏, 金芬, 杨莉莉, 等. 噻虫胺在番茄和土壤中的残留及消解动态[J]. 农药学学报, 2016, 18(4): 490-496.
[9] 罗梅梅, 铁柏清, 贺敏, 等. 超高液相色谱-串联质谱法检测韭菜中噻虫嗪及其代谢物噻虫胺[J]. 农药, 2014, 53(7): 394-396.
[10] 管欢, 黄惠俐, 行艳景, 等. 噻虫胺在甘蔗和土壤中残留分析及消解动态[J]. 现代农药, 2015, 14(2): 42-45.
[11] 黄莹莹, 郭正元.噻虫胺在水稻及其稻田环境中的消解动态研究[J]. 湖南农业科学, 2013, (9): 71-73.
[12] 陈雁君, 王艳, 李宁, 等. HPLC法测定小白菜中噻虫胺农药残留凉的方法研究[J]. 中国热带医学, 2009, 9(2): 361-362.
[13] 范银君, 史雪岩, 高希武. 新烟碱类杀虫剂吡虫啉和噻虫嗪的代谢研究进展[J]. 农药学学报, 2012, 14(6): 587-596.
[14] 陈小坤, 夏晓明, 王红艳, 等.抗吡虫啉棉蚜种群对啶虫脒和噻虫胺的交互抗性及相关酶学机理[J]. 昆虫学报, 2013, 56(10): 1143-1151.
[15] 樊龙飞, 李明, 李荣玉.褐飞虱对噻虫胺、异丙威、啶虫脒的抗药性及其增效配方筛选[J]. 江苏农业科学, 2016, 44(6): 182-186.
[16] 孙克. 全球十大杀虫剂的市场与展望[J]. 农药, 2013,52(7): 625-631.
[17] 中国农药信息网农药登记数据[EB/OL] http://www.chinapesticide. gov.cn/hysj/index.jhtml
[18] 任学祥, 王刚, 左一鸣, 等. 噻虫胺对桃蚜的毒力及其致死剂量对桃蚜解毒酶系活力的影响[J]. 昆虫学报, 2011, 54(3): 299-305.
[19] 李贤贤, 马晓丹, 薛明, 等. 噻虫胺等药剂对韭菜迟眼蕈蚊的致毒效应[J]. 植物保护学报, 2014, 41(2): 225-229.
[20] 郑岩明, 刘霞, 姜莉莉, 等. 噻虫胺等七种杀虫剂对黄曲条跳甲的毒力[J]. 农药学学报, 2015, 17(2): 230-234.
[21] 庄占兴, 胡尊纪, 范金勇, 等. 噻虫胺与高效氯氟氰菊酯复配防治韭菜迟眼蕈蚊幼虫配方筛选与田间应用效果[J]. 农药, 2017, 56(3): 228-230.
[22] 李保同, 汤丽梅, 曾水根, 等. 50%噻虫胺WG防治柑橘吹绵蚧和潜叶蛾天骄药效试验[J]. 农药, 2009, 48(12): 912-914.
[23] 唐静, 杨卫斌, 谭贤勇. 0.06%噻虫胺药肥混剂防治甘蔗螟虫效果初报[J]. 中国糖料, 2013, (3): 64-65.
[24] 李耀发, 党志红, 潘文亮, 等. 新烟碱类杀虫剂噻虫胺拌种防治麦芽的田间药效及安全性评价[J]. 农药, 2013, 52(9): 689-691.
[25] 崔新倩, 张骞, 姜辉, 等.新烟碱类杀虫剂对家蚕的急性毒性评价与中毒症状观察[J]. 桑业科学, 2012, 38(2): 0288-0291.
[26] 季守民, 程传英, 袁传卫, 等. 7种新烟碱类杀虫剂对意大利蜜蜂的急性毒性及风险评价[J]. 农药, 2015, 544 : 282-285.
[27] 吴迟, 姜辉, 王长宾, 等. 四种新烟碱类杀虫剂对蜜蜂的急性毒性及初级风险评估[J]. 农药学学报, 2015, 17(4): 486-491.
[28] 丁悦, 刘敏, 严海娟, 等. 噻虫胺及其混配制剂对意大利蜜蜂和玉米螟赤眼蜂的急性毒性[J]. 昆虫学报, 2015, 58(9): 1030-1036.
[29] 刘保东.噻虫胺的水解和光化学降解研究(硕士论文)[D]. 河南:河南师范大学, 2013.
[30] 吴文铸, 郭敏, 孔德祥, 等.噻虫胺在土壤中的吸附和淋溶特性[J]. 环境化学, 2012, 31(11): 1730-1735.
[31] 胡倩, 阳海, 石妮, 等. 光催化体系中噻虫胺降解动力学及机制[J]. 环境科学, 2016, 37(9): 3524-3531.
[32] 李海屏. 世界化学杀虫剂新品种开发进展及特点(下) [J]. 农资科技,2003, 26(12): 1-4.
[33] 邱达春, 王东生, 衷敬峰. 几种药剂防治水稻稻飞虱田间药效试验[J]. 现代化农业, 2015(4): 67-68.
[34] 张鹏, 赵云鹤, 韩京坤, 等. 不同施药方式下噻虫嗪和噻虫胺对韭菜迟眼蕈蚊的防治效果[J]. 植物保护学报, 2015, 42(4): 645-650.
A Review of Research Progress in the Development of Clothianidin
ZHU Yanfei, ZUO Wenjing, ZHUANG Zhanxing, CUI Ruirui, GUO Wenting, FAN Jinyong
(Key Laboratory for Chemical Pesticide of Shandong Province, Shandong Academy of Pesticide Sciences, Jinan 250033, China)
Clothianidin is one of new neonicotinoids with high effect, safety and high selection. Clothianidin acting on the insect nervous system nicotinic acetylcholine receptor, blocks the normal signal transduction of insect central nervous system, resulting in paralysis and death of pests. Clothianidin has low toxicity, low dosage, long lasting time, no injury to crops, and no cross-resistance to conventional pesticides. It is mainly used for sugar cane, rice and other crops. The research and development status of clothianidin, including the discovery, physical and chemical properties, synthesis routes, analytical methods, insecticidal mechanism, pest resistance, registration, application status and environmental compatibility were introduced. In addition, the development prospect of clothianidin was discussed.
clothianidin; research and development; progress; review
10.16201/j.cnki.cn31-1827/tq.2017.02.06
TQ450
A
1009-6485(2017)02-0028-06
主艳飞(1990—),女,在读硕士,助理工程师,主要从事农药理化性质检测工作。E-mail:zyf0120@126.com。
庄占兴(1965—),男,博士,研究员,主要从事农药理化性质及应用技术研究工作。E-mail:zhzhx206@126.com。
2017-03-24。
