circ-BRWD1靶向调控作用miR-132-3p介导FOXO1成骨
2023-02-04谭文进
谭文进 王 斌
1 广东省广州市南沙区中医医院外二科 511462; 2 佛山市三水区人民医院骨科
世界卫生组织将骨质疏松症定义为通过双能X射线骨密度仪测量的骨矿物质密度低于平均骨量2.5个标准差[1]。它是一种骨骼疾病,其特点是骨量低、骨结构缺陷和高风险,即使在较小的压力下也会断裂[1]。2010年,全球50岁以上骨质疏松骨折约1.5亿,2040年将会增加1倍[2]。钙、维生素D、双膦酸盐的摄入常被用于预防和治疗骨质疏松症。然而,要彻底治愈它,除了常见的物理治疗和药物治疗外,应该关注从基因间的相互作用中寻找治疗骨质疏松症的方法。
环状RNA(circRNAs)是一类非编码RNA,通过将RNA的3’端连接到5’端而具有环状结构[3]。它能靶向miRNA并改变miRNA的表达[3]。据预测,circRNAs会与miRNAs结合,竞争结合位点[4]。circ-BRWD1能通过调节miR-1277/TRAF6轴参与骨关节炎的发展[5]。miR-132-3p介导FOXO1对内皮祖细胞增殖有调控作用[6]。FoxO1/SIRT1/RANKL/OPG通路的激活可能是白藜芦醇治疗骨质疏松症的基础[7]。故假说circ-BRWD1通过靶向miR-132-3p调节FOXO1预防骨质疏松症。本文将为骨质疏松的防治提供一定的依据。
1 对象与方法
1.1 研究对象 选取2021年1—12月因股骨颈骨折行髋关节置换术的绝经后骨质疏松患者(骨密度T值≤-2.5)20例作为PMOP组,术中取自远离关节周围骨的股骨粗隆区的骨小梁样本。另选取非PMOP的外伤性股骨近端骨折的患者(骨密度T值≤-0.5)18例作为对照组,需要手术内固定并暴露骨折端组织。存于液氮当中。所有患者均未接受任何影响骨骼或矿物质代谢的药物治疗。本研究经佛山市三水区人民医院伦理委员会授权,所有患者均签署知情同意书。两组一般资料比较,差异无统计学意义(P>0.05),见表1。

表1 两组一般资料比较
1.2 仪器及试剂 紫外分光光度计、实时PCR检测系统、流式细胞仪、荧光素酶报告检测系统:Bio-Rad公司,美国。PCR试剂盒、引物、ALP试剂盒、茜素红染色试剂盒、载体、miRNA mimics 及对照物、inhibitors、Trizol试剂:Takara公司,中国。抗体:abcam公司,美国。培养基、成骨分化液:Sigma公司,美国。质粒、293T细胞、Lipofectamine 2000、Percoll分离液:Invitrogen公司,美国。质粒抽提试剂盒:QIAGEN公司,德国。
1.3 研究过程 PMOP组和对照组分别取骨,建立BMSCs的体外培养体系,并作BMSCs鉴定,以ARS、ALP检测BMSCs成骨能力,RT-qPCR检测对照组和PMOP组BMSCs的circ-BRWD1、miR-132-3p、FOXO1相对表达值,网上找到circ-BRWD1与miR-132-3p、miR-132-3p与FOXO1的结合靶点,荧光素酶报告基因实验进一步验证。将pc-circ-BRWD1与agomiR-132-3p共转染入BMSCs后检测FOXO1的表达水平:RT-qPCR分析检测control、agomiR-NC、agomiR-132-3p、agomiR-132-3p+pcDNA3.1、agomiR-132-3p+pc-circ-BRWD1转染的BMSCs细胞中FOXO1的相对表达。将pc-circ-BRWD1与agomiR-132-3p或sh-FOXO1共转染BMSCs后检测特异性成骨分化相关因子Runx2的表达水平:RT-qPCR检测在control、pcDNA3.1、pc-circ-BRWD1、pc-circ-BRWD1+agomiR-NC、pc-circ-BRWD1+agomiR-132-3p、pc-circ-BRWD1+sh-NC、pc-circ-BRWD1+sh-FOXO1中Runx2的相对表达。
1.4 试验方法
1.4.1 细胞培养和成骨分化的诱导:骨组织置于抗凝管中,建立BMSCs的体外培养体系:将骨与1%双抗的DMEM培养液混合。分离,重悬细胞,并将细胞悬液注入Percoll分离液,离心,取中间细胞层,加入培养基,吹打混匀后可获得BMSCs细胞悬液。在37℃下储存在5%CO2的环境中行BMSCs的成骨分化。培养基添加了成骨诱导剂:包括10-8mol/L地塞米松、浓度为50μg/ml的抗坏血酸2-磷酸和10mmol/L的2-磷酸甘油。BMSCs以5×105细胞/孔的密度接种在12孔板中,当细胞达到80%汇合度时,用成骨培养基替换培养基。每3d更换1次培养基,然后在第0、7、14、21天收获并分析诱导细胞。
1.4.2 BMSCs鉴定:将细胞离心并悬于PBS中,分装,弃PBS液,于每管加FITC标记的CD34、CD45、CD73、CD90以及抗体,避光孵育,PBS清洗去除未标记抗体,PBS液吹打重悬细胞后,流式细胞仪检测。
1.4.3 碱性磷酸酶染色 (ALP):成骨分化7d或14d后,用PBS洗涤细胞并固定。用PBS洗涤细胞后,加入500μl BCIP/NBT液体底物,室温避光孵育10min。在每个周期后,将细胞洗涤、裂解并与缓冲底物在37℃下1h。添加3N NaOH停止,通过测量对硝基苯酚的吸光度反映的ALP活性在405nm处测定波长。
1.4.4 茜素红染色 (ARS):ARS以检测成骨细胞钙化。BMSC的接种密度为5×104细胞/孔置于12孔板中,培养24h转染后加入分化培养基。然后细胞PBS洗涤2次,95%乙醇固定10min,蒸馏水洗涤3次,用pH 8.3的茜素红S染色液染色37℃ 30min。细胞用蒸馏水冲洗2次后拍照,定量分析。
1.4.5 细胞转染:购买agomiR-NC,agomiR-132-3p,pcDNA3.1、pc-circ-BRWD1[pcDNA3.1(+)/circ-BRWD1 plasmid],agomiR-132-3p,sh-NC、sh-FOXO1载体。BMSCs在转染前以50%~60%的汇合度在6孔板中种植24h,然后根据制造商的说明用Lipofect-tamine 2000转染。
1.4.6 RT-qPCR:使用TRIzol试剂提取总RNA,并使用iScriptTMcDNA合成试剂盒按照试剂盒的方案合成cDNA。用iQTMSYBR Green supermix进行RT-qPCR。7500 HT快速实时PCR系统用于循环和量化反应。评估circ-BRWD1、miR-132-3p和FOXO1的相对基因表达水平。U6和GADPH被用作内参。
1.4.7 双荧光素酶报告基因检测:500ng野生型载体或突变载体与20nmol/L miR-132-3p模拟物或miR-NC的混合物在应用Lipo-fectamine 2000共转染到293细胞中。然后在转染48h后收获细胞并测量的荧光素酶活性。
1.5 统计学方法 用SPSS20.0 软件分析统计所得数据。计量资料以均数±标准差表示,多组比较用单因素方差分析,组间两两比较采用LSD-t检验。两组用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs鉴定 流式细胞术鉴定(见图1):CD34、CD45为阴性,CD73、CD90为阳性。符合BMSCs特点,为BMSCs。

图1 BMSCs的流式细胞术鉴定
2.2 ARS、ALP结果 随着时间的延长,ARS、ALP第0、7、14、21天逐渐升高(见图2、3)。
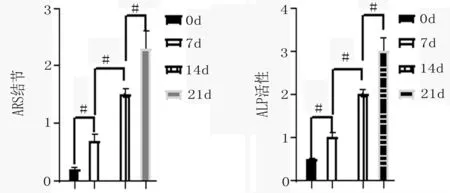
图2 ARS结果(#代表P<0.05) 图3 ALP结果(#代表P<0.05)
2.3 RT-qPCR检测对照组和PMOP组BMSCs的circ-BRWD1、miR-132-3p、FOXO1相对表达值 PMOP组circ-BRWD1、FOXO1相对表达值低于对照组,miR-132-3p高于对照组(见图4)。
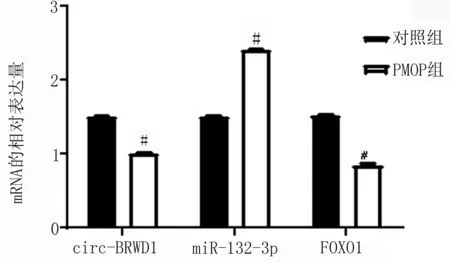
图4 circ-BRWD1、miR-132-3p、FOXO1相对表达值(#代表P<0.05)
2.4 circ-BRWD1与miR-132-3p、miR-132-3p与FOXO1结合位点验证 网址找到circ-BRWD1与miR-132-3p、miR-132-3p与FOXO1的结合靶点,如图5所示。荧光素酶报告基因示miR-132-3p可显著抑制pMIR-circ-BRWD1-WT的荧光素酶活性,而不影响pMIR-circ-BRWD1-MT活性;miR-132-3p可显著抑制pMIR-FOXO1-WT的荧光素酶活性,而不影响pMIR-FOXO1-MT活性(见图6)。
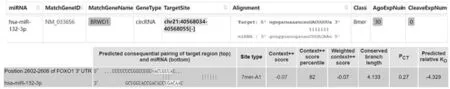
图5 www.targetscan.org、starbase.sysu.edu.cn网址找到circ-BRWD1与miR-132-3p、miR-132-3p与FOXO1的结合靶点
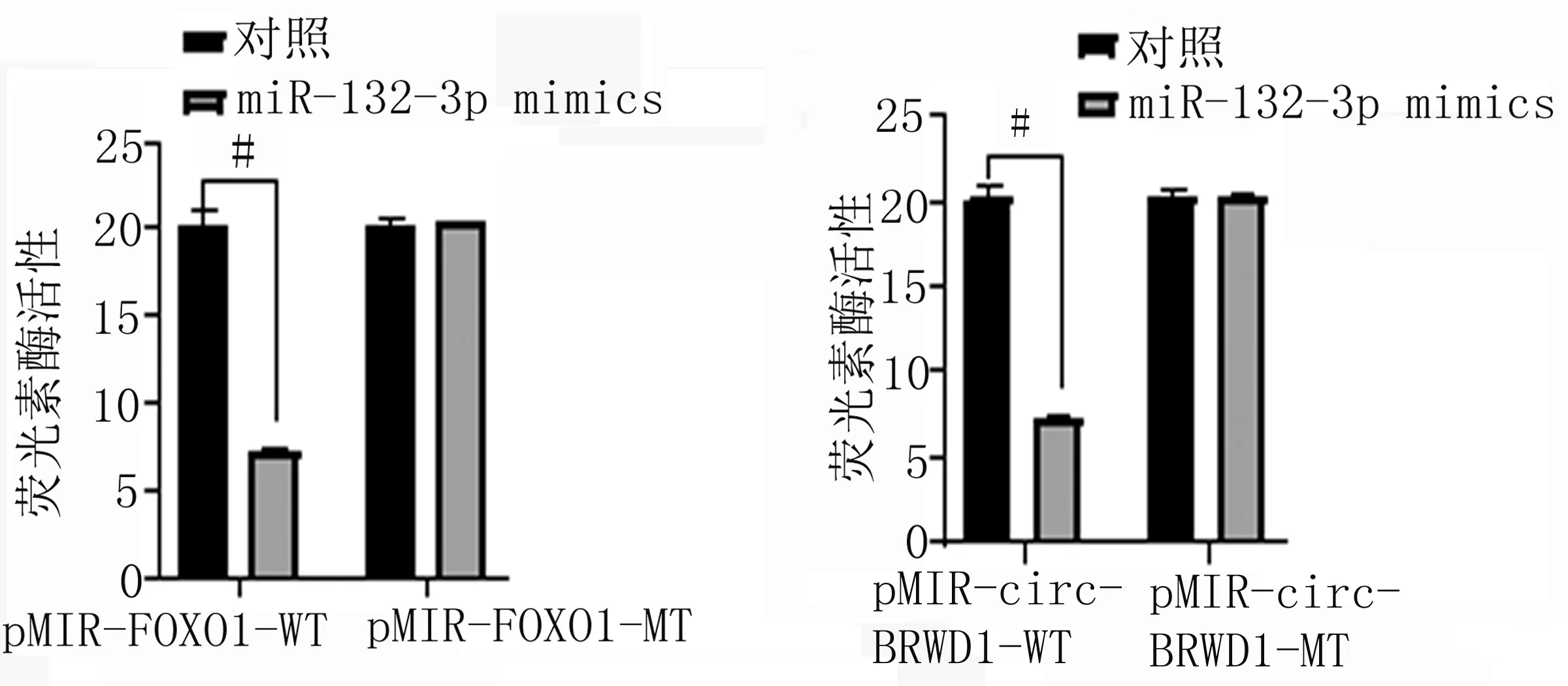
图6 荧光素酶报告基因实验(#代表P<0.05)
2.5 circ-BRWD1通过miR-132-3p调控FOXO1的表达 将pc-circ-BRWD1与agomiR-132-3p共转染后检测FOXO1的表达水平。RT-qPCR结果显示,过表达miR-132-3p显著下调FOXO1表达,而过表达circ-BRWD1则上调FOXO1表达(见图7)。
2.6 miR-132-3p过表达和FOXO1敲低对Runx2表达的影响 将pc-circ-BRWD1与agomiR-132-3p或sh-FOXO1共转染后检测特异性成骨分化相关因子Runx2的表达水平。Runx2的表达水平在过表达circ-BRWD1中升高,在共转染过表达circ-BRWD1+miR-132-3p中降低,在共转染过表达circ-BRWD1+敲除FOXO1中降低(见图8)。

图7 RT-qPCR分析circ-BRWD1通过miR-132-3p调控FOXO1的表达(#代表P<0.05)
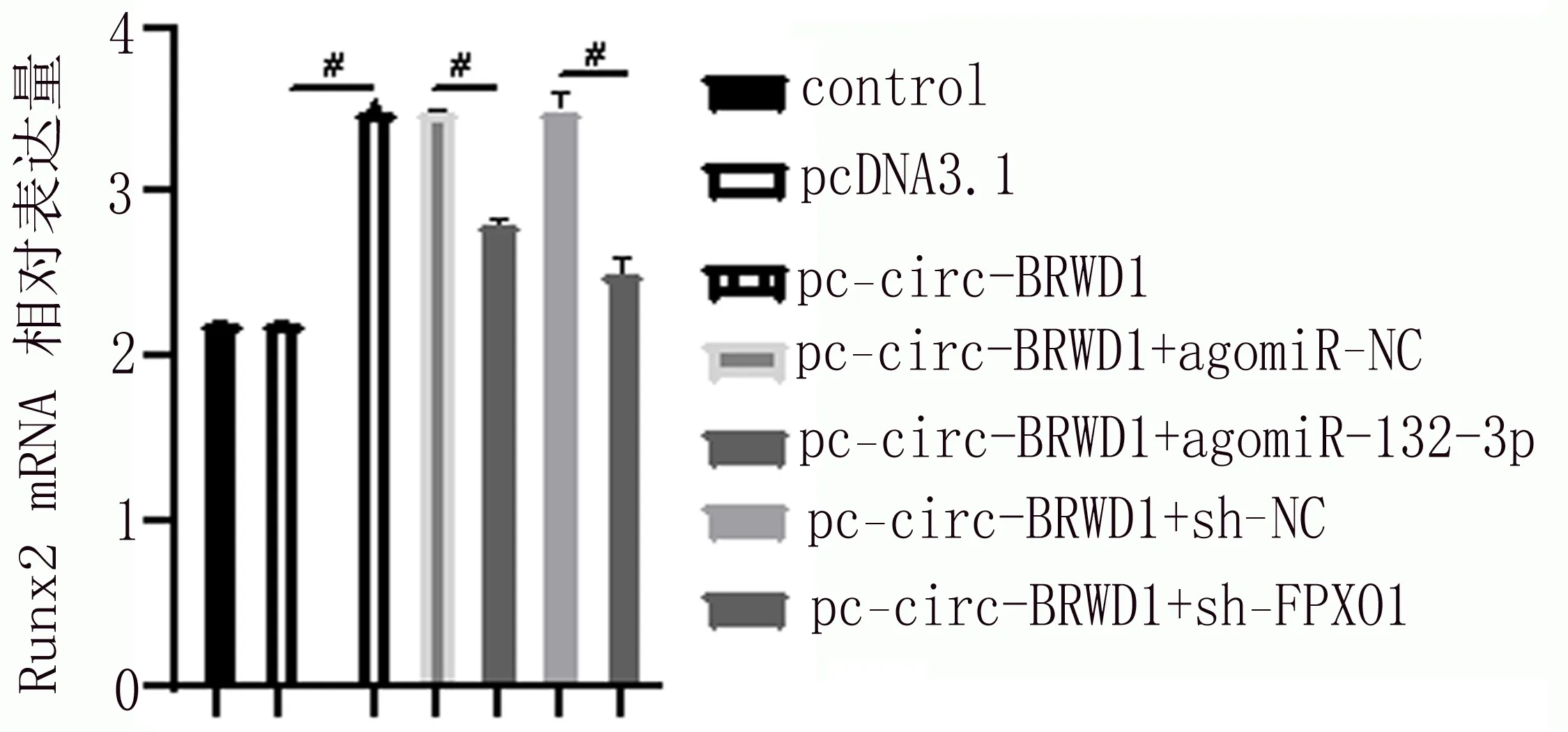
图8 RT-qPCR检测在miR-132-3p过表达和FOXO1敲低对Runx2表达的影响(#代表P<0.05)
3 讨论
FOXO1可通过降低成骨细胞内的氧化应激,对骨形成有一定的促进作用[8]。miR-96-5p可通过调控FOXO1调节成骨细胞分化[8-11]。miR-132-3p可以靶向FOXO1对内皮祖细胞增殖调控[6]。circ-BRWD1能通过调节miR参与骨关节炎的发展[5]。
本研究显示:随着时间的延长,ARS、ALP逐渐升高,说明BMSCs促进成骨分化。RT-qPCR检测对照组和PMOP组BMSCs的相对表达值:circ-BRWD1、FOXO1降低,miR-132-3p升高。说明circ-BRWD1、FOXO1促进成骨,miR-132-3p抑制成骨。网上找到circ-BRWD1与miR-132-3p、miR-132-3p与FOXO1的结合靶点。荧光素酶报告基因示miR-132-3p可显著抑制pMIR-circ-BRWD1-WT的荧光素酶活性,而不影响pMIR-circ-BRWD1-MT活性;miR-132-3p可显著抑制pMIR-FOXO1-WT的荧光素酶活性,而不影响pMIR-FOXO1-MT活性。都证实了circ-BRWD1可靶向调控miR-132-3p、miR-132-3p可靶向调控FOXO1。而有研究[12]显示miR-132-3p通过抑制成骨相关基因FOXO1调控胸黄韧带细胞的成骨分化,验证了他们之间互相调节的作用。模拟失重可通过miR-132-3p/FoxO3a/ROS通路影响成骨细胞凋亡[13]。而本实验RT-qPCR结果显示,过表达miR-132-3p显著下调FOXO1表达,而过表达circ-BRWD1则上调FOXO1表达。这些结果表明,circ-BRWD1可能通过调控miR-132-3p对FOXO1表达产生调控作用。Runx2的表达水平在过表达circ-BRWD1中升高,在共转染过表达circ-BRWD1+miR-132-3p中降低,在共转染过表达circ-BRWD1+敲除FOXO1中降低。这些研究结果表明,miR-132-3p过度表达和FOXO1敲除可能逆转的circ-BRWD1过表达引起的成骨的过度分化。
成骨细胞是骨形成最直接的执行者,是骨质疏松改善的主要细胞。已有研究表明circRNA在地塞米松诱导的骨质松机制中起重要作用[14]。miRNA可以调控BMSCs向成骨细胞分化,其对BMSCs增值影响并导致骨质疏松等相关疾病[15]。上调FoxO1的蛋白表达水平和转录活性从而抑制骨质疏松的形成[16]。circRNA、miRNA、FoxO1可通过成骨分化调节影响骨质疏松。总之,circ-BRWD1可以靶向miR-132-3p并增强FOXO1的表达,从而预防骨质疏松症,并可能提供一种新的治疗策略。
