基于高分辨率熔解曲线分析技术探讨TNF-α基因多态性与银屑病的相关性*
2023-02-04王英俊王蒙昕惠海珍史丙俊戚东卫
王英俊 王蒙昕 惠海珍 史丙俊 江 雪 龚 娟 戚东卫
1 重庆市中医院皮肤科 400011; 2 贵州中医药大学
银屑病(Psoriasis)是一种由多基因调控的慢性炎症性皮肤病,临床上以鳞屑性红斑、斑块为主要表现。银屑病因地区、种族、环境等影响因素不同,在全球的发病率差异较大,流行病学调查表明,我国总体患病率整体约为0.47%,且逐年上升[1]。其中遗传因素在银屑病的发病过程中有着重要影响,全基因组关联分析(GWAS)报道约有50多个易感基因与银屑病相关。相关研究证实银屑病的发病与IL-23及Th17信号通路有关,而肿瘤坏死因子α(TNF-α)是IL-23/Th17信号通路上重要的参与基因,且在银屑病患者的血清和皮损中均有异常表达[2],因此检测分析TNF-α基因多态性在银屑病的发病过程中的重要作用对银屑病的认识及研究具有重要意义。高分辨率熔解曲线(High resolution melting,HRM)分析技术主要用于含突变位点DNA基因的检测,该技术以普通聚合酶联反应(Polymerase chain reaction,PCR)为基础,通过检测DNA双链的解链温度变化来检测DNA序列的改变。因其较好的特异性和灵敏性、操作简单、成本低等优点,目前已广泛应用于检测基因突变和基因分型。本研究拟采用HRM技术对银屑病患者和正常人的TNF-α基因位点突变的检测,并以测序法进行验证,分析该位点与银屑病的相关性。
1 资料和方法
1.1 一般资料 收集2015年1月—2019年5月在我院住院部及门诊就诊的银屑病患者426例作为研究组,其中男290例,女136例,平均年龄(36.47±19.08)岁。对照组为我院体检中心健康人485例,其中男304例,女181例,平均年龄(35.25±17.84)岁,对照组各项指标均正常。本研究已通过重庆市中医院伦理委员会批准,所有研究对象均签署知情同意书。所有研究对象均无血缘关系。
1.2 选择标准 (1)纳入标准:临床表现及皮肤病理检查符合银屑病特点的患者。(2)排除标准:患有类风湿性关节炎、系统性红斑狼疮及皮肌炎等自身免疫性疾病,银屑病家族史,高血压、心脏病、糖尿病等慢性系统性疾病。
1.3 实验方法
1.3.1 DNA提取:取受试者空腹8h以上静脉血2ml置于EDTA抗凝采血管,并于4h内开始DNA提取。根据重庆美基生物技术有限公司提供的试剂盒说明书步骤提取外周血DNA。最后使用OneDrop仪器对DNA纯度及浓度进行检测。
1.3.2 引物的设计与合成:根据NCBI查找基因序列,采用primer3 input在线软件设计rs3093662位点单核苷酸多态性的扩增引物,其上游引物为:5’-GCCAGCCTTCATCCACTCT-3’;下游引物为:5’-CCCACTGCTTCCATACCG-3’。引物由武汉莫纳生物科技有限公司合成。
1.3.3 PCR-HRM检测:反应体系采用MonAmpTMFast SYBRGreen qPCR Mix (None/Low/High ROX),反应体系包括MonAmpTMFast SYBRGreen qPCR Mix 10μl,正向引物(10μM)a0.4μl,反向引物(10μM)a0.4μl,DNA模板b1μl,加Nuclease-Free Water至20μl,PCR-HRM检测在Light Cyder480荧光定量PCR仪上完成。扩增条件为预变性95℃ 30s,进入循环,变性95℃ 1~5s,退火&延伸 55~60℃ 1~5s,并采集荧光,40个循环;HRM检测条件为: 95℃ 1min,40℃ 1min,以1℃/s的温度上升速率从70~95℃收集熔解曲线数据,40℃冷却。依据标本熔解曲线峰型分析各基因型,并随机挑选3个不同特征峰的PCR产物送至武汉莫纳生物科技有限公司进行测序验证。
1.3.4 测序验证:所有扩增产物送至武汉莫纳生物科技有限公司进行测序,测序后运用Chromas软件进行突变碱基的查找。
1.4 统计学方法 运用Hardy-Weinberg(H-W)遗传平衡定律对理论频数和实际频数进行检验,最后应用SPSS22.0统计软件对两组基因型及等位基因频率进行分析。研究组和对照组的基因型和等位基因频率进行χ2检验,P<0.05代表差异具有统计学意义。
2 结果
TNF-α基因 rs3093662位点的基因分型及测序验证结果如图1所示,该结果经验证与PCR-HRM检测SNP结果一致。检测结果如表1所示,rs3093662的AG、AA、GG基因型频率在银屑病研究组和对照组中存在统计学差异(χ2=4.661,P=0.03),A、G等位基因频率在银屑病研究组和对照组中存在统计学差异(χ2=4.518,P=0.03)。

图1 TNF-α rs3093662基因分型分析
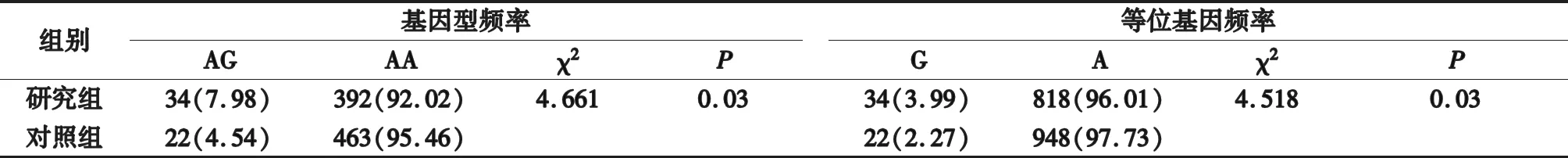
表1 TNF-α基因rs3093662单核苷酸多态性结果
3 讨论
虽然银屑病的发病机制还不清楚,但是有研究显示,银屑病的发生、发展、转归与细胞免疫密不可分,其发病风险涉及免疫系统的多个领域[3]。TNF-α基因位于人体第6号染色体6p21.3上,该染色体存在于组织相容性复合体(MHC)区域内,在MHC区域内的基因大多编码免疫防御相关蛋白,其中编码TNF-α基因位于MHC类区域的6号染色体内[4]。TNF-α是由激活淋巴细胞响应各种刺激产生的,在银屑病免疫炎症反应中起着重要作用,它可以刺激NF-κB信号通路,影响血管内皮生长因子的表达,促进角质形成细胞的增殖、分化,释放炎症介质参与炎症反应[5]。随后发现TNF基因是银屑病的独立易感因子,参与IL-23/Th17通路的炎症反应过程[6]。TNF-α基因多态性大多由其启动子区域决定,并影响着人类疾病的易感性和严重性[7]。有研究报道在银屑病患者与对照组之间,TNF-α基因启动子-308(rs1800629)多态性方面存在显著差异,G等位基因和GG基因型在患者组多于对照组,表明GG型存在银屑病风险[8]。在朱俊卿等的Meta分析中,验证了TNF-α-308A/G的突变基因型和等位基因是银屑病发病的保护因素。反之,TNF-α-238A/G突变基因型和等位基因增加了银屑病的发病风险[9]。目前TNF-α基因单核苷酸多态性位点与银屑病的相关性已被多项研究证实。王文菊等人参与的文献通过对汉族人银屑病易感基因TNF rs3093662的研究,发现TNF、IL-21和CCR4三个基因组成的交互作用模式与银屑病易感性相关[6]。
HRM分析技术作为一种基因分型技术,其原理是通过扩增含突变位点的基因,双链DNA在升温过程中由于突变位点不匹配而解开,荧光染料从解链的DNA上释放,释放时间不同,荧光强度也不同,以及图形变化上就可以判断是否存在突变位点[10],该技术完美地结合了PCR扩增技术与熔解曲线分析技术。近年来HRM分析技术因为有着结果准确性较高、操作简单、成本低等优点,在基因分型、突变扫描、序列匹配等方面都得到了全面应用。
本研究采用HRM分析技术对TNF-α基因rs3093662位点进行检测分析,结果显示426例样本中,rs3093662的G等位基因频率明显高于对照组,表明TNF-α基因rs3093662位点多态性可能与银屑病发病相关,且G等位基因可能为危险基因。因此,加强对TNF-α基因多态性的研究对银屑病分子生物学遗传机制阐述十分必要。尽管这些研究结果与本次不尽相同,考虑可能与TNF-α基因多态性在不同种族、环境及遗传背景下具有差异性相关。TNF-α基因多态性与银屑病发病的相关性仍需大样本、多种族、多区域进一步深入研究。
综上所述,采用HRM技术对银屑病患者TNF-α基因rs3093662位点进行分析,确立了操作简单、结果准确、耗时短的SNP分型方法,研究表明TNF-α基因rs3093662多态性与银屑病发病密切相关。HRM分析技术操作简单,检测快速,准确性高,检测成本低,适合在临床检测中推广应用。
