高孔隙度可再生骨支架仿真与实验研究
2023-02-03徐淑波赵晨浩刘建营张森薛现猛柳婷婷林少宇
徐淑波,赵晨浩,刘建营,张森,薛现猛,柳婷婷,林少宇
高孔隙度可再生骨支架仿真与实验研究
徐淑波1,2,赵晨浩1,刘建营1,张森1,薛现猛1,柳婷婷1,林少宇1
(1.山东建筑大学 材料科学与工程学院,济南 250101;2.华南理工大学 国家金属材料近净成形工程技术研究中心,广州 510640)
确定单元体与股骨的最佳孔隙度骨支架结构。通过扫描电镜分析选区激光熔化(Selective laser melting,SLM)成形试样的微观结构;通过静力学模拟与实验分析不同孔隙度下标准结构与Voronoi多孔结构的压缩变形规律;通过生物力学仿真实验分析步态周期下标准结构与Voronoi多孔结构的应力分布情况。在选区激光熔化成形的316L不锈钢微观组织中,均匀分布着细小的近六边形、伸长六边形的胞状结构和条柱状亚结构,受压时有利于分散应力,提高整体结构的稳定性;在压缩变形时,标准结构应力集中于垂直棱柱,易导致棱柱断裂引起试样倾斜;Voronoi结构连接杆的不均匀分布有利于分散应力,使Voronoi结构的最大等效应力(250.34 MPa)远低于标准结构(738.07 MPa),保证了整体受力均匀与结构稳定;在步态周期下,2种骨支架结构的应力随孔隙度的增加而增加,75%孔隙度的Voronoi结构具有更优异的承压能力与缓解应力屏蔽的作用。通过模拟与试验分析,确定了单元体与股骨的最佳孔隙度及Voronoi结构优异的力学性能,验证了在步态周期下高孔隙度Voronoi骨支架结构的可靠性,为股骨置换手术提供了理论依据。
选区激光熔化;静力学仿真模拟;生物力学仿真实验;Voronoi多孔结构;高孔隙度;步态周期
随着激光选区熔化技术的发展,其在医疗上的应用也越来越广泛,不仅可根据患者的不同情况进行精准的个性化定制[1-2],也可对孔的类型、孔径尺寸、孔壁厚度及孔隙度进行设计,完成特有的多孔结构与胞格结构制造[3],在骨生物医疗领域有着重要的应用前景[4-5]。
近年来,国内外专家学者对SLM打印多孔结构进行了大量理论与实验研究[6-9]。崔新建等[10]采用SLM技术打印了BCC、FCC和FCCZ等3种多孔结构,验证了该技术成形复杂多孔结构件的可行性。高芮宁等[11]采用有限元分析与实验对比分析了多孔支架的力学性能,验证了多孔支架有限元分析的可行性。李姝博等[12]研究了单元体结构对假体多孔结构的微观组织与力学性能的影响,并模拟了在不同多孔结构下人体站立时髋关节假体载荷的传递与应力分布规律。张兰等[13]建立了一种具有高孔隙率的骨小梁结构,并采用有限元软件分析了骨小梁的拉伸性能。
综上所述,研究人员对多孔结构件进行了大量的理论与实验研究,但仍未考虑人体在实际步态周期下应力分布的变化规律,且人体步态周期股骨的受力主要以压应力为主,因此有必要从压缩变形方面探索不同孔隙度多孔结构的变化规律。采用有限元分析与实验研究相结合,系统研究了不同孔隙度、不同骨支架结构的等效应力分布,并从生物载荷的角度验证了骨支架多孔结构的可靠性,可为股骨置换手术提供理论依据。
1 研究对象与方法
1.1 单元体模型设计
1.1.1 单元体多孔结构设计
为适应天然骨小梁微观结构,设计了一种基于种子点的空间(平面)剖分结构的不规则Voronoi多孔结构。同时,为便于突出Voronoi多孔结构的优点,研究孔隙度对股骨力学性能的影响,设计了四棱柱标准多孔结构作为对照组。通过大量研究发现[14-15],骨组织支架结构的理想多孔尺寸为300~900mm,孔隙度为60%~95%。将多孔支架结构的孔尺寸设为300mm,孔隙度设为75%~85%,相关设计参数见表1。
表1 Voronoi孔型多孔结构及对照组设计参数
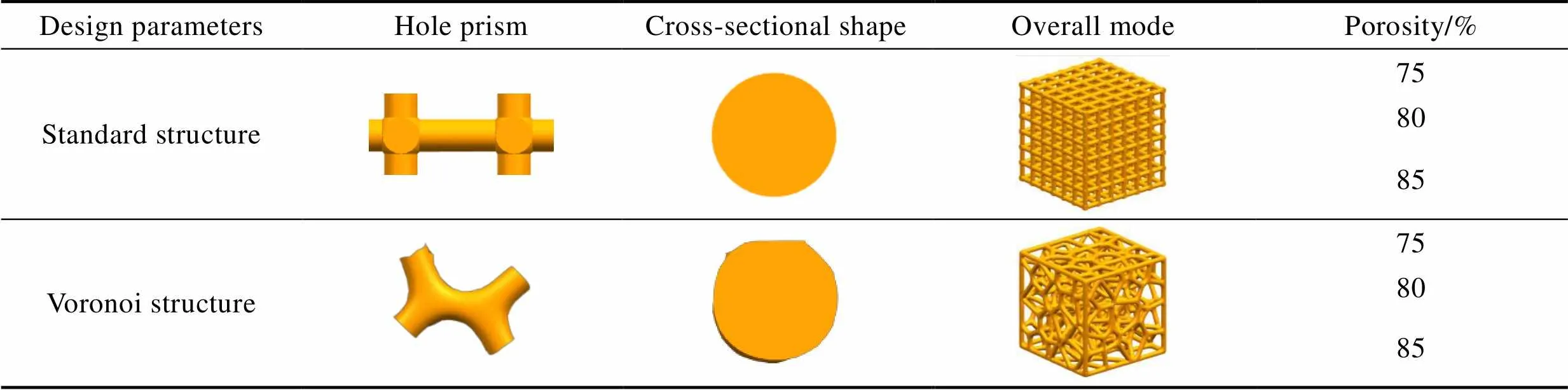
Tab.1 Design parameters of Voronoi porous structure and control group
1.1.2 单元多孔模型建立
在Rhino中,利用插件Grasshopper设计随机多孔结构的建模流程见图1。首先,在20 mm×20 mm区域随机生成所需的种子点,通过相应的概率球半径生成二维Voronoi图;然后,利用Voronoi 3D模块生成含随机单元体的三维Voronoi结构(图1b),并提取三维结构内部的不规则种子点,将相邻的2点连接,构建棱柱为1 mm×1 mm截面的随机多孔模型(图1c);最后,用T-splines插件对棱柱光滑处理,生成棱柱直径为1 mm截面的Voronoi多孔结构模型(图1d)。标准多孔结构的建模需在二维建模区域生成规则点阵,才会得到相应的三维结构。
Voronoi多孔结构建模流程的电池组图见图2。可通过设置体积为20 mm×20 mm×20 mm的正方体区域、种子点数量与棱柱直径,创建出孔径为1 mm、孔隙率为75%~85%的多孔三维结构。将Voronoi多孔结构以.xt格式导入有限元软件Ansys,完成单元体多孔结构的建模。
1.1.3 材料属性设置
有限元模拟与实验的材料均选用316L不锈钢,其具体应力–应变曲线见图3,实验阶段选用SLM技术制备多孔单元体。
1.1.4 边界和约束条件
由于该多孔结构应用于人体骨骼,且人体的骨骼受力以压应力为主[16]。因此,应对多孔结构试样进行压缩测试实验。通过Ansys模拟软件对多孔模型上下表面加入厚度1 mm的实心板,实心板材料设为工程钢材料,接触面设为摩擦接触。整体模型采用四面体网格划分,网格尺寸设为0.3 mm。对底板实施完全固定约束,对上板施加100 N的载荷,载荷方向见图4。为确保有限元分析的准确性,保证多孔结构植入人体后不产生塑性形变,其有限元力学分析仅限于线弹性形变。
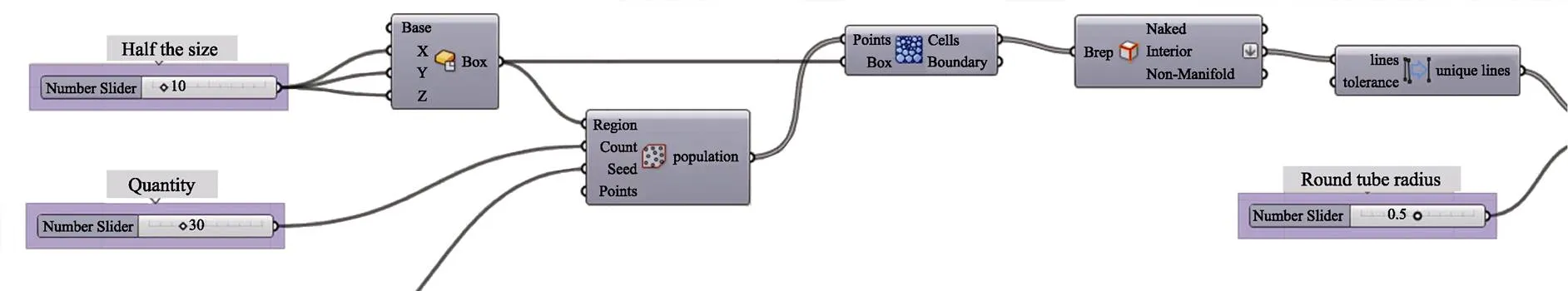
图2 随机多孔结构的Grasshopper主程序电池组图
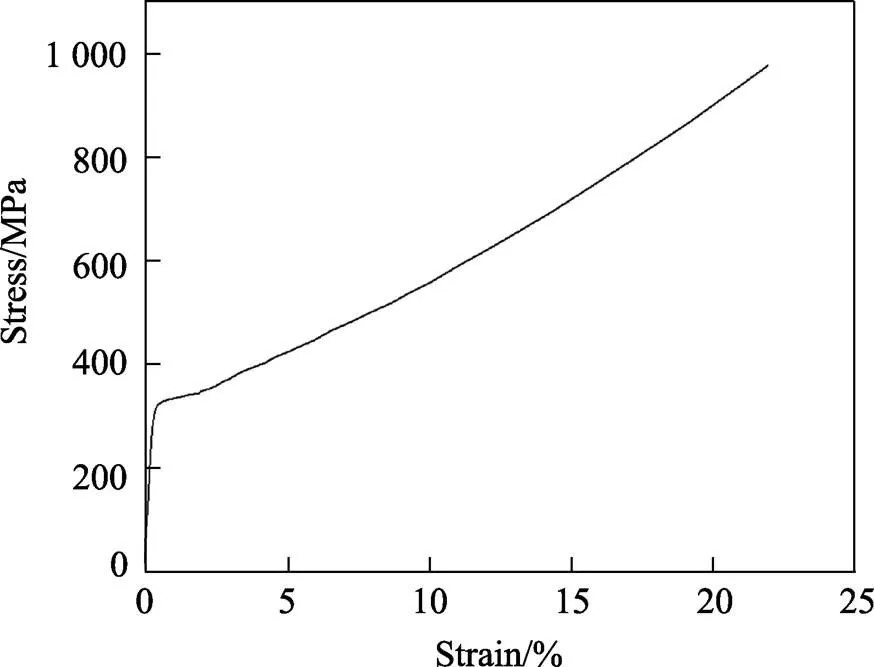
图3 SLM技术制备316L不锈钢压缩应力–应变曲线
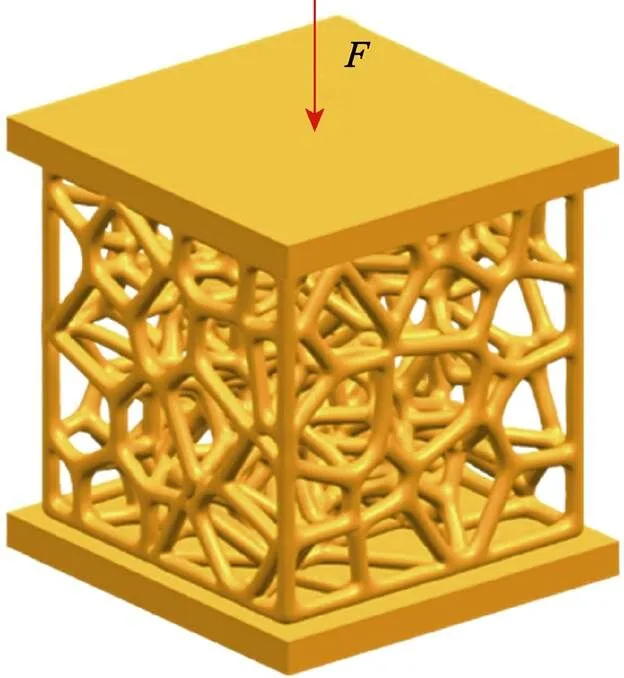
图4 有限元压缩模拟受力方向
1.2 股骨模型设计
1.2.1 股骨三维有限元模型建立
通过螺旋CT扫描机,实现人体股骨长轴方向横断面的螺旋扫描。将股骨CT扫描数据以Dicom 3.0格式导入Mimics软件,阈值设为662~161 3,并通过Calculate 3D界面创建股骨的三维模型(图5a)。但此时的三维股骨模型由若干个曲面片组成(图5b),故需将三维模型以STL格式保存并导入曲面重构软件Geomagic,通过表面装填、缝合、封闭等操作将曲面片拟合成相连曲面,进而生成NURBS曲面模型,实现股骨三维模型的光滑处理。以step的格式导入有限元软件ABAQUS,完成股骨三维模型建模。
图5 股骨实体模型
1.2.2 股骨与假体装配
为设计出最符合骨小梁的多孔骨支架,将股骨中间部分用支架代替,在植入过程中保证假体中心线与股骨髓腔中心线吻合。假体与骨骼的接触设置为“Bonded”,并在Mesh模块中对股骨-假体各部分进行自由网格划分,单元设为四面体形状。根据不同孔隙度的骨支架单元体结构建立股骨-假体模型(图6)。

图6 股骨–假体模型
1.2.3 材料属性设置
在模拟阶段假定骨结构、软骨为连续、均匀、各向同性的弹性材料[17-20],股骨各部分模型具体材料属性见表2。
1.2.4 股骨约束
采用anybody软件模拟体质量为70 kg的成人完成整个行走周期[21-22],忽略其余因素影响,导出完整步态周期下股骨反作用力(HMF)、髋关节后侧力(HAPH)和髋关节近端力(HPDF)的载荷数据,具体的方向及大小见图7。通过ABAQUS载荷模块建立3组数据的载荷模型,同时将远端股骨节点固定约束,模拟步态周期下股骨受力对假体的影响。
表2 模型材料属性
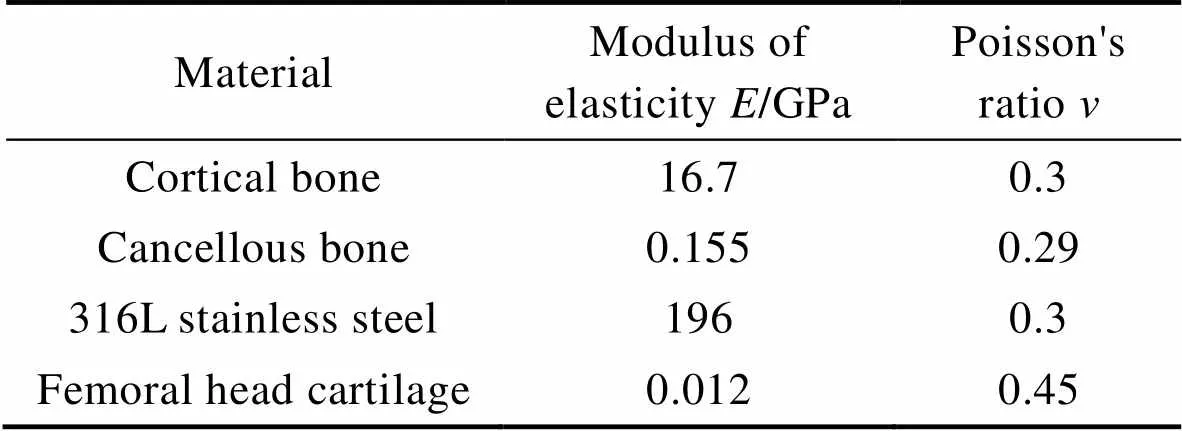
Tab.2 Model material properties
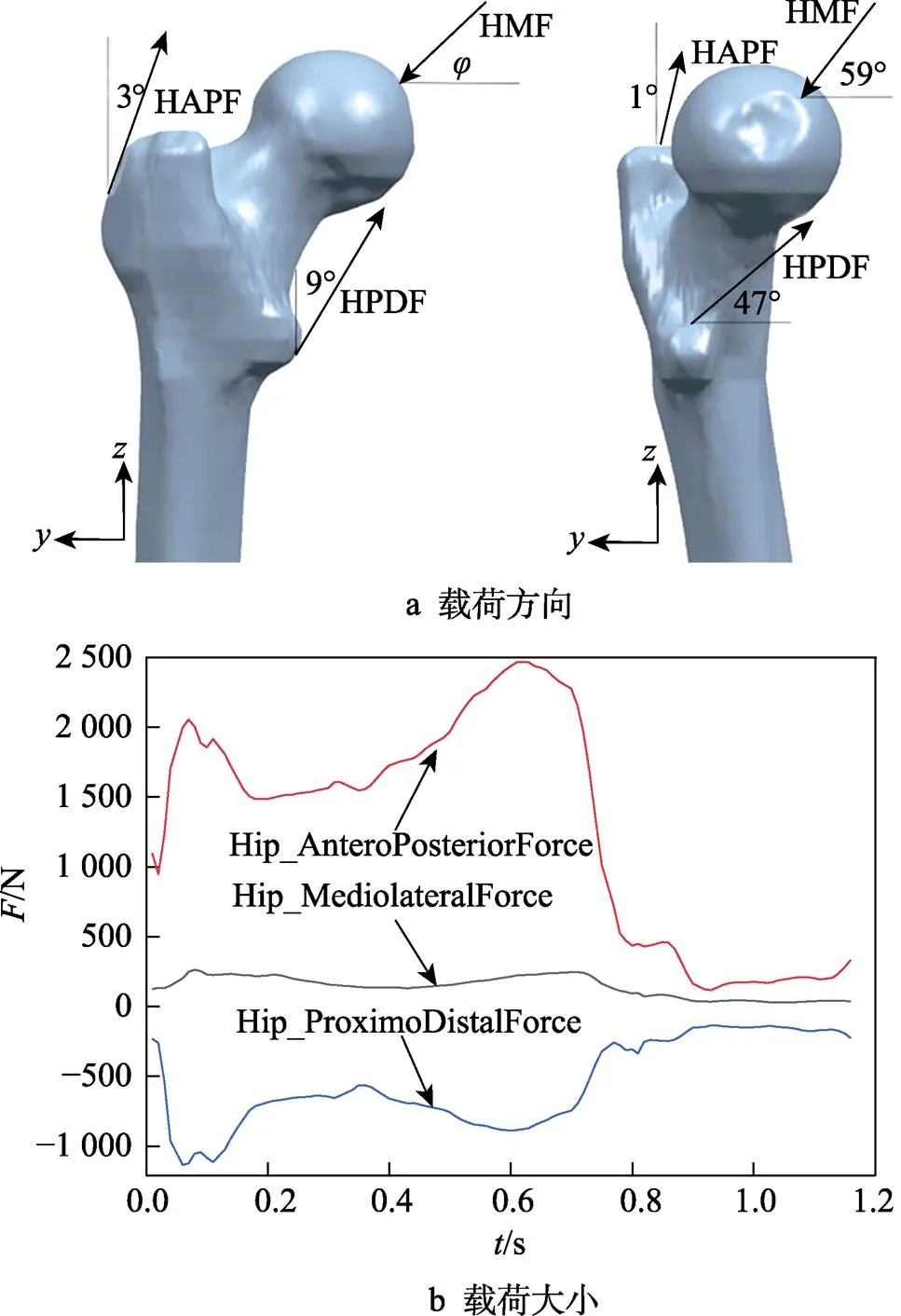
图7 股骨近端各载荷的角度与大小
2 结果分析
2.1 单元体有限元结果分析
不同孔隙度多孔结构压缩试样的等效应力图见图8。由图8可知,标准结构的最大等效应力分别为738.07、1 014.4、1 445.2 MPa,而Voronoi结构的最大等效应力分别为250.34、425.58、876.2 MPa。可见,在相同加载力下,Voronoi结构的最大等效应力远低于标准结构。对试样各部分的应力分析可知,随着孔隙度增大,有限元模型的等效应力逐渐增大,应力对上下板的影响亦逐渐增大,这将导致骨支架与骨骼接触面的应力分布不均匀,从而对骨组织造成更为严重的应力屏蔽。对单元体结构的分析可知,标准结构的应力主要分布在垂直固定面的棱柱上,这说明试样破坏时垂直棱柱会先行断裂,且由于棱柱的不均匀受力,试样易产生倾斜而对人体造成二次损伤。Voronoi结构的应力分布在每个杆件连接处,试样整体的应力分布更为均匀,因而试样在压缩时并无倾斜现象发生。
2.2 实验结果分析
为分析多孔结构在打印过程中的组织演变过程,验证有限元分析的可靠性,对标准结构与Voronoi结构进行SEM分析与力学性能测试。需完成不同孔隙度单元体多孔结构的打印,试验材料选用实验室316L不锈钢粉末,釆用FS271M金属激光3D打印机快速打印成形,打印试样见图9。
2.2.1 多孔316L不锈钢微观组织分析
SLM成形试样的SEM图见图10。由图10可知,晶粒内部均匀分布着近六边形、伸长六边形的胞状结构和条柱状亚结构,且相比于传统316L不锈钢,组织中并未发现孪晶。柱状亚结构条带之间的宽度为400~500 nm(图 10a),胞状组织结构的平均尺寸为1 μm左右(图 10b)。这些细小亚结构在承受压缩应力时可由每个部位均匀分摊,能够承受更高的压缩应力。通过对不锈钢材料的大量调研发现[23-26],316L不锈钢常被用作人体牙齿与骨骼的植入,能有效促进骨组织再生且不产生排异反应,具有良好的生物相容性。因此,采用3D打印成形的316L不锈钢结构作为人骨的实验材料具有较优越的组织优势。

图8 不同孔隙度多孔结构有限元模拟等效应力图

图9 SLM技术打印试样

图10 316L不锈钢试样SEM图像
2.2.2 多孔316L不锈钢压缩性能分析
分别对变形量在2%、10%、30%时的标准结构与Voronoi结构进行取样分析(图11),2种多孔结构与实体金属类似,在压缩过程中均变成鼓形,体现出良好的塑性变形能力。但由于标准结构在压缩过程中连接上、下层的棱柱断裂,导致整体试样出现偏移现象;Voronoi结构的连接杆呈不均匀分布,可用于分散应力,保证试样受力均匀,不易引起试样倾斜。可见,有限元仿真与实验结果相同,Voronoi结构可有效反应试样的实际受力情况。

图11 不同变形量多孔结构试样压缩实验
多孔结构压缩应力–应变曲线见图12。与图10所示的压缩过程相似,多孔结构的压缩变形分为弹性、塑性与压缩密实等3个阶段。其中,弹性阶段的应力–应变呈线性增长;塑性阶段由于多孔结构压缩后晶粒的不均匀性,试样局部发生塑性变形,应力–应变曲线呈现平台状;压缩密实阶段由于变形和作用力方向的不同,会产生一定的剪切应力,最终在孔壁尖角形成应力集中,从而造成裂纹源。随着应力的逐渐增加,裂纹逐渐扩展,致使整体结构完全断裂。整个变形过程无明显的屈服阶段。
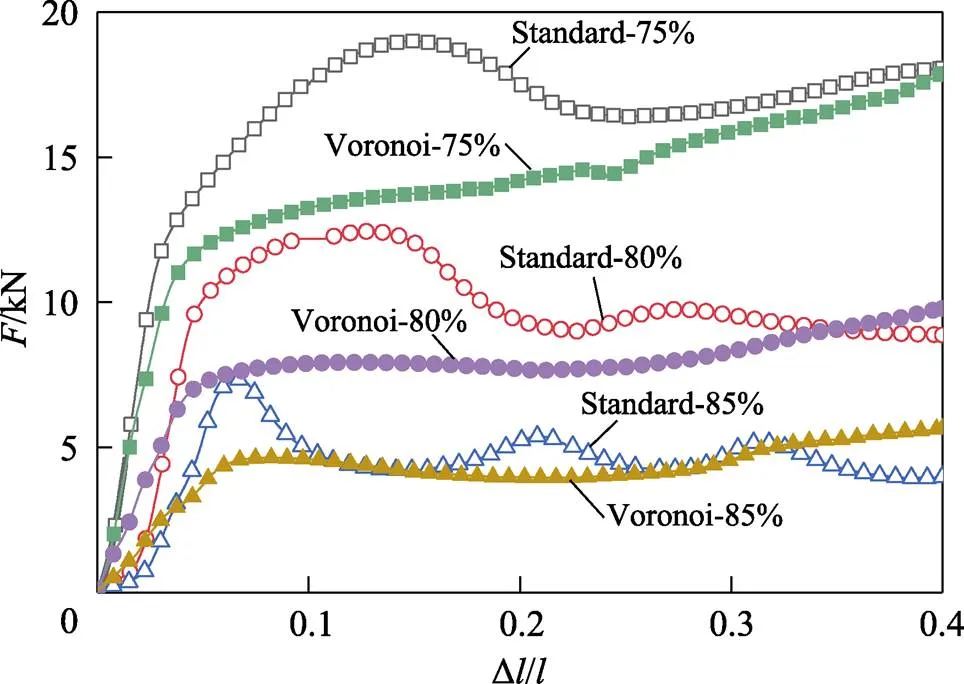
图12 多孔结构压缩应力–应变曲线
由图12还可知,标准件在压缩密实阶段应力出现明显的偏移现象,这说明应力集中于垂直连接柱处,若植入到人体中极易产生应力集中现象,对人体造成二次损伤;而Voronoi结构压缩曲线在经过屈服点后依旧呈线性增长趋势,且增长率非常小,压缩过程并未产生偏移,无明显应力集中。另外,压缩应力随孔隙度的减小而不断增加,孔隙度为75%的Voronoi结构具有更好的承压能力,因而Voronoi结构比标准结构更适合作为人体骨骼植入物。
2.3 多孔316L不锈钢生物力学仿真分析
股骨不同孔隙度、不同结构的等效应力云图见图13。由图13可知,在步态周期下主要应力为股骨反作用力,这说明股骨在步态周期主要受压缩力,验证了压缩实验的必要性。股骨生物力学实验数据与单元体压缩变形相似,其最大等效应力随孔隙的增大逐渐增加,且最大应力点位置逐渐下移;同时,Voronoi结构的最大等效应力远低于标准结构,最大应力点位置较高,且试样应力分布更为均匀,这表明Voronoi结构具有更优异的抗压缩变形能力。

图13 股骨不同孔隙度不同结构的Mises应力云图
对比图13a—c或d—f可知,孔隙度越高,金属假体对骨组织造成的应力屏蔽越严重,假体与骨组织接触面的应力也逐渐增大,易发生假体与骨组织间的摩擦作用,从而减少植入物的使用寿命。因此,75%孔隙度的Voronoi结构最适合作为人骨植入物。
3 结论
通过有限元模拟与试验研究,获得了不同孔隙度、不同结构下单元体多孔结构与股骨-假体多孔结构的压缩变形规律。
1)SLM打印的316L不锈钢均由1 μm以下的细小胞状结构、柱状亚结构构成,在压缩变形时可均匀分摊应力,保证整体结构稳定。
2)多孔结构压缩大致可分为弹性阶段、塑性平台阶段和压缩密实阶段;在压缩过程中,标准多孔结构应力集中在纵向棱柱处,易造成杆件断裂而引起试样倾斜;Voronoi多孔结构的应力集中在多杆交点处,试样受力均匀且无倾斜现象。
3)对6种不同骨支架多孔结构的生物力学仿真实验分析可知,等效应力随孔隙度的减小而逐渐减弱,Voronoi多孔结构能有效降低人体步态周期下的应力屏蔽效应,减少多孔支架与骨组织的摩擦,75%孔隙度的Voronoi多孔结构植入人骨具有更优异的性能。
[1] 吴小宝, 冯坤, 田大为. 3D打印个性化导航截骨导板在膝关节置换中的应用研究进展[J]. 中国医药导报, 2022, 19(4): 52-56.
WU Xiao-bao, FENG Kun, TIAN Da-wei. Research Progress on the Application of 3D Printing Personalized Navigation Osteotomy Guide in Knee Replacement[J]. China Medical Herald, 2022, 19(4): 52-56.
[2] 魏志远, 李浩, 熊旭,等. 双峰3D打印个性化接骨板内固定治疗严重胫骨平台骨折[J]. 中国骨与关节损伤杂志, 2021, 36(10): 1087-1089.
WEI Zhi-yuan, LI Hao, XIONG Xu, et al. Internal Fixation of Bimodal 3D Printing Personalized Bone Plate for Severe Tibial Plateau Fractures[J]. Chinese Journal of Bone and Joint Injury, 2021, 36(10): 1087-1089.
[3] 宋颖, 邓久鹏, 张炜. 骨组织工程多孔支架制备方法的研究进展[J]. 生物医学工程与临床, 2021, 25(2): 246-250.
SONG Ying, DENG Jiu-peng, ZHANG Wei. Research Progress in the Preparation of Porous Scaffolds for Bone Tissue Engineering[J]. Biomedical Engineering and Clinical, 2021, 25(2): 246-250.
[4] FANTINI M, CURTO M, CRESCENZIO D F. A Method to Design Biomimetic Scaffolds for Bone Tissue Engineering Based on Voronoi Lattices[J]. Virtual Physi Prototyping, 2016, 11(2): 77-90.
[5] MACHADO B I, LOPEZ M I, BRACKE J, et al. Next-generation Biomedical Implants Using Additive Manufacturing of Complex, Cellular and Functional Mesh Arrays[J]. Philosophical Transactions of the Royal Society, 2010, 368(1917): 1999-2032.
[6] Gomez S, Vlad M D, Lopez J, et al. Design and Properties of 3D Scaffolds for Bone Tissue Engineering[J]. Acta Biomaterialia, 2016, 42: 341-350.
[7] Tan X P, Tan Y J, Chow C S L, et al. Metallic Powder-bed Based 3D Printing of Cellular Scaffolds for Orthopaedic Implants: A State-of-the-art Review on Manufacturing, Topological Design, Mechanical Properties and Biocompatibility[J]. Materials Science & Engineering, C. Materials for Biogical Applications, 2017, 76: 1328-1343.
[8] Fantini M, Curto M, De Crescenzio F. A Method to Design Biomimetic Scaffolds for Bone Tissue engineering Based on Voronoi Lattices[J]. Virtual & Physical Prototyping, 2016, 11(2): 77-90.
[9] Fantini M, Curto M. Interactive Design and Manufacturing of a Voronoi-based Biomimetic Done Scaffold for Morphological Characterization[J]. International Journal on Interactive Design & Manufacturing, 2018, 12(2): 585-596.
[10] 崔新建, 刘玉德, 石文天,等. 选区激光熔化成形316L不锈钢多孔结构及力学性能[J]. 特种铸造及有色合金, 2020, 40(1): 75-80.
CUI Xin-jian, LIU Yu-de, SHI Wen-tian, et al. Porous Structure and Mechanical Properties of 316L Stainless Steel Formed by Selective Laser Melting[J]. Special Casting and Nonferrous Alloys, 2020, 40(1): 75-80.
[11] 高芮宁, 李祥. 径向梯度多孔支架设计与力学性能分析[J]. 机械工程学报, 2021, 57(3):220-226.
GAO Rui-ning, LI Xiang. Design and Mechanical Properties Analysis of Radial Gradient Porous Scaffolds[J]. Chinese Journal of Mechanical Engineering, 2021, 57(3):220-226.
[12] 李姝博. 3D打印髋关节假体多孔结构力学性能的数值仿真和实验研究[D]. 吉林: 吉林大学, 2020: 51-57.
LI Shu-bo. Numerical Simulation and Experimental Study on Mechanical Properties of 3D Printed Hip Prosthesis Porous Structure[D]. Ji Lin: Jilin University, 2020: 51-57.
[13] 张兰, 王翔, 刘军,等. 3D打印钛合金骨小梁多孔结构的拉伸性能[J]. 中国组织工程研究, 2020, 24(22): 3498-3503.
ZHANG Lan, WANG Xiang, LIU Jun, et al. Tensile Properties of 3D Printed Titanium Alloy Trabecular Bone Porous Structures[J]. Chinese Journal of Tissue Engineering Research, 2020, 24(22): 3498-3503.
[14] 冯雨欣, 王玥涵, 曲佳欣,等. 基于CT的股骨精确建模与三维有限元分析[J]. 软件, 2020, 41(1): 46-49.
FENG Yu-xin, WANG Yue-han, QU Jia-xin, et al. Accurate Modeling and 3D Finite Element Analysis of Femur Based on CT[J]. Software, 2020, 41(1): 46-49.
[15] 孙海波, 徐淑波, 张森,等. SLM成形不同孔隙结构骨支架的仿真与实验研究[J]. 精密成形工程, 2022, 14(2): 123-128.
Sun Hai-bo, Xu Shu-bo, Zhang Sen, et al. Simulation and Experimental Study on SLM Forming of Bone Scaffolds with Different Pore Structures[J]. Precision Forming Engineering, 2022, 14(2): 123-128.
[16] 任启超. 正常重力环境下人体下肢力学特性研究[D]. 太原理工大学, 2017: 23-45.
REN Qi-chao. Research on mechanical properties of human lower limbs in normal gravity environment[D]. Taiyuan University of Technology, 2017: 23-45.
[17] 石志良, 黄琛, 卢小龙,等. Sphere梯度孔结构力学性能有限元分析[J]. 中国生物医学工程学报, 2019, 38(3): 339-347.
SHI Zhi-liang, HUANG Chen, Lu Xiao-long, et al. Finite Element Analysis of Mechanical Properties of Sphere Gradient Holes[J]. Chinese Journal of Biomedical Engineering, 2019, 38(3): 339-347.
[18] 王学斌, 庞清江, 余霄. 人工股骨头置换术中置入不同直径假体球头的有限元分析[J]. 中国骨伤, 2020, 3(6): 558-563.
WANG Xue-bin, PANG Qing-jiang, YU Xiao. Finite Element Analysis of Different Diameter Ball Head Implant in Artificial Femoral Head Replacement[J]. China Journal of Bone Trauma, 2020, 3(6): 558-563.
[19] 张升. 医用合金粉末激光选区熔化成形工艺与性能研究[D]. 武汉: 华中科技大学, 2014: 29-57.
Zhang Sheng. Laser Selective Melting Forming of Medical Alloy Powder and Its Properties[D]. Wuhan: Huazhong University of Science and Technology, 2014: 29-57.
[20] 颜继英. 不同材料赋值下股骨静力学有限元模型的力学仿真分析[J]. 中国组织工程研究, 2020, 24(9): 1390-1394.
YAN Ji-ying. Mechanical Simulation Analysis of Femur Static Finite Element Model with Different Material Assignment[J]. Chinese Journal of Tissue Engineering Research, 2020, 24(9): 1390-1394.
[21] 徐欢欢, 何育民, 孙朝阳,等. AnyBody环境下人体步态的逆向动力学研究[J]. 机械科学与技术, 2019, 38(12): 1819-1824.
XU Huan-huan, HE Yu-min, SUN Chao-yang, et al. Study on Inverse Dynamics of Human Gait in the Environment of AnyBody[J]. Mechanical Science and Technology, 2019, 38(12): 1819-1824.
[22] 罗林聪, 马立敏, 林泽,等. 基于AnyBody骨骼肌肉多体动力学分析的有限元仿真[J]. 医用生物力学, 2019, 34(3): 237-242.
LUO Lin-cong, MA Li-min, Lin Ze, et al. Finite Element Simulation of Multibody Dynamics Analysis of Skeletal Muscle of AnyBody[J]. Medical Biomechanics, 2019, 34(3): 237-242.
[23] LAWRENCE J, CHEW H R, CHONG C K, et al. Laser Modification of the Wettability Characteristics of a 316L Stainless Steel Bio-metal and the Effects Thereof on Human Fibroblast Cell Response[J]. Lasers in Engineering, 2005, 15: 75-90.
[24] 吴启锐. 选区激光熔化成形316L不锈钢多孔结构的力学性能及生物相容性研究[D]. 福建: 福建工程学院, 2021: 56-62.
WU Qi-rui. Study on Mechanical Properties and Biocompatibility of 316L Stainless Steel Porous Structure Formed by Selective Laser Melting[D]. Fu Jian: Fujian Institute of Technology, 2021: 56-62.
[25] 李超. 激光增材制造成形316L不锈钢的研究进展[J]. 机械工程材料, 2022, 46(8): 1-7.
LI Chao. Progress of laser additive manufacturing for forming 316L stainless steel [J]. Mechanical Engineering Materials, 2022, 46(8): 1-7.
[26] 谢焯俊, 方辉, 沈显峰,等. 面向基于Voronoi结构的随机多孔骨植入材料的小孔结构参数化建模方法研究[J]. 生物骨科材料与临床研究, 2020, 17(4): 1-6.
XIE Chao-jun, FANG Hui, SHEN Xian-feng, et al. A parametric modeling method for small pore structures of random porous bone implant materials based on Voronoi structure[J]. Bio-Orthopaedic Materials and Clinical Research, 2020, 17(4): 1-6.
Simulation and experiment of high porosity renewable bone scaffold
XU Shu-bo1,2, ZHAO Chen-hao1, LIU Jian-ying1, ZHANG Sen1, XUE Xian-meng1, LIU Ting-ting1, LIN Shao-yu1
(1. School of Materials Science and Engineering, Shandong Jianzhu University, Jinan 250101, China; 2. National Engineering Technology Research Center for Material Forming, South China University of Technology, Guangzhou 510640, China)
The work aims to determine the optimal porosity bone scaffold structure between the unit body and the femur.The microstructure of the sample formed by selective laser melting (SLM) was analyzed by scanning electron microscope. The compression deformation law of standard structure and Voronoi porous structure under different porosity was analyzed by static simulation and experiment. The stress distribution of the standard structure and the Voronoi porous structure under the gait cycle was analyzed by biomechanical simulation experiment.The microstructure of 316L stainless steel formed by selective laser melting was evenly distributed with fine cell structures of near hexagon, elongated hexagon and strip columnar substructure, which was conducive to the stress dispersion and improved the stability of the whole structure. During the compression deformation, the stress of the standard structure was concentrated in the vertical prism, which easily led to the fracture of the prism and caused the sample tilt. The non-uniform distribution of Voronoi structure was conducive to the stress dispersion, so that the maximum equivalent stress of Voronoi structure (250.34 MPa) was much lower than that of the standard structure (738.07 MPa), ensuring the uniform stress and stability of the whole structure. Under the gait cycle, the stress of the two bone scaffold structures increased with the increase of porosity, and the Voronoi structure with 75% porosity had better bearing capacity and relieved the effect of stress shielding. Through simulation and experimental analysis, the optimal porosity of the unit body and the femur and the excellent mechanical properties of the Voronoi structure are determined and the reliability of the high porosity Voronoi bone scaffold structure under the gait cycle is verified, which provides a theoretical basis for femoral replacement surgery.
selective laser melting; static simulation; biomechanical simulation experiment; Voronoi porous structure ; high porosity; gait cycle
10.3969/j.issn.1674-6457.2023.01.016
R318.08
A
1674-6457(2023)01-0120-08
2022–04–16
2022-04-16
国家自然科学基金(41305124);山东省科技型中小企业创新能力提升工程(2022TSGC2108,2022TSGC2402);山东省自然科学基金面上项目(ZR2021ME182);大学生国创计划(S20211043001,202210430010,202210430008)
Natural Science Foundation of Shandong Province (41305124); Science and Technology Enterprise Innovation Program of Shandong Province (2022TSGC2108, 2022TSGC2402); Natural Science Foundation of Shandong Province (ZR2021ME182); National College Student Innovation and Entrepreneurship Program (S20211043001, 202210430010, 202210430008)
徐淑波(1977—),男,博士,教授,主要研究方向为塑性加工和增材制造。
XU Shu-bo (1977-), Male, Doctor, Professor, Research focus: plastic forming and additive manufacturing.
徐淑波, 赵晨浩, 刘建营, 等. 高孔隙度可再生骨支架仿真与实验研究[J]. 精密成形工程, 2023, 15(1): 120-127.
XU Shu-bo, ZHAO Chen-hao, LIU Jian-ying, et al. Simulation and experiment of high porosity renewable bone scaffold[J]. Journal of Netshape Forming Engineering, 2023, 15(1): 120-127.
