基于SLM的梯度多孔牙种植体力学特性
2023-02-03曾寿金王靖何伟辉许明三韦铁平
曾寿金,王靖,何伟辉,许明三,韦铁平
基于SLM的梯度多孔牙种植体力学特性
曾寿金,王靖,何伟辉,许明三,韦铁平
(福建工程学院 a.福建省智能加工技术及装备重点实验室 b.机械与汽车工程学院,福州 350118)
确定既满足强度要求又能够有良好长期稳定性的梯度多孔牙种植体最佳孔隙值。设计4组不同孔隙率(G30、G40、G50、G60)的梯度多孔结构样件及均质多孔样件S30,选区激光熔化(SLM)成型后通过准静态压缩试验对其力学性能进行研究,测量出样件的弹性模量和屈服强度。通过有限元分析评估不同孔隙率种植体及对应下颌骨组织的应力分布。相较于实体钛合金结构(110 GPa),多孔结构的弹性模量(13.47~15.88 GPa)已完全符合人体自然骨组织(2~20 GPa)范围,多孔结构屈服强度(484.81~834.47 MPa)远高于皮质骨(180.5~211.7 MPa);梯度多孔结构样件弹性模量相较于均质多孔结构略有提升,屈服强度(834.47 MPa)比均质多孔结构样件(730.56 MPa)提高了约14%。梯度多孔种植体周围皮质骨最大等效应力值分布在43.362 9~45.015 4 MPa之间,松质骨最大等效应力值分布在4.756 58~ 5.055 6 MPa之间,完全满足2~60 MPa范围内的最大应力,适合骨组织生长。种植体与下颌骨之间的应力差值随着孔隙率的增大而逐渐变大,孔隙率为30%的TPMS–G型梯度多孔牙种植体与下颌骨应力差值最小,生物力学特性最佳,有利于形成稳定的骨整合。通过试验及仿真模拟,确定了适用于种植体的最佳梯度多孔结构,既满足强度要求,又具有良好的长期稳定性。
选区激光熔化;牙种植体;多孔结构设计;力学性能;有限元分析
当今社会人口老龄化现象逐渐明显,人民生活水平也逐渐提升,使得人们对于牙齿缺损导致的修复需求变得越来越高。对于患者而言,牙齿缺失不仅会对日常进食产生一定的影响,同时也会使言语交流产生障碍,甚至会引起面部口腔区域形貌的改变,长此以往,会影响患者的心理健康[1]。种植牙技术的出现与发展不仅解决了使用活动假牙产生的不便,也从一定程度上改善了颌面的美观。由于牙种植体普遍为金属制件,市场上普通钛合金铸造件的弹性模量达到了110 GPa,而人类的皮质骨弹性模量为3~30 GPa,松质骨弹性模量为1~3 GPa,若种植体使用钛合金铸件,因其弹性模量远高于人体骨组织,长期使用会产生明显的“应力屏蔽”现象[2],导致应力无法传递到周围的骨组织,从而使得种植体最终产生松动甚至脱落现象,缩短种植体的使用寿命[3]。如何降低牙种植体的弹性模量以减轻应力遮挡效应,从而提高种植牙的使用寿命是目前需要解决的主要问题。
选区激光熔化(Selective Laser Melting,SLM)是激光增材制造技术的一种,其原理是利用高能激光束将金属粉末逐层熔化,层层累积,最终成型的三维模型件不仅有着复杂的几何特征,同时还具有优异的力学性能,因此,该技术大量应用于医学和航空航天领域[4]。随着SLM技术的高速发展,多孔材料逐渐受到众多学者的重视。而在牙科领域中,将牙种植体制备成多孔结构来降低弹性模量是较为可行的一种降低应力屏蔽的方法[5]。多孔牙种植体不仅可以有效地减轻应力遮挡效应,而且能增强种植体与骨组织的结合,从根本上提高牙种植体的稳定性。
近年来,众多学者在多孔结构设计上皆取得了一定的成就,其设计方法主要包括通过基本单元和三周期极小曲面(TPMS)为主设计规则多孔结构,以及通过数学模型和计算机程序实现不规则多孔结构[6]。其中,三周期极小曲面(TPMS)是具有复杂的3D拓扑空间结构的极小值表面,其内部结构互联互通,表面光滑,并具有高比表面积和高孔隙率等特点,是用于骨科植入体设计中较为理想的多孔结构,早在2006年,Rajagopalan等[7]就证明了TPMS结构在生物学上具有天然亲和力,为其用作可行的骨组织类似物提供了充分的证据。
虽然当下三周期极小曲面结构的研究已取得阶段性的进展,但在牙种植体的研究中引入TPMS进行结构设计并探究其性能仍旧不多见。文中以三周期极小曲面建模法进行牙种植体多孔部分的结构设计,选用TPMS结构中的G型曲面为孔隙结构进行模型的设计,G型曲面单元具有螺旋二十四面体结构,因其具有较高的比表面积,类似于松质骨的孔隙结构,故十分适合骨细胞的黏附、增殖与分化。TPMS不同曲面结构皆有其独特的隐函数表达式,在进行结构设计时,通过改变隐函数的不同参数即可调控相应多孔单元的孔隙率大小及单元尺寸,从而实现5组不同孔隙率(G30、G40、G50、G60、S30)的多孔结构建模。SLM成型后,通过压缩试验分析样件的力学性能,研究孔隙率变化对多孔结构力学性能的影响并记录其材料属性,为后续仿真处理提供理论数据基础。设计出一段式种植体与简化的下颌骨三维模型,进行三维有限元模拟,探究种植体在植入口腔完成骨愈合后的性能特点,即多孔牙种植体的生物力学特性,以确定适合制备多孔牙种植体的孔隙参数。
1 材料与方法
1.1 TPMS多孔结构的建模方法
三周期极小曲面(Triply Periodic Minimal Surfaces,TPMS)在空间3个独立的方向上是周期性的,曲面上每个点的平均曲率均为0。因此,其具有几何形状多样的优点,可以构建参数化数学模型来进行描述。通过修改TPMS隐函数表达式的参数,可实现对孔径和形状的精确控制[8-9],文中选择的G型曲面结构表达式见式(1)。
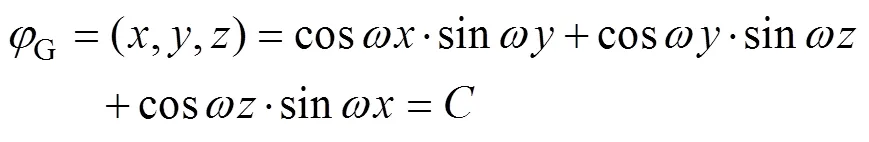
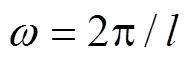
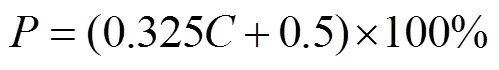
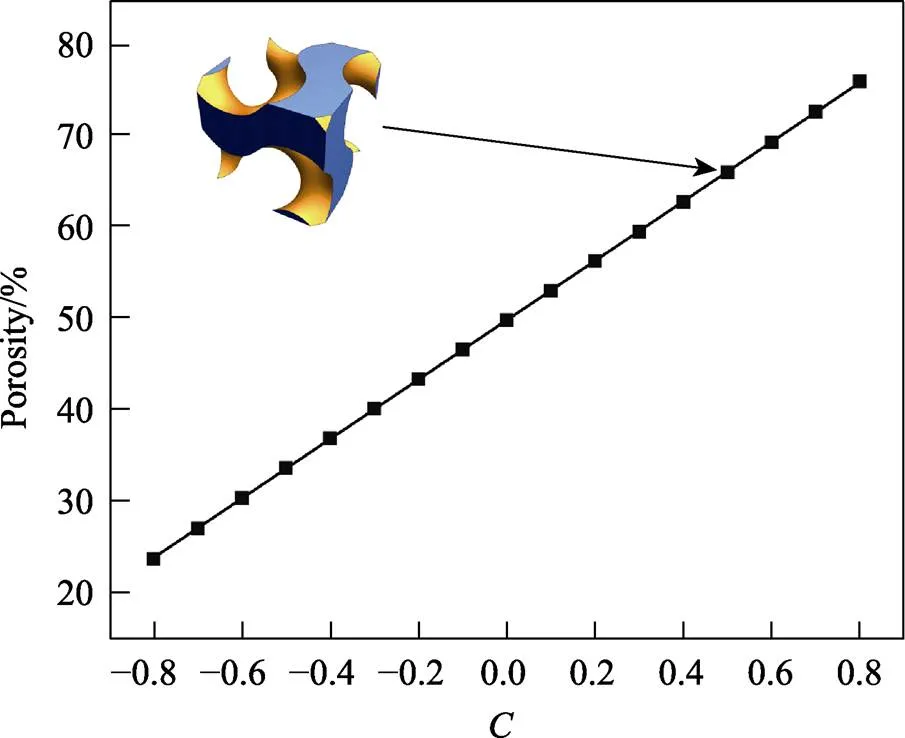
图1 单元偏置量C与孔隙率P的关系
当向种植体添加径向梯度孔隙率时,会产生在中心区域具有高孔隙率而在边缘区域具有较低孔隙率的多孔种植体[10]。偏置量控制着孔隙率的变化,为了产生孔隙率的连续梯度分布,故而偏置量被构建为自变量的函数,在不同的坐标点具有不同的偏移[11]。径向梯度多孔结构偏置量设计方法的工作原理见式(3)—(4)。
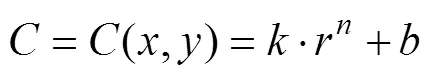
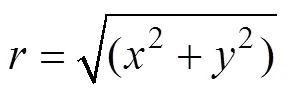
式中:、代表空间结构里的两个方向;3个参数、、可以实现对梯度分布的调控。从函数不难看出,曲面在不同的处具有完全不同的偏置,表明在构建多孔支架时孔隙率是持续过渡的。若径向梯度多孔种植体的半径为,高度为,则内部(=0处)的孔隙率即可定义为in,外部(=处)孔隙率定义为out。in、out对应的偏置量分别为in、out。在给定的前提下,将in、out分别代入式(5)—(6),可以求得、。
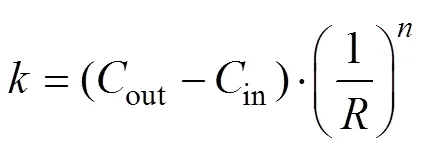
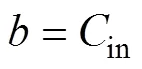
将式(2)、式(5)和式(6)代入式(3)可得式(7)。
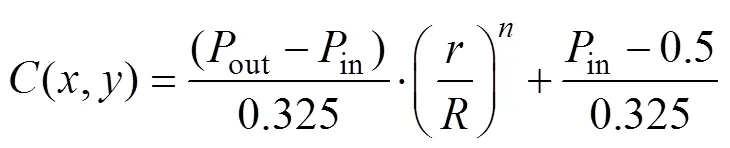
将式(7)代入式(2),即可得出径向梯度多孔种植体的孔隙率分布函数,见式(8)。

根据已知的径向梯度多孔结构设计概念,平均孔隙率可按式(9)计算。
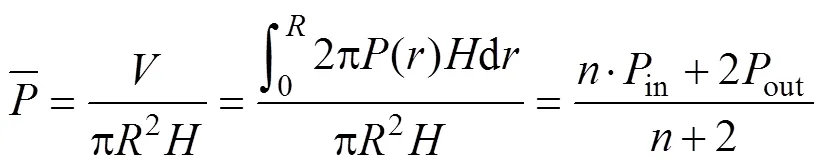
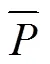
计算出不同结构的偏置函数后,即可利用Mathematica软件内置的RegionPlot3D函数和Export函数对其进行可视化处理,并根据输出参数将曲面封闭,从而可将由数学方程式表示的曲面形成可供3D打印的三维模型STL文件[12]。
1.2 TPMS多孔结构样件设计及SLM成型
为使种植体在植入颌骨后细胞能快速迁移生长,且使种植体在较短时间内就能具有良好的长期稳定性,在设计TPMS结构时应首先确保TPMS结构的孔径在适合颌骨细胞生长的孔径范围内。另外,多孔结构还应具有足够的力学性能,保证其在正常咬合下能保持良好的强度要求,就屈服强度而言,多孔结构的屈服强度需要大于颌骨皮质骨的屈服强度,这样才能保证种植体在植入后,其中的多孔结构在牙齿正常咬合载荷下不发生变形,避免种植体失效。因此,TPMS结构的孔隙率不宜过高,过高的孔隙率会大大降低TPMS结构的力学性能[13]。在国内外对多孔骨植入体孔径的研究中,学者们普遍认为,有利于骨组织长入和血管形成的孔径范围为300~600mm[14],在基于适宜的孔隙要求与孔径需求上,通过工业CT扫描进行孔径统计发现,孔隙率为30%~60%为对应的适宜孔隙范围[15]。
在适宜的孔隙范围基础上,为了进一步探究孔隙率变化对多孔结构力学性能的影响,设计4组平均孔隙率分别为30%、40%、50%、60%的径向梯度多孔结构样件,并设置孔隙率为30%的单一均质多孔结构S30为对照组,如表1所示,其孔隙率梯度分别为10%~55%(G30)、20%~65%(G40)、30%~75%(G50)、40%~85%(G60)。根据《金属机械试验延性测试多孔和多孔金属的压缩试验》(ISO 13314—2011)中圆柱压缩件规范,样件的直径大于等于10倍孔径,样件高度为直径的1~2倍,样件的整体大小只要大于4´4´4个单元即可。单元设置:=3 mm,圆柱半径=7.5 mm,高度=18 mm,5种多孔样件模型如图2所示。
表1 TPMS−G模型结构样件设计参数
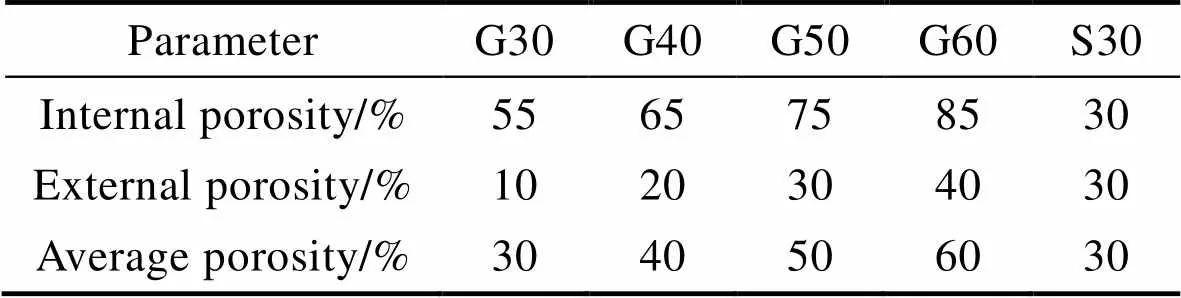
Tab.1 Design parameters of TPMS-G model structure sample
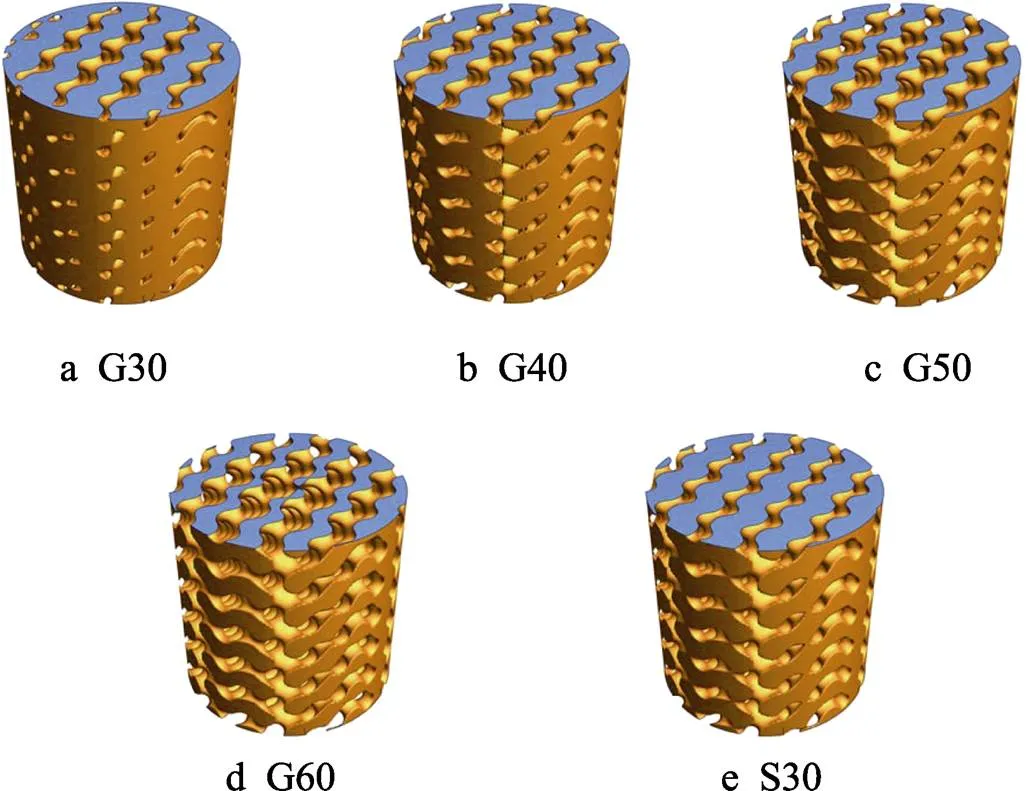
图2 TPMS多孔结构样件模型
SLM样件成型试验使用的金属粉末为Ti6Al4V合金粉,图3为其扫描电子显微镜的形貌图,可以看出,粉末形状接近于球形,粒径范围在20~53mm区间内,其具体化学成分如表2所示,由于粉末周边仅存在较少的卫星粉,故在打印过程中铺粉器的铺粉流畅度会大大提升。
成型设备采用德国SLM公司生产的SLM–125HL打印机,其使用IPG光纤激光的激光器,功率为400 W,可成型多种金属粉末材料(不锈钢304、316粉末、钛合金、镍合金、铝合金等)。成型的工艺参数如下:激光功率275 W,扫描间距0.12 mm,扫描速度1 100 mm/s、铺层粉厚30 um,制造完成后,使用电火花线切割机切下基板上成型的多孔样件[16]。为了减少残余粉末对其机械性能的影响,后续使用超声波清洗机对样件进行清洗,使用DZF–6021真空干燥机进行烘干。

图3 Ti6Al4V粉末形貌
表2 Ti6Al4V粉末化学成分
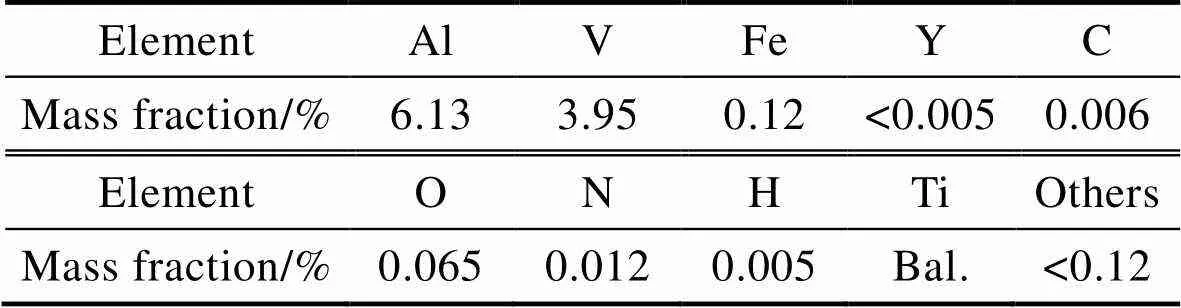
Tab.2 Chemical composition of Ti6Al4V powder
1.3 测试方法
1.3.1 孔隙率测量
成型的多孔结构样件孔隙率(即平均孔隙率)采用称重法进行测量[17],见式(10)。
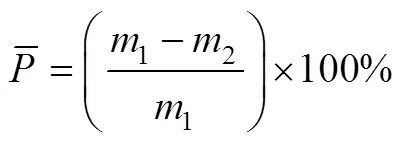
1.3.2 力学性能测试
通过准静态压缩力学性能试验测试多孔样件的强度,试验设备为DNS300电子万能试验机,在样件纵向上施加载荷,试验机压头进给速度为3 mm/min,采样频率为20 Hz。压缩停止后,计算机生成位移–载荷数据文件,数据采样结束。考虑到SLM成型过程对最终成型质量有影响,每个样件重复压缩测试3次。数据采集完成后,分析3组设计样件应力应变数据,最终得出平均弹性模量及平均屈服强度,并选取其中一组的结果进行应力−应变曲线的绘制。
1.4 生物力学仿真
利用SolidWorks软件构建一段式牙种植体三维模型与简单的下颌骨模型,牙种植体主要由上部基台与下部种植体两部分组成,整体结构参考国内ZDI骨组织水平种植体系统手册(浙江广慈仪器有限公司),选用4 mm×10 mm的圆柱体,基台颈部的开口部分参照德国BEGO种植体的形貌;下颌骨模型采用长方体进行简化,主要由皮质骨和松质骨两部分组成,骨块内部区域为松质骨,周围为一圈1 mm厚的皮质骨,在颊、舌、上、下4个不同方向同时包围松质骨[18-19]。
将构建的模型导入ANSA软件,模型网格划分时使用更为细化的四面体单元类型,设定其网格尺寸为0.5 mm,种植体装配模型如图4所示。
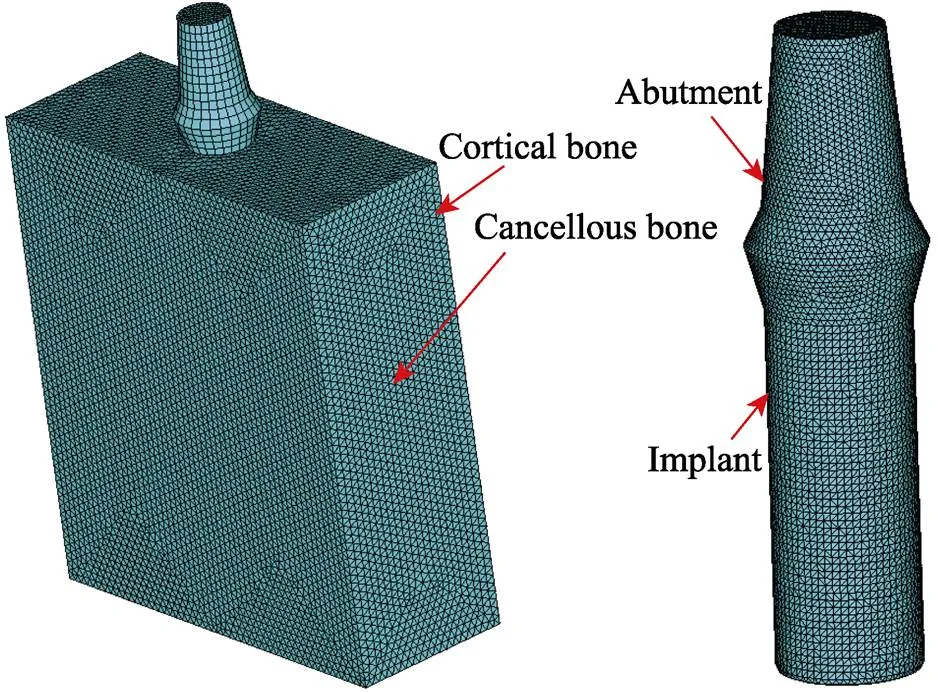
图4 种植体及装配模型
将所有的实心体定义为线性、均质、连续的弹性材料,各种材料的弹性模量和泊松比见表3。研究多孔种植体在植入后是否具有良好的长期稳定性,与周围骨组织之间是否可以传递适当的应力,从而避免“应力屏蔽”现象的产生。与其它学者的设置方法一样[20],为了降低有限元的计算复杂性,种植体网格模型是使用实心结构而非孔隙结构来构造的。在这种情况下,为了确保有限元模拟的有效性,根据先前的压缩测试,将多孔结构的力学性能(弹性模量和屈服强度)赋予有限元中种植牙的植入部分,以模拟多孔结构,这样不仅提高了效率,而且确保了结果的有效性。在种植体基台上方施加大小为118.2 N的集中力以模拟极限咬合力,其方向与种植体长轴呈15°,该力由轴向114.6 N、颊舌向17.1 N和近远向23.4 N共3个力合成[21],同时将边界条件中颌骨下表面及远近中侧的单元格设定为固定不动。接触设置如下:由于研究长期稳定性,考虑已完成了骨结合,故种植体部分与下颌骨模型之间的接触界面设置为绑定接触(Bonded always)。
表3 材料的弹性模量和泊松比
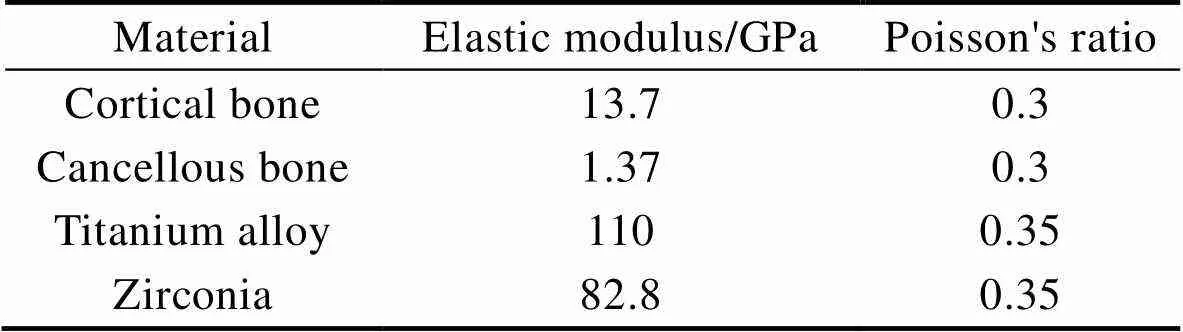
Tab.3 Elastic modulus and Poisson's ratio of materials
使用ANSYS软件(Swanson公司,美国)进行三维模型的应力分析。计算得到种植体与颌骨组织所受的最大等效应力值及种植体与颌骨之间的最大应力差值。
2 结果与分析
2.1 样件成型效果
图5a、b分别为选区激光熔化成型的多孔结构样件图及表面特征图,成型的多孔结构样件表面无明显缺陷,所有样件都是完整且连续的,轮廓规则、清晰,其孔隙特征与设计一致;观察表面形貌发现,样件表面有少量的粉末黏附,多孔结构支杆上有轻微的金属粉末烧结残渣。综上可知,TPMS–G型结构的样件与设计模型相差不大,整体成型效果较好。

图5 SLM成型的多孔样件
2.2 样件力学性能分析
试验得到的多孔样件平均孔隙率和标准差,以及平均弹性模量和平均屈服强度如表4所示,统一取3组数据中的第1组进行TPMS多孔结构样件的压缩应力–应变曲线图绘制,如图6所示,以0.2%塑性应变下的应力作为屈服准则,得到多孔结构的弹性模量和屈服强度,并取相同3组样件数据的均值,最终得出不同孔隙率TPMS–G结构的平均弹性模量及其平均屈服强度。从表4中可以看出,与设计值相比,所有多孔样件的实际孔隙率值均偏小。其原因是SLM打印多孔样件时,会有大量的钻粉留存在样件表面,从而导致测得的实际多孔样件质量偏大,影响实际样件孔隙率的计算[22-23]。通过表4中屈服强度与弹性模量的数据发现,多孔结构可以明显降低弹性模量,相较于实体钛合金结构(110 GPa),多孔结构的弹性模量(13.47~15.88 GPa)已完全符合人体自然骨组织(2~ 20 GPa)范围,同时,多孔结构的屈服强度(484.81~ 834.47 MPa)也远高于皮质骨(180.5~211.7 MPa)[24],说明多孔结构满足种植体的设计强度要求。观察发现,梯度多孔结构样件不仅弹性模量相较于均质多孔结构略有提升,其屈服强度(834.47 MPa)相比均质多孔结构样件(730.56 MPa)也提高了约14%。与其他学者研究结果的规律[25]相似,相对于同质量的均质多孔结构,梯度多孔结构具有更优异的力学性能。而对于不同平均孔隙率的梯度多孔样件,其弹性模量与屈服强度随着孔隙率的增大而逐渐降低,多孔结构的孔隙率越大,其力学性能也越差。文献[12]中研究的梯度多孔结构力学性能随着孔隙率的增大也呈现下降趋势。
表4 TPMS−G多孔结构孔隙率及力学性能
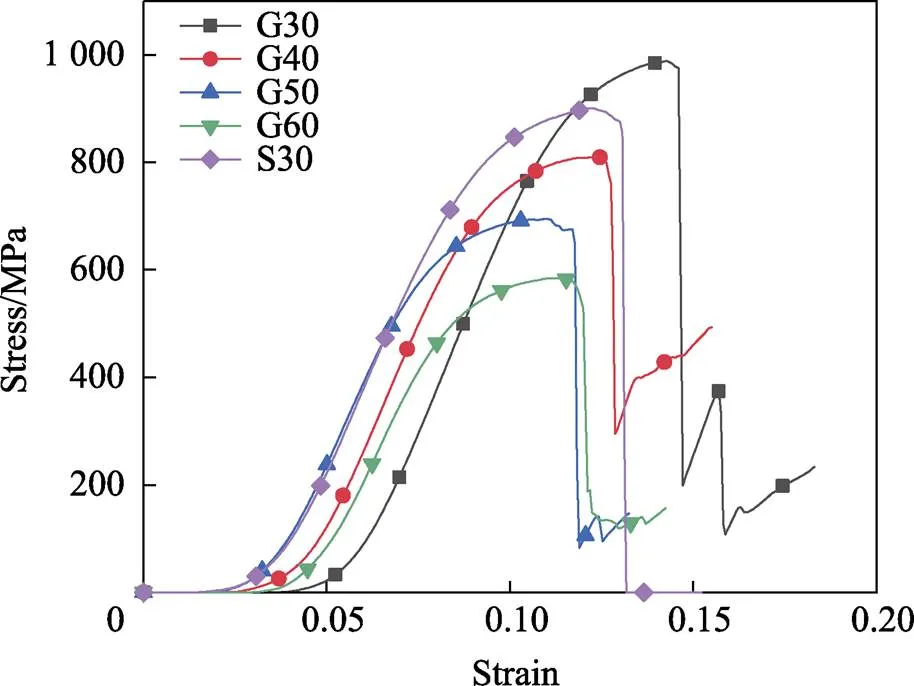
图6 TPMS多孔结构压缩应力–应变曲线
2.3 TPMS多孔结构力学性能与孔隙率关系分析
Gibson−Ashby模型反映了多孔结构的力学性能(即弹性模量、强度)与其孔隙率之间符合幂函数关系这一特征,为本研究设计的TPMS多孔结构力学性能的评估提供了理论支撑,见式(11)—(12)。
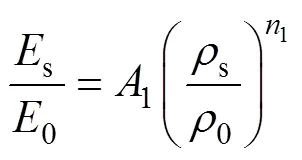
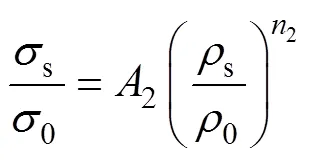
式中:s为Ti6Al4V多孔结构的弹性模量;0为其固体的弹性模量,其值为110 GPa;s为Ti6Al4V多孔结构的屈服强度;0为其固体的屈服强度,大小为869 MPa;s为Ti6Al4V多孔结构的密度;0为其固体的密度,其值为4.43 g/cm3;和为几何比例常数。
TPMS多孔结构的相对密度与力学性能关系如图7所示。由图7可知,多孔结构的相对密度与相对弹性模量和相对屈服强度之间皆符合指数关系,且2分别达到了0.998、0.971,拟合程度较好,Ma等[26]对TPMS均质多孔结构进行了拟合,其拟合程度也较好,故该拟合结果可以为多孔牙种植体结构的应用提供参考价值。
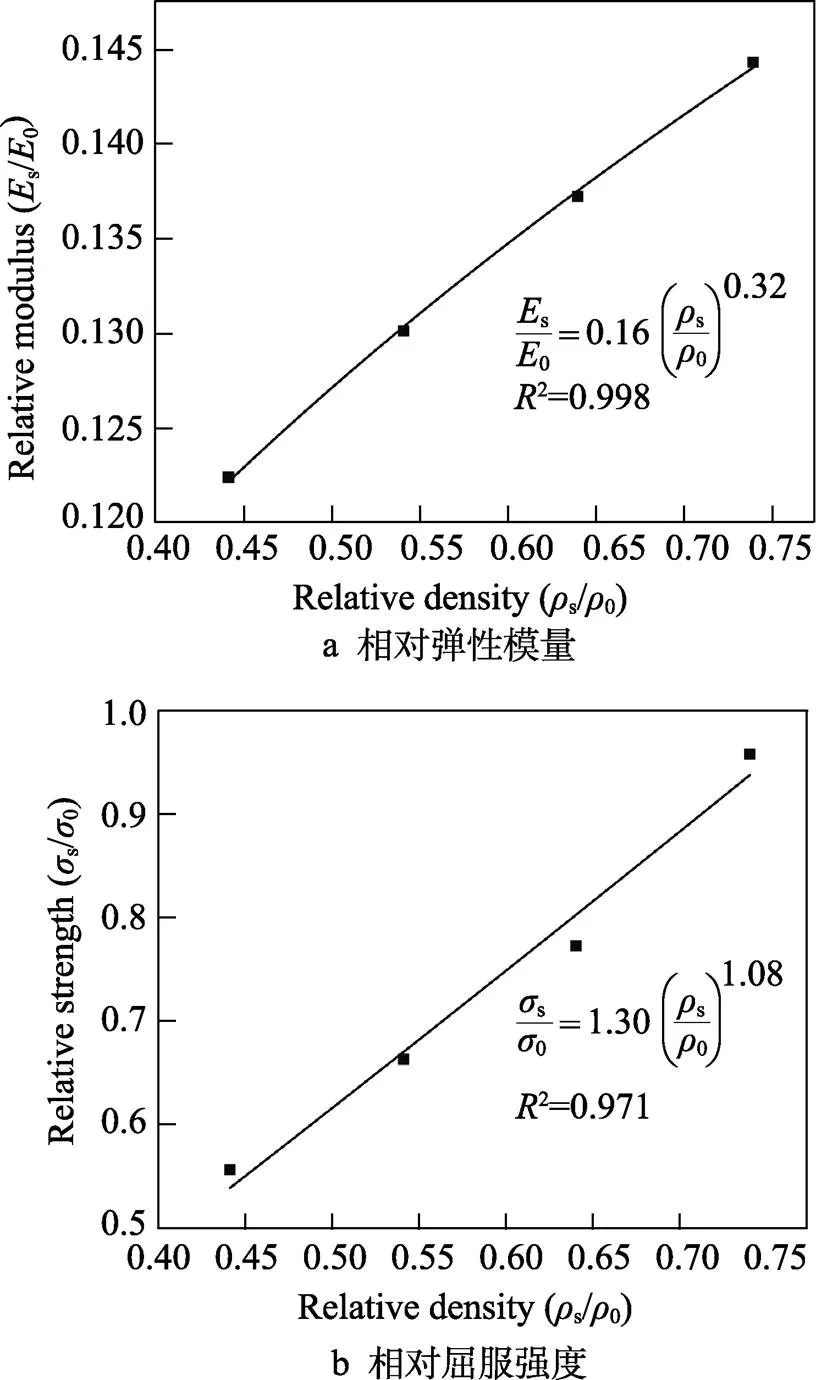
图7 相对密度与力学性能关系
2.4 有限元结果分析
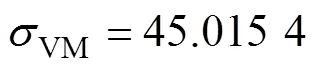
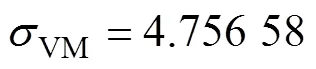
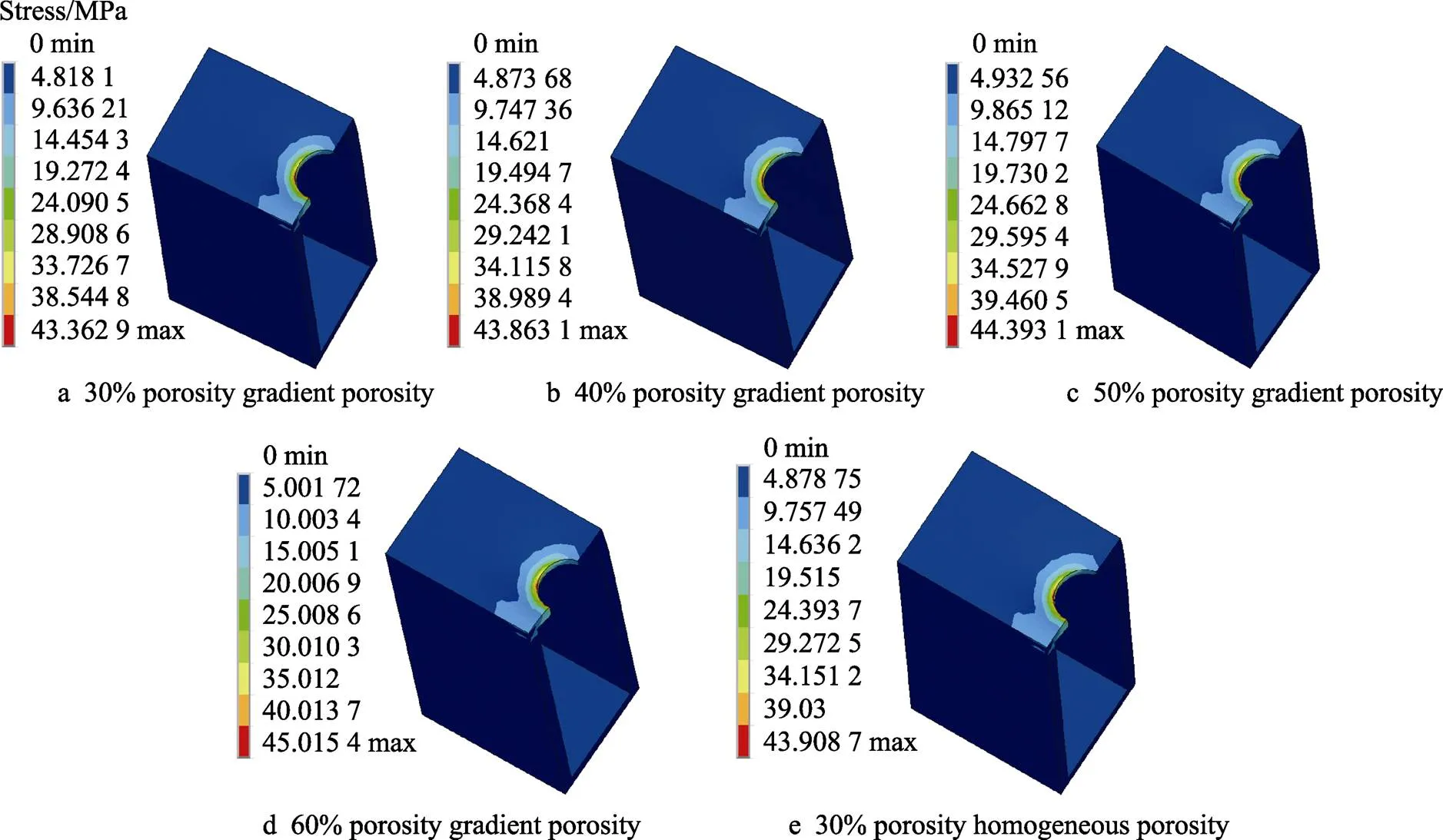
图8 不同孔隙率梯度多孔及均质多孔种植体皮质骨等效应力云图
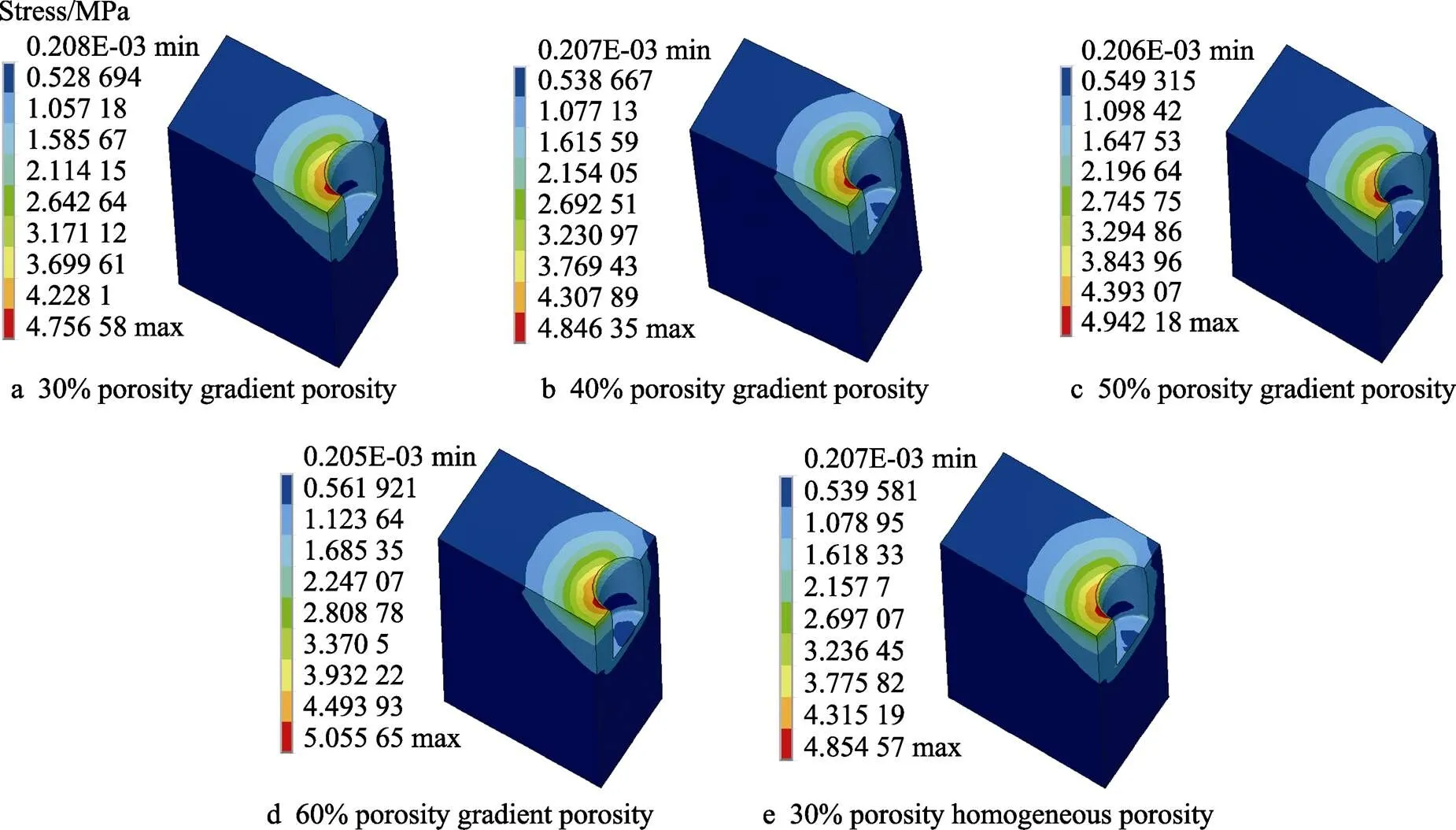
图9 不同孔隙率梯度多孔及均质多孔种植体松质骨等效应力云图
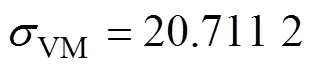
分析有限元结果可知,种植体周围骨组织的应力分布主要为颈部皮质骨应力值最大,颈部松质骨次之,根尖松质骨应力值最小。此外,颈部皮质骨的峰值应力随着TPMS结构孔隙率的增大而增大,这项研究结果与Yazicioglu等[27]、Anssari Moin等[28]和宋凯乐[29]的研究结果一致。
根据Konovalenko等[30]的研究可知,随着孔隙中填料比例的增大,多孔结构样件的弹性模量和强度也随之增大。故随着多孔种植体的孔隙中长入越来越多的骨组织,种植体的弹性模量和强度也会有所提高,根据先前的仿真分析得到的规律,种植体弹性模量和强度提升后,周围骨组织应力刺激减小,更不易造成周围骨组织破坏。
与文献[15]中学者研究标准一样,对于口腔医学植入件,其最大等效应力应低于结构屈服强度的50%,这样才能保证植入件在植入后不发生断裂。根据试验结果可知,多孔结构的屈服强度在484.81~ 834.47 MPa之间,而种植体的最大等效应力为19.693~20.711 2 MPa,远低于结构屈服强度的50%,表明其具有较好的力学性能。
根据骨力学学说[31],当骨组织承受的应力值低于2 MPa时,骨组织会产生废用性骨吸收;当应力值介于2~60 MPa之间时,骨组织保持正常骨质状态,并处于骨塑建活跃状态,可以促进骨组织生长;可当应力值超过60 MPa时,骨组织即会处于病理性过度载荷状态,在长期作用下会导致病理性骨折和非创伤性骨折;人们普遍认为,极限骨骼承载能力为120 MPa,又称之为骨组织的断裂强度。根据仿真分析结果图可知,不同孔隙率的多孔种植体周围皮质骨的最大等效应力值分布在43.362 9~45.015 4 MPa之间,而松质骨的最大等效应力值分布在4.756 58~5.055 6 MPa之间,是完全满足2~60 MPa范围内最大应力的,表明其应力适合,可以促使骨组织生长。
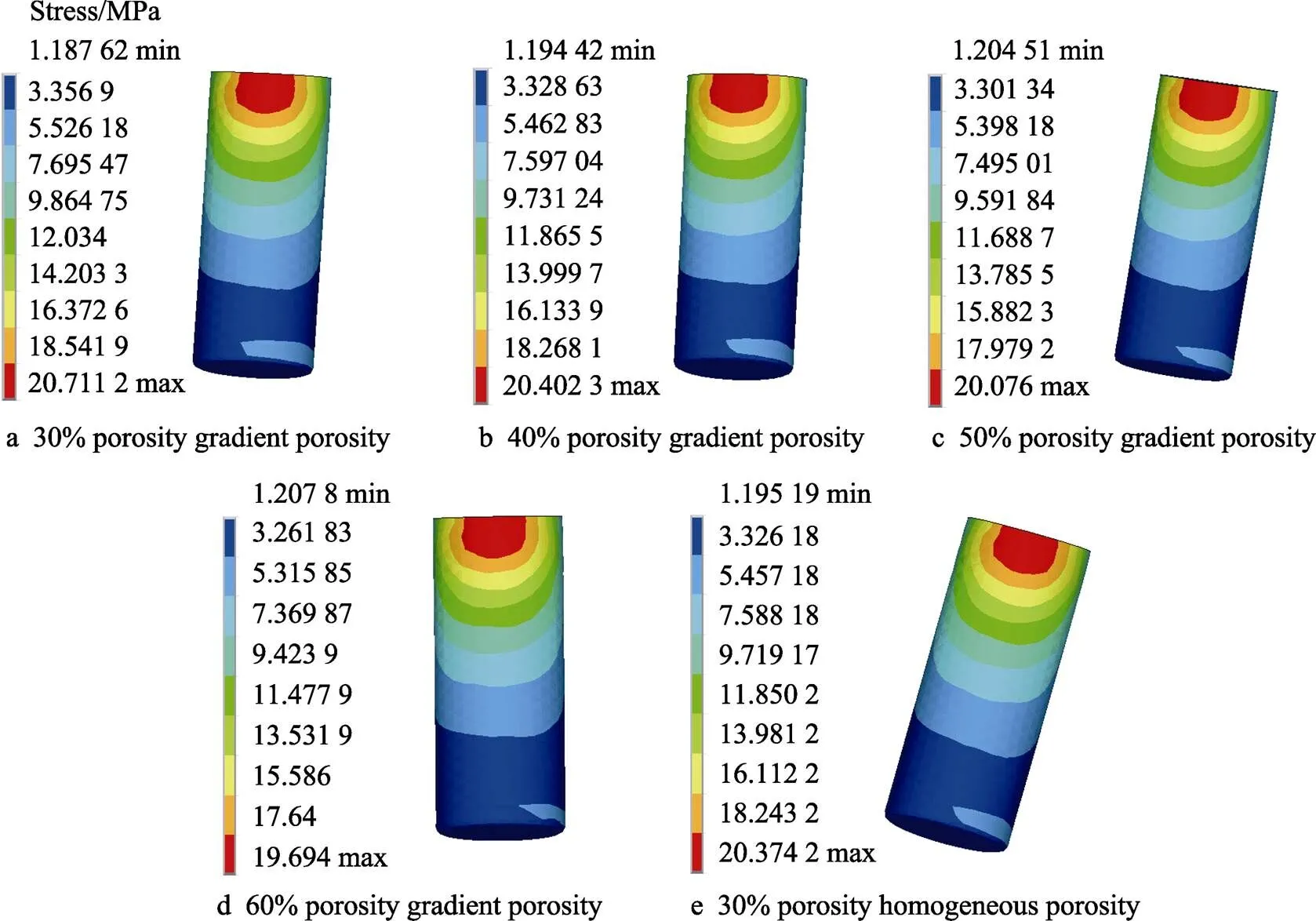
图10 不同孔隙率梯度多孔及均质多孔种植体等效应力分布
牙种植体与下颌骨之间的应力差值越小,说明下颌骨和牙种植体之间受力越均匀,有利于刺激骨组织生长,提高骨结合率,反之,两者差值越大,则会使下颌骨长期属于不受力或受到较微弱力的状态,极易产生骨吸收,最终导致种植失效[32]。可以看出,相较于均质多孔种植体,梯度多孔种植体最大等效应力值更大,与其配合的颌骨最大等效应力值更小,故梯度多孔种植体与下颌骨之间的应力差值更小;且随着孔隙率的增大,多孔种植体与下颌骨之间的应力差值逐渐变大。综上所述,孔隙率为30%的TPMS–G型梯度多孔牙种植体与下颌骨应力差值最小,有利于形成稳定的骨整合。
3 结论
为缓解植入传统金属牙种植体后引起的应力遮挡并促进长期稳定的骨结合,选取了TPMS−G型多孔结构来进行牙种植体多孔部分的设计,探究孔隙率变化带来的影响,通过力学性能测试试验和有限元仿真得出了以下主要结论。
1)制备出的TPMS–G型多孔结构样件成型效果良好。通过压缩试验发现,在满足颌骨细胞黏附、增殖与分化的孔径孔隙率需求范围内,5组不同孔隙率的TPMS−G型多孔结构的力学性能均能够满足种植体的使用要求。相较于实体结构,多孔结构可以降低种植体弹性模量,且梯度多孔结构的弹性模量与屈服强度均强于均质多孔结构,随着梯度多孔结构孔隙率的增大,其力学性能逐渐降低。
2)不同孔隙率的TPMS−G型结构弹性模量和屈服强度被赋予有限元分析模拟的材料配置参数。仿真分析结果表明,在极限咬合载荷下,多孔结构牙种植体周围颌骨组织的最大等效应力值满足骨应力学说,处于骨组织生长的适宜范围,能有效缓解应力遮挡效应。并且相较于均质多孔结构,梯度多孔结构由于其力学性能更优,与相应下颌骨配合状态也明显更好。平均孔隙率为30%的梯度多孔种植体,其周围骨组织最大应力完全满足骨组织正常生长范围,同时与颌骨之间的应力差值也最低,更有利于植入并促进长期稳定的骨结合,提高种植牙植入后的长期稳定性和使用寿命。
然而,有限元分析结果有很大的局限性,无法完全模拟出最实际的日常口腔咀嚼情况,因此需要广泛的临床应用试验。本研究只单独考虑到模拟分析下颌骨的情况,对于另外的多种骨结构,具有梯度多孔结构的种植体是否有利于创建良好的骨整合状态从而到达长期稳定的种植仍需要大量的综合模拟分析。
[1] CHAUNCEY H H, MUENCH M E, KAPUR K K, et al. The Effect of the Loss of Teeth on Diet and Nutrition[J]. Microbiology Resource Announcements, 1984, 34(2): 98-104.
[2] 张伟. 基于SLM多孔牙种植体结构设计研究[D]. 杭州: 浙江工业大学, 2018: 4-5.
ZHANG Wei. Study on the Structure Design of Porous Dental Implants Based on SLM Technology[D]. Hangzhou: Zhejiang University of Technology, 2018: 4-5.
[3] LI Xiang,WANG Cheng-tao, WANG Lin, et al. Fabrication of Bioactive Titanium with Controlled Porous Structure and Cell Culture in Vitro[J]. Rare Metal Materials and Engineering, 2010, 39(10): 1697-1701.
[4] 姜海燕, 林卫凯, 吴世彪, 等. 激光选区熔化技术的应用现状及发展趋势[J]. 机械工程与自动化, 2019(5): 223-226.
JIANG Hai-yan, LIN Wei-kai, WU Shi-biao, et al. Application Status and Development Trend of Laser Selective Melting Technology[J]. Mechanical Engineering & Automation, 2019(5): 223-226.
[5] MASTROGIACOMO M, SCAGLIONE S, MARTINETTI R, et al. Role of Scaffold Internal Structure on in Vivo Bone Formation in Macroporous Calcium Phosphate Bioceramics[J]. Biomaterials, 2006, 27(17): 3230-3237.
[6] 王冠军. 基于激光选区熔化技术可控多孔结构设计及力学性能研究[D]. 南京: 南京航空航天大学, 2018: 3-6.
WANG Guan-jun. Research on the Design and Mechanical Properties of Controllable Porous Structures Based on Selective Laser Melting[D]. Nanjing: Nanjing University of Aeronautics and Astronautics, 2018: 3-6.
[7] RAJAGOPALAN S, ROBB R A. Schwarz Meets Schwann: Design and Fabrication of Biomorphic and Durataxic Tissue Engineering Scaffolds[J]. Medical Image Analysis, 2006, 10(5): 693-712.
[8] ATAEE A, LI Y, FRASER D, et al. Anisotropic Ti-6Al-4V Gyroid Scaffolds Manufactured by Electron Beam Melting (EBM) for Bone Implant Applications[J]. Materials & Design, 2018, 137: 345-354.
[9] YÁNEZ A, CUADRADO A, MARTEL O, et al. Gyroid Porous Titanium Structures: A Versatile Solution to be Used as Scaffolds in Bone Defect Reconstruction[J]. Materials & Design, 2018, 140: 21-29.
[10] AFSHAR M, ANARAKI A P, MONTAZERIAN H. Compressive Characteristics of Radially Graded Porosity Scaffolds Architectured with Minimal Surfaces[J]. Materials Science and Engineering: C, 2018, 92: 254-267.
[11] MELCHELS F P W, TONNARELLI B, OLIVARES A, et al. The Influence of the Scaffold Design on the Distribution of Adhering Cells after Perfusion Cell Seeding[J]. Biomaterials, 2011, 32(11): 2878-2884.
[12] 高芮宁, 李祥. 径向梯度多孔支架设计与力学性能分析[J]. 机械工程学报, 2021, 57(3): 220-226.
GAO Rui-ning, LI Xiang. Design and Mechanical Properties Analysis of Radially Graded Porous Scaffolds[J]. Journal of Mechanical Engineering, 2021, 57(3): 220-226.
[13] ZADPOOR A A, HEDAYATI R. Analytical Relationships for Prediction of the Mechanical Properties of Additively Manufactured Porous Biomaterials[J]. Journal of Biomedical Materials Research Part A, 2016, 104(12): 3164-3174.
[14] LU Xin, ZHANG Da-wei, XU Wei, et al. The Effect of Cu Content on Corrosion, Wear and Tribocorrosion Resistance of Ti-Mo-Cu Alloy for Load-Bearing Bone Implants[J]. Corrosion Science, 2020, 177: 109007.
[15] 徐伟. 基于SLM梯度多孔钛口腔种植体结构设计及应用基础研究[D]. 北京: 北京科技大学, 2021: 29-30.
XU Wei. Structure Design and Application of Gradient Porous Ti-Dental Implant Based on SLM[D]. Beijing: University of Science and Technology Beijing, 2021: 29-30.
[16] 曾寿金, 刘广, 李传生, 等. 基于SLM的股骨柄多孔结构设计与力学性能分析[J]. 中国激光, 2022, 49(2): 174-187.
ZENG Shou-jin, LIU Guang, LI Chuan-sheng, et al. Porous Structure Design and Mechanical Properties Analysis of Femoral Stem Based on Selective Laser Melting[J]. Chinese Journal of Lasers, 2022, 49(2): 174-187.
[17] 高芮宁, 熊胤泽, 张航, 等. SLM制备径向梯度多孔钛/钽的力学性能及生物相容性[J]. 稀有金属材料与工程, 2021, 50(1): 249-254.
GAO Rui-ning, XIONG Yin-ze, ZHANG Hang, et al. Mechanical Properties and Biocompatibilities of Radially Graded Porous Titanium/Tantalum Fabricated by Selective Laser Melting[J]. Rare Metal Materials and Engineering, 2021, 50(1): 249-254.
[18] 刘婷. 多孔结构对个性化根形种植体生物力学特性的影响[D]. 重庆: 重庆医科大学, 2019: 10-12.
LIU Ting. Effect of Porous Microstructure on the Biomechanical Characteristics of Root Analogue Implant[D]. Chongqing: Chongqing Medical University, 2019: 10-12.
[19] 郭芳, 黄硕, 胡敏, 等. 3D打印表面多孔钛根形种植体的生物力学研究[J]. 医用生物力学, 2021, 36(1): 85-91.
GUO Fang, HUANG Shuo, HU Min, et al. Biomechanical Study of Three-Dimensional Printed Titanium Root-Analogue Implant with Porous Surface[J]. Journal of Medical Biomechanics, 2021, 36(1): 85-91.
[20] LIMMAHAKHUN S, OLOYEDE A, CHANTARAPANICH N, et al. Alternative Designs of Load–Sharing Cobalt Chromium Graded Femoral Stems[J]. Materials Today Communications, 2017, 12: 1-10.
[21] 游嘉, 方利华, 张青, 等. 基于SLM技术的表面多孔钛金属多根牙种植体的骨结合研究[J]. 中国生物医学工程学报, 2015, 34(3): 315-322.
YOU Jia, FANG Li-hua, ZHANG Qing, et al. Osseointegration of Multi-Roots Ti6Al4V Implant with Porous Surface Based on SLM Technology[J]. Chinese Journal of Biomedical Engineering, 2015, 34(3): 315-322.
[22] YANG Lei, HAN Chang-jun, WU Hong-zhi, et al. Insights into Unit Cell Size Effect on Mechanical Responses and Energy Absorption Capability of Titanium Graded Porous Structures Manufactured by Laser Powder Bed Fusion[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 109: 103843.
[23] HAN Chang-jun, LI Yan, WANG Qian, et al. Continuous Functionally Graded Porous Titanium Scaffolds Manufactured by Selective Laser Melting for Bone Implants[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2018, 80: 119-127.
[24] GÓMEZ S, VLAD M D, LÓPEZ J, et al. Design and Properties of 3D Scaffolds for Bone Tissue Engineering[J]. Acta Biomaterialia, 2016, 42: 341-350.
[25] 李祥, 高芮宁, 熊胤泽, 等. 基于TPMS结构的多孔钛制备与表征[J]. 稀有金属材料与工程, 2020, 49(1): 325-330.
LI Xiang, GAO Rui-ning, XIONG Yin-ze, et al. Fabrication and Characterization of Porous Titanium Based on TPMS Structure[J]. Rare Metal Materials and Engineering, 2020, 49(1): 325-330.
[26] MA Zhi-bo, ZHANG D Z, LIU Fei, et al. Lattice Structures of Cu-Cr-Zr Copper Alloy by Selective Laser Melting: Microstructures, Mechanical Properties and Energy Absorption[J]. Materials & Design, 2020, 187: 108406.
[27] YAZICIOGLU D, BAYRAM B, OGUZ Y, et al. Stress Distribution on Short Implants at Maxillary Posterior Alveolar Bone Model with Different Bone-to-Implant Contact Ratio: Finite Element Analysis[J]. The Journal of Oral Implantology, 2016, 42(1): 26-33.
[28] ANSSARI MOIN D, HASSAN B, WISMEIJER D. A Patient Specific Biomechanical Analysis of Custom Root Analogue Implant Designs on Alveolar Bone Stress: A Finite Element Study[J]. International Journal of Dentistry, 2016, 2016: 8242535.
[29] 宋凯乐. 面向即刻种植的根形种植体功能性重建研究[D]. 济南: 山东大学, 2021: 41-45.
SONG Kai-le. Functional Reconstruction of Root Analogue Implants for Immediate Implantation[D]. Jinan: Shandong University, 2021: 41-45.
[30] KONOVALENKO I S, TOKTOHOEV C O, KONOVALENKO I S, et al. Study of the Mechanical Properties of Ceramic Composites with Different Volume of Plastic Filler[J]. Procedia Materials Science, 2014, 3: 942-947.
[31] LIU Fang, CHENG Wen-ming, SHAO Jian-bing. Structure Optimization and Finite Element Analysis of the Human Body Exoskeletons Lower Limb Power[M]// Social Robotics. Berlin, Heidelberg: Springer Berlin Heidelberg, 2012: 631-640.
[32] 王亚玲. 基于激光选区熔化技术多孔结构植入体性能的研究[D]. 重庆: 重庆大学, 2017: 55-57.
WANG Ya-ling. Study on Properties of Porous Implants Based on Selective Laser Melting Technique[D]. Chongqing: Chongqing University, 2017: 55-57.
Mechanical Properties of Gradient Porous Dental Implants Based on SLM
ZENG Shou-jin, WANG Jing, HE Wei-hui, XU Ming-san, WEI Tie-ping
(a. Fujian Key Laboratory of Intelligent Machining Technology and Equipment, b. School of Mechanical & Automotive Engineering, Fujian University of Technology, Fuzhou 350118, China)
The work aims to determine the optimal porosity of gradient porous dental implants that meet the strength requirements and have good long-term stability. Four groups of gradient porous structure samples with different porosity (G30, G40, G50, G60) and homogeneous porous sample S30 were designed. After selective laser melting (SLM) molding, their mechanical properties were studied through quasi-static compression experiments, and the elastic modulus and yield strength of the samples were measured. The stress distribution of different porosity implants and corresponding mandibular tissues was evaluated by finite element analysis. Compared with the solid titanium alloy structure (110 GPa), the elastic modulus of porous structure (13.47-15.88 GPa) fully met the range of human natural bone tissue (2-20 GPa), and the yield strength of porous structure (484.81-834.47 MPa) was much higher than that of cortical bone (180.5-211.7 MPa); the elastic modulus of the gradient porous structure sample was slightly higher than that of the homogeneous porous structure, and the yield strength (834.47 MPa) was about 14% higher than that of the homogeneous porous structure sample (730.56 MPa). The maximum equivalent stress of cortical bone around gradient porous implant was 43.362 9-45.015 4 MPa, and the maximum equivalent stress of cancellous bone was 4.756 58-5.055 6 MPa, which fully met the maximum stress in the range of 2-60 MPa and was suitable for bone tissue growth. The stress difference between the implant and the mandible gradually increased with the increase of porosity. The TPMS-G gradient porous dental implant with 30% porosity had the smallest stress difference with the mandible, and had the best biomechanical properties, which was conducive to the formation of stable bone integration. Through experiments and simulation, the optimal gradient porous structure suitable for the implant is determined, which not only meets the strength requirements but also has good long-term stability.
laser selective melting; dental implants; porous structure design; mechanical properties; finite element analysis
10.3969/j.issn.1674-6457.2023.1.008
TN 249;TB31
A
1674-6457(2023)1-0061-10
2022–08–14
2022-08-14
国家自然科学基金(51575110);福建省自然科学基金(2021J011053);福建省区域发展项目(2020H4003);福建省科技型中小企业技术创新资金项目(2022C0027)
National Natural Science Foundation of China (51575110); Fujian Natural Science Foundation (2021J011053); Regional Development Project of Fujian Province (2020H4003); Technological Innovation Fund Project of Fujian Province (2022C0027)
曾寿金(1978—),男,博士,教授,主要研究方向为激光增材制造技术。
ZENG Shou-jin (1978-), Male, Doctor, Professor, Research focus: laser additive manufacturing technology.
曾寿金, 王靖, 何伟辉, 等. 基于SLM的梯度多孔牙种植体力学特性[J]. 精密成形工程, 2023, 15(1): 61-70.
ZENG Shou-jin, WANG Jing, HE Wei-hui, et al. Mechanical Properties of Gradient Porous Dental Implants Based on SLM[J]. Journal of Netshape Forming Engineering, 2023, 15(1): 61-70.
