黄精芡实汤高效液相色谱指纹图谱结合化学模式识别评价及3个主成分含量测定研究
2023-02-03蔡嘉洛李晓屏朱贻霖夏新华易刚强邓桂明童巧珍朱镇华
蔡嘉洛,李晓屏,朱贻霖,夏新华,易刚强,邓桂明,童巧珍,朱镇华
(1.湖南中医药大学第一附属医院,湖南长沙410000;2.湖南中医药大学,湖南长沙 410208)
黄精芡实汤始载于《中医内科临床治疗学》[1],由冷柏枝所录,由黄精、芡实、太子参、山药、大枣、白芍、佩兰等7味中药组成。方中:黄精补脾阴、填精髓,芡实补脾阴而缩泉,太子参补脾气、生津液,三味为本方主药;山药、白芍、大枣皆为补脾之品,养阴兼益气;佩兰醒脾,令全方补而不滞。本方为补脾阴之平稳剂,是治疗脾阴不足中消证的代表方,其主要功效为平补脾气、益阴填精。在现代临床中,主要治疗气阴不足引起的中消之证,如糖尿病前期、2型糖尿病等疾病。本课题组前期研究表明,黄精芡实汤君药黄精中的黄精多糖能够改善3T3-L1脂肪细胞的胰岛素抵抗[2];采用黄精芡实汤治疗糖尿病前期人群,可有效改善患者空腹高血糖状态,临床效果显著[3]。黄精芡实汤因良好的疗效在临床中广泛使用,但其质量控制方法目前仍然处于空白。化学模式识别法是化学计量学的重要内容,可使具有“完整性”和“模糊性”特点的指纹图谱的海量化学信号相互融合,以综合分析和评价中药质量[4-6]。因此,本研究对15个不同批次的黄精芡实汤进行分析,构建高效液相色谱(HPLC)指纹图谱及含量测定方法,并根据化学模式识别技术对其指纹图谱数据加以解析,以期为其质量控制及药效研究提供参考,现将研究结果报道如下。
1 材料
1.1 仪器Vanquish Core高效液相色谱仪(包括在线脱气机、四元梯度洗脱泵、自动进样器、柱温箱、2695溶剂管理系统),2998型二极管阵列检测器,Empower色谱工作站(美国赛默飞公司)。
1.2 试剂芍药苷(paeoniflorin)对照品、芍药内酯苷(albiflorin)对照品、没食子酸(gallic acid)对照品(纯度≥99.0%,西安金萃坊植物技术开发有限公司生产),均由湖南中药大学中药鉴定实验室提供。甲醇(色谱纯,佛山市鑫洋化工科技有限公司生产,批号:20200112);甲酸(色谱纯,天津市科密欧化学试剂有限公司生产,批号:20201011)。
1.3 药材黄精芡实汤中黄精、芡实、太子参、山药、白芍、大枣、佩兰单味药饮片各15批,经湖南中医药大学第一附属医院张志国教授鉴定,黄精为百合科植物多花黄精Polygonatum cyrtonemaHua的干燥根茎,芡实为睡莲科植物芡Euryale feroxSalisb.的干燥成熟种仁,太子参为石竹科植物孩儿参Pseudostellaria heterophylla(Miq.)PaxexPaxetHoffm.的干燥块根,山药为薯蓣科植物薯蓣Dioscorea oppositaThunb.的干燥根茎,白芍为毛茛科植物芍药Paeonia lactifloraPall.的干燥根,大枣为鼠李科枣属植物枣Ziziphus jujubaMill.var.inermis(Bunge)Rehd.的干燥成熟果实,佩兰为菊科植物佩兰Eupatorium fortuneiTurcz.的干燥地上部分。将各饮片随机组合得15批黄精芡实汤样品(编号S1~S15),各单味药饮片来源及组合见表1。
2 方法与结果
2.1 色谱条件色谱柱:Thermo Hypersil GOLD C18柱(2.1 mm×100 mm,1.9 μm);流动相:甲醇-0.1%甲酸水,梯度见表2;体积流量:0.3 mL/min;柱温:30℃;波长:280 nm;进样量:10 μL。

表2 HPLC梯度洗脱条件Table 2 HPLC gradient elution conditions
2.2 黄精芡实汤HPLC指纹图谱研究
2.2.1 供试品溶液的制备取黄精15 g,芡实30 g,太子参30 g,山药15 g,白芍15 g,大枣7枚,佩兰6 g。加水1 000 mL,武火加热至沸腾后文火煎煮30 min,400目纱布趁热过滤,得药液300 mL,冷冻干燥72 h,得冻干粉。按表1制备15批黄精芡实汤冻干粉(S1~S15),即得黄精芡实汤样品[7-8]。精密称取上述黄精芡实汤样品1.0 g,放入具塞的杯内,精密注入沸水50 mL,重新称定质量,以超声萃取30 min,再置于室温条件后重新称定质量。在4℃条件避光储存。使用时0.22 μm针式过滤器清洗,取续用筛液,即得。

表1 15批黄精芡实汤中各单味药饮片来源Table 1 Sources of medicine materical crude slices of each single herbal in 15 batches of Huangjing Qianshi Decoction
2.2.2 缺味阴性对照溶液的制备按《中医内科临床治疗学》的黄精芡实汤比例,以3 g为处方总量,分别配制不含黄精、芡实、山药、白芍、大枣、太子参或佩兰的缺味阴性样品处方。按“2.2.1”项方法处理,得缺味阴性对照溶液。
2.2.3 对照品溶液的制备精密称取芍药苷、芍药内酯苷、没食子酸对照品适量,精密称定,放置于10 mL量瓶中,加甲醇溶解并定容至刻度,制成质量浓度分别为0.5、0.311、0.697 mg·mL-1的混合对照品溶液,即得。
2.2.4 精密度试验黄精芡实汤(S1)试样,按“2.2.1”项下方法配制供试品溶液,按“2.1”项下的色谱方法要求连续进样6次,并记录色谱图。以芍药苷色谱峰(其色谱峰较稳定、分离度较好且保持时限、峰面积适中)为参考峰(S),计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的相对标准偏差(RSD)均小于2.11%,相对峰面积的RSD均小于2.79%,表明所用仪器精密度良好。
2.2.5 重复性试验取黄精芡实汤(S1)样试样,按“2.2.1”项下方法共制成6份供试品溶液。按“2.1”项色谱条件,以芍药苷色谱峰为基准峰(S),计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD均小于2.00%,相对峰面积的RSD均小于3.00%,表明本方法重复性良好。
2.2.6 稳定性试验取黄精芡实汤(S1)的试样少许,按“2.2.1”项下方法配制供试品溶液,室温下依次置于0、3、6、9、12、24、48 h。再按“2.1”项色谱条件,以芍药苷色谱峰为基准峰(S),计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD均小于2.00%,相对峰面积的RSD均小于3.00%,表明供试品溶液于室温下放置48 h内稳定性良好。
2.2.7 指纹图谱的建立及相似度评价取S1~S15批次黄精芡实汤药粉,按“2.2.1”项下方法配制供试品溶液,按“2.1”项色谱条件进样,记录色谱图。将所得的15批黄精芡实汤色谱图像数据,分别输入“中医色谱指纹图谱相似度评价体系(2012版)”,以S1图谱为参考指纹图谱,采取平均数法(时间窗长度=0.10)得到对照指纹图谱,再通过多点校对后实现自动配对,结果见图1。结果表明,各共有峰相对保留时间的平均RSD值均低于1.0%。以15批黄精芡实汤样本HPLC色谱图和对照指纹图谱进行一致性研究,结果显示S1~S15号样本与对照指纹图谱的相似度均高于0.85,见表3,表明不同批次黄精芡实汤样品化学成分组成基本相同,差异较小。

表3 15批黄精芡实汤相似度Table 3 Similarity of 15 batches of Huangjing Qianshi Decoction

图1 15批黄精芡实汤样品HPLC指纹图谱Figure 1 HPLC fingerprints of 15 batches of Huangjing Qianshi Decoction samples
2.2.8 指纹图谱共有峰的指认与归属取“2.2.1”项和“2.2.3”项下制备的黄精芡实汤供试品溶液和混合对照品溶液,按“2.1”项色谱条件进样,根据保留时间和图谱对照分析。确定8号峰为没食子酸,18号峰为芍药内酯苷,19号峰为芍药苷,混合对照品和黄精芡实汤样品的HPLC色谱图见图2。分别按“2.2.1”“2.2.2”项方法获得黄精芡实汤整方溶液、缺味阴性对照溶液,按“2.1”项色谱条件进样测定,记录色谱图,如图3所示。对缺味阴性对照、黄精芡实汤全方HPLC谱图比较,结果显示:峰1和峰18归属于佩兰;峰2和峰11归属于白芍和佩兰;峰5归属于白芍,佩兰和山药;峰6和峰8归属于山药;峰7归属于黄精;峰10归属于佩兰和山药;峰15和峰19归属于白芍。

图2 混合对照品(A)和黄精芡实汤样品(B)的HPLC图谱Figure 2 HPLC diagram of mixed reference substance(A)and Huangjing Qianshi Decoction sample(B)

图3 缺味阴性对照(S1~S7)和黄精芡实汤样品(S8)HPLC图谱Figure 3 HPLC diagram of herbal medicine-lacking hegative control profiles(S1 to S7)and Huangjing Qianshi Decoction samples(S8)
2.3 黄精芡实汤中3种主要成分的含量测定经黄精芡实汤指纹图谱色谱峰及对照品指认,黄精芡实汤HPLC指纹图谱中的8、18和19号色谱峰分别为没食子酸、芍药内酯苷、芍药苷,且经正交偏最小二乘法判别分析结果表明,此3类物质贡献度为前5位,其余2类未能识别。因此,选择没食子酸、芍药内酯苷、芍药苷成分进行含量测定。
2.3.1 色谱条件及供试品溶液制备色谱条件同“2.1”项,供试品溶液按“2.2.1”项下方法制备。
2.3.2 线性关系考察精密称取芍药苷5.00 mg、芍药内酯苷3.11 mg、没食子酸6.97 mg,加70%甲醇溶液,制成芍药苷质量浓度分别为0.050 0、0.100 0、0.250 0、0.500 0、1.000 0 mg·mL-1,芍药内脂苷分别为0.031 1、0.062 2、0.155 5、0.311 0、0.622 0 mg·mL-1,没食子酸分别为0.069 7、0.139 4、0.348 5、0.697 0、1.394 0 mg·mL-1的混合溶液,按“2.1”项下色谱条件进行测定。以没食子酸、芍药内酯苷、芍药苷进样量为横坐标(X,mg)、以峰面积为纵坐标(Y)进行线性回归,得到回归方程:芍药苷的回归方程为y=90 716 904.99x-6 750.791 8,R2=0.999 9;芍药内酯苷的回归方程为y=90 716 904.99x-6 750.791 8,R2=0.999 7;没食子酸的回归方程为y=2 725 712 543x-322 861.385 7,R2=0.999 131 197。结果表明,3种成分在相应的质量范围内与峰面积的线性关系良好。
2.3.3 精密度试验精密称定黄精芡实汤药材粉末(S1)5 g,以“2.2.1”项方法制备供试品溶液,按“2.1”项色谱条件6次进样,记录色谱峰面积。结果显示,没食子酸、芍药内酯苷、芍药苷峰面积的RSD分别为0.92%、0.99%、0.87%,表明仪器精密度良好。
2.3.4 稳定性试验精密称定黄精芡实汤药材粉末(S1)5 g,以“2.2.1”项方法制备供试品溶液,供试品溶液放置0、3、6、9、12、24 h后,按“2.1”项色谱条件进样,色谱峰面积作为参考。结果显示,没食子酸、芍药内酯苷、芍药苷各成分峰面积的RSD分别为1.10%、0.99%、0.97%,表明24 h内供试品溶液的稳定性良好。
2.3.5 重复性试验取黄精芡实汤药材粉末(S1)6份,每份约5 g,精密称定,分别按照“2.2.1”项下方法制备6份供试品溶液,按“2.1”项下色谱方法进样,记录色谱峰面积,并按外标一点法计算样品中3个成分的含量。结果显示,芍药苷、芍药内酯苷、没食子酸的平均质量分数分别为0.119、0.126、0.039 mg/g,RSD分 别 为1.20%、1.90%、2.10%,表明该方法重复性良好。
2.3.6 加样回收试验取黄精芡实汤药材粉末(S1)约1 g,确定对照品含量,样品量=1∶1,按“2.2.1”项下方法制备供试品溶液,制备6份样品溶液,按照“2.1”项下色谱条件进行测定,记录峰面积并计算回收率。结果显示,没食子酸、芍药内酯苷、芍药苷的平均加样回收率分别为101.0%、101.1%、100.9%,RSD分别为2.10%、3.50%、2.70%,表明该方法准确度良好。
2.3.7 含量测定分别取15批黄精芡实汤溶液,按“2.1”项下色谱条件测定,外标一点法计算样品中3个成分的含量,具体结果见表4。

表4 15批黄精芡实汤芍药苷、芍药内脂苷、没食子酸含量测定Table 4 Determination of the content of paeoniflorin,albiflorin and gallic acid
2.4 统计分析
2.4.1 聚类分析(CA)通过聚类分析,可以将所有结果中具有类似点的样品归为一类[9]。以15组黄精芡实汤图谱的共有峰峰面积为变量,使用SPSS 26.0统计软件,采用瓦尔德连接方法,进行聚类分析。结果显示,当距离为5时,15组黄精芡实汤可聚 为2类,其 中S3、S5、S12、S13、S4、S6、S11、S8为一类,S1、S2、S7、S9、S10、S14、S15为一类,表明S3、S5、S12、S13、S4、S6、S11、S8组与S1、S2、S7、S9、S10、S14、S15组黄精芡实汤存在差异。结果见图4。
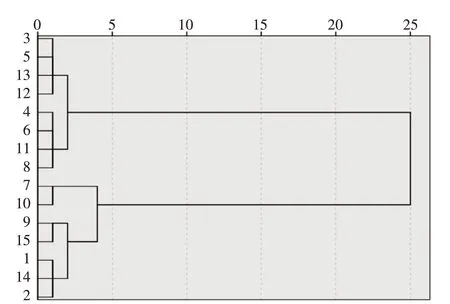
图4 15组黄精芡实汤的聚类分析树状图Figure 4 Cluster analysis dendrogram of 15 groups of Huangjing Qianshi Decoction
2.4.2 主成分分析(PCA)主成分分析是统计分析方法中最常见的数据分析方法,即利用各数据关键特征描述样本,根据数据特征进行分析[10]。为更好地客观反映各批次黄精芡实汤之间的差异性,将15批黄精芡实汤样品的共有峰的峰面积结果导入SIMCA 14.1软件,进行主成分分析。提取出4个变量,累计方差贡献率为87.067%,提示该模型的预测能力较好。提取前2个主成分作15批黄精芡实汤药材的PCA得分图,见图5。结果表明,15批黄精芡实汤聚为2类,与CA结果相互印证,S3、S5、S12、S13、S4、S6、S11、S8为一类,S1、S2、S7、S9、S10、S14、S15为一类,可见不同批次的黄精芡实汤之间存在一定的差异。
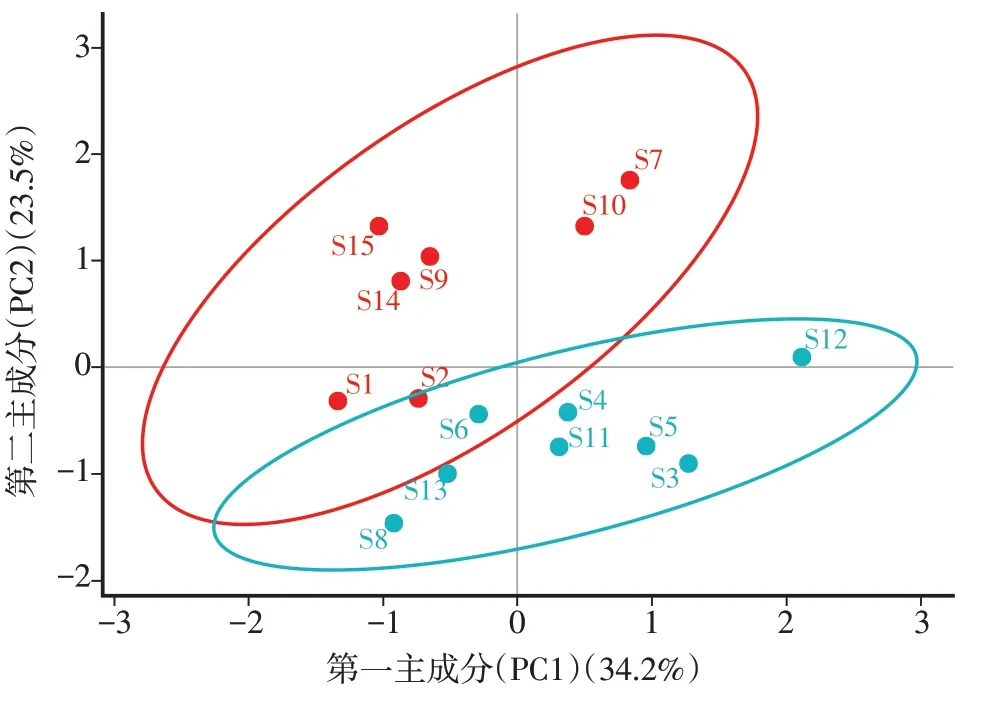
图5 15批黄精芡实汤的主成分分析(PCA)得分图Figure 5 Principal component analysis(PCA)scores of 15 batches of Huangjing Qianshi Decoction
2.4.3 正交偏最小二乘法-判别分析(OPLSDA)OPLS-DA技术采取了监督的模式识别方法,即通过该技术找出导致样本间不同的因素。因此在PCA研究的基础上,为研究不同来源黄精芡实汤样品间的区别,以15批黄精芡实汤药材指纹图谱的19个共有峰峰面积为变量,选择SIMCA 14.1开展OPLS-DA研究,OPLS-DA模拟数据R2X为0.751,R2Y为0.984,Q2为0.921,说明该模型可靠性好[11-12]。进一步检验该模型的有效性,使用SIMCA 14.1对其进行置换试验,见图6,结果显示,Q2均在R2之下,Q2的回归直线与y轴交点在负半轴,即该模型有效。由OPLS-DA分析可知,15批黄精芡实汤划为2类,见图7[13]。OPLS-DA载荷图见图8,结果显示,第一主成分影响较大的有峰2、峰7、峰9、峰10、峰11、峰13、峰14、峰16、峰19,对第二主成分影响较大的有峰1、峰3、峰4、峰5、峰8、峰12。利用变量投影重要性(VIP)法筛选检测了使黄精芡实汤有差异的标志性成分,结果见图9,以VIP>1.4为筛选标准,标记出5个贡献较大的成分,依次为8、4、19、18、5号色谱峰。经对照品比对指认出其中的8号峰为没食子酸,18号峰为芍药内酯苷,19号峰为芍药苷,并对这3个主要成分进行了含量测定,化学计量学分析结果表明这3个测定指标的选择是合理的。
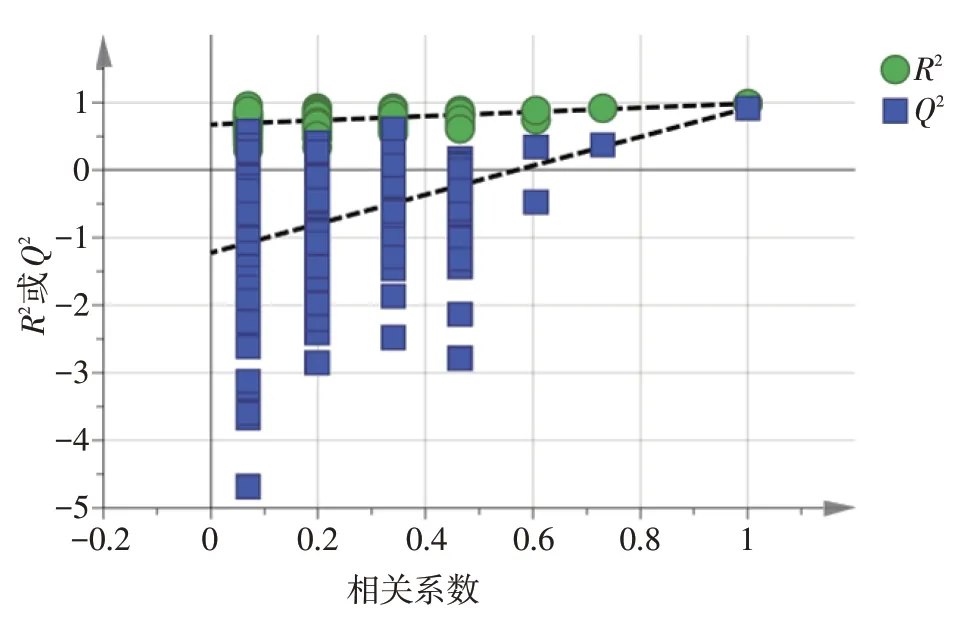
图6 OPLS-DA模型的置换检验结果(n=200)Figure 6 Displacement test results for the OPLS-DA model(n=200)

图7 15批黄精芡实汤的OPLS-DA得分图Figure 7 OPLS-DA score plots of 15 batches of Huangjing Qianshi Decoction

图8 19个共有峰的主成分分析(PCA)载荷图Figure 8 Principal component analysis(PCA)loading plots for the 19 common peaks
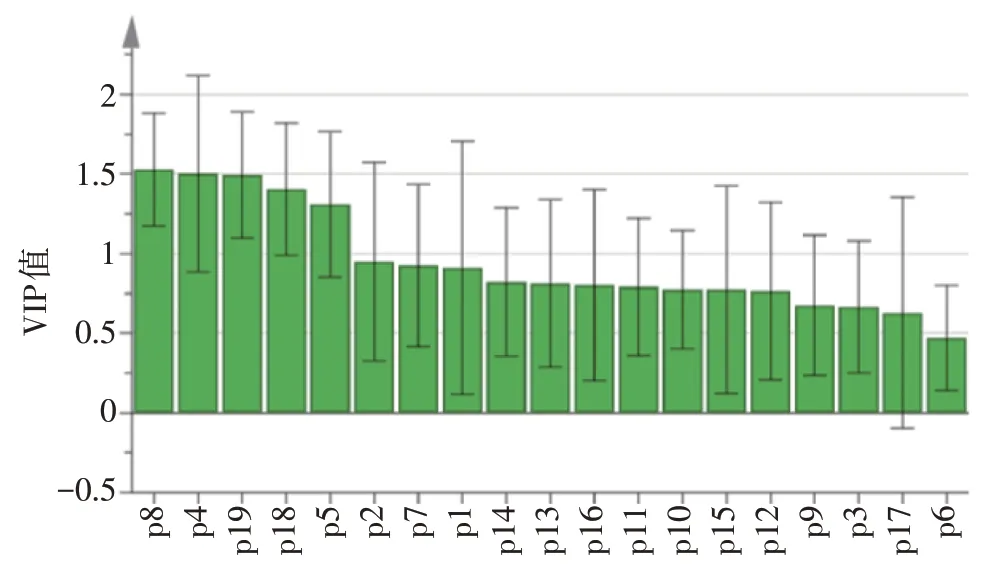
图9 19个共有峰的OPLS-DA变量投影重要性(VIP)值图Figure 9 OPLS-DA VIP values of 19 common peaks
3 讨论
目前,在阻止糖尿病前期进展方面,西药治疗尚无专药,多数仍会发展为2型糖尿病,失去关键的“治未病”阶段[14-15]。而根据中医临床特征,本课题组经过长期临床研究,认为糖尿病前期病机应为营阴受损,阴虚则燥热内生,久则耗气伤阴,出现气阴两虚证[16-17]。治则立滋阴益气之法,以黄精芡实汤(出自《中医内科临床治疗学》)调治,重治“中消”并防“下消”,旨在标本兼治、防其传变。建立综合有效地控制黄精芡实汤质量的方法,对确保临床疗效具有重要的研究意义。本研究采用HPLC结合化学模式识别方法,取得了良好效果,总结经验如下。
3.1 提取条件考察本研究考察了不同体积分数甲乙醇(20%、60%、90%)及水对黄精芡实汤指纹图谱色谱峰的影响,结果发现,用水萃取的黄精芡实汤样品指纹图谱中色谱峰数量最多且峰面积最高,故选用水作为萃取介质。另外,本研究还考察了热回流提取和超声波萃取等2个途径,结果发现,超声波萃取峰面积远远大于热回流提取,故选用超声波提取。此外,还考察了10、30、60 min等3个不同萃取时间,试验结果表明30 min萃取的效果最高。因此,选择水为主要介质,超声提取时间为30 min。
3.2 色谱条件优化本研究考察了甲醇-0.1%甲酸水溶液、甲酸-0.05%甲酸水溶液、甲醇-水、乙腈-水不同流动相体系的分离效果。最终发现甲醇-0.1%甲酸水溶液流动相体系洗脱时,色谱图基线平稳、分离度良好,即确定甲醇-0.1%甲酸水溶液为流动相。此外,依次还考察了30、35、40℃的柱温,发现柱温为30℃时色谱分析法峰的峰形状、保留时间效应更佳,因此,最后选定柱温为30℃。对黄精芡实汤样本进行了180~450 nm波段扫描,并根据以上各项结果及色谱峰值响应值及数目计算得出,在280 nm波段环境下,黄精芡实汤HPLC指纹图谱基线比较稳定,共有峰值量最多,且具有最大的响应值,因此,选用280 nm作为黄精芡实汤HPLC指纹图谱的主要监测波段。比较了Ascentis Express C18(150 mm×4.6 mm,2.7 μm)、Thermo Hypersil GOLD C18(2.1 mm×100 mm,1.9 μm)、SUPELCOSIL LC-PAH(4.6 mm×250 mm,5 μm)3种色谱柱,结果表明Thermo Hypersil GOLD C18的分离度最好,且分析时间合适,因此选择此柱进行实验。
3.3 指纹图谱研究针对中药方剂质量控制的难题,本试验在前期研究中依据刘昌孝等[18]所提出的“中药质量标志物”理论,从化学成分特有性质对黄精芡实汤品质标志物进行了检测分析,并选取与药材品质特征性质有关的标记,形成了黄精芡实汤HPLC指纹图谱,明确了19个共有峰,并对其中成分辨别出没食子酸、芍药苷、芍药内酯苷等3个化学成分。且15批黄精芡实汤各共有峰相对保留时间、峰面积结果均说明各批次黄精芡实汤化学组成一致性良好。
经与各缺味阴性对照HPLC图谱比较,山药、佩兰、黄精、白芍的色谱峰得以充分展现,但大枣、芡实、太子参并未贡献色谱峰。可能由于在本试验条件下,主要测得紫外吸收较强物质,而大枣、芡实、太子参中主要成分为柠檬苦素型三萜类化合物,该类物质在紫外区,响应低、干扰大,很难达到理想的基线分离[19-21]。因此本研究对黄精芡实汤的质量监控方法仍存在一定局限,今后我们将尝试更多的多学科结合的方法,形成较为完整的黄精芡实汤指纹图谱,以不断完善黄精芡实汤的质量控制研究[22-24]。
3.4 化学模式识别对黄精芡实汤药材的指纹图谱共有峰峰面积进行CA、PCA和OPLS-DA分析,结果显示各批次黄精芡实汤质量基本相似。此外,8、4、19、18、5号色谱峰是影响黄精芡实汤成分差异的标志性成分,其中,8、18、19号等3类物质分别被识别为没食子酸、芍药苷、芍药内酯苷,其余2类未能识别。此3类物质分别为芡实、山药、芍药、佩兰的主要药效成分,同时也分别为黄精芡实汤中君药(芡实)、臣药(山药、芍药)、佐药(佩兰)代表成分。金超等[25]研究发现,芍药苷、芍药内酯苷可干预胰岛素抵抗进程发展;薛琛等[26]研究发现,没食子酸可抑制α-葡萄糖苷酶。可见,这3种化合物现代药理学研究均与黄精芡实汤作为消渴病代表方的功效不谋而合。因此,本研究选择8、18、19号色谱峰进行定量测定是合理的,且作为黄精芡实汤的质量控制标准也是具有科学性和实用性的。
综上所述,本研究建立的黄精芡实汤药材HPLC指纹图谱和含量测定方法重复性好,专属性强,可用于黄精芡实汤药材及相关制剂的质量评价。
