补肾生精调和气血法调控Bcl-2相关线粒体凋亡信号通路改善大鼠卵巢储备功能的研究
2023-02-03黄佳梅蔡紫璨张花黎玲叶朝阳金志春
黄佳梅,蔡紫璨,张花,2,黎玲,2,叶朝阳,2,金志春,2
(1.湖北中医药大学,湖北武汉430065;2.华中科技大学同济医学院附属湖北妇幼保健院,湖北武汉 430070)
卵巢储备功能减退(diminished ovarian reserve,DOR)是指卵巢皮质区内储备的卵母细胞数量和质量下降,常伴随生殖内分泌功能紊乱和生育能力下降。本病的发生机制目前尚不完全明确,但卵巢颗粒细胞异常凋亡而导致卵泡过度闭锁是DOR发病的关键[1-2]。有研究通过观察颗粒细胞的凋亡情况,评估卵母细胞和胚胎的形态,预测体外受精(IVF)的结局,发现颗粒细胞凋亡与IVF女性受孕和妊娠率呈负相关[3-4]。在治疗上,对有生育需求的患者,鼓励积极试孕,或采用辅酶Q10、生长激素、脱氢表雄酮、中医药等药物预处理后进行辅助生殖技术助孕,但这些药物的疗效目前尚无定论[2],其中中医药因疗效良好、副作用小等优势具有广阔的应用前景,值得进一步深入研究。
本课题组前期研究结果表明,补肾生精调和气血法中药复方可恢复DOR模型大鼠动情周期,降低血清卵泡刺激素(FSH)、黄体生成素(LH)、丙二醛(MDA)水平,升高血清雌二醇(E2)和抗氧化指标超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)、总抗氧化能力(T-AOC)水平,改善DOR大鼠卵巢抗氧化损伤。本研究以B淋巴细胞瘤2(Bcl-2)相关线粒体凋亡信号通路为切入点,进一步探讨补肾生精调和气血法改善卵巢储备功能的作用机制,以期为其临床应用提供依据,现将研究结果报道如下。
1 材料
1.1 动物60只SPF级性成熟雌性SD大鼠,体质量200~220 g,由湖南斯莱克景达实验动物有限公司提供,动物质量合格证号:430727221100041752。实验于华中科技大学实验动物中心完成,动物使用许可证号:SYXK(鄂)2016-0057。饲养环境:室温24~25℃,湿度50%~60%,光照周期12/12 h(明/暗),自由摄食饮水。动物适应环境7 d后用于实验。本动物实验经华中科技大学动物伦理委员会审批通过(批号:S2699)。
1.2药物补肾生精调和气血法中药复方组成:菟丝子15 g、补骨脂10 g、枸杞子15 g、熟地黄15 g、山茱萸15 g、山药15 g、当归10 g、川芎10 g、白芍药10 g、香附子10 g、党参15 g、黄芪15 g、白术15 g。所有中药饮片由湖北省妇幼保健院中药房提供。采用常规水煎法制备,具体方法如下:取总药材2倍量双蒸水浸泡20 min后,武火煎煮,沸后文火再煎20 min,取药汁;再加2倍量双蒸水,武火沸后文火再煎20 min,取药汁。将2次中药汁均匀混合,并用旋转蒸发仪浓缩至生药浓度1.0 g·mL-1,4℃密封保存备用。安道生(注射用环磷酰胺,0.2 g×1支,德国Baxter Oncology GmbH公司生产,批号:1A445A);补佳乐(戊酸雌二醇片,每片含戊酸雌二醇1 mg,拜尔医药保健有限公司生产,批号:626A)。
1.3 试剂卵泡刺激素(FSH)、黄体生成素(LH)酶联免疫吸附测定(ELISA)试剂盒(武汉伊莱瑞特生物科技股份有限公司);雌二醇(E2)、抗苗勒管激素(AMH)等检测试剂盒(罗氏诊断产品上海有限公司);B淋巴细胞瘤2(Bcl-2)抗体(美国Abcam公司);兔抗Bcl-2相关X蛋白(Bax)抗体(美国Novus Biologicals公司);兔抗半胱氨酸蛋白酶3(Caspase-3)抗体、兔抗半胱氨酸蛋白酶9(Caspase-9)抗体、兔抗血红素氧合酶1(HO-1)抗体、小鼠抗醌氧化还原酶1(NQO-1)抗体(武汉三鹰生物技术有限公司);辣根过氧化物酶(HRP)标记的山羊抗兔IgG、HRP标记的山羊抗小鼠IgG(上海生工生物工程技术服务有限公司);DAKO免疫组化试剂盒,大鼠HO-1、NQO-1、Bax、Bcl-2、Caspase-3、Caspase-9内参引物合成(武汉恒意赛生物科技有限公司);NucleoZOL试剂(德国Macherey-Nagel公司);Luna Universal One-Step RT-qPCR Kit试剂盒(美国New England Biolabs公司)。
1.4 仪器DM4000生物显微镜(德国Leika公司);Access全自动电化学发光免疫分析仪(美国Beckman Couiter公司);iMark酶 标仪、Mini-PROTEAN Tetra电泳槽、MiniP4小型垂直电泳转印系统、CFX Connect荧光定量PCR检测系统(美国Bio-Rad公司);BG-gdsAUTO 710 MINI化学发光成像分析系统(上海Baygene生物技术有限公司);P100+超微量分光光度计(美国Pultton公司)。
2 方法
2.1 分组与动物模型制备适应性喂养结束次日起,每日检查实验大鼠阴道脱落细胞,阴道涂片见大鼠动情周期4~5 d规律性改变(动情前期、动情期、动情后期、动情间期)。将动情周期正常的大鼠按随机数字表分为正常组,模型组,西药组,中药低、中、高剂量组,每组各10只。除正常组外,其余各组大鼠参照前期预实验模型研究给予75 mg·kg-1环磷酰胺单次腹腔注射复制DOR模型。正常组给予等体积生理盐水腹腔注射。每日上午10点进行阴道细胞学涂片,观察大鼠动情周期变化情况,以造模大鼠出现动情周期紊乱(周期延长、停滞或无明显周期改变)确定造模成功[5]。
2.2 给药动物给药剂量参照“人和动物间按体表面积折算的等效剂量比值表”[6]进行换算。于造模次日开始,西药组给予戊酸雌二醇片混悬液(溶于去离子水)0.105 mg·kg-1·d-1灌胃,中药低、中、高剂量组分别对应给予补肾生精调和气血法中药复方水煎液8.075、16.15、32.3 g·kg-1·d-1灌胃,正常组、模型组给予等体积去离子水灌胃,每日1次,连续21 d。
2.3 大鼠一般情况及动情周期自造模当日开始每日观察各组大鼠一般情况,包括饮食摄水量、皮毛色泽、精神状态、二便情况、体质量,同时进行阴道脱落细胞涂片,观察动情周期变化。
2.4 取材给药结束后次日,麻醉大鼠,心尖取血,分离血清,置-20℃冰箱备测。取出双侧卵巢称质量,一侧卵巢置于4%多聚甲醛中固定,另一侧干冰速冻后置于-20℃冰箱保存备用。
2.5 血清FSH、LH、E2、AMH水平检测采用ELISA法检测血清FSH、LH,采用电化学发光法检测血清E2、AMH水平,具体操作步骤按照试剂盒说明书进行。
2.6苏木素-伊红(HE)染色法观察卵巢病理组织学变化取卵巢组织于4%多聚甲醛中固定48 h后,进行浸蜡、脱水、石蜡包埋、切片,HE常规染色,光学显微镜下观察卵巢病理组织学变化。
2.7 Western Blot法检测大鼠卵巢组织中HO-1、NQO-1、Bcl-2、Bax、Caspase-3和Caspase-9的蛋白表达放射免疫沉淀分析(RIPA)液裂解离心提取卵巢组织总蛋白,按照蛋白定量试剂盒进行样本蛋白含量测定,加5×Laemmli混匀,-80℃冰箱保存备用。以鼠β-actin为内参,进行凝胶电泳、转膜、封闭,加按体积比稀释的一抗HO-1(1∶2 000)、NQO-1(1∶10 000)、Bcl-2(1∶1 000)、Bax(1∶1 000)、Caspase-3(1∶1 000)、Caspase-9(1∶1 000)4℃冰箱孵育过夜,加按体积比稀释的二抗(1∶20 000)室温孵育2 h,显影,结果使用ImageJ软件测定图像平均灰度值数据后进行分析统计。
2.8 实时荧光定量聚合酶链反应(PCR)法检测大鼠卵巢组织中HO-1、NQO-1、Bcl-2、Bax、Caspase-3、Caspase-9的mRNA表达NucleoZOL裂解并提取卵巢组织中总RNA,测定RNA样品浓度,设计目的基因对应引物,HO-1、NQO-1、Bcl-2、Bax、Caspase-3、Caspase-9引物序列见表1。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,按照Luna Universal One-Step RT-qPCR Kit试剂盒说明书操作。以20 μL反应体系进行检测,反应体系:One-Step Reaction Mix 10 μL、RT Enzyme Mix 1 μL、0.4 μmol/L上游引物、0.4 μmol/L下游引物、2 μL RNA样品(浓度0.1 μg/μL)。反应条件:反转录55℃10 min;预变性95℃3 min;变性95℃10 s、退火58℃30 s、延伸72℃30 s共循环40次。结果使用Bio-Rad CFX Manger软件进行数据处理及分析,并计算目的基因mRNA的相对表达量。

表1 PCR引物序列表Table 1 Sequence list of PCR primers
2.9 统计方法采用SPSS 26.0统计软件进行实验数据分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 补肾生精调和气血法对DOR大鼠血清性激素水平的影响表2结果显示:与正常组比较,模型组大鼠血清FSH、LH水平升高,E2、AMH水平降低,差异有统计学意义(P<0.05);与模型组比较,西药组和中药中、高剂量组血清FSH及西药组和中药低、中、高剂量组LH水平降低,各给药组E2及中药高剂量组AMH水平升高,差异有统计学意义(P<0.05)。中药各剂量组上述指标与西药组比较,差异均无统计学意义(P>0.05)。
表2 各组大鼠血清FSH、LH、E2、AMH水平比较Table 2 Comparison of serum FSH,LH,E2 and AMH levels among various groups of rats (±s)
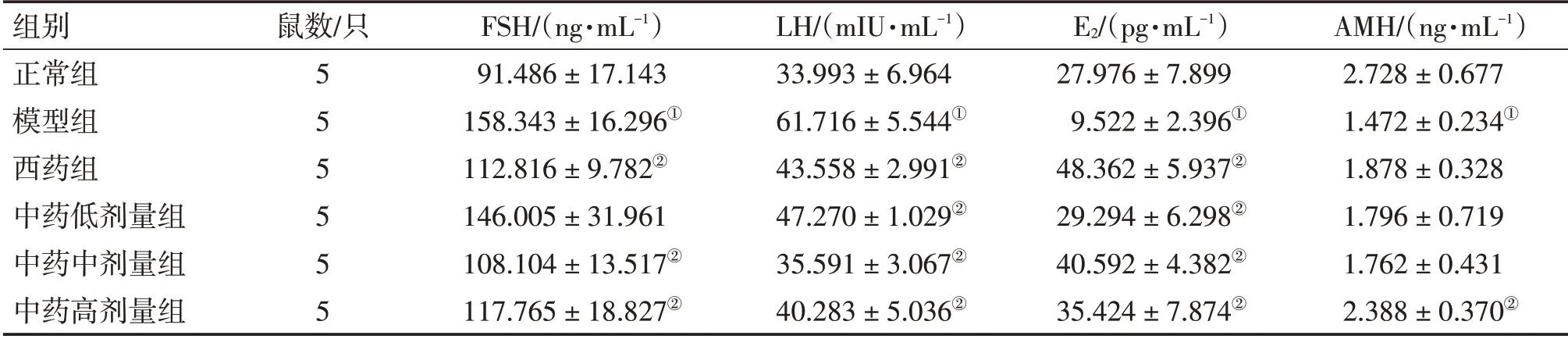
表2 各组大鼠血清FSH、LH、E2、AMH水平比较Table 2 Comparison of serum FSH,LH,E2 and AMH levels among various groups of rats (±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组西药组中药低剂量组中药中剂量组中药高剂量组鼠数/只5 5 5 5 5 5 FSH/(ng·mL-1)91.486±17.143 158.343±16.296①112.816±9.782②146.005±31.961 108.104±13.517②117.765±18.827②LH/(mIU·mL-1)33.993±6.964 61.716±5.544①43.558±2.991②47.270±1.029②35.591±3.067②40.283±5.036②E2/(pg·mL-1)27.976±7.899 9.522±2.396①48.362±5.937②29.294±6.298②40.592±4.382②35.424±7.874②AMH/(ng·mL-1)2.728±0.677 1.472±0.234①1.878±0.328 1.796±0.719 1.762±0.431 2.388±0.370②
3.2 补肾生精调和气血法对DOR大鼠卵巢组织形态学的影响图1结果显示:正常组可见各级卵泡均匀生长(包括初级卵泡、次级卵泡、发育卵泡)。与正常组比较,模型组卵巢皮质处生长卵泡较少,以初级卵泡为主,且部分卵泡内仅1~2层颗粒细胞环绕,闭锁卵泡增多。药物干预后,西药组和中药低、中、高剂量组卵巢皮质生长卵泡数量较模型组明显增多,闭锁卵泡减少,且黄体组织体积增大。中药中、高剂量组卵泡颗粒细胞及生长卵泡数量较西药组多。
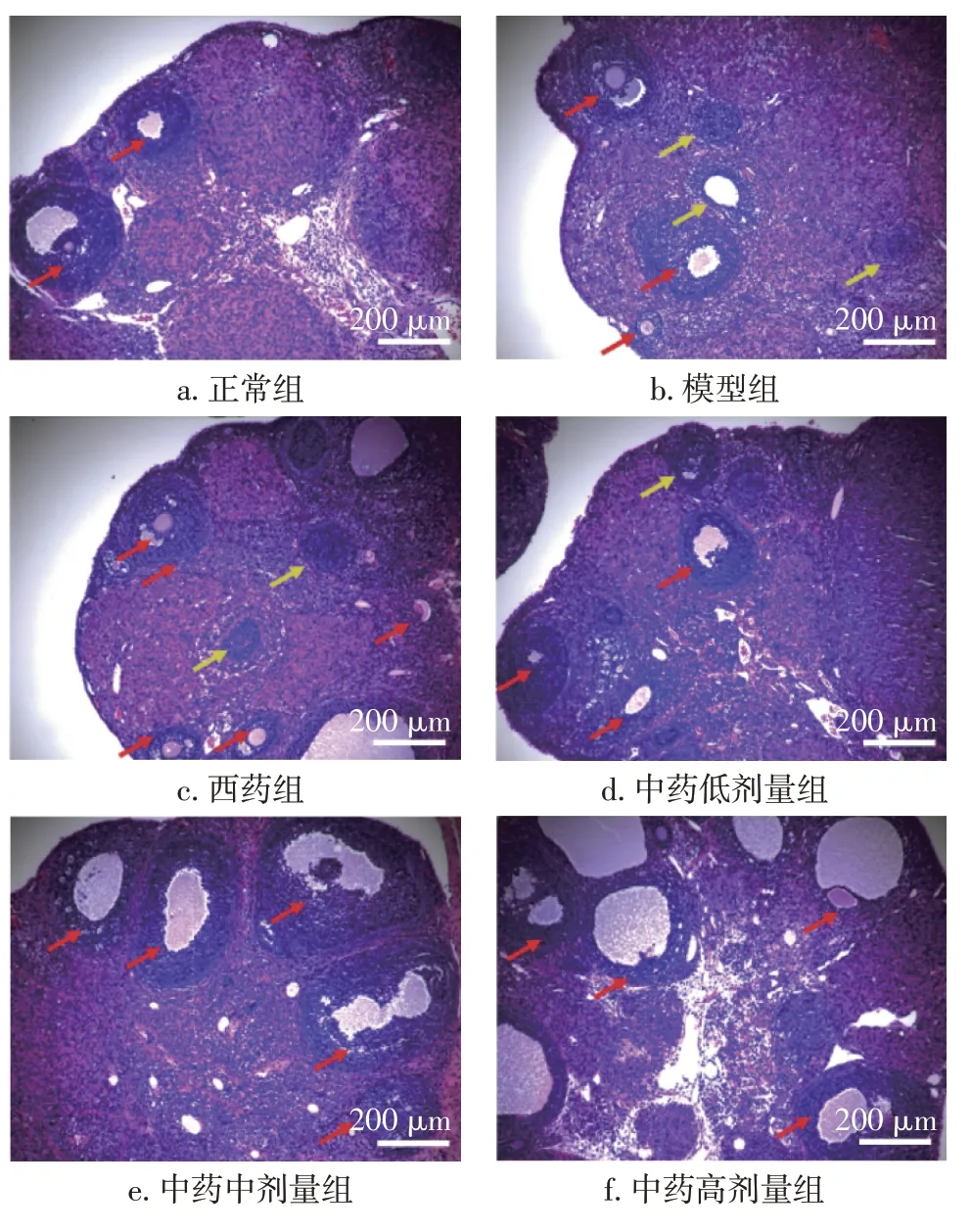
图1 各组大鼠卵巢组织形态学比较(HE染色,×100)Figure 1 Comparison of the histomorphology of the ovaries among various groups of rats(HE staining,×100)
3.3 补肾生精调和气血法对DOR大鼠卵巢组织HO-1、NQO-1、Bcl-2、Bax蛋白表达的影响表3、图2结果显示:与正常组比较,模型组大鼠卵巢组织HO-1、NQO-1、Bcl-2蛋白表达水平下调,Bax蛋白表达水平上调(均P<0.05);与模型组比较,西药组和中药中、高剂量组HO-1,中药低、中、高剂量组NQO-1,西药组和中药中、高剂量组Bcl-2蛋白表达水平上调(均P<0.05),中药高剂量组Bax水平下调(P<0.05)。
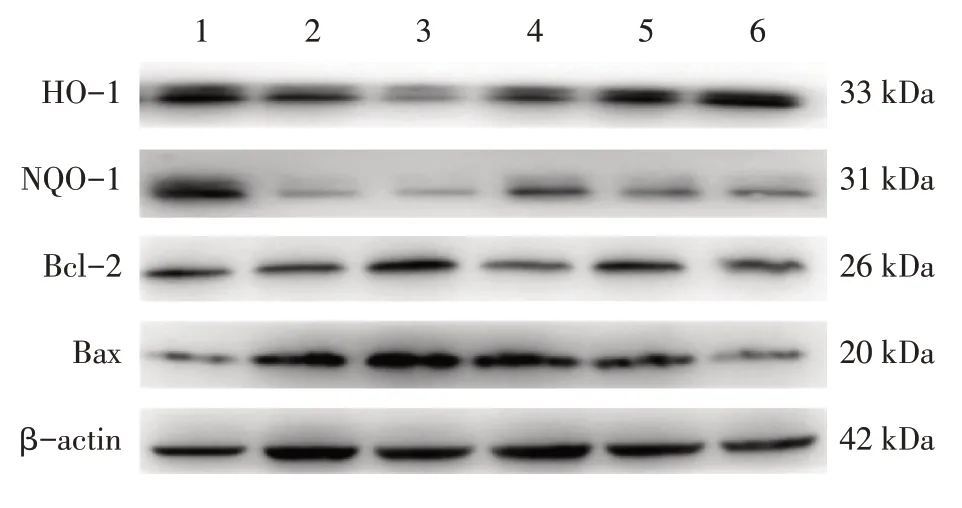
图2 各组大鼠卵巢组织HO-1、NQO-1、Bcl-2、Bax蛋白的Western Blot电泳图Figure 2 Western Blot electrophotogram of HO-1,NQO-1,Bcl-2 and Bax proteins in rat ovarian tissue in various groups of rats
表3 各组大鼠卵巢组织HO-1、NQO-1、Bcl-2、Bax蛋白相对表达量比较Table 3 Comparison of the protein relative expressions of HO-1,NQO-1,Bcl-2 and Bax in the ovarian tissues among various groups of rats (±s)
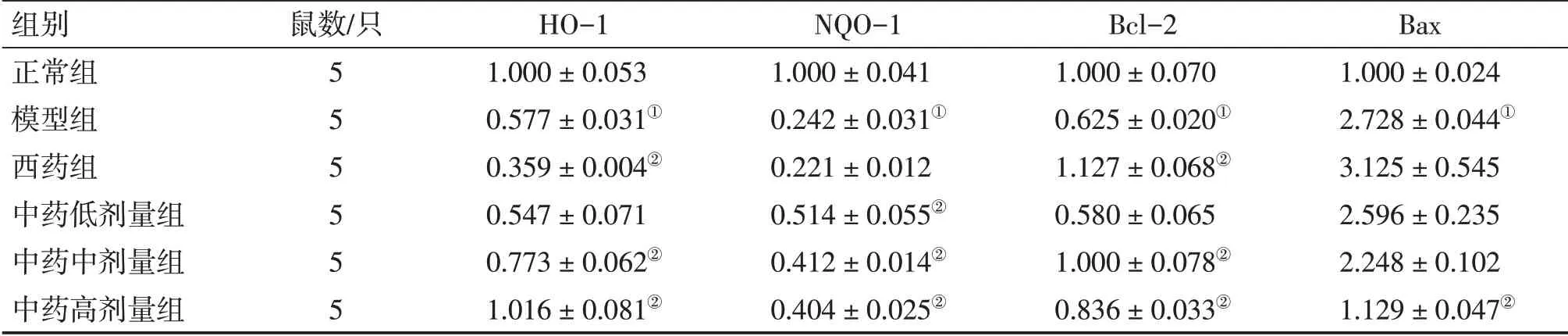
表3 各组大鼠卵巢组织HO-1、NQO-1、Bcl-2、Bax蛋白相对表达量比较Table 3 Comparison of the protein relative expressions of HO-1,NQO-1,Bcl-2 and Bax in the ovarian tissues among various groups of rats (±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组西药组中药低剂量组中药中剂量组中药高剂量组鼠数/只5 5 5 5 5 5 HO-1 1.000±0.053 0.577±0.031①0.359±0.004②0.547±0.071 0.773±0.062②1.016±0.081②NQO-1 1.000±0.041 0.242±0.031①0.221±0.012 0.514±0.055②0.412±0.014②0.404±0.025②Bcl-2 1.000±0.070 0.625±0.020①1.127±0.068②0.580±0.065 1.000±0.078②0.836±0.033②Bax 1.000±0.024 2.728±0.044①3.125±0.545 2.596±0.235 2.248±0.102 1.129±0.047②
3.4 补肾生精调和气血法对DOR大鼠卵巢组织Caspase-3、cleaved Caspase-3、Caspase-9、cleaved Caspase-9蛋白表达的影响表4、图3结果显示:与正常组比较,模型组大鼠卵巢组织cleaved Caspase-3、Caspase-9、cleaved Caspase-9蛋白表达水平升高(均P<0.05);与模型组比较,西药组和中药低、中、高剂量组Caspase-3、cleaved Caspase-3、Caspase-9、cleaved Caspase-9蛋白表达水平均呈下调趋势,其中,中药低、高剂量组Caspase-3,中药低、中、高剂量组cleaved Caspase-3,中药低剂量组Caspase-9及中药低、中剂量组cleaved Caspase-9下调水平有统计学意义(P<0.05)。
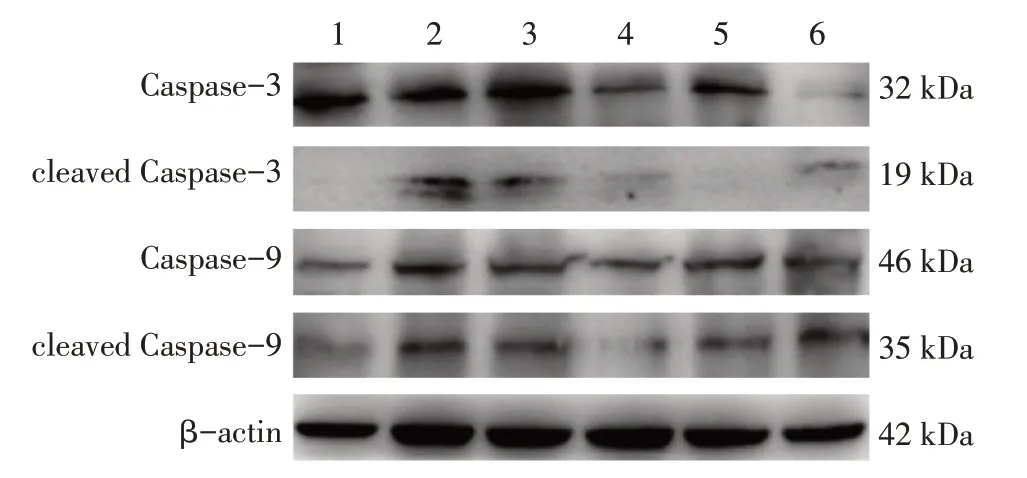
图3 各组大鼠卵巢组织Caspase-3、cleaved Caspase-3、Caspase-9、cleaved Caspase-9蛋白的Western Blot电泳图Figure 3 Western Blot electrophotogram of Caspase-3,cleaved Caspase-3,Caspase-9 and cleaved Caspase-9 proteins in rat ovarian tissue among various groups of rats
表4 各组大鼠卵巢组织Caspase-3、cleaved Caspase-3、Caspase-9、cleaved Caspase-9蛋白相对表达量比较Table 4 Comparison of the protein relative expressions of Caspase-3,cleaved Caspase-3,Caspase-9 and cleaved Caspase-9 in rat ovarian tissue among various groups of rats (±s)
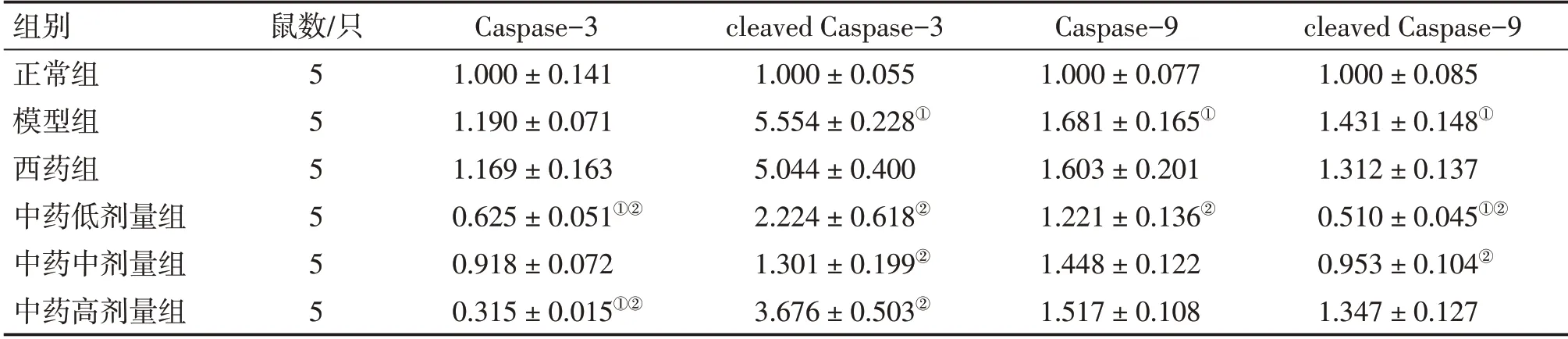
表4 各组大鼠卵巢组织Caspase-3、cleaved Caspase-3、Caspase-9、cleaved Caspase-9蛋白相对表达量比较Table 4 Comparison of the protein relative expressions of Caspase-3,cleaved Caspase-3,Caspase-9 and cleaved Caspase-9 in rat ovarian tissue among various groups of rats (±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组西药组中药低剂量组中药中剂量组中药高剂量组鼠数/只5 5 5 5 5 5 Caspase-3 1.000±0.141 1.190±0.071 1.169±0.163 0.625±0.051①②0.918±0.072 0.315±0.015①②cleaved Caspase-3 1.000±0.055 5.554±0.228①5.044±0.400 2.224±0.618②1.301±0.199②3.676±0.503②Caspase-9 1.000±0.077 1.681±0.165①1.603±0.201 1.221±0.136②1.448±0.122 1.517±0.108 cleaved Caspase-9 1.000±0.085 1.431±0.148①1.312±0.137 0.510±0.045①②0.953±0.104②1.347±0.127
3.5 补肾生精调和气血法对DOR大鼠卵巢组织HO-1、NQO-1、Bcl-2、Bax、Caspase-3、Caspase-9 mRNA表达的影响表5结果显示:与正常组比较,模型组大鼠卵巢组织Caspase-3、Caspase-9 mRNA表达水平升高(均P<0.05),HO-1、NQO-1、Bcl-2 mRNA表达有下调趋势,Bax mRNA表达上调(均P>0.05);与模型组比较,西药组和中药低、中、高剂量组HO-1、NQO-1、Bcl-2 mRNA表达均有上调趋势,其中,中药低、中剂量组HO-1,西药组和中药低、中剂量组Bcl-2 mRNA上调水平有统计学意义(均P<0.05),Bax、Caspase-3、Caspase-9 mRNA表达均有下调趋势,其中,西药组和中药低、中、高剂量组Caspase-3,中药低、中、高剂量组Caspase-9 mRNA表达下调水平有统计学意义(均P<0.05)。
表5 各组大鼠卵巢组织HO-1、NQO-1、Bcl-2、Bax、Caspase-3、Caspase-9 mRNA相对表达量比较Table 5 Comparison of the mRNA relative expressions of HO-1,NQO-1,Bcl-2,Bax,Caspase-3 and Caspase-9 in the ovarian tissue among various groups of rats (±s)
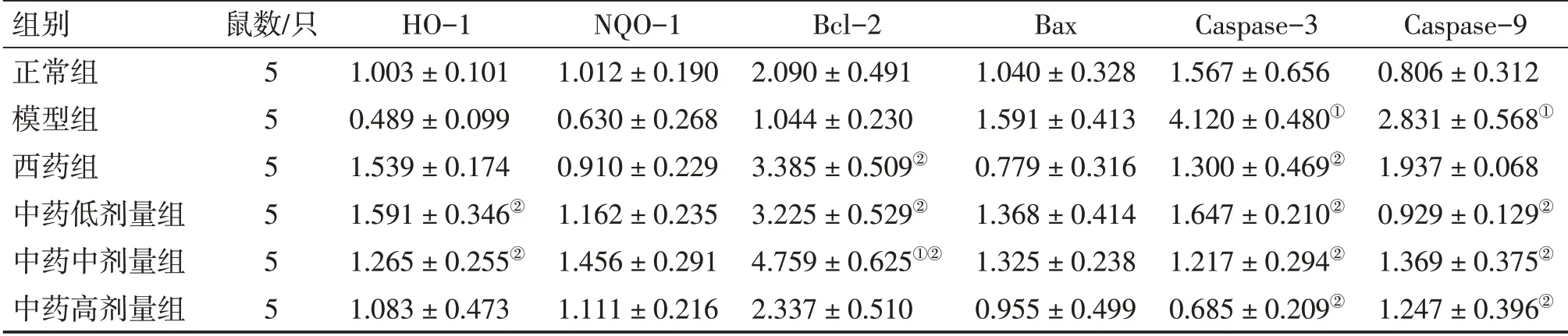
表5 各组大鼠卵巢组织HO-1、NQO-1、Bcl-2、Bax、Caspase-3、Caspase-9 mRNA相对表达量比较Table 5 Comparison of the mRNA relative expressions of HO-1,NQO-1,Bcl-2,Bax,Caspase-3 and Caspase-9 in the ovarian tissue among various groups of rats (±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组西药组中药低剂量组中药中剂量组中药高剂量组鼠数/只5 5 5 5 5 5 HO-1 1.003±0.101 0.489±0.099 1.539±0.174 1.591±0.346②1.265±0.255②1.083±0.473 NQO-1 1.012±0.190 0.630±0.268 0.910±0.229 1.162±0.235 1.456±0.291 1.111±0.216 Bcl-2 2.090±0.491 1.044±0.230 3.385±0.509②3.225±0.529②4.759±0.625①②2.337±0.510 Bax 1.040±0.328 1.591±0.413 0.779±0.316 1.368±0.414 1.325±0.238 0.955±0.499 Caspase-3 1.567±0.656 4.120±0.480①1.300±0.469②1.647±0.210②1.217±0.294②0.685±0.209②Caspase-9 0.806±0.312 2.831±0.568①1.937±0.068 0.929±0.129②1.369±0.375②1.247±0.396②
4 讨论
细胞凋亡是细胞程序性死亡的一种形式,维持着机体稳态的平衡,细胞过度凋亡可引发机体神经退行性疾病、自身免疫疾病及发育不全等多种疾病,女性卵巢卵泡发育、排卵和黄体形成退化的复杂调控同样依赖促凋亡和抗凋亡因子的平衡调节[4,7]。卵泡颗粒细胞过度凋亡会导致卵泡加速闭锁,卵巢卵泡中主要涉及环磷酸腺苷(cAMP)、Bcl-2、Fas/FasL 3条细胞凋亡信号通路[8]。其中,Bcl-2家族蛋白主要包括以Bcl-2为代表的抗凋亡蛋白和以Bax为代表的促凋亡效应蛋白作用于线粒体外膜,共同调控着线粒体外膜通透性及线粒体凋亡途径。激活的Bax因子在线粒体外膜聚合并形成孔道,使线粒体外膜通透性改变,并触发线粒体中细胞色素C、凋亡诱导因子(AIF)等多种凋亡因子释放入胞浆,细胞色素C、凋亡蛋白酶激活因子1(Apaf-1)与Caspase-9前体结合形成凋亡复合体[9]。Caspase-9为凋亡启动因子,结合后发生自身切割活化为cleaved Caspase-9,进一步激活下游Caspase-3等效应因子,剪切并活化为cleaved Caspase-3,释放细胞色素C诱导凋亡级联反应,形成凋亡小体[4,7]。Bcl-2则通过抑制Bax的活性,将其隔离在线粒体外膜,以阻断凋亡信号传导[10]。随着卵巢颗粒细胞凋亡,血清E2、AMH分泌减少,在下丘脑-垂体-卵巢轴(HPOA)负反馈的调节下血清FSH、LH分泌持续增多,从而出现不同程度的卵巢功能减退;而FSH、LH、E2、AMH等生殖激素同时也影响着颗粒细胞的凋亡[11]。本研究结果显示,与正常组比较,模型组大鼠血清FSH、LH水平升高,E2、AMH水平降低,卵巢组织可见生长卵泡明显减少,提示环磷酰胺诱导卵巢储备功能减退(DOR)造模成功。中药干预后,DOR大鼠生殖内分泌水平及卵巢卵泡生长情况均有所恢复。
除上述经典凋亡途径外,机体过高的活性氧(ROS)水平引起氧化应激同样可以激活线粒体凋亡途径,诱导卵巢颗粒细胞凋亡[12-13]。研究[14-15]发现,Bcl-2具有促氧化剂和抗氧化剂活性的作用,可通过多种途径微调细胞内ROS水平,将细胞内的氧化还原状态维持在对细胞生存最有利的水平,在氧化应激状态下,防止ROS的过度积累,从而抑制线粒体凋亡信号传导。Bcl-2的表达对细胞过氧化氢酶(CAT)、SOD、GSH、环氧化酶(COX)等多种抗氧化因子的活性均有影响[16]。Keap1/Nrf2/抗氧化反应元件(ARE)是机体抵抗氧化应激的关键信号通路,可通过位于Bcl-2启动子内的ARE调节Bcl-2的转录,而血红素加氧酶1(HO-1)和醌氧化还原酶1(NQO-1)是该通路下游的关键靶基因[17]。本课题组前期研究结果显示,环磷酰胺制备的DOR模型大鼠出现氧化损伤状态、卵巢储备功能下降,表现为血清SOD、GSH、TAOC水平下降,MDA水平升高。本研究进一步发现环磷酰胺诱导DOR模型大鼠卵巢Bcl-2、HO-1、NQO-1蛋白及mRNA表达下调,Bax、Caspase-3、Caspase-9蛋白及mRNA表达上调,提示DOR模型大鼠发病机制与Bcl-2相关线粒体凋亡信号通路有关。
DOR归属于中医学“经水早断”“月经过少”“闭经”“不孕”等范畴。中医学认为,DOR主要病机为先天肾精虚衰,后天肾精充养不足,脾肾虚弱,冲任气血失调。近年来,运用中药单体、复方、针灸等抑制卵巢颗粒细胞凋亡、抗氧化损伤,是改善卵巢储备功能研究的热点,其治疗多以补肾健脾、行气养血填精为主[18-19]。补肾生精调和气血法中药复方为本课题组长期临床及实验研究的基础方,前期临床研究结果显示,本方联合雌孕激素治疗可有效改善卵巢早衰患者月经周期、阴道干涩和性欲低下等症状,调节患者生殖内分泌,并改善子宫内膜厚度、卵巢体积和窦卵泡数[20-21]。并在实验研究[22-23]中发现,本方可上调血管内皮生长因子(VEGF)及其受体Flt-1、激酶插入区受体(KDR)蛋白的表达,具有促进卵巢组织间质血管生成的作用,可间接改善卵巢储备功能。本研究在前期研究的基础上,进一步发现补肾生精调和气血法可通过上调卵巢HO-1、NQO-1、Bcl-2蛋白表达,下调Bax蛋白表达,阻断下游Caspase相关蛋白的激活,发挥卵巢保护作用,提示补肾生精调和气血法调控Bcl-2相关线粒体凋亡信号通路,抑制卵巢颗粒细胞凋亡,可能是其改善大鼠DOR的机制之一。
综上所述,补肾生精调和气血法中药可通过调控Bcl-2相关线粒体凋亡信号通路,抑制卵巢颗粒细胞凋亡,改善大鼠卵巢储备功能。
